Введение
Фенилкетонурия (ФКУ; OMIM #261600; МКБ-10: Е70.0) — наследственное заболевание с аутосомно-рецессивным типом наследования, причиной которого является дефицит фермента фенилаланингидроксилазы (ФАГ). Дефицит фермента ФАГ обусловлен мутациями в гене РАН, локализованном на длинном плече 12-й хромосомы (12q22-q24.1). Дефицит ФАГ приводит к нарушению обмена незаменимой аминокислоты фенилаланина (ФА) [1], при этом в тканях происходит накопление ФА и его метаболитов, обладающих нейротоксическим действием [2]. Естественное течение заболевания характеризуется прогрессированием неврологической симптоматики с формированием необратимых изменений и развитием тяжелой умственной отсталости. Частота ФКУ варьирует в различных популяциях [3], в России она составляет 1:7142 [4]. В связи с широкой распространенностью ФКУ в Российской Федерации проводится неонатальный скрининг этого заболевания с определением уровня ФА в крови у всех новорожденных. Подтверждающая диагностика и расчет диеты осуществляются в соответствии с федеральными рекомендациями Минздрава России [5]. Эффективным методом патогенетической терапии является строгая диета с ограничением белка (источника ФА) с использованием лечебных смесей, не содержащих ФА [6]. Однако у детей, принимающих такие аминокислотные смеси, часто формируется негативное отношение к лечению вплоть до отказа от него из-за низких органолептических свойств этих продуктов [7].
В связи с особенностями нарушения аминокислотного обмена у детей с ФКУ часто отмечается снижение в крови уровня одной из незаменимых аминокислот — тирозина. Дефицит тирозина может приводить к нарушению синтеза катехоламинов и тироксина [8]. В связи с этим для коррекции метаболического дефекта продукты лечебного питания, разработанные для больных ФКУ, обогащены тирозином. Рекомендован мониторинг уровня тирозина, а также других незаменимых аминокислот в крови у пациентов, получающих специализированные диетические лечебные продукты (СДЛП) [9].
Женщины фертильного возраста, больные ФКУ, могут планировать деторождение и при использовании методов молекулярно-генетической предимплантационной и пренатальной диагностики могут иметь здоровое потомство. Однако продукты метаболизма ФА проникают через фетоплацентарный барьер и способны оказывать нейротоксическое действие на плод, что приводит к развитию материнской ФКУ. Материнская ФКУ — эмбриофетопатия, развивающаяся у плода в результате воздействия продуктов аномального метаболизма беременной женщины с ФКУ при отсутствии диетического лечения [10]. Без диетотерапии при материнской ФКУ у плода существенно повышается риск развития врожденных пороков развития,
в т. ч. пороков сердца [11]. Таким образом, исключительное внимание следует уделять профилактике материнской ФКУ. Единственным методом предотвращения нарушений в аминокислотном обмене у беременной женщины с ФКУ является ограничение поступления ФА в организм с пищей. Это достигается традиционным методом строго соблюдаемой диетотерапии, принцип которой ничем не отличается от диетотерапии детей, больных ФКУ. Адекватная терапия способна предотвратить все или большинство проявлений материнской ФКУ. Рекомендуется осуществлять диетотерапию уже в период подготовки к беременности. Соблюдение строгой диеты, обеспечивающей поступление жизненно важных для роста и развития плода нутриентов, возможно лишь при применении СДЛП, не содержащих ФА.
С целью улучшения вкусовых характеристик лечебного питания для больных ФКУ разработаны отечественные СДЛП: «БенАмин 13-phe», «БенАмин 15-phe», «БенАмин 20-phe», «БенАмин 40-phe», «БенАмин 70-phe», «БенАмин 75-phe». Все продукты имеют сбалансированный аминокислотный состав, обогащены всеми необходимыми витаминами (А, Е, D, К, С, В1, В2, В6, В12, РР), фолиевой, пантотеновой кислотами, биотином, холином, инозитолом, L-карнитином, минеральными веществами (макро- и микроэлементы: кальций, фосфор, калий, натрий, магний, хлориды, медь, железо, цинк, марганец, йод), пребиотиками с учетом возрастных физиологических потребностей.
Улучшение органолептических свойств СДЛП достигается благодаря использованию форм кристаллических L-аминокислот с повышенной растворимостью и использованию передовых технологий микрокапсулирования. Продукты дополнительно обогащены пребиотиками, оказывающими стимулирующее действие на рост собственной симбиотической кишечной микрофлоры и естественным образом способствующими укреплению иммунной системы. СДЛП не содержат ГМО, ароматизаторы, сахарозу, консерванты, имеют натуральный приятный вкус и запах, формирующий правильные пищевые привычки. Хорошие органолептические свойства СДЛП способны улучшить качество жизни и повысить комплаентность больных ФКУ.
Цель исследования: оценить клиническую эффективность СДЛП для детей, взрослых и беременных женщин, больных ФКУ.
Материал и методы
В амбулаторных условиях проведено открытое многоцентровое проспективное неконтролируемое исследование. В исследование включены 46 пациентов с подтвержденным диагнозом ФКУ, применявших или не применявших СДЛП ранее.
Пациенты или их родители (иные законные представители) подписали письменное информированное согласие на участие в исследовании.
Критерии включения: установленный диагноз ФКУ на основе клинико-биохимических данных; информированное согласие пациента или его законного представителя на участие в исследовании.
Критерии исключения: плохая переносимость СДЛП (аллергические реакции или нарушения стула); острые инфекционные или соматические заболевания, возникшие в ходе исследования; отказ пациента или его законного представителя от участия в исследовании.
Исследуемый продукт (ИП) «БенАмин 13-phe» (далее — ИП-1), разработанный для детей первого года жизни, получали 6 детей (3 мальчика и 3 девочки). Средний возраст детей на момент включения в исследование составил 4,3±2,4 мес. Все дети родились доношенными на сроке 39±1 нед. с нормальными показателями физического развития: при рождении масса мальчиков составила 3590±629 г, девочек — 3166±153 г; длина мальчиков —52,6±2,1 см, девочек — 50,3±0,6 см. Перинатальный период у всех детей был благополучным.
Исследуемый продукт «БенАмин 15-phe» (далее — ИП-2), предназначенный для детей первого года жизни, получали тоже 6 младенцев (4 мальчика и 2 девочки). Средний возраст на момент включения в исследование составил 5,1±3,0 мес. Все дети родились доношенными с нормальными антропометрическими показателями: масса мальчиков составила 3087±643 г, девочек — 3250±353 г; длина мальчиков — 51,8±2,8 см, девочек — 51 см. Перинатального поражения центральной нервной системы не отмечалось ни у одного ребенка.
Группу детей, получавших продукт «БенАмин 20-phe» (далее — ИП-3), составили 6 пациентов (4 мальчика и 2 девочки) в возрасте старше года с установленным диагнозом «классическая ФКУ». Средний возраст детей на момент включения в исследование составил 1,7±0,4 года. Все дети родились доношенными с нормальными показателями физического развития: при рождении масса мальчиков составила 3365±461 г, девочек — 3250±282 г; длина мальчиков — 54±2,2 см, девочек — 50,5±2,1 см. Перинатальный период у всех детей был благополучным.
Группу детей, получавших продукт «БенАмин 40-phe» (далее — ИП-4), составили 8 пациентов (6 мальчиков и 2 девочки) в возрасте 3–8 лет. Средний возраст детей на момент включения в исследование составил 5,3±0,9 года. Все дети родились доношенными на сроке 38±1,5 нед. с нормальными показателями физического развития: при рождении масса мальчиков составила 3441±589 г, девочек — 3395±530 г; длина мальчиков — 52±2 см, девочек — 50,5±2,1 см. Перинатальный период у всех детей был благополучным.
В группу получавших продукт «БенАмин 70-phe» (далее — ИП-5) вошли 12 пациентов: 11 детей (4 мальчика и 7 девочек) старше 6 лет и один взрослый пациент 18 лет. Средний возраст пациентов на момент включения в исследование составил 10,8±2,1 года. Все дети родились в срок с нормальными показателями физического развития.
В группу получавших ИП «БенАмин 75-phe» (далее — ИП-6) вошли 8 пациентов: 6 детей (4 мальчика и 2 девочки) старше 6 лет, мужчина 22 лет и беременная женщина 31 года. Средний возраст детей на момент включения в исследование составил 12±3 года. Все дети родились в срок с нормальными показателями физического развития. Перинатальный период у всех пациентов был благополучным.
СДЛП торговой марки «БенАмин» в 100 г сухого продукта содержит от 13 до 75 г белкового эквивалента. Детям первого года жизни назначают смеси с белковым эквивалентом 13–15, детям старше 1 года назначают смеси с более высоким содержанием белка.
Безопасность и клиническая эффективность разработанных СДЛП у больных ФКУ оценивались в соответствии с принципами надлежащей клинической практики, действующими в странах Евросоюза с 1991 г. (European Good Clinical Practis Guidelines, 1991), на основании результатов осмотра и обследования.
Длительность исследования составила 4 нед., в течение которых предусматривалось 3 визита к врачу-исследователю (дополнительные визиты назначались по показаниям). Во время визитов проводились опрос и сбор информации (жалобы, анамнез жизни (anamnesis vitae) и заболевания (anamnesis morbi)), физикальный осмотр с оценкой физического развития, изучалась медицинская документация (истории болезни, амбулаторные карты, анкеты и пр.), выполнялся анализ на определение в крови уровня аминокислот.
Оценка соматического статуса включала в себя анализ общего состояния и самочувствия пациента, состояния слизистого и кожного покрова, исследование функций сердечно-сосудистой, дыхательной, мочевыводящей систем, желудочно-кишечного тракта и др. Оценивались наличие/отсутствие диспепсических явлений, аллергических реакций, отказов от употребления СДЛП.
Анализ физического развития проводили с использованием модулей программы «WHO Anthroplus 2009» на основании измерения антропометрических показателей (массы и длины тела) с помощью стандартизированных электронных весов и ростомера. Далее оценивали показатели Z-scores массы тела к возрасту, роста к возрасту и индекса массы тела к возрасту при рождении, перед началом и на фоне диетического лечения с применением ИП. Оценка физического развития пациентов базировалась на диагностике отклонений антропометрических показателей от медианы стандартной популяции (Z-scores). Согласно стандартам «WHO Anthroplus 2009» средневозрастными показателями Z-score массы тела и роста считали показатели в пределах +2SD (standard deviation — стандартное отклонение), для Z-score индекса массы тела — от -2SD до +1SD.
Неврологический статус и психомоторное развитие оценивались с помощью методик для определения уровня эмоционального, психического, моторного, речевого развития больных детей различного возраста и взрослых. У детей первого года жизни использовался метод количественной оценки нарушения психомоторного развития Л.Т. Журбы и Е.М. Мастюковой [12].
Всем детям на первом визите был назначен ИП, проведен расчет питания с постепенным переводом ребенка с ранее применяемого СДЛП на ИП, который подбирался в соответствии с Клиническими рекомендациями Минздрава России [5]. При назначении и коррекции диетотерапии оценивали фактическое питание пациентов по разработанным нами анкетам, включавшим режим питания, разовый и суточный объем, характеристику съеденной пищи. Оценивались пищевая ценность лечебных рационов с подсчетом основных нутриентов (белков, жиров и углеводов) и энергетической ценности по таблицам справочника «Химический состав российских пищевых продуктов» и каталога специализированных продуктов детского питания, а также с применением «Норм физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации». Методом расчета аминокислотного скора оценивали биологическую ценность белкового компонента специализированных продуктов на основе аминокислот без ФА.
Клинический и биохимический анализ крови выполнялся в поликлинике по месту жительства спустя 4 нед. после начала применения ИП. Во избежание формирования ятрогенной анемии и с целью ограничения числа инвазивных манипуляций у детей клинический и биохимический анализ крови проводился однократно, при завершении исследования. Биохимический анализ венозной крови включал определение общего белка, аланинаминотрансферазы, аспартатаминотрансферазы, билирубина общего, глюкозы, холестерина, триглицеридов, щелочной фосфатазы, гамма-глютамилтранспептидазы, мочевины, креатинина, натрия, калия, кальция.
Уровень ФА определялся трижды: до начала лечения, через 2 нед. применения препарата и при завершении исследования. Для анализа использовалась периферическая кровь, взятая на бланк-фильтр (форма № 903) утром натощак не ранее чем через 3 ч после еды.
Анализ проводился стандартным флуориметрическим методом. Допустимый безопасный показатель ФА крови у детей 0–12 лет применявших СДЛП, должен составлять 2–6 мг/дл, 13–15 лет — 2–10 мг/дл, старше 16 лет — 2–15 мг/дл, у беременных женщин — в зависимости от срока гестации: в I триместре — 1,6–4,2 мг/дл, во II триместре — 1,6–7,5 мг/дл, в III триместре — 1,6–10 мг/дл [5].
Уровень тирозина и других аминокислот определяли методом тандемной масс-спектрометрии с использованием сертифицированного набора NeoBase MS/MSkit (Perkin Elmer, Финляндия). Анализ проводился до начала диетотерапии и через 4 нед. ее применения. Преимущество данного метода заключается в возможности одномоментного исследования спектра аминокислот в периферической крови. Для анализа использовались образцы крови, взятые для определения ФА. Референсные значения уровня тирозина крови составляют: у детей от 8 дней до 6 мес.— 10–300 мкМ/л, старше 6 мес.— 15–235 мкМ/л. Референсные значения соотношения ФА/тирозина крови: от 8 дней до 6 мес.— 0,15–6,1, старше 6 мес.— 0,15–6,5.
Статистическая обработка клинических данных проводилась стандартными методами с применением пакета компьютерных программ Statistica, Microsoft office. Достоверность отличий между группами определялась с помощью непараметрического критерия Манна — Уитни. Уровень статистической значимости различий принимали равным р<0,05.
Результаты и обсуждение
На протяжении 4 нед. все пациенты успешно принимали ИП, показавшие хорошие вкусовые качества. Диспепсических явлений, нарушений стула, аллергических реакций на протяжении всего исследования не зарегистрировано. Пациенты и их родители отметили хорошую растворимость смесей, более приятный запах по сравнению с ранее использовавшимися СДЛП.
Биохимические показатели белкового, жирового и углеводного обмена не выходили за пределы нормальных значений. Отсутствовали признаки электролитных нарушений и изменений кальциево-фосфорного обмена. Показатели клинического анализа крови, в т. ч. гемоглобина, соответствовали возрастной норме.
В результате применения ИП средний уровень ФА крови снизился и находился в пределах безопасных значений (рис. 1). Динамика показателей ФА, тирозина и индекса массы тела отражена в таблице 1.
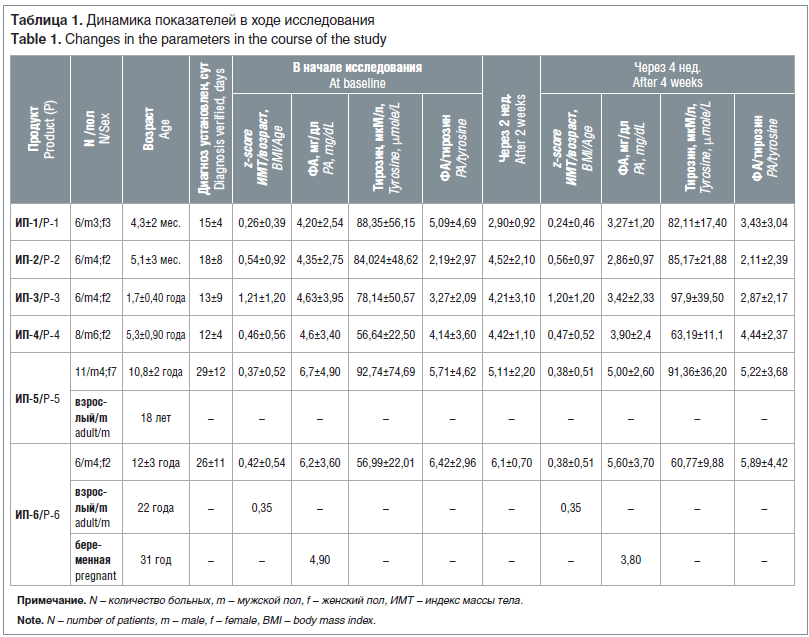
Темпы физического развития к концу исследования соответствовали средневозрастным значениям. Отмечалась удовлетворительная прибавка массы и длины.
У двоих детей до приема ИП были выявлены сухость кожи, экзантема. Спустя 4 нед. приема ИП экзантема у всех больных разрешилась, кожа стала чистой. Соматический и неврологический статус у всех пациентов — без патологии.
Беременная женщина (возраст 31 год) была включена в исследование на сроке 24–25 нед. гестации, беременность у нее была первая, в I триместре отмечался токсикоз. Пациентка успешно принимала ИП-6, показатели ФА крови, а также клинического и биохимического анализа находились в пределах нормы. Вес до беременности был 51 кг. За первые 3 мес. беременная потеряла в весе 4 кг в связи с токсикозом. На первом визите вес женщины был 52 кг. К концу исследования ее вес составил 53,2 кг, за 4 нед. прибавка составила 1,2 кг (средняя еженедельная прибавка — 300 г), что соответствует норме весовой прибавки беременных.
Согласно патогенезу ФКУ нарушение метаболизма ФА приводит к нарушению синтеза незаменимой аминокислоты тирозина. Тирозин играет важную роль в биосинтезе нейромедиаторов головного мозга (эпинефрина, норэпинефрина и допамина), тироксина и меланина в коже. Уровень тирозина у больных ФКУ может значительно колебаться в течение суток и имеет наиболее низкие значения в утренние часы, особенно при длительном голодании, и существенно возрастает сразу после приема пищи [13]. Более того, одна из гипотез формирования умственной отсталости у детей с ФКУ обусловлена недостатком синтеза нейромедиаторов и тиреоидных гормонов, вызванным дефицитом тирозина [14]. А значит, важной задачей диетотерапии является поддержание стабильной нормальной концентрации тирозина в крови, не допускающее критического его снижения. Достигнуть этого можно обогащением СДЛП тирозином и дробным (не реже 4 р./сут) приемом СДЛП. Последнее часто не реализуется из-за низкой комплаентности по причине неприятного вкуса аминокислотных смесей. Улучшенные органолептические свойства ИП значительно изменили отношение больных к СДЛП.
В естественном белке на долю тирозина приходится около 4%, а на долю ФА — 4,5–5,0%. В норме 67–90% ФА превращаются в тирозин. Таким образом, содержание тирозина в лечебном питании должно быть не менее 7,5–8,0% с учетом покрытия дефицита тирозина, синтезированного из ФА.
ИП содержат больше тирозина в сравнении с некоторыми зарубежными аналогами. Так, содержание тирозина в ИП составляет примерно 12,5% на 100 г белка.
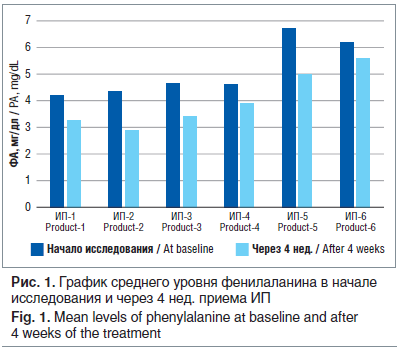
Исследование концентрации тирозина в крови у пациентов после завершения исследования показало некоторое его повышение, однако это повышение было статистически незначимым (р>0,05) (рис. 2). Тем не менее есть отличие по значению SD, что говорит о более однородном распределении значений тирозина у пациентов, получавших ИП, и существенной отдаленности этого показателя от нижней границы нормы почти у всех больных. При применении ИП не отмечалось крайне низкого и превышающего нормальные значения уровня тирозина.
Соотношение ФА/тирозин снизилось через 4 нед. приема ИП, но не достигло статистически значимого различия. В целом прослеживается тенденция к улучшению по показателям концентрации тирозина крови в исследуемой когорте.
Исследование спектра аминокислот в крови у больных, принимающих ИП, показало, что уровень других незаменимых аминокислот находился внутри референсных пределов, что указывает на сбалансированность ИП по аминокислотному составу и хорошую биодоступность нутриентов смеси.
Заключение
Специализированные продукты на основе аминокислот без ФА — главный источник белка для больных ФКУ. Благодаря развитию современных технологий созданы новые отечественные продукты с оптимизированным аминокислотным, а также макро- и микронутриентным составом, что повышает их биологическую ценность. Продукты обогащены тирозином и позволяют поддерживать концентрацию тирозина в пределах нормальных значений. Улучшенные органолептические свойства смесей способствуют частому дробному их приему в течение дня, а рецептурный состав продуктов на основе аминокислот без ФА соответствует рекомендуемым нормам потребления основных пищевых веществ. Проведенное исследование показало высокую клиническую эффективность и переносимость исследуемых СДЛП, что выражалось в снижении уровня ФА после употребления ИП уже в течение 4 нед. (включая детей первого года жизни) на 25–35%. Таким образом, ИП полностью соответствуют требованиям к питанию больных, страдающих наследственными нарушениями обмена ФА.
Сведения об авторах:
1Семенова Наталия Александровна — к.м.н., врач-генетик, старший научный сотрудник, ORCID iD 0000-0001-7041-045X;
1Байдакова Галина Викторовна — к.б.н., ведущий научный сотрудник, ORCID iD 0000-0001-8806-5287;
2Никитина Наталья Викторовна — врач-генетик, заведующая отделением, ORCID iD 0000-0002-2811-4718;
2Подолина Валентина Константиновна — врач-педиатр, ORCID iD 0000-0003-1854-0040;
3Беляшова Елена Юрьевна — врач-генетик, заведующая отделением, ORCID iD 0000-0002-7289-9532;
3Кузнецова Вера Николаевна — к.м.н., врач-генетик, ORCID iD 0000-0002-7624-0639;
4Кочегурова Елена Михайловна — к.м.н., врач-генетик, заведующая отделением, ORCID iD 0000-0003-4473-528X;
5Андреева Лилия Петровна — к.м.н., врач-генетик, ORCID iD 0000-0001-8700-7325;
5Хайлова Ольга Николаевна — врач-генетик, ORCID iD 0000-0002-7428-1488;
1Куцев Сергей Иванович — д.м.н., профессор, член-корреспондент РАН, директор, ORCID iD 0000-0002-3133-8018.
1ФГБНУ «МГНЦ». 115478, Россия, г. Москва, ул. Москворечье, д. 1.
2ГБУЗ СО «КДЦ «ОЗМР». 620041, Россия, г. Екатеринбург, ул. Флотская, д. 52.
3ГАУЗ «ООКБ № 2». 460000, Россия, г. Оренбург, ул. Невельская, д. 24.
4ГБУЗ ТО «ОКПЦ им. Е.М. Бакуниной». 170036, Россия, г. Тверь, Санкт-Петербургское ш., д. 115, к. 3.
5ГУЗ «СОДКБ». 410028, Россия, г. Саратов, ул. Вольская, д. 6.
Контактная информация: Семенова Наталия Александровна, e-mail: semenova@med-gen.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 31.06.2019.
About the authors:
1Nataliya A. Semenova – MD, PhD, geneticist, Senior Researcher, ORCID iD 0000-0001-7041-045X;
1Galina V. Baydakova – PhD (biology), Leading Researcher, ORCID iD 0000-0001-8806-5287;
2 Nataliya V. Nikitina – MD, geneticist, Head of the Department, ORCID iD 0000-0002-2811-4718;
2Valentina K. Podolina – MD, pediatrician, ORCID iD 0000-0003-1854-0040;
3Elena Yu. Belyashova – MD, Head of the Department, ORCID iD 0000-0002-7289-9532;
3Vera N. Kuznetsova – MD, PhD, geneticist, ORCID iD 0000-0002-7624-0639;
4Elena M. Kochegurova – MD, PhD, geneticist, Head of the Department, ORCID iD 0000-0003-4473-528X;
5Liliya P. Andreeva – MD, PhD, geneticist, ORCID iD 0000-0001-8700-7325;
5Olga N. Khaylova – MD, geneticist, ORCID iD 0000-0002-7428-1488;
1Sergey I. Kutsev – MD, PhD, Professor, Corresponding Member of RAS, Director, ORCID iD 0000-0002-3133-8018.
1Research Centre for Medical Genetics. 1, Moskvorechie str., Moscow, 115522, Russian Federation.
2Clinical and Diagnostic Center “Protection of Health of Mother and Child”. 52, Flotskaya str., Yekaterinburg, 620041, Russian Federation.
3Orenburg Regional Clinical Hospital No. 2. 24, Nevelskaya str., Orenburg, 460000, Russian Federation.
4E.M. Bakunina Regional Clinical Perinatal Center. 115 build. 3, St. Petersburg highway, Tver, 170036, Russian Federation.
5Saratov Regional Children's Clinical Hospital. 6, Vol-skaya str., Saratov, 410028, Russian Federation.
Contact information: Nataliya A. Semenova, e-mail: semenova@med-gen.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 31.06.2019.












