Введение
Монохориальное многоплодие является беременностью высокого риска из-за значительной частоты развития ряда специфических осложнений, патофизиологическая причина которых связана с наличием в монохориальной плаценте сосудистых анастомозов между системами гемоциркуляции обоих плодов [1]. В настоящее время прогноз при развитии осложнений при монохориальном многоплодии зависит от раннего начала лечения и метода коррекции: при отсутствии лечения частота перинатальных потерь составляет 80–100% [2].
Потенциально несбалансированные сосудистые анастомозы приводят к развитию синдрома фето-фетальной трансфузии (СФФТ) в 10–15% случаев монохориальной многоплодной беременности. СФФТ обычно возникает между 15-й и 26-й неделями. Диагноз СФФТ традиционно ставится на основании наличия маловодия с максимальным вертикальным карманом у плода-донора 2 см и плода-реципиента более 8 см [3, 4]. Клинические рекомендации по многоплодной беременности регламентируют проведение УЗИ при монохориальном многоплодии каждые 2 нед. для диагностики СФФТ [4]. Однако некоторые случаи СФФТ могут быть пропущены даже в течение 2-недельного интервала, а другие потеряны из-за поздней диагностики. Такой подход, требующий привлечения значительного количества медицинских и экономических ресурсов, влияет на психологическое состояние пациенток, тогда как в большинстве (85%) случаев монохориального многоплодия трансфузионный синдром не развивается [5]. Таким образом, попытки предсказать, какие монохориальные многоплодные беременности подвержены повышенному риску развития СФФТ, оправданы. Раннее прогнозирование СФФТ сможет улучшить исходы беременности, одновременно снизив нагрузку на семью и систему здравоохранения.
Ранними проявлениями гемодинамического дисбаланса, развивающегося при СФФТ, могут быть увеличение толщины воротникового пространства (ТВП) одного плода более 95-го перцентиля и/или его дискордантность между близнецами более 0,6 мм, а также изменение кровотока в венозном протоке у одного из плодов [6–8]. Несмотря на то, что увеличение ТВП одного из плодов, разница в ТВП между плодами и аномальный кровоток в венозном протоке показали себя в качестве ранних признаков гемодинамического дисбаланса, возникающего при СФФТ, чувствительность данных предикторов развития СФФТ низкая, а опубликованные данные о прогнозе развития СФФТ по изменению кровотока в венозном протоке и увеличению ТВП не однозначны [9].
В качестве ранних маркеров СФФТ предлагались и другие эхографические признаки, такие как дискордантность по количеству амниотической жидкости [10], обнаружение артерио-артериальных анастомозов (ААА) [11], складка межплодовой перегородки [12] и изменение уровня циркулирующей материнской мРНК [13].
Таким образом, наряду со стандартными ультразвуковыми маркерами СФФТ в I триместре, существует ряд потенциальных показателей, которые могут войти в прогностическую модель развития трансфузионного синдрома и улучшить раннюю диагностику данного осложнения.
Цель исследования: оценить роль ультразвуковых маркеров I триместра в прогнозировании СФФТ при монохориальной двойне.
Материал и методы
Проведено проспективное исследование с участием 178 пациенток с монохориальной диамниотической двойней в I триместре беременности (11+0 — 14+0 нед.) в период с января 2016 г. по сентябрь 2022 г., которые проходили УЗИ 1 раз в 2 нед. в КДО ФГБУ «НИИ ОММ» Минздрава России г. Екатеринбурга и ГБУ «ОПЦ» г. Челябинска.
Пациенток после инвазивной диагностики, проведенной в I триместре беременности, и c врожденными пороками развития в исследование не включали.
Ультразвуковое сканирование выполняли в соответствии с четко определенным протоколом опытные специалисты по УЗИ на аппаратах Voluson E10 и E8 (GE Healthcare, США) [4]. Все пациентки были проинформированы о СФФТ и его возможном развитии при последующих посещениях.
В процессе исследования были сформированы 2 группы. В первую группу вошли пациентки, у которых в дальнейшем был диагностирован СФФТ (n=68). Вторую группу составили пациентки, у которых беременность протекала без трансфузионного синдрома (n=110). Пациенткам с СФФТ II–IV стадий в ФГБУ «НИИ ОММ» Минздрава России лазерную коагуляцию плацентарных анастомозов проводили в качестве терапии первой линии (n=57). При выраженной задержке роста одного из плодов при диссоциации более 40%, связанной с неблагоприятным прогнозом для жизни близнеца, в качестве альтернативного лечения предлагалась селективная лазерная коагуляция сосудов пуповины (n=7). После 26 нед. беременности при диагностике СФФТ проводилось родоразрешение.
Статистический анализ данных проводили с помощью программного обеспечения: Microsoft Office, Ехсеl 2016, SPSS 23.0.0 (IBM, США). Для количественных переменных проверка нормального распределения признаков проводилась с помощью критерия Шапиро — Уилка. В случае подтверждения нормальности распределения признака рассчитывали средние арифметические значения и стандартные отклонения (M±SD), в противном случае — медиану, 25-й и 75-й процентили. Для показателей, характеризующих качественные признаки, указывали абсолютное значение и относительную величину в процентах. Для величин, имеющих нормальное распределение, сравнение в двух независимых группах проводилось с помощью Т-критерия Стьюдента. Для параметров, не имеющих нормального распределения, сравнение двух независимых групп проводилось с помощью критерия Манна — Уитни.
Признаки в унивариантном анализе с р<0,2 были выбраны для потенциального включения в многомерные модели прогноза. Модели прогноза построены с помощью линейного дискриминантного анализа (LDA). Использовали следующие настройки программного обеспечения при выполнении LDA: метод прямой пошаговый (Fвкл.=3,84, Fискл.=2,71). Статистическую значимость модели оценивали по статистике лямбда Уилкса. Дискриминантную способность модели оценивали с помощью коэффициента канонической корреляции (R2): чем ближе R2 к единице, тем больше разделительная способность модели. Точность классификации представлена специфичностью и чувствительностью и их средним значением.
Результаты исследования
За период исследования наблюдалось 178 беременностей с монохориальной диамниотической двойней, начиная с I триместра. Средний возраст матери составил 30±6 лет, 31 (47%) пациентка была первородящей. У 98 (55%) женщин беременность наступила в результате применения вспомогательных репродуктивных технологий. СФФТ диагностирован у 65 (36,5%) из 178 пациенток с 16-й по 26-ю неделю беременности, у 3 (1,6%) — в 27–29 нед., диагностики СФФТ до 16 нед. беременности в данном исследовании не было. Тяжесть СФФТ оценивали по классификации Квинтеро: I стадия зарегистрирована у 5 (7,32%) пациенток, II стадия — у 8 (11,7%), III стадия — у 39 (57,3%), IV стадия — у 10 (14,7%), V стадия — у 6 (8,8%). Выживаемость плодов составила 118/129 (91,4%) (в семи наблюдениях остался 1 плод в результате коагуляции пуповины и регресса этого плода во II триместре, эти плоды не учитывались, т. е. общее число плодов составило 129). Тяжелая неонатальная заболеваемость наблюдалась у 10/118 (8,4%), а поражение центральной нервной системы было диагностировано у 6/118 (5%) новорожденных.
Перед разработкой инструментов многомерного прогнозирования рисков были определены и исследованы прогностические факторы (предикторы), которые могут быть включены в модель. На первом этапе были исследованы традиционные маркеры I триместра, которые, по данным литературы, являются наиболее значимыми в прогнозировании СФФТ. В результате нашего исследования мы получили значимое увеличение дискордантности ТВП (0,6 см) у плодов с СФФТ (р=0,036). Увеличение пульсационного индекса (ПИ) кровотока в венозном протоке у одного из плодов выше нормативных значений и значительная разница этих показателей у плодов из монохориальной двойни были выявлены у пациенток с СФФТ (р=0,036).
Дискордантность роста близнецов в I триместре беременности обычно бывает проявлением неравномерного разделения плаценты или гемотрансфузии и значительно реже вызывается генетическими или хромосомными аномалиями [5]. Результаты нашего исследования также показали значительное отличие по разнице копчиково-теменного размера (∆КТР) в случае развития СФФТ (р=0,046; рис. 1).
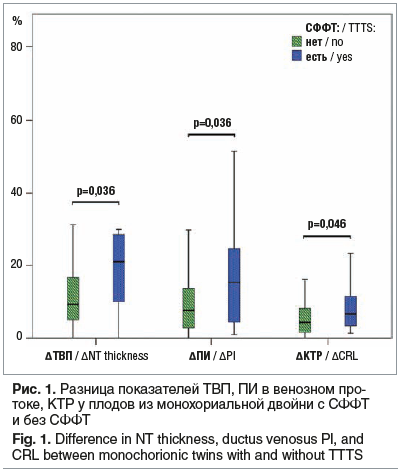
По данным исследования трех маркеров (разница ТВП (∆ТВП), кровотока в ВП (∆ПИ) и ∆КТР) чувствительность модели составила 71%, специфичность — 71%, что не является достаточным для создания прогностической модели (для создания прогностической модели чувствительность должна составлять более 80%).
На втором этапе были проанализированы другие ультразвуковые признаки, которые при сравнении между группами с СФФТ и без СФФТ показали значимость различий <0,2 и рассматривались как потенциальные для модели логистической регрессии (см. таблицу).
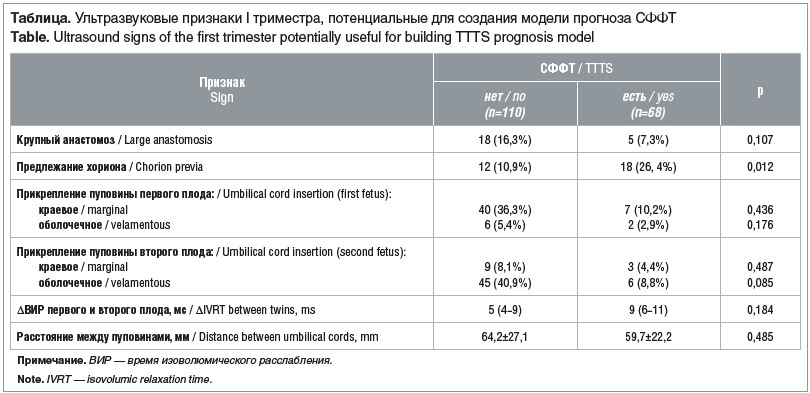
В ходе исследования выявлена прогностическая ценность признака «предлежание хориона (ПХ)» в развитии СФФТ (р=0,012), что является новым маркером прогноза. Окончательное ремоделирование плаценты происходит в конце I — начале II триместра беременности, что делает возможным оценку плацентарных крупных анастомозов уже в ходе первого скрининга при допплеровском исследовании.
Результаты исследования показали, что частота формирования СФФТ была ниже в группе монохориальных двоен с ААА, выявленными при допплеровском исследовании (18/110, 16,3%), по сравнению с группой без ААА (5/68, 7,3%). Однако эта разница не была статистически значимой (р=0,107). ААА представляют собой прямые поверхностные анастомозы «конец в конец», расположенные на хорионической пластинке. Кровоток через эти анастомозы, как правило, двунаправленный. Однако, по результатам нашего исследования, при СФФТ у 4 (5,8%) пациенток отмечалась несбалансированная форма кривой кровотока, когда стабильно преобладал сигнал с одной стороны изолинии (рис. 2).

Несмотря на то, что клиническая картина СФФТ развивается не раньше 16 нед. беременности, ранние признаки нарушения сердечной функции могут проявляться уже в I триместре. Оценить время изоволюмического расслабления (ВИР) левого желудочка сердца плода как маркера нарушения диастолической функции сердца плода в режиме импульсного допплера возможно в ранние сроки беременности. В ходе исследования разница ВИР (∆ВИР) в I триместре у плодов в группе с СФФТ была выше, чем в группе без СФФТ, однако статистически значимой разницы получить не удалось (р=0,184).
Чувствительность дискриминантной модели, построенная на двух признаках, ∆ВИР и ∆ТВП, которые, по нашему мнению, имеют потенциальную патогенетическую связь с формированием сердечной недостаточности у плодов в I триместре, не превышала 63% и не была включена в прогностическую модель развития СФФТ (рис. 3).

По результатам исследования с помощью логистической регрессии была построена прогностическая модель СФФТ по следующим ультразвуковым признакам: ПХ, ∆КТР, ∆ТВП (абсолютная разность ТВП), увеличение ПИ в венозном протоке более 95-го процентиля (рис. 4).

Полученные характеристики (чувствительность 81% и специфичность 81%) удовлетворяют нашим требованиям, поэтому на основании данной статистической модели прогноза мы планируем разработку специализированного калькулятора, который будет удобно использовать в клинической практике для прогнозирования СФФТ в I триместре беременности.
С помощью логистической регрессии была построена прогностическая модель СФФТ по следующим ультразвуковым признакам: ПХ, КТР, ТВП, ПИ в венозном протоке: F=2,07 × ПХ + 0,08 × (КТР1 - КТР2) + 4,45 × ПИ_2 + 2,12 × |ТВП>3| - 7,52. p = 1 / (1 + e-F). При p<0,25 пациентка имеет низкий риск СФФТ, если p≥0,25, то пациентка относится к группе высокого риска формирования СФФТ и требует в дальнейшем консультации в центре фетальной хирургии.
Обсуждение
Результаты настоящего исследования подтверждают концепцию прогнозирования СФФТ по результатам УЗИ в I триместре беременности. Несмотря на то, что увеличение ТВП одного из плодов, разница в ТВП между плодами и аномальный кровоток в венозном протоке показали себя в качестве ранних признаков гемодинамического дисбаланса, возникающего при СФФТ, опубликованные данные не однозначны. Разница ТВП плодов имеет удовлетворительную чувствительность и специфичность в прогнозировании тяжелых случаев СФФТ, однако такой скрининг до сих пор связан со значительными ложноположительными и ложноотрицательными результатами, так как частота обнаружения СФФТ составляет всего 52% [8]. Использование комбинации маркеров — аномального кровотока в венозном протоке и изменений ТВП — повышает прогностическую значимость данных параметров. Так, по мнению некоторых авторов при дискордантности ТВП у плодов ≥0,6 мм и аномальном кровотоке в венозном протоке риск развития СФФТ увеличивается в несколько раз [6, 7]. В 2017 г. V. Stagnati et al. [9] при проведении метаанализа прогностической точности ультразвуковых маркеров I триместра для последующего развития СФФТ отметили более низкую чувствительность ∆КТР по сравнению с ∆ТВП и повышением ПИ в венозном протоке, что может быть связано c ограничением роста плода-донора только в двух третях случаев. В одной трети случаев СФФТ без задержки роста донора несоответствие КТР в I триместре могло снизить прогностическую эффективность трех ультразвуковых маркеров.
Таким образом, при УЗИ необходимо определить монохориальность, увеличение ТВП >95-го процентиля у одного из плодов, ∆КТР у плодов 0,6 мм или патологический кровоток в венозном протоке, что повышает вероятность осложненного течения монохориального многоплодия. Однако прогностическая точность этих трех общепринятых маркеров недостаточна для внесения каких-либо изменений в клинические рекомендации по ведению многоплодной беременности. В связи с этим L. Lewi et al. [3] предложили формулу для прогнозирования СФФТ, объединяющую результаты УЗИ в I и II триместрах. Дискордантность амниотической жидкости и дискордантность КТР≥12 мм рассматривались в I триместре, в то время как места прикрепления пуповины и окружности живота оценивались на 16-й неделе беременности. Различные комбинации этих результатов соответствовали разным уровням риска развития СФФТ. Более того, авторы пришли к выводу, что более 50% вероятности осложненного исхода было связано с наличием дискордантности амниотической жидкости и мест прикрепления пуповины, определяемого как сочетание центрального прикрепления пуповины у одного близнеца и эксцентричного — у другого. Однако другие исследования [14–16] не подтвердили взаимосвязь между оболочечным прикреплением пуповины и СФФТ. Вероятно, СФФТ ассоциирован в большей степени с несбалансированным переливанием крови от одного плода другому, чем со снижением кровотока к плоду за счет оболочечного прикрепления пуповины. В нашем исследовании частота оболочечного прикрепления пуповины была одинаковой в группах с СФФТ и без СФФТ. Поэтому оболочечное прикрепление пуповины не было выбрано для создания модели прогноза СФФТ. A. Fichera et al. [11] в 2005 г. в качестве ультразвукового предиктора СФФТ предложили использовать наличие крупного ААА в плаценте, но в дальнейшем данный признак не нашел широкого использования в качестве прогностического маркера при СФФТ. В нашем исследовании наличие крупного анастомоза в плаценте с несбалансированной формой кривой кровотока мы определили как один из значимых ультразвуковых признаков при формировании СФФТ. Однако отсутствие достаточной статистической мощности не позволило нам включить данный маркер в прогностическую модель СФФТ.
Ранее нами была установлена разница показателей ВИР при тяжелом СФФТ более 9 мс во II триместре беременности [17]. Однако в литературе мы не встретили исследований данного показателя в I триместре при монохориальном многоплодии. В ходе настоящего исследования мы не получили достоверной разницы этого показателя в исследуемых группах, чтобы включить разницу ВИР в модель прогноза. Вероятно, в I триместре беременности, когда плацента еще находится в процессе формирования, сердечная дисфункция у плодов не выражена настолько, чтобы ее можно было зафиксировать при измерении ВИР в допплеровском режиме. В то же время данный маркер заслуживает внимания при прогнозировании СФФТ в 16 нед. беременности, когда плацента уже сформировалась.
Нами выявлено, что в группе с СФФТ достоверно чаще встречалось ПХ. В ходе литературного поиска примеров использования данного маркера для прогноза СФФТ не найдено. Известно, что кровоснабжение матки на 40% хуже в нижнем сегменте относительно дна и стенок. Имплантация хориона в нижних отделах матки при монохориальном многоплодии сопровождается ишемией и сосудистыми нарушениями, что в дальнейшем может привести к дисбалансу кровообращения и развитию СФФТ [18]. Однако данное предположение требует дальнейшего изучения. В нашем исследовании ПХ было включено в математическую модель наряду с традиционными признаками, что позволило повысить чувствительность модели прогноза СФФТ в I триместре беременности до 81%.
Проанализировав данные литературы, чувствительность и специфичность моделей c применением маркеров I триместра беременности для прогноза развития СФФТ во II триместре беременности, мы пришли к выводу, что разработанная в ходе настоящего исследования модель имеет наилучшие возможности.
Заключение
В ходе настоящего исследования выявлен новый маркер прогнозирования риска в I триместре беременности — ПХ, а также прогностические факторы, которые требуют оценки в более крупной проспективной серии монохориальных многоплодных беременностей. При наличии способа прогнозирования тяжелого течения осложнений монохориального многоплодия на ранних этапах беременности появляется дополнительная возможность стратифицировать пациенток. Это позволит увеличить кратность УЗИ у пациенток группы высокого риска до 1 раза в неделю или чаще, укажет на необходимость маршрутизации пациенток в специализированные учреждения, что поможет снизить число неблагоприятных исходов.
Сведения об авторах:
Маркова Татьяна Владимировна — к.м.н., ведущий научный сотрудник ФГБУ «НИИ ОММ» Минздрава России; 620014, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0002-4882-8494.
Косовцова Наталья Владимировна — д.м.н., руководитель отдела биофизических методов исследования, врач высшей категории, ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0002-4670-798Х.
Шумаков Сергей Юрьевич — заведующий отделением «Клиника одного дня» ГБУЗ «ОПЦ»; 454076, Россия, г. Челябинск, ул. Воровского, д. 70, стр. 12; ORCID iD 0009-0003-2510-2660.
Чумарная Татьяна Владимировна — к.б.н., старший научный сотрудник лаборатории математической физиологии ИИФ УрО РАН; 620049, Россия, г. Екатеринбург, ул. Первомайская, д. 106.
Ермак Елена Михайловна — д.м.н., профессор кафедры онкологии, лучевой диагностики и лучевой терапии ФГБОУ ВО ЮУГМУ Минздрава России; 454092, Россия, г. Челябинск, ул. Воровского, д. 64; ORCID iD 0009-0002-8534-6504.
Поспелова Яна Юрьевна — к.м.н., врач ультразвуковой диагностики, аспирант ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0002-9988-1199.
Контактная информация: Маркова Татьяна Владимировна, e-mail: ta.ma.vl@mail.ru.
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 11.07.2023.
Поступила после рецензирования 03.08.2023.
Принята в печать 28.08.2023.
About the authors:
Tat'yana V. Markova — C. Sc. (Med.), leading researcher, Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620014, Russian Federation; ORCID iD 0000-0002-4882-8494.
Natal'ya V. Kosovtsova — Dr. Sc. (Med.), Head of the Division of Biophysical Methods, Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620014, Russian Federation; ORCID iD 0000-0002-4670-798Х.
Sergey Yu. Shumakov — Head of the Department "One-day Clinic", Regional Perinatal Center; 70, build. 12, Vorovskiy str., Chelyabinsk, 454076, Russian Federation; ORCID iD 0009-0003-2510-2660.
Tat'yana V. Chumarnaya — C. Sc. (Biol.), senior researcher of the Laboratory of Mathematic Physiology, Institute of Immunology and Physiology of the Ural Branch of the RAS; 106, Pervomaiskaya str., Yekaterinburg, 620049, Russian Federation.
Elena M. Ermak — Dr. Sc. (Med.), professor of the Department of Oncology, Radiology, and Radiotherapy, South Ural State Medical University; 64, Vorovskiy str., Chelyabinsk, 454092, Russian Federation; ORCID iD 0009-0002-8534-6504.
Yana Yu. Pospelova — C. Sc. (Med.), ultrasound specialist, post-graduate student, Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620014, Russian Federation; ORCID iD 0000-0002-9988-1199.
Contact information: Tat'yana V. Markova, e-mail: ta.ma.vl@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 11.07.2023.
Revised 03.08.2023.
Accepted 28.08.2023.












