Введение
Гидраденит супаратива / акне инверса (ГС/АИ) — заболевание, известное ранее как синдром фолликулярной окклюзии. Этот термин был введен D.M. Pillsburry, W.B. Shelley и А.М. Kligman в 1956 г. [1]. Нынешнее название применяется с 2006 г., когда оно (после долгого периода путаницы в терминологии) было утверждено на 1-й Международной конференции по ГС/АИ в Дессау (Германия).
По разным данным, распространенность заболевания в мире колеблется от 1% до 4%. Женщины подвержены ГС/АИ в 3 раза чаще, чем мужчины [2, 3].
Долгое время процесс описывался в виде триады: конглобатные акне и инверсные акне, гидраденит и подрывающий фолликулит или перифолликулит головы [4]. И только в 1975 г. был описан четвертый компонент — пилонидальная киста [1]. Все проявления на коже, несмотря на разную локализацию, характеризуются общим патогенезом и сходными гистопатологическими изменениями, в основе которых лежит фолликулярная гиперкератинизация.
Этиология и патогенез ГС/АИ на сегодняшний день до конца не изучены, поэтому современная медицина не способна представить универсальный протокол лечения таких пациентов.
В основе патогенеза заболевания лежит окклюзия волосяных фолликулов, которая в 30–40% случаев обусловлена генетической предрасположенностью к акне [5], гиперкератинизацией и образованием лимфогистиоцитарного воспаления с гранулематозной реакцией. Только в небольшой части случаев (в 4 из 12) наблюдалось воспаление в апокриновых железах, сопровождавшееся воспалением вокруг эккринных желез, волосяных фолликулов и структур, выстланных эпителием. Эти наблюдения свидетельствуют о том, что структуры, выстланные плоским эпителием, вероятно, представляют собой аномальные расширенные волосяные фолликулы, являются более постоянной диагностической особенностью при гнойном гидрадените, чем при воспалении апокриновых желез, которое, по-видимому, является вторичным явлением [6]. Фолликулярная окклюзия приводит к растяжению и разрыву фолликулов с выходом содержимого в окружающую дерму, что способствует миграции нейтрофилов и лимфоцитов в очаг воспаления [7–9], формируя воспалительный инфильтрат с последующим образованием рубцовой ткани [10].
Общепризнанным является тот факт, что бактерии не влияют на развитие заболевания, но вторичная бактериальная инфекция поддерживает воспалительный процесс и способствует рецидивированию [11].
Гистологическая картина при ГС/АИ не имеет специфических критериев. Поэтому в современной дерматологии до сих пор диагноз устанавливается на основании клинической картины заболевания. При патоморфологическом исследовании на ранних стадиях обнаруживают фолликулярную окклюзию с наличием или отсутствием воспаления, фолликулярные кисты, уменьшение объема сальной железы, гиперплазию, нейтрофильные абсцессы [6]. В тяжелых случаях обнаруживают В-клетки и плазматические клетки в псевдофолликулах, абсцессах и пазухах, окруженные хроническим воспалительным инфильтратом, с наличием гистиоцитов и гигантских клеток, а также большое количество грануляционной ткани [12].
Локализации процесса, путаница в терминологии и отсутствие специфических гистологических изменений часто являются причинами неправильной диагностики — дерматологи ориентируются в описании клинической картины только на проявления воспалительного процесса, упуская из виду распространенность высыпаний и формирование абсцессов. Результатом этого являются ошибочные диагнозы: гидраденит или вульгарные акне, что влечет за собой отсутствие терапевтического успеха.
Дебютирует ГС/АИ, как правило, после полового созревания с небольших красных плотных папул или, реже, пустул, которые, постепенно увеличиваясь в размерах, сливаются с окружающими тканями. Постепенно дерматоз трансформируется в хронический воспалительный рецидивирующий процесс с наличием псевдокомедонов, болезненных папул, расположенных в глубоких слоях кожи, с тенденцией к формированию абсцессов, сливающихся в синусы, и с разрешением процесса в рубцы [2–5]. Несомненно, внешне процесс может напоминать вульгарные акне или гидраденит (в зависимости от локализации высыпаний), особенно в самом начале развития, а с учетом возраста пациентов в большинстве случаев такие высыпания определяются как юношеские акне.
Однако высыпания при ГС/АИ связаны с апокриновыми потовыми железами и кроме лица имеют другие типичные места локализации — это преимущественно подмышечная, паховая и аногенитальная области. Также отмечены случаи ГС/АИ в области живота. У женщин заболевание часто развивается в грудной складке, в области промежности, у мужчин — в анальной зоне [8, 13]. Внимание дерматолога может привлечь также то, что содержимое элементов не эвакуируется, а остается внутридермально в виде округлых подкожных образований [14, 15] (рис. 1, 2).
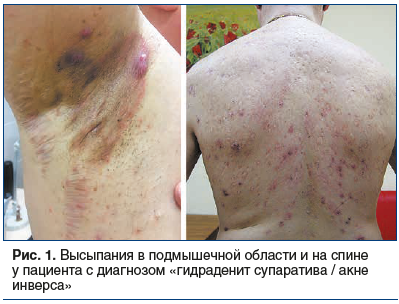
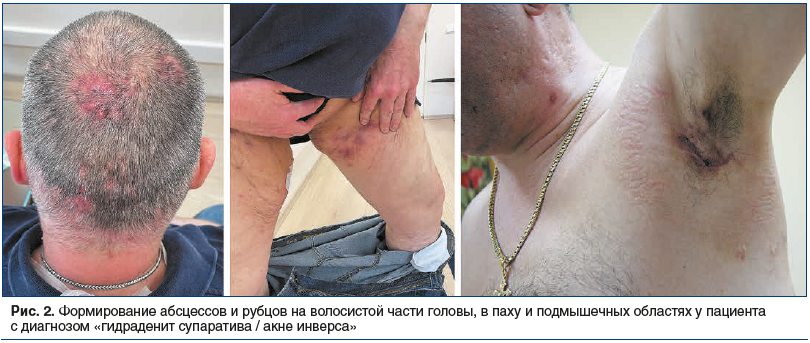
По мере нарастания кожной симптоматики присоединяются общие симптомы. Пациенты жалуются на боль, жжение, обильное потоотделение, слабость, в тяжелых случаях — на невозможность ходить или сидеть, а также на неприятный запах. Такое состояние может продолжаться в течение длительного времени, и, что важно отметить, отсутствует положительная реакция на терапию антибиотиками [5, 16, 17].
Диагностика ГС/АИ
Критерии диагностики заболевания утверждены на 2-м Международном симпозиуме по ГС/АИ (Second International Hidradenitis suppurativa research symposium, 2009). Для постановки диагноза необходимо наличие трех обязательных критериев [18]:
-
Поражения: в начальных стадиях заболевания — глубокие болезненные узлы, абсцессы, дренирующие синусы, рубцы. Вторичные поражения — открытые комедоны по типу «надгробий».
-
Локализация: подмышечная, паховая, анальная области, область промежности, область живота.
-
Хроническое течение с наличием рецидивов.
Проводя дифференциальную диагностику, в первую очередь следует обратить внимание на нетипичные для вульгарных акне места локализации (см. диагностические критерии). Подкрепляет диагноз ГС/АИ отсутствие положительной динамики в ответ на антибиотикотерапию.
При отсутствии высыпаний на лице и дифференциальной диагностике с гидраденитом внимание дерматолога привлечет наличие дренирующих синусов, рубцов, открытых комедонов по типу «надгробий» и локализация не только в подмышечных областях. Немаловажным также является наличие постоянных рецидивов при ГС/АИ.
При дифференциальной диагностике с фурункулом, карбункулом, фолликулярной пиодермией необходимо учитывать характер высыпаний. При ГС/АИ кроме воспалительных элементов, которые, как правило, без хирургического вмешательства самостоятельно не вскрываются, еще присутствуют и макрокомедоны. Дополнительным ориентиром является симметричность высыпаний, характерная для ГС/АИ.
Лечение ГС/АИ
Лечение ГС/АИ требует комплексного подхода, который должен включать немедикаментозные и медикаментозные пути решения проблемы. Необходимо обращать внимание на образ жизни пациента и вредные привычки. Очень большую роль в достижении успеха терапии играют контроль массы тела и отказ от курения.
В.С. Melnik, С.С. Zouboulis опубликовали результаты наблюдения, свидетельствующие о том, что у женщин, страдающих ГС/АИ, отмечается высокая чувствительность к андрогенам [19], поэтому препараты, содержащие андрогены, необходимо исключать из терапии [20]. Внимание пациентов необходимо акцентировать на трех важных фактах. Во-первых, доказано, что на образование фолликулярной окклюзии влияет никотин, вследствие этого у курильщиков заболевание протекает в более тяжелой форме [21]. Во-вторых, ухудшению процесса способствует механическая травматизация высыпаний самими пациентами с последующим более глубоким инфицированием [22]. В-третьих, установлена прямая корреляция между метаболическим синдромом и тяжестью течения ГС/АИ, поэтому всем больным с лишним весом рекомендуется его снижать [21]. Согласно систематическому обзору научной группы альянса ГС/АИ снижение веса (у пациентов с индексом массы тела более 30 кг/м2) с высоким уровнем доказательности способствует уменьшению тяжести заболевания в долгосрочной перспективе [22]. В когортном исследовании, проведенном в Дании, установлено, что возвращение к нормальному весу до полового созревания снижает риск возникновения заболевания до уровня заболеваемости у детей без избыточного веса [22].
Из-за частого сочетания ГС/АИ с болезнью Крона и/или локализации в перианальной области пациента необходимо обследовать у гастроэнтеролога и проктолога [14].
При выборе тактики лечения ГС/АИ практикующим врачам рекомендуется ориентироваться на классификацию этого заболевания, разработанную H.J. Hurley в 1989 г. [9, 19]. Существуют и другие классификации (Sartorius score, the Hidradenitis Suppurativa Severity Index, Physician Global Assessment), но они в основном применяются в клинических научных исследованиях [9].
Согласно классификации Hurley выделяют три стадии заболевания:
I — наличие одного или нескольких изолированных абсцессов без рубцов или пазух.
II — наличие рецидивирующих абсцессов, локализующихся более чем в одной анатомической области. Формирование синусовых ходов.
III — наличие обширных абсцессов с множеством взаимосвязанных пазух, приводящих к формированию рубцов.
Тактика терапии зависит от стадии патологического процесса. При I–II стадии вполне возможно обойтись наружными средствами, в то время как III стадия заболевания рассматривается как показание к биологической терапии [23–25].
Согласно данным современной литературы препаратами первой линии являются антибиотики и стероидные средства на фоне хирургического дренирования гнойных полостей. Согласно рекомендациям European S1 guideline for the treatment of hidradenitis suppurativa/acne inverse, клиндамицин — единственный антибиотик, рекомендуемый для местного применения [9]. У пациентов с I–II стадией ГС/АИ по Херли возможно местное применение клиндамицина 1%, особенно при отсутствии абсцессов [9]. При наличии нескольких поражений и частых обострений может быть рассмотрена терапевтическая группа системных тетрациклинов [26]. Альтернативным вариантом может быть тройной режим приема рифампицина (10 мг/кг 1 р/сут), моксифлоксацина (400 мг 1 р/сут) и метронидазола (500 мг 3 р/сут) в течение 12 нед. с прекращением приема метронидазола через 6 нед. Пациентам со II–III стадией ГС/АИ, у которых имеется несколько активных поражений, следует сразу назначать системный клиндамицин и рифампицин (300 мг 2 р/сут) [27–29]. Антибактериальные препараты оказывают противовоспалительное действие и подавляют рост вторичной бактериальной флоры. Большое значение в терапии имеют высокая дозировка и продолжительная длительность приема препаратов. Схемы лечения системными тетрациклинами и клиндамицином, рекомендуемые при гнойничковых заболеваниях кожи, не дают результата при ГС/АИ, что служит дополнительным дифференциально-диагностическим признаком.
Хорошие результаты наблюдаются при применении в качестве эксфолианта резорцинола 15% 2 р/сут. Его используют как в качестве монотерапии, так и совместно с другими средствами, в зависимости от степени и глубины поражения. Резорцинол обладает кератолитическим, антисептическим действием, а также подавляет зуд [30].
Отдельные авторы предлагают совместное использование метронидазола 400 мг 2 р/сут и клиндамицина 600 мг 3 р/сут внутривенно в течение 2 нед. [31].
Кортикостероидные препараты также являются неотъемлемой частью лечения этого сложного заболевания. Препараты данной группы назначают с целью уменьшения выраженности воспаления. Для системной терапии используется введение триамценолона ацетонида непосредственно в образования [32] или прием внутрь гидрокортизона, дексаметазона, преднизолона. Длительность терапии составляет 7–14 дней [33].
Поскольку имеются наблюдения, подтверждающие взаимосвязь ГС/АИ и повышенной чувствительности к андрогенам [19], оправдано назначение антиандрогенов (ципротерон ацетат, эстрогены, финастерид) [34, 35].
В отношении других препаратов, в частности цитостатиков, имеется меньше публикаций, но в ряде случаев отмечена успешная терапия циклоспорином [36–38].
В современной литературе нет единого взгляда на применение метотрексата в терапии ГС/АИ. В раннем исследовании, проведенном в 2002 г. G.B. Jemec [39], метотрексат использовался в качестве монотерапии на период от 6 нед. до 6 мес., автор отметил ограниченную эффективность препарата при данной патологии. Однако, несмотря на отсутствие эффекта от метотрексата, некоторые исследователи утверждают, что его добавление в низких дозах к терапии биологическими препаратами необходимо с целью предотвращения нейтрализации аутоантител, что предупреждает развитие вторичной резистентности к биологической терапии [9, 40]. Оправдано назначение метотрексата также и при наличии у пациентов с ГС/АИ сопутствующих ревматологических заболеваний [9]. Более поздние исследования, проведенные P. Kozub et al. [41], продемонстрировали, что метотрексат неэффективен ни в качестве монотерапии, ни в сочетании с инфликсимабом. Авторы доказали, что метотрексат не увеличивает клиническую эффективность инфликсимаба [41].
Противоречивость данных об эффективности терапии метотрексатом обсуждается до сих пор. Патогенетически механизм развития заболевания связан с дисфункцией Т-регуляторных клеток и Т-хелперов 17-го типа, что приводит к повышению уровня IL-17А и IL-6, запуская тем самым каскад воспалительных реакций. В данном случае терапевтическое действие метотрексата связано с подавлением Т-хелперов 17-го типа за счет изменения уровней активности и скорости созревания дендритных клеток и Т-лимфоцитов [42]. Однако в литературе нет достаточного количества примеров, когда терапия метотрексатом улучшала течение ГС/АИ [43].
Изотретиноин при данном заболевании может быть неэффективен, поскольку в основе патогенеза заболевания лежит окклюзия волосяных фолликулов с гиперкератинизацией и последующее иммунное воспаление с вовлечением в процесс CD3/CD8 и естественных киллеров (NK-клеток). Была обнаружена отрицательная корреляция между длительностью течения заболевания и процентом NK-клеток, также отмечено увеличение содержания фактора некроза опухоли α и IL-6 [7]. Современные исследования также подтверждают низкую эффективность изотретиноина: около 60% пациентов не реагировали на лечение, а у 13% наблюдались рецидивы [44, 45].
Однако более современный препарат из класса ретиноидов — алитретиноин в дозе 10 мг/сут в течение 2 мес. с последующей поддерживающей дозой 20 мг, согласно данным [46], вызвал стойкую ремиссию у большинства больных. Данное противоречие можно объяснить тем, что алитретиноин (9-цис-агонист ретиноевой и пан-ретиноевой кислот) — новый системный препарат из группы ретиноидов, обладающий противоопухолевой активностью.
Несмотря на многочисленные работы, представленные в мировой литературе, лечение ГС/АИ является очень сложной задачей, ремиссия непродолжительная, составляет менее 1 года или полностью отсутствует, последующие рецидивы приводят к инвалидизации пациента.
Хирургическое вмешательство (либо простое иссечение поврежденных тканей, либо полное местное иссечение с последующей пересадкой кожи) является важной частью ведения таких пациентов и применяется при II–III стадиях заболевания. Важно не только вскрытие воспалительных элементов, но и их дренирование и иссечение дивертикул, как правило, располагающихся глубже основного воспалительного очага [9, 47]. Пациенты с ГС/АИ I–II стадии не нуждаются в хирургических вмешательствах [9].
Встречаются практические рекомендации по применению лазеров при ГС/АИ: carbon dioxide laser [48], NG:Yag laser [49], IPL [50], но наблюдений еще недостаточно, чтобы делать окончательные выводы.
Что касается биологической терапии, то анти-TNFα моноклональные антитела — инфликсимаб и адалимумаб показаны пациентам с III стадией ГС/АИ [9].
Впервые применили адалимумаб у 3 пациентов А.А. Navarini, R.M. Trueb в 2010 г. Все пациенты ранее получали изотретиноин в комбинации с антибиотиком, без эффекта. Применение адалимумаба позволило устранить клинические симптомы и субъективные ощущения. Однако после отмены биологической терапии клинические проявления начали возвращаться, и пациентам назначили повторный курс биологической терапии [51].
В противовес этому исследованию, эффективность адалимумаба доказана в проспективных двойных слепых плацебо-контролируемых исследованиях с участием более 800 больных, что позволило в дальнейшем включить ГС/АИ в перечень показаний для терапии адалимумабом [52, 53].
Адалимумаб следует рассматривать в качестве биологического агента первого выбора при ГС средней/тяжелой степени после неуспешного применения традиционных методов лечения, за которыми следуют инфликсимаб, устекинумаб и анакинра в качестве препаратов второй и третьей линий терапии соответственно [54].
В литературе имеются доказательства эффективности инфликсимаба у 30-летнего пациента с предшествующим неэффективным курсом терапии рифампицином 300 мг/сут, преднизолоном 50 мг/сут и изотретиноином 30 мг/сут. У данного пациента уже после первого введения инфликсимаба наблюдалось значительное уменьшение выраженности воспалительного процесса и снижение болевых ощущений [23]. Положительные результаты также продемонстрированы при лечении другими биологическими препаратами — этанерцептом и устекинумабом [24, 25]. Таким образом, можно сделать выводы, что биологические препараты демонстрируют эффективность у пациентов с ГС/АИ, и поиски оптимальной биологической терапии продолжаются.
Заключение
Гидраденит супаратива / акне инверса до сих пор является загадкой дерматологии. Несмотря на многочисленные исследования в этой области, остаются неясными многие вопросы. Среди них — важный вопрос тактики терапии пациентов с уже сформированной резистентностью к антибиотикам и противопоказаниями к адалимумабу или другим биологическим методам лечения.
Появляются новые теории, которые принципиально меняют концепцию патогенеза, о котором шла речь выше. Два исследования продемонстрировали наличие биопленки в очагах, в основном при тяжелых формах, что объясняет постоянные рецидивы в предыдущих рубцах. Эти данные свидетельствуют о патогенной роли изолированной флоры, вводя новую концепцию болезни — «хозяин — микробиом». Вместо аутовоспалительного процесса с неясным механизмом ГС/АИ можно рассматривать как аутоинфекционный из-за кожной иммунной дисрегуляции. Эта дисрегуляция позволяет аномальной бактериальной инфекции пролиферировать на фоне неадекватной гипервоспалительной реакции вместо эвакуации бактерий из дермы [51].
Эта теория может открыть возможности для разработки новых методов лечения ГС/АИ. Остается еще много вопросов, на которые нужно ответить. В частности, способствует ли ранний микробный сдвиг окклюзии фолликулов? Может ли потеря «микробного щита» быть частично восстановлена посредством иммуномодуляции или трансплантации микробиоты, как это исследовалось при воспалительных заболеваниях кишечника? Экспериментальные исследования в этом направлении уже ведутся, что позволит в скором времени получить более определенные ответы.












