Бактериальные инфекции кожи, вызывающие ее гнойное воспаление, были выделены в группу инфекционных дерматозов французским ученым H. Leloir в 1891 г. под названием пиодермиты (pyon – гной, derma – кожа). За рубежом пиодермии обычно относят к обширной группе инфекций кожи и мягких тканей (ИКМТ), включающей, помимо инфекций кожи и ее придаточных образований, инфекции подкожно–жировой клетчатки и нижележащих тканей.
В экономически развитых странах ИКМТ составляют 1/3 всех инфекционных заболеваний. По данным отечественных исследований, гнойничковые инфекции кожи составляют 30–40% всей дерматологической патологии у лиц трудоспособного возраста, у военнослужащих этот показатель достигает 60%. В детской дерматологической практике данная патология относится к числу наиболее частых и составляет от 30 до 50% всех случаев обращений к врачу [1–3].
Этиология
Основной источник ИКМТ – микроорганизмы, контаминирующие и колонизирующие поверхность кожи. Грамположительные кокки S. aureus и S. Pyogenes, способные проникать в толщу эпидермиса при наличии его повреждений, несомненно, играют ведущую роль в этиологии гнойничковых инфекций кожи. Причем S. aureus является наиболее частым возбудителем, несколько реже встречаются инфекции, вызванные S. pyogenes, а также смешанная инфекция с участием обоих микроорганизмов. Согласно результатам зарубежных многоцентровых исследований, кроме S. aureus, S. pyogenes, в развитии ИКМТ могут принимать участие Corynebacterium diphtheriae, P. aeruginosa, Enterobacteriaceae, Streptococcus spp. Большое значение в определении этиологической роли предполагаемого возбудителя имеет тип инфекции (табл. 1). В отличие от первичных пиодермий вторичные, как и большинство некротизирующих ИКМТ инфекций, имеют полимикробную этиологию.
Важную роль в развитии инфекции играют вирулентность микроорганизма и степень бактериальной обсемененности. Показано, что вероятность развития инфекции прямо пропорциональна степени бактериальной обсемененности и вирулентности микроорганизма и обратно пропорциональна силе защитной реакции организма. Вероятность колонизации увеличивается при наличии заболеваний кожи аллергического генеза. Так, у больных атопическим дерматитом колонизация пораженных участков S. aureus выявляется в 90% случаев [3].
Патогенез
В возникновении той или иной формы пиодермии большую роль играют: вид патогена, его вирулентность, состояние макроорганизма, а также разнообразные эндогенные и экзогенные предрасполагающие факторы, снижающие барьерную и защитную функции кожи.
Вирулентность стафилококков и стрептококков определяется рядом выделяемых ими патогенных токсинов и энзимов (коагулазой, лейкоцидином, стрептокиназой, гиалуронидазой стрептолизином, гемолизинами и др.), которые облегчают проникновение патогенов в кожу, приводят к повреждению и расслоению всех слоев эпидермиса, вызывают гемолиз и некротизацию дермы и подлежащих тканей, нарушая их нормальный метаболизм [4,5].
В возникновении и развитии ИКМТ большое значение имеют реактивность организма, его механизмы сопротивления микробной агрессии. Недостаточность иммунокомпетентной системы при этом носит, как правило, вторичный (приобретенный) характер. Она может формироваться в преморбидный период вследствие перенесенных или сопутствующих тяжелых заболеваний. Заболевания эндокринной системы (ожирение, сахарный диабет, недостаточная активность гипофизарно–надпочечниковой системы, щитовидной, половых желез) способствуют снижению механизмов антиинфекционной защиты организма. Более половины больных (52%) хронической пиодермией злоупотребляют углеводами (как правило, легкоусвояемыми), что создает постоянную перегрузку инсулярного аппарата поджелудочной железы и может способствовать расстройствам углеводного обмена той или иной степени, накоплению в тканях углеводов, являющихся благоприятной питательной средой для пиококков. Существенную роль отводят также себорейному состоянию кожи. Вследствие увеличения количества кожного сала и изменения его химического состава происходит снижение стерилизационных свойств кожи и активации гноеродных кокков [6].
Немаловажное значение в развитии гнойничковых заболеваний кожи имеют хронические инфекционные заболевания различных органов и тканей: пародонтоз, кариес, гингивит, тонзиллит, фарингит, инфекции урогенитального тракта, дисбактериоз, кишечные интоксикации, снижающие общую и местную антибактериальную резистентность организма и способствующие развитию у больных последующей специфической сенсибилизации, которая отягощает течение инфекционного процесса. Существенную роль в развитии хронической пиодермии играют заболевания центральной и вегетативной нервной системы, умственное или физическое перенапряжение, «истощающие заболевания» – алкоголизм, голодание, неполноценное питание (недостаток белков, витаминов, минеральных солей, гиповитаминозы, особенно А и С. Витамин А участвует в процессе кератинообразования, витамин С регулирует проницаемость сосудистой стенки, является синергистом кортикостероидов). Большую роль в развитии пиодермий играют различные иммунодефицитные состояния, возникающие вследствие врожденного или приобретенного иммунодефицита (ВИЧ–инфекция, прием глюкокортикостероидов, цитостатиков и иммунодепресантов). Дефекты клеточной антибактериальной защиты в виде угнетения фагоцитарной активности нейтрофилов, нарушения хемотаксиса, а также снижение опсонических факторов сыворотки крови и иммуноглобулинов способствуют хронизации инфекции и частым рецидивам [7].
Важнейшее значение в патогенезе ИКМТ имеют нарушения Т–клеточной системы иммунитета. В основе расстройств специфических механизмов иммунологической реактивности лежит уменьшение числа Т–лимфоцитов в периферической крови, снижение количества СD3– и CD4–клеток и изменение их взаимосвязи с моноцитами, что приводит к ослаблению Т–клеточного иммунного ответа. Недостаточность иммунной системы (иммунологический дисбаланс) больного и антигенная мимикрия возбудителя нередко ведут к хронизации инфекции и формированию бактерионосительства, а нерациональное применение антибиотиков – к резистентности возбудителя [8].
Весомое значение в развитии бактериальных инфекций кожи имеют неблагоприятные воздействия окружающей среды, нарушающие целостность кожного покрова и создающие «входные ворота» для проникновения инфекции. К ним в первую очередь относят влияние высокой или низкой температуры, повышенной влажности, приводящей к мацерации кожи, повышенное загрязнение и микротравматизации профессиональными факторами (маслами, цементом, угольной пылью). Входные ворота для инфекции возникают при бытовых микротравмах (порезы, уколы), расчесах при зудящих дерматозах. Нарушение кожного барьера в виде сухости и истончения рогового слоя способствуют проникновению микроорганизмов в глубокие слои кожи и подлежащие ткани, что приводит к развитию пиодермического процесса.
Клинические разновидности ИКМТ
ИКМТ представляют собой достаточно многочисленную и разнородную по клинической картине группу заболеваний, приводящих к поражениям различной глубины, распространенности и степени тяжести. Общим, характерным для всех признаком является наличие локального гнойного воспаления, при тяжелом течении сопровождающегося развитием системной воспалительной реакции. Клинические формы зависят от вида этиологического фактора, анатомической локализации, приуроченности к придаткам кожи, глубины и площади поражения, длительности течения процесса.
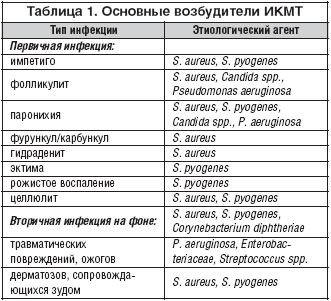
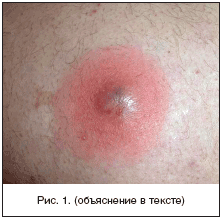
В отечественной дерматологии принята классификация первичных пиодермий, предложенная J. Jadasson еще в 1934 г. и построенная по этиологическому принципу. В ней выделяют: стафилодермии, преимущественно поражающие кожу вокруг придатков (сально–волосяных фолликулов, потовых желез); стрептодермии, поражающие гладкую кожу преимущественно вокруг естественных отверстий и смешанные стрепто–стафилококковые инфекции. В каждой из трех групп в зависимости от глубины поражения выделяют поверхностные и глубокие формы. Кроме того, гнойничковые заболевания кожи разделяют на первичные, возникающие на неизмененной кожи, и вторичные, развивающиеся как осложнения на фоне уже существующего дерматоза, как правило, зудящего (чесотки, экземы, атопического дерматита). По длительности течения различают острые и хронические пиодермии. Стафилоккоковые пиодермии обычно связаны с придатками кожи (волосяными фолликулами, апокриновыми железами). Для них характерно образование глубокой пустулы, в центре которой формируется полость, заполненная гнойным экссудатом. По периферии располагается зона эритематозно–отечной воспалительной кожи. Нагноительный процесс заканчивается формированием рубца (рис. 1). Стрептококковые пиодермии чаще развиваются на гладкой кожи, вокруг естественных отверстий (полости рта, носа) и начинаются с образования фликтены – поверхностно расположенного пузыря с дряблой складчатой покрышкой, внутри которого содержится серозно–гнойное содержимое. Тонкие стенки фликтены быстро вскрываются, и содержимое изливается на поверхность кожи, ссыхаясь в медово–желтые слоистые корочки. Процесс склонен к распространению по периферии в результате аутоинукуляции (рис. 2). Стафилодермиями чаще страдают мужчины, стрептодермиями – женщины и дети [3,4].
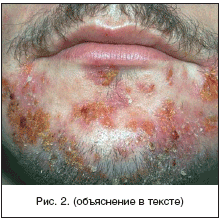
В зарубежной литературе все ИКМТ с практической точки зрения делят на три основные группы: первичные пиодермии, в подавляющем большинстве вызванные S. aureus и пиогенными b–гемолитическими стрептококками (преимущественно группы А), и развивающиеся на неизмененной коже (фолликулит, импетиго, рожистое воспаление); вторичные пиодермии развивающиеся на фоне повреждений кожи или сопутствующей соматической патологии (например, пролежни, диабетическая язва стопы, инфекции после укусов животных, послеоперационные раневые и посттравматические инфекции), а также на фоне дерматозов, сопровождающихся зудом и расчесами (аллергический дерматит, псориаз, чесотка и т.д.); некротические инфекции, представляющие наиболее тяжелую форму ИКМТ (целлюлит полимикробной этиологии – синергидный целлюлит, некротизирующий фасциит, мионекроз – газовая гангрена) (рис. 3). При данной патологии определение глубины и распространенности поражения является приоритетом врача–хирурга, т.к. только при хирургической обработке можно наиболее точно определить истинную степень распространения инфекции. Начальная тактика ведения этих пациентов одинакова. Она заключается в раннем проведении хирургического вмешательства и назначении адекватной антимикробной терапии [9].
Лечение ИКМТ
Терапия больных с бактериальными инфекциями кожи должна быть комплексной (этиотропной и патогенетической) и проводиться после тщательного анамнестического, клинического и лабораторного обследования больного. Необходимо выявление и лечение сопутствующих заболеваний, обследование на очаги фокальной инфекции, а в случае длительно персистирующего процесса – исследования иммуностатуса. Основным и единственным методом этиотропного лечения больных ИКМТ являются антибиотики. При острых поверхностных нераспространенных процессах (импетиго, фолликулиты, паронихии) терапия может быть ограничена местным применением антибиотиков и антисептиков. Во всех прочих случаях требуется проведение системной антибактериальной терапии.
Показаниями к назначению системной антибиотикотерапии являются глубокие формы пиодермий: фурункулы (особенно с локализацией на лице и шее), карбункул, гидраденит, рожистое воспаление, целлюлит. Перечисленные формы бактериальных инфекций кожи имеют длительное, нередко хроническое рецидивирующее течение, большую распространенность процесса и часто сопровождаются симптомами общей интоксикации в виде лихорадки, головной боли, слабости, а также развитием регионарных осложнений (лимфаденит, лимфангит). В качестве этиотропного средства антибиотики используются при лечении дерматоза бактериальной природы – болезни Лайма. Они являются препаратами выбора при лечении вульгарных угрей. В дерматовенерологической практике антибиотики широко применяются как для лечения инфекционных дерматозов, так и заболеваний, обусловленных инфекциями, передающимися половым путем (ИППП) [4].
Перед назначением антибактериального препарата желательно производить посев гноя с определением чувствительности выделенного микроорганизма к различным антибиотикам и по результатам исследования назначать соответствующий препарат. Однако это не всегда выполнимо, особенно при угрозе или развитии осложнений инфекции. Как показывает анализ современной литературы и собственный клинический опыт, сегодня наиболее часто в лечении бактериальных инфекций кожи используются следуюшие группы антибиотиков: 1. β–лактамы: а) природный пенициллин, его дюрантные формы и полусинтетические пенициллины; б) цефалоспорины (1–4 поколения). 2. Макролиды. 3. Тетрациклины. 4. Фторхинолоны.
В последние годы пенициллин и его дюрантные препараты редко применяются в терапии ИКМТ, так как подавляющее число штаммов пиококков приобрели способность продуцировать фермент b–лактамазу (пенициллиназу), подавляющую антибактериальную активность пенициллина. Кроме того, β–лактамы относятся к препаратам, имеющим высокую частоту аллергических реакций.
Тетрациклины, аминогликозиды в настоящее время используются значительно реже. Это связано с большим количеством резистентных штамов микроорганизмов к этим антибиотикам (из чего следует их низкая терапевтическая активность), а также с наличием тяжелых побочных эффектов. Следует помнить, что тетрациклины противопоказаны при беременности, детям и пациентам с печеночной недостаточностью.
Фторхинолоны назначаются в основном при лечении заболеваний, передающихся половым путем, из–за высокой чувствительности к ним возбудителей урогенитальных инфекций, а при пиодермиях используются только при неэффективности других групп антибиотиков. Однако при заболеваниях центральной нервной системы, у беременных, а также в педиатрии диапазон их применения ограничен – они назначаются в основном по жизненным показаниям. Необходимо также не забывать и о фотосенсибилизирующем эффекте фторхинолонов, и связанных с этим мерах предосторожности, особенно весной и летом [10].
Современная лечебная практика предъявляет к выбору антибиотика определенные требования. Прежде всего препарат должен обладать широким спектром антимикробного действия и минимально выраженной антибиотикорезистентностью к микробным агентам, не иметь тяжелых побочных действий, обладать минимальным риском развития аллергических реакций, быть удобным в применении для пациента (наличие пероральной формы, удобного режима дозирования) и доступным по цене. Кроме того, очень важно, чтобы у антибиотика отсутствовали клинически значимые взаимодействия с другими лекарственными препаратами. На сегодняшний день этим требованиям в полной мере соответствуют антибиотики – макролиды.
Классификация и механизмы
фармакотерапевтического действия
макролидов
Макролиды уже более 50 лет широко используются в клинической практике. Первый природный антибиотик этой группы – эритромицин (метаболит Streptomyces erythreus) был получен еше в 1952 году. Макролиды можно классифицировать по химической структуре и по происхождению. Основу химической структуры данного класса антибиотиков составляет макроциклическое лактонное кольцо. В зависимости от числа атомов углерода в кольце макролиды подразделяются на 14–, 15– и 16–членные (табл. 2).
Среди макролидов выделяют 3 поколения:
а) первое поколение: эритромицин, олеандомицин;
б) второе поколение: спирамицин, рокситромицин, джозамицин, кларитромицин и др.;
в) третье поколение: азитромицин (Азитрал).
Антибактериальный эффект макролидов основан на нарушении синтеза рибосомальных белков микробной клетки и ингибировании тем самым процесса воспроизведения возбудителя. Они в основном оказывают бактериостатический эффект, что обусловливает целесообразность их назначения в острой фазе воспаления. Макролиды относятся к «тканевым антибиотикам», т.е. при распределении в организме они накапливаются преимущественно не в кровяном русле, а в тех органах и тканях, где имеется воспаление, создавая тем самым высокие концентрации препарата. Хорошо распределяясь в организме, макролиды способны преодолевать гистогематологические барьеры (за исключением гематоэнцефалического), значительно превосходя в этом β–лактамные антибиотики. Однако широкое (и часто необоснованное) применение достаточно быстро привело к появлению высокого процента эритромициноустойчивых штамов возбудителей, особенно стафилококов. Это, в свою очередь, значительно снизило использование эритромицина в клинической практике [11].
Интерес к макролидам вновь возник в начале 80–х годов XX века, после появления новых поколений антибиотиков этой группы – азалидов (в частности, азитромицина). Азитромицин был синтезирован в 1983 году на основе эритромицина. Препарат по своим фармакокинетическим свойствам превзошел все показатели своего предшественника и стал первым представителем новой группы антибиотиков – азалидов. Уникальность азитромицина базируется на его исключительной фармакокинетике. Азитромицин устойчив в кислой среде, благодаря чему хорошо всасывается после приема внутрь. Одновременный прием с пищей уменьшает всасывание на 50%, поэтому препарат принимают за 1 час до или через 2 часа после еды. Липофильность молекулы азитромицина обеспечивает, помимо высокого уровня всасывания в кишечнике, еще и отличное проникновение препарата в ткани. Быстрое проникновение азитромицина из крови в ткани обеспечивается также низким уровнем связывания азитромицина с белками крови, что дает возможность достигать быстрого терапевтического эффекта при инфекциях, поражающих клетки и ткани. Высокая концентрация препарата в области поражения, в 10–100 раз превышающая концентрацию в кровяном русле, позволяет активно воздействовать на патогенный очаг, тем самым обеспечивая быстрый клинический эффект и скорейшее выздоровление. Современные макролиды (в частности, азитромицин) проявляют наибольщую эффективность в отношении таких возбудителей, как S. pyogenus, S. aureus, S. pneumoniae, некоторых грамотрицательных микроорганизмов (гонококи), а также внутриклеточных возбудителей (в частности, Chlamidia trachomatis и Ureaplasma urealyticum), что обусловливает их высокую востребованность в дерматовенерологической практике [12].
Важное значение для антибактериальной активности макролидов второго поколения имеет их взаимодействие с нейтрофилами. Благодаря своей способности проникать внутрь нейтрофилов и создавать в них высокие концентрации, многие макролиды позитивным образом модифицируют функции данных клеток, влияя, в частности, на хемотаксис, активность фагоцитоза и киллинга. Наряду с противомикробным действием данные антибиотики обладают умеренной противовоспалительной активностью. Активируя клетки макрофагального ряда, они способны проникать в них и при миграции фагоцитирующих клеток в очаг воспаления поступать туда вместе с ними. Уникальность этих препаратов заключается еще и в том, что они обладают выраженным постантибиотическим эффектом, то есть сохраняют высокие концентрации в очаге воспаления в течение 5–7 дней после отмены. Данный саногенетический эффект позволил разработать короткие курсы лечения, не превышающие 3–5 суток, и удобный режим дозирования (1 раз в сутки). Это, в свою очередь, обеспечивает комплаентность лечения и повышает качество жизни больного. Наиболее выражен постбиотический эффект у азитромицина, что позволяет создавать в очагах инфекции концентрацию антибиотика, многократно превышающую МПК в отношении активных возбудителей при лечении как острых, так и хронических инфекций. В последнее время получены доказательства иммуномодулирующего действия азитромицина в эксперименте на здоровых добровольцах. Первая фаза иммуномодулирующего эффекта состоит в дегрануляции нейтрофилов и оксидантного взрыва, что способствовало активизации защитных механизмов. По достижении эрадикации возбудителей отмечалось уменьшении продукции ИЛ–8 и стимуляция апоптоза нейтрофилов, что минимизировало выраженность воспалительной реакции [13].
Макролиды, как природные, так и полусинтетические, по сравнению с другими антибиотиками оказывают минимальное влияние на нормальную микрофлору человеческого организма и не вызывают дисбиоза. Поэтому азитромицин рассматривается не только как высокоэффективный, но и наиболее безопасный антибиотик с минимальным числом противопоказаний к назначению. Нежелательные реакции при его приеме в целом встречаются крайне редко и не превышают 5%. Наиболее частыми побочными эффектами являются симптомы со стороны желудочно–кишечного тракта (тошнота, тяжесть в эпигастральной области), которые, как правило, выражены умеренно, не требуют отмены препарата и быстро проходят при приеме лекарств после еды [11].
Клиническая эффективность азитромицина
Как свидетельствуют сравнительные исследования, при ИКМТ среди антибиотиков, применяющихся в амбулаторной практике, наиболее эффективны макролиды нового поколения, в первую очередь 15– и 16–членные (азитромицин, джозамицин, рокситромицин). Накоплен уже 20–летний положительный опыт применения азитромицина в отечественной дерматовенерологической практике. В дерматологии он являются базовой терапией стафилококковых и стрептококковых поражений кожи и мягких тканей (фурункул, импетиго, целлюлит), а в венерологической практике – при лечении ИППП. В отличие от большинства макролидов у азитромицина отсутствуют клинически значимые взаимодействия с другими лекарственными препаратами. Он не связывается с ферментами комплекса цитохрома Р450, вследствие чего не проявляет реакции лекарственного взаимодействия с препаратами, метаболизирующимися по этому пути. Это свойство является немаловажным, поскольку в реальной клинической практике большинство больных, у которых возникают ИКМТ, имеют фоновые или сопутствующие заболевания, по поводу которых получают соответствующее лечение. Также необходимо подчеркнуть, что наряду с хорошей переносимостью и отсутствием выраженных побочных реакций макролиды (азитромицин) имеют еще одно безусловное преимущество по сравнению с другими группами антибиотиков – это то, что он может назначаться беременным и детям [14].
В настоящее время одним из наиболее часто применяемых препаратов в клинической практике является препарат Азитрал (азитромицин), производимый фармацевтической компанией «Shreya Life Sciences». Азитрал (азитромицин) аналогичен оригинальному азитромицину – первому представителю подгруппы азалидов из группы макролидных антибиотиков, используемому в лечении ИКМТ и урогенитальных инфекций. Исследования показали, что клиническая эффективность препарата, назначаемого в разовой дозе 500 мг в течение 3 дней, сопоставима с эффективностью большинства широко применяемых антибактериальных средств. Это позволяет в 2–3 раза сократить обычный курс антибиотикотерапии, а уникальный фармакокинетический профиль Азитрала обеспечивает одноразовый суточный прием и высокую комплаентность терапии [15].
Благодаря особенностям фармакокинетики и своеобразному спектру антимикробного действия, охватывающему основных возбудителей инфекций мочеполового тракта, азитромицин является препаратом первого выбора в терапии сочетанных ИППП, в том числе хронического осложненного урогенитального хламидиоза и ВЗОМТ у небеременных женщин, и альтернативным средством для лечения этого заболевания в период беременности. При однократном приеме 1 г азитромицина (Азитрала) его концентрация в течение недели в ткани предстательной железы и матки превышает МПК для C. trachomatis (0,125 мкг/мл) в 42,5 раза, а в цервикальном канале – в 12 раз, что является терапевтической концентрацией для лечения этой инфекции. Более того, даже спустя 2 недели терапевтическая концентрация азитромицина в ткани предстательной железы превышает МПК для C. trachomatis в 13,6 раз. Авторами было доказано, что именно при таком приеме в тканях, где вегетируют C. trachomatis, поддерживается высокая терапевтическая концентрация препарата в течение 6–8 циклов развития. Полученные данные свидетельствуют о высокой эффективности пульс–терапии Азитралом (по 1 г 1 раз в неделю, курсовая доза 3 г). в комплексном лечении хронического хламидийного уретропростатита и ассоциирующейся с ним микоуреаплазменной и гарднереллезной инфекции. Важно отметить, что препарат Азитрал хорошо переносится больными, доступен по цене и поэтому может широко использоваться в терапии осложненного урогенитального хламидиоза и ВЗОМТ [16,17].
Изучение эффективности, безопасности и переносимости азитромицина у 30 детей от 6 месяцев до 3 лет со стафилококковыми инфекциями различной локализации ЛОР–органов и кожи показало, что азитромицин (Азитрал) не уступает по эффективности антистафилококковым пенициллинам. Наряду с высокой эффективностью, характеризующейся быстрой и стойкой обратной динамикой основных клинических симптомов и местных воспалительных изменений в 100% случаев отмечалась хорошая переносимость препарата и отсутствие побочных явлений у всех детей. Широкий спектр антимикробной активности, особенности фармакокинетики, низкий процент нежелательных явлений и ряд преимущества перед другими макролидами обусловливают приоритет использования препарата при различных кожных инфекционных процессах (импетиго, фурункулез, фолликулит, целлюлит, паронихия) у детей. Эффективность азитромицина в педиатрической практике, доказанная клиническими испытаниями, позволяет рекомендовать его в качестве альтернативы b–лактамным антибиотикам, а у детей с отягощенным аллергоанамнезом – как препарат выбора [18,19].
Одним из важнейших фармакоэкономических показателей, определяющих выбор антибиотика, является соотношение стоимость/эффективность. Оно определяется, как отношение стоимости лекарственного лечения (для пероральных препаратов она равна стоимости курсовой дозы) к доле успешно пролеченных больных. Следует обратить внимание на то, что Азитрал среди существующих препаратов азитромицина проявляет оптимальное соотношение цена/качество [20].
Известно, что неэффективность антибиотикотерапии во многом определяется снижением чувствительности к применяемому препарату. В настоящее время клинически значимая резистентность к азитромицину отсутствует. По данным мониторинга антибиотикорезистентности устойчивость к азитромицину и другим макролидам последнего поколения среди возбудителей ИКМТ не превышает 2–10%. Чувствительность штаммов S. pyogenes, выделенных на территории России, к антибиотику азитромицин составляет 92%. Как показано в ряде исследований, клиническая эффективность азитромицина выше, чем у тетрациклинов и b–лактамных антибиотиков. Сравнительное клинико–микробиологическое изучение эффективности при глубоких стафилодермиях 5–дневного курса азитромицина и 10–дневного приема цефалексина показало более высокую терапевтическую активность макролида. Эрадикация возбудителя при применении азитромицина отмечалась в 94%, при цефалексине в 90% случаев, клиническое излечение – соответственно в 56 и 53% случаев. При этом частота побочных реакций, как правило, не требующих отмены препарата, не превышает 5%, что значительно ниже по сравнению с эритромицином (до 14%) или пероральными формами b–лактамов [21,22].
Таким образом, азитромицин обладает широким спектром антимикробного действия, высокой бактериостатической активностью по отношению чувствительных к нему инфекций, высокую биодоступность с избирательным действием в очаге воспаления, он малотоксичен, имеет минимум побочных эффектов и удобный режим приема. Следовательно, препарат отвечает современным требованиям рациональной антибиотикотерапии и может быть рекомендован для эффективного применения в дерматовенерологической практике.

Литература
1. Jones M.E., Karlowsky J.A., Draghi D.C, Thornsberry C., Sahm D.F., Nathwani D. Epidemiology and antibiotic susceptibility of bacteria causing skin and soft tissue infections in the USA and Europe: a guide to appropriate antimicrobial treatment. Int J Antimicrob Agent 2003; 22:406–19.
2. Н.Н. Мурашкин, М.Н. Глузмина, Л.С. Галустян. Гнойничковые поражения кожи в практике детского дерматолога: свежий взгляд на старую проблему. РЖКВБ: Научно–практический журнал, 2008, №4, с. 67–71.
3. Белькова Ю.А. Пиодермии в амбулаторной практике. Болезни и возбудители. Клиническая микробиология и антимикробная химиотерапия: № 3, том 7, с. 255–270, 2005.
4. Т.А. Белоусова, М.В. Горячкина. Бактериальные инфекции кожи: проблема выбора оптимального антибиотика. РМЖ 2005, том 13, №16, с. 1086–1089.
5. Таха Т.В., Нажмутдинова Д.К. Рациональный выбор антибиотикотерапии при пиодермиях. РМЖ 2008, том 16, №8, с. 552–555.
6. Новоселов В.С., Плиева Л.Р. Пиодермии. РМЖ 2004, том 12, №5, с. 327–335.
7. Масюкова С.А., Гладько В.В., Устинов М.В., Владимирова Е.В., Тарасенко Г.Н., Сорокина Е.В. Бактериальные инфекции кожи и их значение в клинической практике дерматолога. Consilium medicum 2004, том 6, №3, с. 180–185.
8. T. File. Diagnosis and antimicrobial therapy of skin and soft tissue infections. Ohio, USA. Клиническая микробиология и антимикробная химиотерапия: № 2, том 5, с. 119–125, 2003
9. Шляпников С.А., Федорова В.В. Использование макролидов при хирургичесаких инфекциях кожи и мягких тканей. МРЖ,2004.–т.12,№4,с204–207
10. Гучев И.А., Сидоренко С.В, Французов В.Н. Рациональная антимикробная химиотерапия инфекций кожи и мягких тканей. Антибиотики и химиотерапия. 2003, т.48, 10, с.25–31
11. Parsad D., Pandhi R., Dogras S. A guide to selection and appropriate use ofmacrolides in skin infection Am J Clin Dermatol 2003; 4:389–97
12. Яковлев С.В., .Ухтин С.А. Азитромицин: основные свойства, оптимизация режимов применения на основе фармакокинетических и параметров. Антибиотики и химиотерапия. 2003 т. 48, №2. – с. 22–27
13. Туровский А.Б,.Колбанова И.Г Макролиды в лечении инфекций дыхательных путей с позиций ЛОР–врача: «за» и «против» Consilium medicum, 2010г.,№4, том.12, с.11–14.
14. Прохорович Е.А. Азитромицин. От клинической фармакологии к клинической практике. РМЖ 2006, том 14, №7, с. 567–572
15. Бердникова Н.Г. Актуальные аспекты применения азитромицина (Азитрал) в терапии внебольничных пневмоний у взрослых. РМЖ 2006, том 14, №22, с. 1625–1628.
16. Хрянин А.А., Решетников О.В. Макролиды в лечении хламидийной инфекции у беременных (эффективность, безопасность, экономичность). РМЖ 2008, том 16, №1, с. 23–27.
17. Серов В.Н., Дубницкая Л.В., Тютюнник В.Л. Воспалительные заболевания органов малого таза: диагностические критерии и принципы лечения. РМЖ 2011, том 19, №1, с. 46–50.
18. Талашова С.В. Некоторые аспекты применения антибактериальных препаратов в педиатрии на примере макролидов. РМЖ 2009, том 17, №7, с. 464–466
19. Мазанкова Л.Н., Ильина Н.О. Место азалидов в педиатрической практике. РМЖ 2008, том 16, №3, с. 121–125.
20. Соловьев А.М., Поздняков О.Л., Терещенко А.В. Почему азитромицин считается препаратом выбора для лечения урогенитальной хламидийной инфекции. РМЖ 2006, том 14, №15, с. 1160–1164.
21. Гуров А.В., Изотова Г.Н., Юшкина М.А. Возможности применения препарата Азитрал в терапии гнойно–воспалительных заболеваний ЛОР–органов. РМЖ 2011, том 19, №6, с. 405.
22. Klani R. Double–blind, double–dummy comparison of azithromycin and cephalexin in the treatmen of skin and skin structure infection. Eur.J. Clin. Microbiol. Infect.Dis. 1999,Oct. 10 (10) – p.880–84












