На развитие ДПН оказывает влияние комплекс связанных между собой раз¬личных патофизиологических и патобиохимических механизмов, которые приводят к мета¬болическим и/или сосудистым изменениям, первоначально проявляющимся обратимыми функциональными повреждениями нервов, а впоследствии – серьезными морфологическими дефектами (вплоть до необратимых изменений). Не подлежит сомнению, что в патогенезе диабетической полинейропатии перво¬степенное значение имеет гипергликемия, которая способна повреждать как са¬ми нервы, так и эндоневральные кровеносные сосуды. Повышенное содержание глюкозы выявляется не только в крови, но и в поврежденных органах–мишенях, например, в нервных клетках. Так как глюкоза способна проникать в нервную клетку независимо от инсулина, активизируется полиольный путь обмена веществ. В результа¬те повышения активности ключевого фермента – альдозоредуктазы, образуется по¬вышенное количество сорбитола. Он медленно диффундирует из нервных клеток или окисляется сорбитолдегидрогеназой с образованием фруктозы. Именно внутриклеточное накопление сорбитола является причиной различных повреждений нервов. Так, при активации полиольного пути обмена веществ происходит исто¬щение запасов «вторичного мессенджера»– миоинозитола.
Кроме того, обсужда¬ется возможность нарушения образования оксида азота (NО), как одного из негативных последствий накопления сорбитола. Сужение сосудов с последующим пониженным давлением кислорода в периферических нервах обусловлено, воз¬можно, уменьшением содержания этого сосудорасширяющего вещества.
Следующим важным моментом в патогенезе ДПН яв¬ляется накопление в тканях свободных радикалов. Обычно в организме оки¬слительные и антиоксидантные процессы сбалансированы, поэтому постоянно образующиеся при окислительном стрессе свободные радикалы нейтрализуются. У больного диабетом данное равновесие сдвигается в сторону повышенной про¬дукции свободных радикалов. Свободные радикалы, вступая в реакции с ненасыщенными связями соединений, нарушают структуру ферментных белков, ДНК и липидов клеточных мембран. В процессе метаболизма глюкозы в условиях окислительного стресса образуются радикалы кислорода. У больных СД их число многократно увеличивается, что приводит к блокаде расщепления глюкозы. Происходит повышение концентрации промежуточных продуктов, таких как фруктозо–6–фосфат и глицеральдегид–3–фосфат. Эти продукты в клетке деградируют по различным патобиохимическим путям: гексозаминовому, диацилглицероловому, пути с образованием протеинкиназы С, с образованием конечных продуктов гликирования (AGE–продуктов – advanced glycosylation end products) и соединений NF–кВ. AGE–продукты – класс чрезвычайно гетерогенных веществ, которые обладают характерной флюоресценцией. В организме чело-века они играют ключевую этиологическую роль в процессах старения и таких болезней, как атероскле-роз, болезнь Альцгеймера и сахарный диабет. Наибо¬лее известный из AGEs — это HbA1с. Белок, будучи однажды гликозилированным, теряет свою физиологическую функцию. В результате присоединения к рецепторным белкам образуются RAGEs (receptor agglutinat glucosulation) – продукты, которые вызывают ухудшение различных клеточных функций, в том числе экспрес¬сию генов и внутриклеточную сигнальную трансдукцию [11].
В результате гликозилирования базальных мембран кровеносных сосудов разви¬ваются функциональные сосудистые нарушения (ретинопатия, нефропатия). Микроангиопатии, вызываемые AGE–продуктами в Vasa nervorum, ведут к нарушению питания нервов и являются дополнительным фактором возни¬кновения полинейропатии [17].
Важная роль в патогенезе ДПН отводится эндогенному фактору роста нервной ткани (ФРН). У животных с диабетом выявлен дефицит ФРН и замедленная скорость его переноса [7]. Причинно–следственная связь с гипергликемией позволяет предполагать, что пониженный уровень ФРН может быть нормализован при помощи инсулинотерапии или аллотрансплантации островковых клеток.
В развитии ДПН обсуждается также участие и иммунологических процессов. У больных диабетом с нейропатией часто обнаруживаются антитела к симпатическим нервным ганглиям, надпочечникам и n. vagus (блуждающий нерв) [10]. Однако патогенетическое значение этих антител остается пока еще неясным.
Представленные патогенетические модели указывают на то, что развитие диабетической полинейропатии полимодально. Она является следствием многофакторных событий, в которых центральную роль играет глюкозотоксичность.
Наиболее перспективными направлениями в лечении ДПН следует считать применение средств, действие которых затрагивает и патогенетические механизмы, и клинические проявления ДПН. Поскольку подобной направленностью действия обладают нейротропные витамины группы B, то препаратами выбора для лечения ДПН можно считать именно их. [9]. Уникальным препаратом, содержащим комбинацию витаминов группы В, является Мильгамма® композитум, выпускаемая фармацевтической компанией Woerwag Pharma.
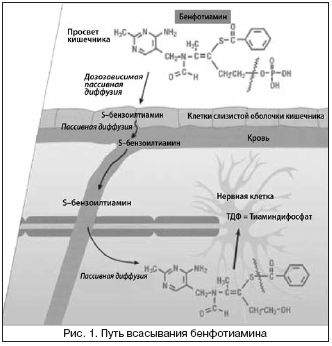
Сенсационное открытие было сделано в 1952 году японскими учеными из группы Фудзивары: изучая механизмы проникновения в клетку и биотрансформации тиамина в организме, им удалось синтезировать уникальное липофильное вещество бенфотиамин, которое не разрушается тиаминазами кишечника, полностью всасывается в кровь, длительно циркулирует в организме, что очень важно для пролонгации лечебного эффекта. Это доказано исследованиями Heinrich, Schreeb, Becker, Greb [2,4,13]. После приема внутрь бенфотиамин в неизмененном виде достигает верхних отделов тонкой кишки, где происходит его дозопропорциональное всасывание. Под действием фосфатазы слизистой оболочки кишечника отщепляется монофосфатная группа и липофильные свойства молекулы (благодаря бензольному кольцу) начинают превалировать. Образующийся таким образом S–бензоилтиамин (S–БТ) может беспрепятственно пассивно диффундировать через клетки слизистой оболочки и попадать неизмененным в кровь (рис. 1).
Всасывание водорастворимых производных тиамина в концентрациях до 2 ммоль происходит с помощью механизмов активного транспорта. Это обусловлено полярными свойствами водорастворимого тиамина, который может проникать через биологические мембраны только в незначительных количествах. При этом процентная доля резорбированного вещества тем меньше, чем выше доза. Так, ежедневный предел всасывания для водорастворимого тиамина составляет 5–10 мг. Резорбция водорастворимого тиамина составляет при дозе 1 мг примерно 50%, при 5 мг 33% и при 20 мг – лишь 25%.
Биологически активным веществом бенфотиамина является тиаминдифосфат (ТДФ), который ранее назывался также тиаминпирофосфатом. ТДФ – это кофермент различных многоферментных комплексов, среди которых наибольшее значе¬ние для нервных клеток имеют ферменты, участвующие в углеводном обмене. Тиа¬мин–зависимые ключевые ферменты играют важную роль в окислительных про¬цессах расщепления глюкозы.
Результаты исследования, выполненного Berndt (1977), свидетельствуют о недостатке тиамина в организме и по¬вышенной потребности в нем при СД. Радиактивно меченый препарат тиамина назначался перорально, и по содержанию тиамина в моче судили о степени обеспеченно¬сти организма тиамином. У обследован¬ных больных диабетом с полинейропатией и без нее отмечался значительно более низкий уровень выделения тиамина в сравнении со здоровыми лицами, составлявшими контрольную группу. Это является достоверным показателем наличия дефицита тиамина или повышенной потребности в нем. С помощью определения эритроцитарной транскетолазы (ЭТК) дефицит тиа¬мина был выявлен у 18% больных диабетом, в то время как у здоровых людей аналогичная ситуация наблюдалась лишь в 1% случаев (р<0,001). В рамках клинического исследования 35 больных диабетом 1 и 2 типов с симптоматической дистальной симметричной полинейропатией в течение 90 суток по¬лучали бенфотиамин–содержащий комбинированный препарат [Wolf, 1995]. Тиаминовый статус у пациентов оценивался с помощью определения ЭТК. Проводились 4 измерения: до начала лечения, на 7, 45 и 90–е сутки.
Значения ЭТК более 1,22 [Rieder, 1980] рассматриваются как пограничный уровень недостаточного обеспечения тиамином. У пациентов, получавших бенфотиамин, уже через неделю уровень тиамина в гемолизате и плазме увеличился в 8 и 25 раз соответственно. Была достигнута оптимизация обеспечения тиамином в течение всего срока исследования, в то время как при назначении плацебо уже на 7–й день наблюдалось ухудшение тиаминового статуса (р<0,05). Фармакодинамический эффект или клиническая эффективность бенфотиамина подтверждались в этом исследовании улучшением скорости проведения импульса по нер¬ву.
Наряду с описанными выше эффектами тиамину и пиридоксину может быть свой¬ственно также антиноцицептивное действие. Был проведен ряд исследований, посвященных изучению антиноцицептивного действия комбинации витаминов группы В. Возможными точками при¬ложения действия являются непосредственно болевые рецепторы, чувствительность которых варьирует в результате влияния различных тканевых гормонов (например, брадикинина) и нейропептидов. Сенсибилизация болевых рецепторов проявля¬ется, например, как воспалительная гипералгезия. И здесь возможна взаимосвязь, так как недостаток в тиамине и пиридоксине сопровождается симптомами воспаления кожи и слизистых оболочек. Весьма существенно, что эти результаты подтверждались неоднократно, в том чи¬сле и при проведении двойного слепого клинического исследования. В качестве модели в большинстве случаев выступал болевой синдром позвоночного столба, при котором комбинация витаминов В1 и В6 демонстрировала значительные преимущества как сама по себе [Schwieger, 1988]), так и в соче¬тании с диклофенаком [Koch, 1991]. Применение Мильгаммы в сочетании с НПВП позволяет значительно снизить количество побочных эффектов, характерных для НПВП при сохранении эффективности [Данилов А.Б., 2007; Левин О.С. 2008].
Следует также отметить влияние высоких доз нейротропных витаминов группы В на регенерацию поврежденных нервов. При экспериментальном аллергическом неврите в первую очередь нарушается миелиновый обмен. В этом случае за счет активации фосфолипазы–А, происходит чрезмерный гидролиз эфиров жирных кислот, также наблюдается негативное влияние на жидкую субстанцию миелиновых оболочек. Одновременно проис¬ходит активация ацилтрансферазы. Одновременное применение высоких доз тиамина, пиридоксина и цианокобаламина при исполь¬зовании данной модели сопровождается более поздним и слабым про¬явлением неврологической симптоматики.
Результаты последних исследований достоверно подтверждают, что бенфотиамин, а также витамин В6 в составе препарата Мильгамма композитум могут предотвращать образование конечных продуктов ускоренного гликирования белков (AGE–продуктов) и повышать ак¬тивность транскетолазы на 400%.
Эффективность применения бенфотиамина при диабетической полинейропатии подтвержде¬на в нескольких плацебо–контролируемых двойных слепых исследованиях.
В исследовании Ледерманна (Ledermann) у 20 пациентов с диабетической полинейропатией применялся бенфотиамин в ежедневной дозе 320 мг (в сочетании с витамином В6 и витамином В12) или плацебо [8]. В качестве изучаемых па¬раметров использовались субъективные критерии (показатель невропатии по Katzenwadel) и объективные величины (измерение вибрационного порога с помощью калиброванного камертона).
В ходе терапии уже в течение 3 недель наступало значительное улучшение показателей нейропатии, которое фиксировалось с помощью шкалы нейропатических нарушений (р<0,01) и вибрационных ощущений (р<0,01). Отмечено уменьшение болевых ощущений (р<0,01) и расстройств чувствительности (р<0,05). Предпочтение как врачами, так и пациентами отдавалось те¬рапии с использованием препарата Мильгамма композитум (р<0,01). Никаких нежелатель¬ных эффектов при применении препарата не наблюдалось.
В исследовании Штраке (Stracke) эффективность бенфотиамина подтверждена с помощью оценки объективного параметра – скорости проведения импульса по нерву [15]. 24 больных диабетом 1 и 2 типов с симптоматической ДПН более 3 месяцев принимали различные дозировки бенфотиамина. В течение первых 2 недель пациенты получали 320 мг бенфотиамина в сутки, затем вплоть до 12–й недели – ежедневно по 120 мг. Через 3 месяца скорость проведения по нерву в n. peroneus в группе с активным лечением значительно улучшилась (р<0,006), а в группе плацебо – напротив, ухудшилась. В n. medianus было зарегистрировано сходное действие, однако оно не было статистически достоверным. Параллельно с данными резуль¬татами отмечались положительные тенденции при определении вибрационного порога – улучшение примерно на 30%. В противоположность этому вибрационные ощущения в группе плацебо ухудшились почти на 32%.
В исследовании BEDIP (BEnfotiamine in the treatment of Diabetic Polyneuropathy) 40 пациентам с диабетом 1 или 2 типа и полинейропатией назначалось по 400 мг бенфотиамина в сутки или плацебо сроком более 3 недель [5,6]. Балльная оценка по показателю нейропатии (по Katzenwadel) изначаль¬но была повышена, кроме того, отмечались нарушения вибрационного порога. В процессе лечения бенфотиамином балльная оценка по нейропатической шкале существен¬но улучшалась. Отчетливых измене¬ний в вибрационных ощущениях не происходило, однако наблюдалось значительное уменьшение боли. Побочных эффектов, связанных с применением бенфотиамина, зафиксировано не было. Уровень HbA1c и уровень глюкозы в крови оставались постоянными на протяжении всего периода исследования. Это иссле¬дование подтвердило результаты двух ранее проведенных рандомизированных, слепых, плацебо–контролируемых исследований и отчетливо продемонстрировало положительную динамику лечения ДПН при курсовом применении бенфотиамина.
В отдельных экспериментальных исследованиях изучалось влияние бенфотиамина на развитие ретинопатии, нефропатии и дисфункции сосудистого эндотелия. У крыс со стрептозотоциновым диабетом число патологических ацеллюлярных капиллярных сегментов не возрастало и, следовательно, повышенного риска развития ретинопатии выявлено не было. Развитие микроальбуминурии уменьшалось на 70–80%. Бенфотиамин предотвращает гиперфильтрацию, которая является ранним признаком нефропатии [1].
Группа шотландских специалистов под руководством Кэмерона в экспериментах на живот¬ных в течение 24 недель исследовала у крыс с индуцированным диабетом влияние бенфотиамина на нервные волокна и функцию сосудистого эндотелия. Установлено, что бенфотиамин нормализует нейрональные и сосудистые процессы, протекающие при участии NO, что имеет терапевтическое значение при диабетической ангиопатии и нейропатии.
Большой интерес в этой связи вызывают результаты проведенного исследования Нью–Йоркской рабочей группы под руко¬водством Vlassara, которая совместно с сотрудниками Немецкого научно–ис-следовательского института диабета в Дюссельдорфе и Диабетического центра в Бад–Ойнхаузене с помощью лазерной допплеровской флоуметрии установили, что через час после приема пищи, содержащей вредные конечные продукты ускоренного гликирования, ми¬крососудистая функция у больных диабетом 2 типа ухудшается. Но при заблаговременном приеме бенфотиамина можно полностью из¬бежать индуцированной AGE–продуктами сосудистой дисфункции, выра¬жавшейся в сужении просвета и ухудшении кровоснабжения. Это имеет большое значение для профилактики и терапии осложнений диабета [14].
Анализ клинических исследований эффективности тиамина при лечении ДПН позволяет сделать вывод о целесообразности его применения у больных СД для профилактики и лечения диабетической нейропатии.
Таким образом, терапевтическая эффективность бенфотиамина при диабетической нейропатии имеет патогенетическое обоснование. Введение в/м водорастворимого тиамина (100 мг) в комбинации с другими витаминами группы В (пиридоксин 100 мг, цианокобаламин 1000 мкг) в виде препарата Мильгамма используется на начальном этапе лечения ДПН, когда желательно быстрое достижение эффекта, оказывая патогенетическое (тиамин) и дополнительно неспецифическое положительное действие (пиридоксин, кобаламин) на функциональное состояние периферического нерва. Для длительного и профилактического лечения целесообразно использовать препарат Мильгамма композитум. Пероральная терапия Мильгаммой композитум проводится в течение 4–6 недель по 2–3 драже в сутки, обеспечивая возможность целенаправленного патогенетического воздействия при диабетической полинейропатии. Таким образом, двухэтапный курс терапии препаратами Мильгамма и Мильгамма композитум имеет патогенетическое обоснование: 10–дневный курс внутримышеных инъекций позволяет быстро достигать целевых концентраций тиамина в плазме крови и купировать болевые симптомы; пероральный прием Мильгаммы композитум увеличивает эффективность инъекционного курса и пролонгирует лечебный эффект. В дальнейшем рекомендуется проводить терапевтический прием Мильгаммы композитум 2 раза в год.
Литература
1. Babaei–Jadidi R., Karachalias N., Kupich C, Ahmed N., Thornalley P.J.: High–dose thiamine therapy counters dyslipi–daemia in streptozotocin–induced diabetic rats. Diabetolo¬gia 47 (2004)2235–46.
2. Becker K. W., Kienecker E.–W., Dick P.: Neurochirurgia 33(1990)113–121.
3. Benbow SJ, Wallymahmed ME, MacFarime IA. Diabetic peripheral neuropathy and quality of life. QJ Med 1998;91:733–37.
4. Greb A., Bitsch R.: Int. J. Clin. Pharmacol. Therapy 36 (1998) 16–221.
5. Haupt E., Ledermann H., Kopcke W.: Benfotiamin in the treatment of diabetic polyneuropathy – a three–week randomized, controlled pilot study (BEDIP–Study). Int. J. Clin. Pharmacol. and Therap., Vol. 43, 2 (2005) 71–77.
6. Haupt E.: 4th International Symposium on Diabetic Neuropathy, Noordwijkerhout (1997).
7. Hellweg R., Wohrle M., Hartung H.D.: J. Neurosci. Res. 26/2(1990) 258–267.
8. Ledermann H., Wiedey K.D.:Therapiewoche 39 (1989) 1445–1449.
9. Pomero F, Molinar MA, La Selva M, et al. Benfotiamine is similar to thiamine in correcting endothelial cell defects induced by high glucose. Acta Diabetol 2001;38:135–8.
10. Rabinowe S.L.: Diabetes Metab. Res. 6 (1990) 169–188.
11. Rashi G.: Kidney Int. 66,3 (2004) 1099–1 106.
12. Reichard P, Nilsson B–Y, Rosengwist V. The effect of long–term intensified insulin treatment on the development of microvascular complications of diabetes mellitus N Engl J Med 1993;329: 304–09.
13. Schreeb K.H., Freudenthaler S., Vormfelde S.V, Gundefi Remy U., Gleiter C.H.: Eur. J. Clin. Pharmacol. 52,4 O’l’l/) 319–320.
14. Stirban A.: Diabetes und Stoffwechsel,.Suppl 1 (2005),32–33.
15. Stracke H., Lindemann A., Federlin K.: Exp.Clin.Endocrinol. Diabetes 104(1996) 311–316.
16. Young MJ, Boulton AJM, MacLeod AF, et al. A multicentre study of the prevalence of diabetic peripheral neuropathy in the United Kingdom hospital clinic population. Diabetologia 1993;36:1–5.
17. Ziegler D., Gries F.A.: Nervenheilkunde 12 (1993) 405–410.








.gif)



