–Ц–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–∞—П –∞–љ–µ–Љ–Є—П (–љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–∞—П –Є–Ј –≤—Б–µ—Е –∞–љ–µ–Љ–Є–є) –≤–њ–µ—А–≤—Л–µ –Њ–њ–Є—Б–∞–љ–∞ –≤ XVI —Б—В–Њ–ї–µ—В–Є–Є –њ–Њ–і –љ–∞–Ј–≤–∞–љ–Є–µ–Љ morbus virginum (–њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–ї–∞—Б—М —Г –і–µ–≤—Г—И–µ–Ї –≤ 14–17 –ї–µ—В) –Є chlorosis, –Є–ї–Є –Ј–µ–ї–µ–љ–∞—П –±–Њ–ї–µ–Ј–љ—М. –Ц–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–∞—П –њ—А–Є—А–Њ–і–∞ —Е–ї–Њ—А–Њ–Ј–∞ –≤–њ–µ—А–≤—Л–µ –Њ—В–Љ–µ—З–µ–љ–∞ Sydenham –≤ XVIII —Б—В–Њ–ї–µ—В–Є–Є, –Ї–Њ–≥–і–∞ –±—Л–ї–∞ –њ—А–Є–Ј–љ–∞–љ–∞ —Б–≤—П–Ј—М –∞–љ–µ–Љ–Є–Є, –≥–Є–њ–Њ—Е—А–Њ–Љ–Є–Є –Є –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–∞. –Ґ–∞–Ї, –≤ 1832 –≥. Pierre Blaud —Б–Њ–Њ–±—Й–Є–ї –Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –ї–µ—З–µ–љ–Є—П —Е–ї–Њ—А–Њ–Ј–∞ —Б–µ—А–љ–Њ–Ї–Є—Б–ї—Л–Љ –ґ–µ–ї–µ–Ј–Њ–Љ. –Т 1866 –≥. Perls –≤–љ–µ–і—А–Є–ї –≤ –њ—А–∞–Ї—В–Є–Ї—Г —А–µ–∞–Ї—Ж–Є—О –љ–∞ –њ—А—Г—Б—Б–Ї—Г—О –ї–∞–Ј—Г—А—М –≤ —Ж–µ–ї—П—Е –≤—Л—П–≤–ї–µ–љ–Є—П —В–Ї–∞–љ–µ–≤–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞, –Ї–Њ—В–Њ—А–∞—П –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –±—Л–ї–∞ –і–Њ–њ–Њ–ї–љ–µ–љ–∞ –≤–љ–µ–і—А–µ–љ–Є–µ–Љ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –Љ–µ—В–Њ–і–∞ –У–µ–є–ї—М–Љ–∞–є–µ—А–∞ –Є –Я–ї–Њ—В–љ–µ—А–∞ –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ.
–Ю–±–Љ–µ–љ –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ
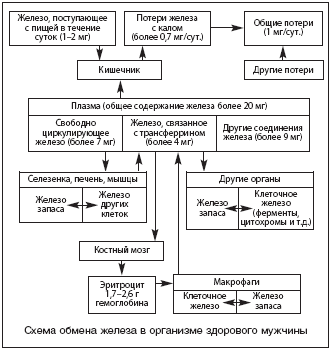
–Я–Њ –і–∞–љ–љ—Л–Љ Jacobs, Worwood (1974), –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞ –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ 70 –Ї–≥ –Є–Љ–µ–µ—В—Б—П 4,5 –≥ –ґ–µ–ї–µ–Ј–∞. –Ц–µ–ї–µ–Ј–Њ –Ї–∞–Ї –±–Є–Њ–Љ–µ—В–∞–ї–ї –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Љ–Є—В–Њ–Ј–µ –Ї–ї–µ—В–Њ–Ї, –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ––≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є—П—Е, –≤ —Б–Є–љ—В–µ–Ј–µ –Ф–Э–Ъ –Є —В.–і. –Т –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –µ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Љ–Њ–ґ–љ–Њ —Г—Б–ї–Њ–≤–љ–Њ —А–∞–Ј–і–µ–ї–Є—В—М –љ–∞ –Ї–ї–µ—В–Њ—З–љ–Њ–µ, –љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–µ –Є –ґ–µ–ї–µ–Ј–Њ –Ј–∞–њ–∞—Б–∞. –Ъ–ї–µ—В–Њ—З–љ–Њ–µ –ґ–µ–ї–µ–Ј–Њ –≤—Л—П–≤–ї—П–µ—В—Б—П –≤ —Б–ї–µ–і—Г—О—Й–Є—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є—П—Е.
1. –Т –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М, –≤ –≥–µ–Љ–Њ–њ—А–Њ—В–µ–Є–љ–∞—Е, –Њ—Б–љ–Њ–≤–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П–µ—В—Б—П –≥–µ–Љ (–≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ, –Љ–Є–Њ–≥–ї–Њ–±–Є–љ, —Ж–Є—В–Њ—Е—А–Њ–Љ—Л, –Ї–∞—В–∞–ї–∞–Ј–∞ –Є –њ–µ—А–Њ–Ї—Б–Є–і–∞–Ј–∞).
2. –Ц–µ–ї–µ–Ј–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є–µ —Д–µ—А–Љ–µ–љ—В—Л –љ–µ–≥–µ–Љ–Є–љ–Њ–≤–Њ–є –≥—А—Г–њ–њ—Л (—Б—Г–Ї—Ж–Є–љ–∞—В–і–µ–≥–Є–і—А–Њ–≥–µ–љ–∞–Ј–∞, –∞—Ж–µ—В–Є–ї––Ї–Њ—Н–љ–Ј–Є–Љ––Р––і–µ–≥–Є–і—А–Њ–≥–µ–љ–∞–Ј–∞, –Э–Р–Ф–Э–—Ж–Є—В–Њ—Е—А–Њ–Љ, –°–—А–µ–і—Г–Ї—В–∞–Ј–∞ –Є —В.–і.).
–Т–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–µ –ґ–µ–ї–µ–Ј–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –±–µ–ї–Ї–∞–Љ–Є —В—А–∞–љ—Б—Д–µ—А—А–Є–љ–Њ–Љ –Є –ї–∞–Ї—В–Њ—Д–µ—А—А–Є–љ–Њ–Љ, —Б–Њ–і–µ—А–ґ–∞—Й–Є–Љ–Є—Б—П –≤–Њ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–Љ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—Й–Є–Љ–Є —В—А–∞–љ—Б–њ–Њ—А—В–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –Є–Њ–љ–∞–Љ –ґ–µ–ї–µ–Ј–∞. –Ґ—А–∞–љ—Б—Д–µ—А—А–Є–љ – –±–µ–ї–Њ–Ї –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є, –Њ—В–љ–Њ—Б—П—Й–Є–є—Б—П –Ї b––≥–ї–Њ–±—Г–ї–Є–љ–∞–Љ. –£ –ї—О–і–µ–є –Њ—Б–љ–Њ–≤–љ—Л–Љ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —Б–Є–љ—В–µ–Ј–∞ —П–≤–ї—П–µ—В—Б—П –њ–µ—З–µ–љ—М. –Ч–∞ —Б—Г—В–Ї–Є –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—Б—П –і–Њ 12–14 –Љ–≥ –±–µ–ї–Ї–∞ –љ–∞ 1 –Ї–≥ –Љ–∞—Б—Б—Л —В–µ–ї–∞, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В 5–9% –Њ—В –≤—Б–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —В—А–∞–љ—Б—Д–µ—А—А–Є–љ–∞. –Ы–∞–Ї—В–Њ—Д–µ—А—А–Є–љ – –±–µ–ї–Њ–Ї, —В–∞–Ї–ґ–µ –Њ—В–љ–Њ—Б—П—Й–Є–є—Б—П –Ї —Б–µ–Љ–µ–є—Б—В–≤—Г —В—А–∞–љ—Б—Д–µ—А—А–Є–љ–Њ–≤, –њ–µ—А–µ–љ–Њ—Б—П—Й–Є–є –Є–Њ–љ—Л —В—А–µ—Е–≤–∞–ї–µ–љ—В–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞.
–Ц–µ–ї–µ–Ј–Њ –Ј–∞–њ–∞—Б–∞ – –±–µ–ї–Ї–Њ–≤—Л–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П —Д–µ—А—А–Є—В–Є–љ –Є –≥–µ–Љ–Њ—Б–Є–і–µ—А–Є–љ – —Б –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –Њ—В–ї–Њ–ґ–µ–љ–Є–µ–Љ –≤ –њ–µ—З–µ–љ–Є, —Б–µ–ї–µ–Ј–µ–љ–Ї–µ –Є –Љ—Л—И—Ж–∞—Е. –Ч–∞–і–µ–є—Б—В–≤—Г–µ—В—Б—П –њ—А–Є –љ–µ–і–Њ—Б—В–∞—В–Ї–µ –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞. –Э–∞–Є–±–Њ–ї—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –ґ–µ–ї–µ–Ј–∞ (–Ј–∞ –≤—Л—З–µ—В–Њ–Љ –Ї—А–Њ–≤–Є) —Б–Њ–і–µ—А–ґ–Є—В—Б—П –≤ —Б–ї–µ–і—Г—О—Й–Є—Е –Њ—А–≥–∞–љ–∞—Е: —Б–µ–ї–µ–Ј–µ–љ–Ї–∞ (336 –Љ–Ї–≥/–≥), –ї–µ–≥–Ї–Є–µ (319 –Љ–Ї–≥/–≥), –њ–µ—З–µ–љ—М (195 –Љ–Ї–≥/–≥), –Љ—Л—И—Ж—Л (–і–Њ 27,9%, –≤ –≤–Є–і–µ –Љ–Є–Њ–≥–ї–Њ–±–Є–љ–∞ 21,9%, —Д–µ—А—А–Є—В–Є–љ–∞ 6,91%), –њ–µ—З–µ–љ—М (7,8%, —Д–µ—А—А–Є—В–Є–љ, –≥–µ–Љ–Њ—Б–Є–і–µ—А–Є–љ).
–°—Г—Й–µ—Б—В–≤—Г–µ—В –Є –ї–∞–±–Є–ї—М–љ—Л–є –њ—Г–ї –ґ–µ–ї–µ–Ј–∞ – –Њ—В 80 –і–Њ 90 –Љ–≥: –ґ–µ–ї–µ–Ј–Њ, –њ–Њ–Ї–Є–і–∞—О—Й–µ–µ –њ–ї–∞–Ј–Љ—Г –Ї—А–Њ–≤–Є, –њ—А–Њ—Е–Њ–і—П—Й–µ–µ –≤ –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ–µ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–Њ, –≤ –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ—Л–µ –њ—А–Њ–Љ–µ–ґ—Г—В–Ї–Є, –≥–і–µ –Њ–љ–Њ –Љ–Њ–ґ–µ—В —Б–≤—П–Ј—Л–≤–∞—В—М—Б—П —Б –Ї–ї–µ—В–Њ—З–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ–Њ–є, –∞ –Љ–Њ–ґ–µ—В –≤–Њ–Ј–≤—А–∞—Й–∞—В—М—Б—П –Њ–±—А–∞—В–љ–Њ –≤ –њ–ї–∞–Ј–Љ—Г –Ї—А–Њ–≤–Є.
–Ш—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —П–≤–ї—П–µ—В—Б—П –њ–Є—Й–µ–≤–Њ–µ –ґ–µ–ї–µ–Ј–Њ, –≤—Б–∞—Б—Л–≤–∞—О—Й–µ–µ—Б—П –≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–Љ —В—А–∞–Ї—В–µ –≤ –љ–∞–Є–±–Њ–ї—М—И–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ 12––њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–µ –Є –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–∞—Е —В–Њ—Й–µ–є –Ї–Є—И–Ї–Є. –Т –ґ–µ–ї—Г–і–Ї–µ –∞–і—Б–Њ—А–±–Є—А—Г–µ—В—Б—П —В–Њ–ї—М–Ї–Њ –љ–µ–≥–µ–Љ–Њ–≤–Њ–µ –ґ–µ–ї–µ–Ј–Њ, —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 20%. –У–µ–Љ–Њ–≤–Њ–µ (—Б–Њ–і–µ—А–ґ–∞—Й–µ–µ –њ—А–Њ—В–Њ–њ–Њ—А—Д–Є—А–Є–љ) –ґ–µ–ї–µ–Ј–Њ –≤ —Н–њ–Є—В–µ–ї–Є–Њ—Ж–Є—В–∞—Е —А–∞—Б–њ–∞–і–∞–µ—В—Б—П –љ–∞ –Є–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –ґ–µ–ї–µ–Ј–Њ, –Њ–Ї–Є—Б—М —Г–≥–ї–µ—А–Њ–і–∞ –Є –±–Є–ї–Є—А—Г–±–Є–љ. –Т —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–µ –ґ–µ–ї–µ–Ј–Њ –Ј–∞—Е–≤–∞—В—Л–≤–∞–µ—В—Б—П —Н–љ—В–µ—А–Њ—Ж–Є—В–∞–Љ–Є, –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –≤ –Ї—А–Њ–≤—М, –Њ—Б—В–∞–≤–ї—П—П –љ–µ–±–Њ–ї—М—И–Њ–є –Ј–∞–њ–∞—Б –≤ –і–µ–њ–Њ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є —В–Њ—Й–µ–є –Ї–Є—И–Ї–Є. –Т —Б–Њ–µ–і–Є–љ–µ–љ–Є–Є —Б —В—А–∞–љ—Б—Д–µ—А—А–Є–љ–Њ–Љ —В—А–∞–љ—Б–њ–Њ—А—В–Є—А—Г–µ—В—Б—П –≤ —Н—А–Є—В—А–Њ–Ї–∞—А–Є–Њ—Ж–Є—В—Л, –њ—А–Њ–љ–Є–Ї–∞—П –≤ –Ї–ї–µ—В–Ї—Г, —Г—З–∞—Б—В–≤—Г–µ—В –≤ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –≤—Б–µ—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞.
–Ю—А–≥–∞–љ–Є–Ј–Љ —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ —А–µ–≥—Г–ї–Є—А—Г–µ—В –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –ґ–µ–ї–µ–Ј–∞ –Є–Ј —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –≤ –Ї—А–Њ–≤—М. –Я—А–Є –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П—Е –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞—П –µ–≥–Њ —З–∞—Б—В—М –њ—А–Њ—Е–Њ–і–Є—В —З–µ—А–µ–Ј —Б–ї–Є–Ј–Є—Б—В—Г—О –Њ–±–Њ–ї–Њ—З–Ї—Г –Ї–Є—И–Ї–Є –≤ —В–Њ–Ї –Ї—А–Њ–≤–Є, –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–∞—П —З–∞—Б—В—М –Ј–∞–і–µ—А–ґ–Є–≤–∞–µ—В—Б—П –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є. –Я—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –ґ–µ–ї–µ–Ј–∞ –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Ј–∞–і–µ—А–ґ–Є–≤–∞–µ—В—Б—П –Љ–µ–љ—М—И–∞—П —З–∞—Б—В—М, –±–Њ–ї—М—И–∞—П —Г—Б—В—А–µ–Љ–ї—П–µ—В—Б—П –≤ –њ–ї–∞–Ј–Љ—Г –Ї—А–Њ–≤–Є. –Т –њ—А–Њ—В–Є–≤–љ–Њ–Љ —Б–ї—Г—З–∞–µ (–њ–Њ–≤—Л—И–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –ґ–µ–ї–µ–Ј–∞) –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ—Б—В–∞–µ—В—Б—П –±–Њ–ї—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –ґ–µ–ї–µ–Ј–∞, –Ї–ї–µ—В–Ї–∞, –љ–∞—Б—Л—Й–µ–љ–љ–∞—П –ґ–µ–ї–µ–Ј–Њ–Љ, —Б–Њ –≤—А–µ–Љ–µ–љ–µ–Љ —Б–Љ–µ—Й–∞–µ—В—Б—П –Ї –Ї–Њ–љ—Ж—Г –≤–Њ—А—Б–Є–љ–Ї–Є, —Б–ї—Г—Й–Є–≤–∞–µ—В—Б—П –Є –≤—Л–≤–Њ–і–Є—В—Б—П —Б –Ї–∞–ї–Њ–Љ –≤–Љ–µ—Б—В–µ —Б –љ–µ–≤—Б–Њ—Б–∞–≤—И–Є–Љ—Б—П –ґ–µ–ї–µ–Ј–Њ–Љ.
–£—Б–≤–Њ–µ–љ–Є–µ –њ–Є—Й–µ–≤–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –љ–∞–њ—А—П–Љ—Г—О –Ј–∞–≤–Є—Б–Є—В –Њ—В —Б–Њ—Б—В–∞–≤–∞ —Б–∞–Љ–Њ–є –њ–Є—Й–Є. –Э–∞–ї–Є—З–Є–µ –≤ –љ–µ–є —П–љ—В–∞—А–љ–Њ–є, –∞—Б–Ї–Њ—А–±–Є–љ–Њ–≤–Њ–є, –ї–Є–Љ–Њ–љ–љ–Њ–є –Ї–Є—Б–ї–Њ—В, –∞ —В–∞–Ї–ґ–µ —Д—А—Г–Ї—В–Њ–Ј—Л, —Б–Њ—А–±–Є—В–∞, –Љ–µ—В–Є–Њ–љ–Є–љ–∞ –Є —Ж–Є—Б—В–µ–Є–љ–∞ —Г—Б–Ї–Њ—А—П—О—В –Ј–∞–і–∞–љ–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б, –љ–∞–њ—А–Њ—В–Є–≤, —Д–Њ—Б—Д–∞—В—Л, —Д–Є—В–∞—В—Л, –Њ–Ї—Б–∞–ї–∞—В—Л, –њ—А–µ–њ–∞—А–∞—В—Л –Ї–∞–ї—М—Ж–Є—П –Є —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –Ї–∞–ї—М—Ж–Є–є –њ—А–Њ–і—Г–Ї—В—Л (—В–≤–Њ—А–Њ–≥, –Љ–Њ–ї–Њ–Ї–Њ) —В–Њ—А–Љ–Њ–Ј—П—В. –Э–∞–Є–±–Њ–ї—М—И–Є–Љ–Є –њ–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—О –ґ–µ–ї–µ–Ј–∞ (–≤ –Љ–≥ –љ–∞ 100 –≥ –њ—А–Њ–і—Г–Ї—В–∞) –њ—А–Њ–і—Г–Ї—В–∞–Љ–Є —П–≤–ї—П—О—В—Б—П –њ–µ—З–µ–љ—М –≥–Њ–≤—П–ґ—М—П – 9,8 –Љ–≥, —Б–Њ–ї—М –њ–Њ–≤–∞—А–µ–љ–љ–∞—П – 10,0, –Ї—А—Г–њ–∞ –≥—А–µ—З–љ–µ–≤–∞—П – 8,0, —П–Ј—Л–Ї –≥–Њ–≤—П–ґ–Є–є – 5,0, —Д–∞—Б–Њ–ї—М – 12,4, –≥–Њ—А–Њ—Е – 9,4.
–Ю–і–љ–∞–Ї–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –ґ–µ–ї–µ–Ј–∞ –≤ –њ—А–Њ–і—Г–Ї—В–µ –њ–Є—В–∞–љ–Є—П –љ–µ –Ї–Њ—А—А–µ–ї–ї–Є—А—Г–µ—В —Б –µ–≥–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Ї –≤—Б–∞—Б—Л–≤–∞–љ–Є—О –≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–Љ —В—А–∞–Ї—В–µ, —З—В–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –ї—Г—З—И–Є–Љ —Г—Б–≤–Њ–µ–љ–Є–µ–Љ –ґ–µ–ї–µ–Ј–∞ –≤ –≤–Є–і–µ –≥–µ–Љ–∞. –Ґ–∞–Ї, –Є–Ј –њ—А–Њ–і—Г–Ї—В–Њ–≤ –њ–Є—В–∞–љ–Є—П —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П –і–Њ 7% –Њ—В —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ —Г—Б–≤–∞–Є–≤–∞–µ—В—Б—П –Є–Ј –±–Њ–±–Њ–≤ —Б–Њ–Є, –Є–Ј —Д—А—Г–Ї—В–Њ–≤ – –љ–µ –±–Њ–ї–µ–µ 3%, –Љ—П—Б–љ—Л–µ –њ—А–Њ–і—Г–Ї—В—Л –Њ–±–ї–∞–і–∞—О—В –±–Њ–ї—М—И–Є–Љ –њ—А–Њ—Ж–µ–љ—В–Њ–Љ —Г—Б–≤–Њ–µ–љ–Є—П – –і–Њ 22% –ґ–µ–ї–µ–Ј–∞ –Є–Ј —В–µ–ї—П—В–Є–љ—Л (—В–µ–ї—П—В–Є–љ–∞ —Б–Њ–і–µ—А–ґ–Є—В –і–Њ 90% –ґ–µ–ї–µ–Ј–∞ –≤ –≤–Є–і–µ –≥–µ–Љ–∞), –і–Њ 11% –Є–Ј —А—Л–±–љ—Л—Е –Є–Ј–і–µ–ї–Є–є (–ґ–µ–ї–µ–Ј–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ –≤–Є–і–µ —Д–µ—А—А–Є—В–Є–љ–∞ –Є –≥–µ–Љ–Њ—Б–Є–і–µ—А–Є–љ–∞).
–§–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –ґ–µ–ї–µ–Ј–∞ –Є–Ј –њ–Є—Й–Є –Њ–≥—А–∞–љ–Є—З–µ–љ–Њ. –Я—А–Є –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ–Љ –њ–Є—В–∞–љ–Є–Є –≤–Ј—А–Њ—Б–ї—Л–є –Љ—Г–ґ—З–Є–љ–∞ –њ–Њ–ї—Г—З–∞–µ—В –≤ –і–µ–љ—М –і–Њ 18 –Љ–≥ –ґ–µ–ї–µ–Ј–∞, –Є–Ј –Ї–Њ—В–Њ—А–Њ–≥–Њ —Г—Б–≤–∞–Є–≤–∞–µ—В—Б—П —В–Њ–ї—М–Ї–Њ 1–1,5 –Љ–≥, —Г –ґ–µ–љ—Й–Є–љ –њ—А–Є 12–15 –Љ–≥ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П —Г—Б–≤–Њ–µ–љ–Є–µ –Ї–Њ—Б–љ–µ—В—Б—П —В–Њ–ї—М–Ї–Њ 1–1,3 –Љ–≥ –ґ–µ–ї–µ–Ј–∞. –Я–Њ –і–∞–љ–љ—Л–Љ –У—Г—А–µ–≤–Є—З–∞ –Ь.–Ш. (1977), –≤ –љ–Њ—А–Љ–µ –≥–µ–Љ–Њ–≤–Њ–µ –ґ–µ–ї–µ–Ј–Њ –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П —Г –Љ—Г–ґ—З–Є–љ –і–Њ 16,9+1,6%, —Г –ґ–µ–љ—Й–Є–љ 13,6+1,1%.
–Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤—Б–∞—Б—Л–≤–∞–µ–Љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 2–2,5 –Љ–≥. –Ъ —Н—В–Њ–Љ—Г –њ—А–Є–±–∞–≤–ї—П–µ—В—Б—П 21 –Љ–≥ –ґ–µ–ї–µ–Ј–∞ –Є–Ј —А–∞–Ј—А—Г—И–µ–љ–љ—Л—Е —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, 11 –Љ–≥ – –Є–Ј –њ—Г–ї–∞ –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, 1 –Љ–≥ – –Є–Ј –і–µ–њ–Њ. –°—Г–Љ–Љ–∞—А–љ–Њ –і–Њ 35 –Љ–≥ –≤ —Б—Г—В–Ї–Є.
–†–∞—Б—Е–Њ–і—Л —Б–Ї–ї–∞–і—Л–≤–∞—О—В—Б—П –Є–Ј —Б–ї–µ–і—Г—О—Й–Є—Е –≤–µ–ї–Є—З–Є–љ: —Б–Є–љ—В–µ–Ј –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ (17–40 –Љ–≥), —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ–Њ—В–µ—А–Є (—Б –Ї–∞–ї–Њ–Љ, –Љ–Њ—З–Њ–є, –њ–Њ—В–Њ–Љ, —Б–ї—Г—Й–Є–≤–∞—О—Й–Є–Љ—Б—П —Н–њ–Є—В–µ–ї–Є–µ–Љ –Ї–Њ–ґ–Є – –љ–µ –±–Њ–ї–µ–µ 1 –Љ–≥). –†–∞—Б—Е–Њ–і—Л –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –њ–Њ–ї–љ–Њ—Б—В—М—О –њ–Њ–Ї—А—Л–≤–∞—О—В—Б—П –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ–Љ –ґ–µ–ї–µ–Ј–∞, –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –Њ—В—Б—Г—В—Б—В–≤–Є—П –њ–Њ–≤—Л—И–µ–љ–љ—Л—Е –њ–Њ—В—А–µ–±–љ–Њ—Б—В–µ–є –≤ –љ–µ–Љ, —Б–љ–Є–ґ–µ–љ–Є—П –µ–≥–Њ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—П –њ–Њ—В–µ—А—М. –Т —З–Є—Б–ї–Њ–≤–Њ–Љ –≤–∞—А–Є–∞–љ—В–µ —Н—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –њ–Њ—В–µ—А–µ –±–Њ–ї–µ–µ 2 –Љ–≥ –≤ —Б—Г—В–Ї–Є.
–°–љ–Є–ґ–µ–љ–Є–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ –љ–∞–њ—А—П–Љ—Г—О —Б–≤—П–Ј–∞–љ–Њ —Б –њ–Є—Й–µ–≤—Л–Љ —А–∞—Ж–Є–Њ–љ–Њ–Љ –Є –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –њ—А–Є –Њ–±—Й–µ–Љ –≥–Њ–ї–Њ–і–∞–љ–Є–Є, —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –њ—А–Њ–і—Г–Ї—В–Њ–≤ –њ–Є—В–∞–љ–Є—П, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –ґ–µ–ї–µ–Ј–Њ, –њ–∞—В–Њ–ї–Њ–≥–Є–Є 12––њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є –Є –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–Њ–≤ —В–Њ–љ–Ї–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞ (–ї–Є–±–Њ —А–µ–Ј–µ–Ї—Ж–Є—П –і–∞–љ–љ—Л—Е –Њ—В—А–µ–Ј–Ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞).
–Я–Њ—В–µ—А–Є –ґ–µ–ї–µ–Ј–∞ —З–µ—В–Ї–Њ –∞—Б—Б–Њ—Ж–Є–Є—А—Г—О—В—Б—П —Б –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А—П–Љ–Є, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —В–µ–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ —Б—З–Є—В–∞—О—В—Б—П —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є – —Г –Љ–µ–љ—Б—В—А—Г–Є—А—Г—О—Й–Є—Е –ґ–µ–љ—Й–Є–љ. –£ 10–25% –ґ–µ–љ—Й–Є–љ, –Ї–Њ—В–Њ—А—Л–µ —Б—З–Є—В–∞—О—В —Б–µ–±—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Ј–і–Њ—А–Њ–≤—Л–Љ–Є, –≤–Њ –≤—А–µ–Љ—П –Љ–µ–љ—Б—В—А—Г–∞—Ж–Є–Є —В–µ—А—П–µ—В—Б—П –±–Њ–ї–µ–µ 40 –Љ–≥ –ґ–µ–ї–µ–Ј–∞, —Г 5% –Њ–±—К–µ–Љ —В–µ—А—П–µ–Љ–Њ–є –Ї—А–Њ–≤–Є –Ј–∞ —Ж–Є–Ї–ї –њ—А–µ–≤—Л—И–∞–µ—В 90 –Љ–ї (45 –Љ–≥ –ґ–µ–ї–µ–Ј–∞). –Я—А–Є –Њ–±–Є–ї—М–љ—Л—Е –Є –і–ї–Є—В–µ–ї—М–љ—Л—Е –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А—П—Е –Є—Е –≤–µ–ї–Є—З–Є–љ–∞ –і–Њ—Б—В–Є–≥–∞–µ—В 100–500 –Љ–ї –Ї—А–Њ–≤–Є (50–250 –Љ–≥ –ґ–µ–ї–µ–Ј–∞). –°—Г—В–Њ—З–љ–∞—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –ґ–µ–ї–µ–Ј–µ —Г –ґ–µ–љ—Й–Є–љ, —В–µ—А—П—О—Й–Є—Е 30–40 –Љ–ї –Ї—А–Њ–≤–Є –Ј–∞ 1 —Ж–Є–Ї–ї, 1,5–1,7 –Љ–≥. –Т —Б–Є—В—Г–∞—Ж–Є–Є –Њ–±–Є–ї—М–љ–Њ–є –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –і–Њ 3 –Љ–≥/—Б—Г—В., –љ–Њ —В–∞–Ї–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –ґ–µ–ї–µ–Ј–∞ –љ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М —Г—Б–≤–Њ–µ–љ–Њ –Є–Ј –њ–Є—Й–Є. –°–Њ–Ј–і–∞–µ—В—Б—П –і–µ—Д–Є—Ж–Є—В, –Ї–Њ—В–Њ—А—Л–є –Є–Ј –Љ–Є–Ј–µ—А–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ј–∞ –Њ–і–љ–Є —Б—Г—В–Ї–Є (0,5–1 –Љ–≥), —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –Ј–∞ –Љ–µ—Б—П—Ж –і–Њ 15–20 –Љ–≥, –Ј–∞ –≥–Њ–і –і–Њ 189–240 –Љ–≥, –≤ —В–µ—З–µ–љ–Є–µ 10 –ї–µ—В –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –і–Њ 1,8–2,4 –≥. –°—А–Њ–Ї –ґ–µ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –ґ–µ–љ—Б–Ї–Њ–≥–Њ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ (–∞ –Ј–љ–∞—З–Є—В, –Є –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ—Л—Е –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А—М) –љ–µ –Љ–µ–љ–µ–µ 40 –ї–µ—В. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Ї –≤–Њ–Ј—А–∞—Б—В—Г 42–45 –ї–µ—В –ґ–µ–љ—Й–Є–љ–∞ –њ–Њ–і—Е–Њ–і–Є—В —Г–ґ–µ —Б –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ –ґ–µ–ї–µ–Ј–∞, —Е–Њ—В—П –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є –Ј–і–Њ—А–Њ–≤—М—П –љ–µ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П.
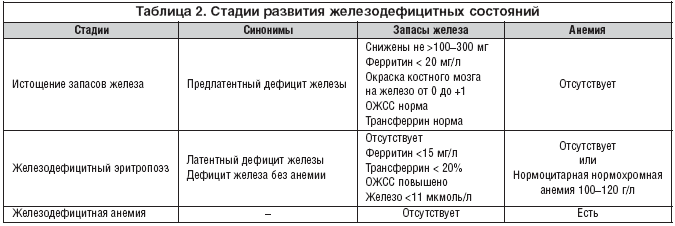
–£ –Љ—Г–ґ—З–Є–љ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А—М –љ–µ –±—Л–≤–∞–µ—В. –Я–Њ—Н—В–Њ–Љ—Г –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–Љ–Є—Б—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ–Љ. –Я–Њ–Є—Б–Ї –Є–Љ–µ–µ—В —Б–Љ—Л—Б–ї –љ–∞—З–Є–љ–∞—В—М —Б –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ (—П–Ј–≤–µ–љ–љ–∞—П –±–Њ–ї–µ–Ј–љ—М –ґ–µ–ї—Г–і–Ї–∞ –Є 12––њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є, –Њ–њ—Г—Е–Њ–ї–Є, –і–Є–≤–µ—А—В–Є–Ї—Г–ї—Л —А–∞–Ј–ї–Є—З–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є, –≥–ї–Є—Б—В–љ—Л–µ –Є–љ–≤–∞–Ј–Є–Є, —Н—А–Њ–Ј–Є–Є —Б–ї–Є–Ј–Є—Б—В–Њ–є, –≥—А—Л–ґ–Є –њ–Є—Й–µ–≤–Њ–і–љ–Њ–≥–Њ –Њ—В–≤–µ—А—Б—В–Є–Є –і–Є–∞—Д—А–∞–≥–Љ—Л, –∞–љ–Ї–Є–ї–Њ—Б—В–Њ–Љ–Є–і–Њ–Ј) (—В–∞–±–ї. 1).
–†–µ–ґ–µ –≤—Б—В—А–µ—З–∞—О—В—Б—П –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л–µ –∞–љ–µ–Љ–Є–Є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–µ –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–µ–є –≤ –Ј–∞–Љ–Ї–љ—Г—В—Л–µ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–∞ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —А–µ—Г—В–Є–ї–Є–Ј–∞—Ж–Є–Є –ґ–µ–ї–µ–Ј–∞. –Я—А–Є–Љ–µ—А–∞–Љ–Є –Љ–Њ–≥—Г—В —Б–ї—Г–ґ–Є—В—М –ї–µ–≥–Њ—З–љ—Л–є —Б–Є–і–µ—А–Њ–Ј —Б –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–µ–є –≤ –ї–µ–≥–Њ—З–љ—Г—О —В–Ї–∞–љ—М, –Є —Н–љ–і–Њ–Љ–µ—В—А–Є–Њ–Ј, –љ–µ —Б–≤—П–Ј–∞–љ–љ—Л–є —Б –њ–Њ–ї–Њ—Б—В—М—О –Љ–∞—В–Ї–Є. –Т —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ –≤–Њ –≤—А–µ–Љ—П –Љ–µ–љ—Б—В—А—Г–∞—Ж–Є–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ –Ј–∞–Љ–Ї–љ—Г—В—Г—О –њ–Њ–ї–Њ—Б—В—М, —З–∞—Й–µ –≤—Б–µ–≥–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Г—О —Н–Ї—В–Њ–њ–Є—З–µ—Б–Ї–Є.
–Ґ—А–µ—В—М–µ–є –њ—А–Є—З–Є–љ–Њ–є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ —П–≤–ї—П–µ—В—Б—П –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ —А–∞—Б—Е–Њ–і–Њ–≤–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–Љ: –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М, –ї–∞–Ї—В–∞—Ж–Є—П, –і–µ—В—Б–Ї–Є–є –Є –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤—Л–є –≤–Њ–Ј—А–∞—Б—В.
–†–∞–Ј–≤–Є—В–Є–µ –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ —Г –і–µ—В–Є—И–µ–Ї –Љ–ї–∞–і—И–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Љ–љ–Њ–≥–Њ–њ–ї–Њ–і–љ–Њ–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –њ—А–Є –љ–µ–і–Њ–љ–Њ—И–µ–љ–љ–Њ—Б—В–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є, –Љ–Њ–≥—Г—В —П–≤–ї—П—В—М—Б—П –і–µ—Д–Є—Ж–Є—В —Д–µ—А–Љ–µ–љ—В–Њ–≤ –Ї–Є—И–µ—З–љ–Є–Ї–∞, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л—Е –і–ї—П —Г—Б–≤–Њ–µ–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –Є–Ј –Љ–Њ–ї–Њ–Ї–∞ –Љ–∞—В–µ—А–Є.
–Ф–∞–ї—М–љ–µ–є—И–Є–є —А–Њ—Б—В –і–µ—В–µ–є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–∞—Б—Е–Њ–і–љ—Г—О —Б—В–∞—В—М—О –ґ–µ–ї–µ–Ј–∞, –њ—А–Є—З–µ–Љ –Є –і–µ–≤–Њ—З–Ї–Є, –Є –Љ–∞–ї—М—З–Є–Ї–Є –Њ–Ї–∞–Ј—Л–≤–∞—О—В—Б—П –≤ –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є. –Т –њ—Г–±–µ—А—В–∞—В–љ—Л–є –њ–µ—А–Є–Њ–і –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Н—Б—В—А–Њ–≥–µ–љ–љ—Л–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –љ–∞ —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј –Є —Г—В–Є–ї–Є–Ј–∞—Ж–Є—О –ґ–µ–ї–µ–Ј–∞ (–љ–µ–Ї–Њ—В–Њ—А–Њ–µ —В–Њ—А–Љ–Њ–ґ–µ–љ–Є–µ) —Б–Њ–Ј–і–∞—О—В —Г—Б–ї–Њ–≤–Є—П –і–ї—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–∞ —Г –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—М–љ–Є—Ж —Б–ї–∞–±–Њ–≥–Њ –њ–Њ–ї–∞. –С–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М –Є –ї–∞–Ї—В–∞—Ж–Є—П – —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П, –њ—А–Є—Б—Г—Й–Є–µ –ґ–µ–љ—Б–Ї–Њ–Љ—Г –Њ—А–≥–∞–љ–Є–Ј–Љ—Г, –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –≤ 100% —Б–ї—Г—З–∞–µ–≤ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–Њ–Љ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –ґ–µ–љ—Й–Є–љ—Л –Є –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–є –∞–љ–µ–Љ–Є–Є. –Я–Њ—Б–ї–µ–і–љ–µ–µ –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ, —В–∞–Ї –Ї–∞–Ї –і–Є–∞–≥–љ–Њ–Ј –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–є –∞–љ–µ–Љ–Є–Є –і–Њ–ї–ґ–µ–љ –Њ—Б–љ–Њ–≤—Л–≤–∞—В—М—Б—П –љ–∞ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –∞–љ–∞–ї–Є–Ј–∞—Е –Ї—А–Њ–≤–Є. –Я–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–∞—П –Ї—А–Њ–≤—М —А–µ–∞–≥–Є—А—Г–µ—В –љ–∞ –Є—Б—В–Њ—Й–µ–љ–Є–µ –і–µ–њ–Њ –ґ–µ–ї–µ–Ј–∞ –≤ –њ–Њ—Б–ї–µ–і–љ—О—О –Њ—З–µ—А–µ–і—М, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –њ–µ—А–µ—А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ј–∞–њ–∞—Б–Њ–≤ –ґ–µ–ї–µ–Ј–∞ –Љ–µ–ґ–і—Г –Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–Љ –Љ–∞—В–µ—А–Є –Є –њ–ї–Њ–і–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–Љ –њ–Њ—А—П–і–Ї–µ (—В–∞–±–ї. 2).
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –±–ї–∞–≥–Њ–і–∞—А—П –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ, —Г–ї—Г—З—И–∞—О—Й–Є–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–љ–∞–±–ґ–µ–љ–Є—П –Ї–Є—Б–ї–Њ—А–Њ–і–Њ–Љ, —Б–Є–Љ–њ—В–Њ–Љ—Л, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–µ —В–Ї–∞–љ–µ–≤–Њ–є –≥–Є–њ–Њ–Ї—Б–Є–µ–є, –Љ–Њ–≥—Г—В –љ–µ –њ—А–Њ—П–≤–ї—П—В—М—Б—П –≤–њ–ї–Њ—В—М –і–Њ –њ–∞–і–µ–љ–Є—П —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –љ–Є–ґ–µ 80 –≥/–ї (–і–≤—Г–Љ—П –∞–і–∞–њ—В–∞—Ж–Є–Њ–љ–љ—Л–Љ–Є –≤–∞–ґ–љ–µ–є—И–Є–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є —П–≤–ї—П—О—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ–≥–Њ –≤—Л–±—А–Њ—Б–∞ –Є —Г—Б–Є–ї–µ–љ–љ–Њ–µ –Њ—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –≤ —В–Ї–∞–љ—П—Е, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–µ–µ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ —Н—А–Є—В—А–Њ—Ж–Є—В–∞—Е 2–3––і–Є—Д–Њ—Б—Д–Њ–≥–ї–Є—Ж–µ—А–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л – 2–3––Ф–§–У).
–†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В –≤—Л—Б–Њ–Ї—Г—О —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ —Б—А–µ–і–Є –љ–∞—Б–µ–ї–µ–љ–Є—П – –і–Њ 200 –Љ–ї–љ —З–µ–ї–Њ–≤–µ–Ї –≤ –Љ–Є—А–µ. –І–∞—Б—В–Њ—В–∞ –Ц–Ф–Р –і–Њ—Б—В–Є–≥–∞–µ—В 98% —Б—А–µ–і–Є –≤—Б–µ—Е –∞–љ–µ–Љ–Є–є. –У—А—Г–њ–њ–∞–Љ–Є —А–Є—Б–Ї–∞ —П–≤–ї—П—О—В—Б—П –Є—Б—Е–Њ–і—П –Є–Ј –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –Њ–±–Љ–µ–љ–∞, –ґ–µ–љ—Й–Є–љ—Л –і–µ—В–Њ—А–Њ–і–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –±–µ—А–µ–Љ–µ–љ–љ—Л–µ, –Ї–Њ—А–Љ—П—Й–Є–µ, –і–µ—В–Є –Љ–ї–∞–і—И–Є—Е –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –≥—А—Г–њ–њ. –°–Ї—А—Л—В—Л–є –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –і–Њ—Б—В–Є–≥–∞–µ—В, –њ–Њ –і–∞–љ–љ—Л–Љ –Т–Ю–Ч, 100%, –∞–љ–µ–Љ–Є—П – –Њ—В 21 –і–Њ 80%. –Э–µ—Е–≤–∞—В–Ї–∞ –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ–є –ґ–µ–љ—Й–Є–љ—Л —З—А–µ–≤–∞—В–∞ —А–∞–Ј–≤–Є—В–Є–µ–Љ –≥–Є–њ–Њ–Ї—Б–Є–Є —Б –і–∞–ї—М–љ–µ–є—И–µ–є —Ж–µ–њ–Њ—З–Ї–Њ–є –≤—В–Њ—А–Є—З–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Д–µ—В–Њ–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О.
–Т I —В—А–Є–Љ–µ—Б—В—А–µ –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –ґ–µ–ї–µ–Ј–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 0,6–0,8 –Љ–≥/—Б—Г—В., –љ–µ –Њ—В–ї–Є—З–∞—П—Б—М –Њ—В —В–∞–Ї–Њ–≤–Њ–≥–Њ –і–Њ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –≤–Њ II —В—А–Є–Љ–µ—Б—В—А–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –і–Њ 2–4 –Љ–≥/—Б—Г—В., –≤ III – –і–Њ 12 –Љ–≥/—Б—Г—В. –Ч–∞ –≤–µ—Б—М –≥–µ—Б—В–∞—Ж–Є–Њ–љ–љ—Л–є –њ–µ—А–Є–Њ–і –љ–∞ –Ї—А–Њ–≤–µ—В–≤–Њ—А–µ–љ–Є–µ —А–∞—Б—Е–Њ–і—Г–µ—В—Б—П 500 –Љ–≥ –ґ–µ–ї–µ–Ј–∞, –љ–∞ –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –њ–ї–Њ–і–∞ – 280–290 –Љ–≥, –њ–ї–∞—Ж–µ–љ—В—Л – –Њ—В 25 –і–Њ 100 –Љ–≥. –Ъ –Ї–Њ–љ—Ж—Г –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –≤ —Д–µ—В–Њ–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–Љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ —Б–Њ—Б—А–µ–і–Њ—В–∞—З–Є–≤–∞–µ—В—Б—П –Њ–Ї–Њ–ї–Њ 450 –Љ–≥ –ґ–µ–ї–µ–Ј–∞, –≤ —Г–≤–µ–ї–Є—З–µ–љ–љ–Њ–Љ –Њ–±—К–µ–Љ–µ –Ї—А–Њ–≤–Є – –і–Њ 500 –Љ–≥. –Я—А–Є —А–Њ–і–∞—Е —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ–Њ—В–µ—А—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В 150 –Љ–≥, –ї–∞–Ї—В–∞—Ж–Є—П –Ј–∞–±–Є—А–∞–µ—В –і–Њ 400 –Љ. –°—Г–Љ–Љ–∞—А–љ–∞—П –≤–µ–ї–Є—З–Є–љ–∞ –њ–Њ—В–µ—А–Є –ґ–µ–ї–µ–Ј–∞ –Ї –Њ–Ї–Њ–љ—З–∞–љ–Є—О –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1200–1400 –Љ–≥.
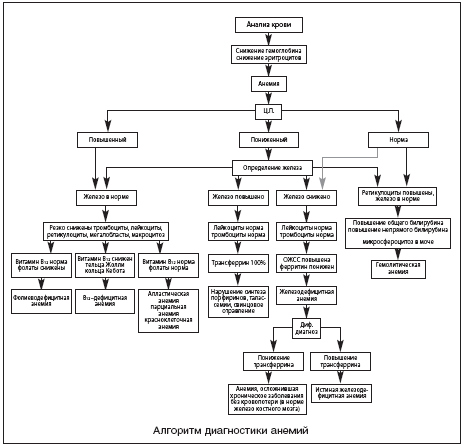
–Я–Њ —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –∞–љ–µ–Љ–Є–Є —А–∞–Ј–і–µ–ї—П—О—В:
–Ы–µ–≥–Ї–∞—П —Б—В–µ–њ–µ–љ—М 110–91 –≥/–ї
–°—А–µ–і–љ–µ—В—П–ґ–µ–ї–∞—П —Б—В–µ–њ–µ–љ—М 90–81 –≥/–ї
–Ґ—П–ґ–µ–ї–∞—П —Б—В–µ–њ–µ–љ—М –Љ–µ–љ–µ–µ 80 –≥/–ї
–£ –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –њ–Њ–љ–Є–ґ–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –і–Њ 110–100 –≥/–ї –љ–µ –≥–Њ–≤–Њ—А–Є—В –Њ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П—Е –Є –Њ–±—К—П—Б–љ—П–µ—В—Б—П —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Њ–±—К–µ–Љ–∞ –Ї—А–Њ–≤–Є, –≥–µ–Љ–Њ–і–µ–ї—О—Ж–Є–µ–є. –Р–љ–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—А–Њ–≥–Њ–Љ —П–≤–ї—П–µ—В—Б—П 100–96 –≥/–ї (—Н—А–Є—В—А–Њ—Ж–Є—В—Л – 3,0 –Љ–ї–љ), —В—П–ґ–µ–ї–∞—П —Д–Њ—А–Љ–∞ –∞–љ–µ–Љ–Є–Є –Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П —Б 60 –≥/–ї.
–Ы–µ—З–µ–љ–Є–µ
–Ы–µ—З–µ–љ–Є–µ –Ц–Ф–Р –њ—А–Њ–≤–Њ–і–Є—В—Б—П —В–Њ–ї—М–Ї–Њ –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –ґ–µ–ї–µ–Ј–∞, –Є–Љ–µ—О—Й–Є–Љ–Є –±–Њ–ї—М—И—Г—О –≤—Б–∞—Б—Л–≤–∞–µ–Љ–Њ—Б—В—М –≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–Љ —В—А–∞–Ї—В–µ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–Є—Й–µ–≤—Л–Љ –ґ–µ–ї–µ–Ј–Њ–Љ.
–Я—А–µ–њ–∞—А–∞—В—Л, –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–µ –≤ —В–µ—А–∞–њ–Є–Є, –і–Њ–ї–ґ–љ—Л –њ–Њ–Љ–Є–Љ–Њ 2––≤–∞–ї–µ–љ—В–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ —Б–Њ–і–µ—А–ґ–∞—В—М –∞—Б–Ї–Њ—А–±–Є–љ–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й—Г—О –µ–≥–Њ —Г—Б–≤–Њ–µ–љ–Є—О. –Р–і–µ–Ї–≤–∞—В–љ—Л–є –≥–µ–Љ–Њ–њ–Њ—Н–Ј –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–µ–љ –±–µ–Ј —Г—З–∞—Б—В–Є—П —Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –≤–Є—В–∞–Љ–Є–љ–∞ –Т12. –Ю–±–∞ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ —Г—Б–Є–ї–Є–≤–∞—О—В —Б–Є–љ—В–µ–Ј –Ф–Э–Ъ –≤ –Ї—А–Њ–≤–µ—В–≤–Њ—А–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е, –∞ —В–∞–Ї–ґ–µ —А–µ–≥—Г–ї–Є—А—Г—О—В –≤–µ—Б—М —Ж–Є–Ї–ї –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –∞–љ–µ–Љ–Є–Є –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ —В—А–µ–±—Г–µ—В—Б—П –±–µ—А–µ–Љ–µ–љ–љ—Л–Љ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Љ–∞–ї–Њ–Ї—А–Њ–≤–Є—П. –Ъ –љ–Є–Љ –Љ–Њ–≥—Г—В –±—Л—В—М –Њ—В–љ–µ—Б–µ–љ—Л:
– –ґ–µ–љ—Й–Є–љ—Л, –њ—А–µ–ґ–і–µ –±–Њ–ї–µ–≤—И–Є–µ –∞–љ–µ–Љ–Є–µ–є;
– –ґ–µ–љ—Й–Є–љ—Л, –Є–Љ–µ—О—Й–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є –Є–ї–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤;
– –Љ–љ–Њ–≥–Њ —А–Њ–ґ–∞–≤—И–Є–µ –ґ–µ–љ—Й–Є–љ—Л;
– –±–µ—А–µ–Љ–µ–љ–љ—Л–µ —Б —Г—А–Њ–≤–љ–µ–Љ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤ I —В—А–Є–Љ–µ—Б—В—А–µ –Љ–µ–љ—М—И–µ 120 –≥/–ї;
– –±–µ—А–µ–Љ–µ–љ–љ—Л–µ —Б –Љ–љ–Њ–≥–Њ–њ–ї–Њ–і–Є–µ–Љ;
– –±–µ—А–µ–Љ–µ–љ–љ—Л–µ —Б —П–≤–ї–µ–љ–Є—П–Љ–Є —В–Њ–Ї—Б–Є–Ї–Њ–Ј–∞;
– –ґ–µ–љ—Й–Є–љ—Л, —Г –Ї–Њ—В–Њ—А—Л—Е –≤ —В–µ—З–µ–љ–Є–µ –Љ–љ–Њ–≥–Є—Е –ї–µ—В –Љ–µ–љ—Б—В—А—Г–∞—Ж–Є–Є –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є—Б—М –±–Њ–ї–µ–µ 5 –і–љ–µ–є.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є–є –њ—А–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ –і–Њ–Ј–µ 1–2 –Ї–∞–њ—Б—Г–ї—Л –≤ –і–µ–љ—М –≤ —В–µ—З–µ–љ–Є–µ 4–6 –Љ–µ—Б., –љ–∞—З–Є–љ–∞—П —Б 12–14––є –љ–µ–і–µ–ї–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –С–∞—А–Ї–∞–≥–∞–љ –Ч.–°., –Ш–і–µ–ї—М—Б–Њ–љ –Ы.–Ш., –Т–Њ—А–Њ–±—К–µ–≤.–Р.–Ш. –†—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ –њ–Њ –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є–Є. –Ь.: –Ь–µ–і–Є—Ж–Є–љ–∞, 1985.
2. –С–µ—А—З–∞–љ—Г –®—В. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—П. –С—Г—Е–∞—А–µ—Б—В. 1985 –≥.
3. –С—Г–і–∞–љ–Њ–≤ –Я.–Т. –Я—А–Њ–±–ї–µ–Љ—Л –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л—Е –∞–љ–µ–Љ–Є–є —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е. –Ц—Г—А–љ–∞–ї «–Ґ—А—Г–і–љ—Л–є –њ–∞—Ж–Є–µ–љ—В». вДЦ8. 2009.
4. –Т–µ—А—В–Ї–Є–љ –Р.–Ы., –У–Њ—А–Њ–і–µ—Ж–Ї–Є–є –Т.–Т., –У–Њ–і—Г–ї—П–љ –Ю.–Т. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–љ—Л—Е –ґ–µ–ї–µ–Ј–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–є –∞–љ–µ–Љ–Є–µ–є. Med links.2006 –≥.
5. –У–Њ—А–Њ—Е–Њ–≤—Б–Ї–∞—П –У.–Э. –Ь–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є –≤–µ—Б—В–љ–Є–Ї. вДЦ 22,2008 –≥.
6. –У—Г—А–≤–Є—З –Ь.–Ш., –©–µ—А–±–∞ –Ь.–Ь., –†—Л—Б—Б –Х.–°., –®–∞–њ–Є—А–Њ –≠.–Ы. –Т—Б–∞—Б—Л–≤–∞–љ–Є–µ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–Њ–≤–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –њ—А–Є –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–є –∞–љ–µ–Љ–Є–Є. –Я—А–Њ–±–ї–µ–Љ—Л –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є–Є. 1973, 33
7. –Ь.–Ф–ґ. –Ф–µ–љ—Е—Н–Љ, –Ш.–І–∞–љ–∞—А–Є–љ. –С–Њ–ї–µ–Ј–љ–Є –Ї—А–Њ–≤–Є —Г –њ–Њ–ґ–Є–ї—Л—Е. –Ь.:–Ь–µ–і–Є—Ж–Є–љ–∞, 1989.
8. –Ш–і–µ–ї—М—Б–Њ–љ –Ы.–Ш. –У–Є–њ–Њ—Е—А–Њ–Љ–љ—Л–µ –∞–љ–µ–Љ–Є–Є. –Ь.,1981.
9. –Ъ–Њ–Ї–Њ–ї–Є–љ–∞. –Т.–§. –§–µ—А—А–Њ––§–Њ–ї—М–≥–∞–Љ–Љ–∞ –≤ –ї–µ—З–µ–љ–Є–Є –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–є –∞–љ–µ–Љ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —Б —О–≤–µ–љ–Є–ї—М–љ—Л–Љ–Є –Љ–∞—В–Њ—З–љ—Л–Љ–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П–Љ–Є. –Ь. Gastro portal.
10. –Ь–∞–і—М—П—А –Ш. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤. –С—Г–і–∞–њ–µ—И—В. 1987 –≥.












