Введение
В 2004 г. в лаборатории А. Циклински [1] был описан новый иммунологический процесс, при котором активированные нейтрофилы выбрасывают нити ДНК, обрамленные катионными белками и пептидами. Эти структуры обладают способностью фиксировать микроорганизмы, попавшие во внутреннюю среду макроорганизма, из-за чего они получили название нейтрофильных внеклеточных ловушек (НВЛ). В настоящее время эти ловушки наряду с дегрануляцией и фагоцитозом рассматриваются как третий защитный антиинфекционный механизм нейтрофилов — клеток врожденного иммунитета [1–3]. В силу содержания в составе НВЛ таких мощных антимикробных белков, как миелопероксидаза (МПО) и эластаза, α-дефензинов и пептида LL-37, продукта расщепления гранулярного белка каталецидина, НВЛ обладают способностью не только фиксировать/захватывать, но и нейтрализовать и приводить к гибели бактерии [4], грибы [5, 6] и оболочечные вирусы [7, 8], особенно на ранних этапах развития инфекции. Однако многие возбудители инфекций, такие как пневмококк, гемофильная палочка, β-гемолитические стрептококки группы А, золотистый стафилококк, стрептококки группы В, клебсиелла и др., в процессе эволюции научились ускользать от НВЛ, делая данный тип защиты бесполезным [9].К тому же показано, что вместе с положительным НВЛ оказывают и серьезное отрицательное действие, связанное с их белковым составом: они включают 70% положительно заряженных гистонов и 20–30% катионных белков типа α-дефензинов и пептида LL-37. Попав во внеклеточное пространство, они оказывают токсическое действие на ткани организма [10–13]. Это действие особенно ярко проявляется при избыточной миграции нейтрофилов в воспалительный очаг, например в легочную ткань, когда паутина из нитей ДНК пронизывает эту ткань и, более того, выявляется в плазме [13]. При гриппозной инфекции тяжесть заболевания коррелирует с уровнем НВЛ, состоящих преимущественно из МПО-ДНК, и более высокий уровень таких ловушек соответствует более тяжелому поражению легочной ткани [14]. Надо отметить, что, помимо прямого повреждающего действия на легочную ткань, НВЛ оказывают отрицательное влияние, образуясь в кровотоке, где они вызывают механическое нарушение кровообращения (в первую очередь в мелких сосудах органов и тканей) с формированием тромбов из сгустков слизи, состоящих из ДНК, муцина, продуктов распада клеток [15].
Развитие инфекционного процесса практически всегда сопровождается образованием НВЛ. Большинство наблюдений свидетельствуют, что баланс между положительной защитной и отрицательной цитотоксический ролью НВЛ смещается в сторону последней. Это делает НВЛ мишенью для разработки новых подходов в лечении и профилактике инфекционно-воспалительных процессов респираторного тракта [16]. Идеальным является такой вариант, при котором нивелируются патогенные, но сохраняются защитные, положительные свойства нейтрофилов. Таким требованиям удовлетворяет азоксимера бромид, выпускающийся под торговым названием Полиоксидоний и являющийся сополимером N-окси-1,4-этиленпиперазина и (N-карбокси)-1,4-этиленпиперазиния бромида. Полиоксидоний проявляет эффективность при инфекционно-воспалительных заболеваниях вирусной, бактериальной и грибковой этиологии. Характерной особенностью этого препарата является его способность нейтрализовать внеклеточные кислородные радикалы, всегда образующиеся одновременно с НВЛ, и усиливать внутриклеточные. В результате этого усиливаются бактерицидные свойства лейкоцитов, их фагоцитарная активность и, соответственно, повышается антиинфекционный иммунитет, что подтверждается клинической практикой [17]. Цель настоящего исследования — изучение способности Полиоксидония в опытах in vitro оказывать влияние на образование внеклеточных ловушек нейтрофилами, стимулированными форбол-миристат-ацетатом (ФМА) — классическим активатором нейтрофилов.
Материал и методы
Выделение первичных нейтрофилов человека. Периферическую кровь здоровых доноров в возрасте от 20 до 40 лет забирали в утренние часы натощак в полипропиленовые пробирки с гепарином (20 МЕ×мл-1 крови). Нейтрофилы выделяли с помощью центрифугирования в одноступенчатом градиенте плотности Ficoll-Hypaque (плотность 1,077 г/см3), как было описано ранее [18, 19]. Полученные клетки были представлены более чем на 98% гранулоцитами, а их жизнеспособность составляла 99%, что определяли тестом с 0,1% раствором трипанового синего. Нейтрофилы ресуспендировали в полной культуральной среде, включающей RPMI 1640 с добавлением 10 мМ HEPES, 2 мМL-глутамина 1% инактивированной эмбриональной телячьей сыворотки (все компоненты предоставлены Sigma-Aldrich), и культивировали при 37 оС в атмосфере 5% CO2.Азоксимера бромид. Для экспериментов использовали препарат Полиоксидоний лиофилизат для инъекций (ООО «НПО Петровакс Фарм») во флаконах из темного стекла с дозировкой 3 мг. В качестве растворителя использовался DPBS (Gibco) с pH 7,0–7,3. Для изучения дозозависимого эффекта Полиоксидоний в дозах 10, 100, 500 или 1000 мкг/мл добавляли к нейтрофилам за 1 ч до внесения в лунки планшета ФМА. В основных экспериментах использовали дозу Полиоксидония 100 мкг/мл.
Индукция и иммунофлуоресцентное окрашивание НВЛ. Для обнаружения НВЛ использовали флуоресцентную микроскопию. Для этого свежевыделенные нейтрофилы (2×105/мл) в полной культуральной среде адгезировали на круглых покровных стеклах, находящихся в 24-луночном планшете, в течение 30 мин при 37 оС. Нейтрофилы прединкубировали в лунках с различными концентрациями Полиоксидония или средой (контроль) в течение 1 ч при 37 оС и 5% СО2. Образование НВЛ индуцировали 30 нМ ФМА в течение 3 ч. После стимуляции НЕТоза (процесс программируемой клеточной гибели, сопровождающийся выбросом нейтрофилом НВЛ) клетки фиксировали в лунках в растворе 4% параформальдегида (Sigma) в течение 15 мин при комнатной температуре. Удаляли супернатант и осторожно промывали стекла в PBS 3 раза по 5 мин. Препараты окрашивали с помощью Syber Green (Invitrogen) в течение 7 мин в темноте. После промывания препаратов дистиллированной водой их погружали в Moviol (ProLong Gold, Molecular Probes) и анализировали с использованием флуоресцентного микроскопа «Leica DM LB» (Leica Microsystems, Германия). Фотографирование препаратов проводили с помощью камеры «Leica DC300F».
Подсчет НВЛ. Количественная оценка нетотических нейтрофилов проводилась с использованием флуоресцентной микроскопии, как было описано ранее [9]. Подсчитывали общее число клеток и число промежуточных и нетотических нейтрофилов в каждом поле зрения. Далее оценивали процент НЕТоза в нескольких полях зрения. Для каждой дозы препарата было поставлено не менее трех экспериментов с тремя разными донорами и проанализировано не менее 300 клеток.
Статистическая обработка. Статистическую обработку данных проводили с помощью программ Excel 2003 (Microsoft, США), а также с использованием одномерного дисперсионного анализа (ANOVA) и теста множественного сравнения Бонферрони для оценки различий между группами.
Результаты исследования
В ходе проведенного исследования выявлено, что Полиоксидоний обладает способностью дозозависимо ингибировать образование НВЛ in vitro в диапазоне доз 10–1000 мкг/мл. На рисунке 1 представлены данные, которые получили, подсчитывая процент нетотических клеток (к ним относили нейтрофилы, выбросившие наружу деконденсированную ДНК) (рис. 2). Полиоксидоний в различных концентрациях добавляли за час до внесения ФМА. Подсчитывали процент нетотических клеток на фотографиях, полученных с использованием флуоресцентного микроскопа. Контролем служили нейтрофилы без добавления ФМА и Полиоксидония.
Как показано на рисунке 1, процент нетотических нейтрофилов под действием 100 мкг/мл Полиоксидония уменьшался на 39%. При дозе препарата 500 мкг/мл данный показатель составил 49%, при дозе 1000 мкг/мл — 63%. Таким образом, можно сделать вывод, что Полиоксидоний обладает способностью ингибировать НЕТоз in vitro на 39–63% в зависимости от используемой дозы. При этом при применении дозы 100 мкг/мл и более препарат оказывал достоверное действие.
Более детальный анализ клеточной популяции нейтрофилов при использовании дозы Полиоксидония 100 мкг/мл позволил выявить 3 типа нейтрофилов: интактные, промежуточные и нетотические. Промежуточными клетками считали клетки, которые по внешнему виду отличались от интактных, но не выбрасывали свою ДНК и содержимое наружу. Отличительным признаком таких клеток были больший размер по сравнению с интактными нейтрофилами и нечеткие края. Нетотическими нейтрофилами считали полностью разрушенные клетки, деконденсированная ДНК которых в виде сетей (ловушек) была выброшена во внеклеточное пространство. Примеры интактных, промежуточных и нетотических клеток приведены на рисунке 2.
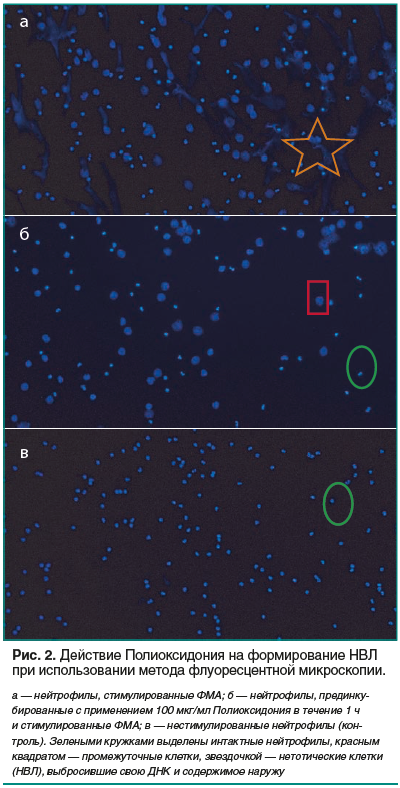
Влияние Полиоксидония в дозе 100 мкг/мл на образование НВЛ показано на рисунке 3. Полиоксидоний в дозе 100 мкг/мл добавляли в лунки с клетками за 1 ч до добавления ФМА. ФМА добавлен во все лунки. Полиоксидоний примерно в 4 раза уменьшает процент нетотических нейтрофилов, при этом основной эффект Полиоксидония реализуется за счет увеличения количества промежуточных клеток.

Таким образом, Полиоксидоний ингибирует НЕТоз на его промежуточных стадиях, когда мембрана клетки набухает, но далее процесс останавливается и выброса ДНК не происходит. На фотографиях, полученных с использованием флуоресцентного микроскопа, можно видеть, что предварительная инкубация нейтрофилов с Полиоксидонием в дозе 100 мкг/мл в течение 1 ч значительно замедляет НЕТоз (см. рис. 2).
Обсуждение
Практически при всех острых и хронических воспалительных процессах как инфекционной, так и неинфекционной природы происходит образование НВЛ, вносящих значительный негативный вклад в течение заболеваний [18, 20]. В состав НВЛ входят белки и пептиды, одинаково токсичные как для эукариотических, так и для прокариотических клеток. Важные в составе фагосом нейтрофилов и макрофагов, эти белки и пептиды, выходя за пределы клетки, оказывают повреждающее действие на клетки хозяина и существенно ухудшают течение патологического процесса [10–14].Патогенетическая роль НВЛ доказана при различных заболеваниях, в т. ч. сопряженных с нарушением функционирования слизистых оболочек, в частности при респираторных инфекциях. Так, например, доказано, что в механизме формирования экссудата (выпота) среднего уха как при остром, так и при хроническом процессе НВЛ играют ключевую роль. Формирование НВЛ приводит к повышению вязкости секрета и ассоциируется с гиперпродукцией преимущественно MUC5B-муцина, что в дальнейшем препятствует процессу элиминации слизи и очищению полости среднего уха, снижая эффективность этиотропной терапии [21].
НВЛ играют также значимую роль в развитии пневмококковой внебольничной пневмонии. Формируясь как на эпителии, так и в эндотелиальном пространстве, они вызывают повреждение альвеолярно-эндотелиального барьера с последующим развитием дыхательной недостаточности. В исследованиях показано, что уровень образования НВЛ напрямую коррелирует с тяжестью течения пневмонии [22].
В основе патогенеза вирусных инфекций, обусловленных вирусами гриппа, респираторно-синцитиальными (РС) вирусами и риновирусами, важную роль также играют НВЛ. Вирус-индуцированные НВЛ приводят к повреждению эпителия и повышают вязкость слизи. С образованием НВЛ связывают обструкцию дыхательных путей у детей при РС-бронхиолитах, сопровождающихся свистящим дыханием [16].
Риновирусные инфекции также небезобидны. Инфицирование риновирусом слизистой оболочки экспериментальных животных повышало формирование НВЛ, которые определялись в большом количестве в носоглоточном смыве и бронхоальвеолярном лаваже. При этом пик продукции НВЛ наблюдался через 2 сут после инфицирования. Тяжесть респираторных симптомов кор-
релировала с уровнем ДНК в слизистой. Снижение уровня НВЛ приводило к снижению тяжести респираторных симптомов, в т. ч. обострения астмы на фоне аллергенов клеща домашней пыли, обусловленных ринови-русом [23].
Повреждающий эффект НВЛ выявлен при развитии инфекционно-воспалительных процессов практически всех органов и тканей, особенно при поражении респираторного тракта, когда наблюдается длительное и повышенное образование НВЛ [10, 11]. На сегодняшний день терапевтические подходы к коррекции формирования НВЛ крайне ограничены, поэтому актуальной задачей клинической медицины является разработка методов, снижающих формирование и токсический эффект НВЛ, образующихся при развитии воспалительного процесса. Такие методы должны входить в комплекс лечебных и профилактических мероприятий.
Данная работа открывает новые перспективные возможности коррекции НВЛ при инфекционно-воспалительной патологии с помощью Полиоксидония. Важно отметить, что Полиоксидоний, обладающий противовоспалительным, иммуномодулирующим и детоксицирующим действием, уже более 20 лет используется в рутинной клинической практике и демонстрирует хороший клинический эффект при лечении острых и хронических инфекционно-воспалительных процессов, в т. ч. респираторного тракта, и высокий профиль безопасности [24]. Это позволяет применять его у детей с 6 мес. и у пациентов с аллергическими заболеваниями, а также в комплексной терапии с антибактериальными, противовирусными, противогрибковыми и антигистаминными препаратами, глюкокортикостероидами и цитостатиками.
Проведенные исследования выявили принципиально новые лечебные свойства Полиоксидония, а именно его способность подавлять образование активированными нейтрофилами внеклеточных ловушек наряду с его противовоспалительными, иммуномодулирующими и детоксицирующими свойствами. Эти эффекты наблюдаются параллельно со снижением образования нейтрофилами внеклеточных активных форм кислорода (АФК, выявляемых с помощью люминол- и люцигенин-зависимой хемилюминесценции) и повышением образования внутриклеточных АФК, а именно супероксидного аниона и перекиси водорода (выявляемых с помощью дихлорфлуоресцеин диацетата), что было показано методом проточной цитометрии [17, 25]. Общеизвестно, что внеклеточные и внутриклеточные АФК играют различную роль в жизни клетки. Если внеклеточные АФК, в т. ч. в составе НВЛ, оказывают преимущественно токсический эффект на окружающие ткани, то внутриклеточные АФК стимулируют клеточный метаболизм. От них зависит усиление фагоцитоза, бактерицидности, синтеза цитокинов [17, 25]. Таким образом, к комплексу известных положительных эффектов Полиоксидония добавляется и такое важное свойство, как способность снижать образование НВЛ и, следовательно, их цитотоксический эффект, что, без сомнения, вносит существенный вклад в лечебный эффект препарата и открывает новые возможности для коррекции формирования НВЛ и патогенетической терапии большого числа заболеваний.
Конфликт интересов: автор статьи Ю.А. Дагиль является сотрудником компании ООО «НПО Петровакс Фарм».








.gif)



