Клинические проявления ОКС отмечаются большим разнообразием, а эффективность лечения во многом определяется сроками его начала. Этим обусловлена чрезвычайная важность ранней диагностики, госпитализации и начала лечения. Лечение ОКСбпST прежде всего преследует цель предотвращения развития внезапной коронарной смерти и Q–инфаркта миокарда [9,13,17].
Вопросы классификации, диагностики и патогенетического механизма ОКС и нестабильной стенокардии описаны в работах E. Braunwald [6–9,19]. Нестабильная стенокардия имеет 3 клинических варианта: 1) приступ стенокардии, возникший в покое и обычно продолжающийся > 20 минут; 2) стенокардия малых физических нагрузок, возникшая в течение последних 2–х месяцев; 3) ранее диагностированная стенокардия с участившимися более длительными и тяжелыми приступами.
Наиболее частым патогенетическим механизмом ОКС является тромбоз пораженной атеросклерозом коронарной артерии. Тромб образуется в месте разрыва или повреждения поверхности атеросклеротической бляшки. Вероятность разрыва бляшки зависит от ее расположения, размера, консистенции и состава липидного ядра, прочности фиброзной капсулы, а также выраженности местной воспалительной реакции и напряжения стенки сосуда. В случаях, когда нарушение проходимости коронарной артерии является неполным и обратимым, развивается клиническая картина нестабильной стенокардии или ОИМ без зубца Q. Полная окклюзия коронарной артерии приводит к развитию ОИМ с зубцом Q [13,26]. Это определяет необходимость разделения ОКС на ОКС с подъемом ST и ОКСбп ST и дифференциацию подходов к лечению [2,3,8].
Другими патогенетическими механизмами развития ОКС, встречающимися значительно реже, являются: 1. Динамическая обструкция коронарной артерии вследствие локального спазма (стенокардия Принцметала). Другой причиной обструкции может стать диффузная микроваскулярная дисфункция, например, эндотелиальная дисфункция или патологическая констрикция мелких интрамуральных резистивных сосудов. 2. Критическое сужение коронарной артерии вследствие прогрессирующего атеросклероза без явлений коронароспазма и острого тромбоза. 3. Надрыв эндотелия коронарной артерии. 4. Вторичное нарушение коронарного кровотока вследствие увеличения потребности в кислороде (например, при лихорадке, тахикардии, тиреотоксикозе), снижения коронарного кровотока (например, при гипотонии) и кислородотранспортной функции (например, при анемии, гипоксемии) [26].
Принципы лечения пациентов с ОКСбпST подробно изложены в рекомендациях ВНОК [2], Европейского кардиологического общества 2007 г. [5,18] и Американской ассоциации сердца [3,8]. В настоящее время назначение антикоагулянтов при лечении ОКСбпST является обязательным.
Первым из антикоагулянтных препаратов, который начал применяться при лечении ОКСбпST, стал нефракционированный гепатит (НФГ) [21]. Препарат был открыт еще в 1916 году. НФГ состоит из смеси полисахаридов с различной длиной цепей и молекулярными массами от 5000 до 30 000 Дальтон. Механизм действия препарата реализуется путем связывания с антитромбином III (АТIII) – протеолитическим ферментом, тормозящим превращение фибриногена в фибрин. Связывание НФГ с АТIII приводит к конформационным изменениям АТIII, что вызывает резкое повышение его активности (примерно в 1000 раз). Комплекс НФГ– АТIII инактивирует ряд активированных факторов свертывания: IIa (тромбина), IXa (фактора Кристмаса, тромбопластина плазмы), Xa (фактора Стюарта–Прауэра) и XIa (предшественника плазменного тромбопластина). Однако основным является ингибирование тромбина и Xa фактора. Это препятствует тромбообразованию, но не вызывает лизирования уже существующего тромба. НФГ активно связывается с белками плазмы. Это определяет различие антикоагулянтного эффекта, т.к. виды связывающих белков и их количество имеют индивидуальные различия. Кроме того, период полувыведения НФГ зависит от дозы препарата: при низких дозах этот период – меньше, при высоких – больше [23]. Проблемными моментами при применении НФГ являются: необходимость в постоянной в/в инфузии с коррекцией дозы по уровню АЧТВ [19] и опасность развития гепарин–индуцированной тромбоцитопении (36). Причем поддержание целевого уровня АЧТВ для достижения необходимого антикоагулянтного эффекта может вызывать значительные трудности [20,22]. Кроме того, при отмене НФГ возможно рецидивирование ОКС за счет развития синдрома рикошета (rebound syndrome). Сочетанное применение НФГ и ацетилсалициловой кислоты (АСК) позволяют уменьшить вероятность рецидива острой коронарной патологии после отмены НФГ [37].
Клиническая эффективность и безопасность НФГ оценивалась в 6 относительно небольших рандомизированных плацебо–контролируемых исследованиях [10,23,29,33,35,37]. В вышеуказанных исследованиях проводили сравнение комбинации НФГ и АСК с одной АСК. При использовании НФГ снижение летальности и частоты развития острого инфаркта миокарда составило 54%, а в исследованиях с использование НФГ и НМГ 63%. Опубликованы 2 мета–анализа проведенных исследований. Первый мета–анализ, включивший в себя результаты трех исследований, показал снижение общей летальности и частоты развития инфаркта миокарда при использовании комбинации НФГ + АСК на 54% (р=0,03) в первые 2 недели лечения [11]. По результатам второго мета–анализа, включающего данные 6 исследований, получено снижение частоты летальных исходов и инфарктов миокарда в течение 12 недель на 33% (р=0,06) [30].
Синтетический пентасахарид фондапаринукс является селективным ингибитором Xa фактора. Преимущества фондапаринукса выражаются в меньшем влиянии на плазменные протеины и эндотелиальные клетки, дозонезависимом клиренсе и длительном периоде полувыведения. Это позволяет вводить препарат всего 1 раз в сутки в фиксированной дозе, независимо от веса пациента [17,32]. При использовании фондопаринукса не требуется специального лабораторного контроля. Фондопаринукс не влияет на активность тромбина. Молекулы ингибиторов Xa фактора не содержат участка, реагирующего на протамин сульфат. В связи с этим использование протамина сульфата в качестве антидота неэффективно. В случае развития кровотечения на фоне применения фондапаринукса необходимо использование свежезамороженной плазмы [38].
В настоящее время проведено 5 международных клинических исследований фондапаринукса у больных с острым коронарным синдромом (PENTUA [32], PENYALYSE [12], пилотное исследование ASPIRE [28], OASIS–5 [39], OASIS–6 [40]. Основными, наиболее масштабными исследованиями, давшими оценку клинической эффективности и безопасности фондапаринукса, были исследования OASIS 5 и OASIS 6, где препарат сравнивался с эноксапарином. В исследование OASIS 5 были включены пациенты с ОКСбпST. Пациенты были разделены на группы фондапаринукса и эноксапарина. Особенностью дизайна исследования являлась замена эноксапарина на НФГ тем пациентам, которым планировалось проведение коронарной ангиопластики. По влиянию на первичные конечные точки (смерть, инфаркт миокарда, рефрактерная ишемия) в течение первых 9 дней эффективность обоих лекарств оказалась одинаковой, но применение фондапаринукса сопровождалось меньшим числом серьезных кровотечений. В первые 30 дней общая летальность в группе больных, получавших фондапаринукс, оказалось достоверно меньшей, чем в группе эноксапарина (соответственно 295 и 352, р=0,02). В группе фондапаринукса на 180–й день наблюдения оказались меньше общая летальность, суммарная конечная точка общей летальности и инфарктов миокарда и суммарная конечная точка общей летальности, инфарктов миокарда и инсультов. Исследователи связывают полученный результат с большим количеством кровотечений в группе эноксапарина, а также с заменой эноксапарина на НФГ у пациентов, которым проводилась коронарная ангиопластика. Единственной клинической проблемой при применении фондапаринукса оказалось достоверное увеличение частоты тромбозов катетеров при проведении ангиопластики. Однако необходимо отметить, что количество тромбозов катетеров было минимальным (8 на 3104 пациента в группе эноксапарина, 29 на 3135 пациентов в группе фондапаринукса). В исследование OASIS 6 были включены пациенты с инфарктом миокарда с подъемом сегмента ST. Результаты исследования позволили включить фондапаринукс и в рекомендации по лечению ОКС с подъемом сегмента ST.
Стратегия антикоагулянтной терапии при ОКСбпST продолжает интенсивно изучаться. В частности, это связано с появлением новых антикоагулянтных препаратов. Задача выбора оптимального антикоагулянта при лечении ОКС продолжает оставаться актуальной [14]. При выборе препарата необходимо учитывать финансовые возможности лечебных учреждений, что требует реальной оценки затрат при переходе на препарат, имеющий формально более высокую закупочную цену. Более высокая стоимость новых антикоагулянтных препаратов по сравнению со стоимостью НФГ требует фармакоэкономической оценки целесообразности их широкого применения в клинической практике. В литературе имеются данные исследований по фармакоэкономической оценке методов диагностики и выбора тактики лечения [25], эффективности дезагрегантов [16,31], фармакоэкономическое сравнение эффективности НФГ и НМГ [27] при лечении ОКС. Сравнения эффективности, безопасности, фармакоэкономических аспектов применения фондапаринукса и НФГ при лечении ОКС ранее не проводилось. Методика проведения фармакоэкономического анализа подробно изложена в отечественной литературе [1].
Важнейшей проблемой всех развитых стран является увеличение расходов на здравоохранение. Фармакоэкономические исследования позволяют оценить затраты и результаты методов лечения, изучить экономические преимущества клинического применения лекарственных препаратов, в том числе с близкой эффективностью. Затраты на лечение имеют отличия в разных странах, поэтому получаемые результаты невозможно механически экстраполировать на конкретные национальные условия. Для объективизации получаемых фармакоэкономических данных необходимо проведение фармакоэкономических исследований в российских условиях.
Целью настоящего исследования являлось клиническое и фармакоэкономическое сравнение НФГ и селективного ингибитора Xa фактора фондапаринукса при лечении ОКСбпST.
Материалы и методы
Открытое проспективное, рандомизированное клиническое исследование проведено в клиническом госпитале медико–санитарной части Главного управления внутренних дел по г. Москве. Стационар не имеет ангиографического и кардиохирургического отделений.
Исследование состояло из двух основных этапов:
1. Анализ клинической эффективности и безопасности лечения антикоагулянтами.
2. Анализ затрат и соотношения затраты/эффективность.
В исследование было включено 100 пациентов, которым при поступлении в госпиталь выставлялся диагноз ОКСбпST. Критериями диагноза являлись: 1) клиническая картина, 2) наличие ИБС в анамнезе или высокий риск развития ИБС (сочетание гиперхолестеринемии, курения и артериальной гипертонии), 3) ишемические изменения на ЭКГ, 4) положительный тропониновый тест и/или повышение уровня МБ КФК. При наличии двух факторов диагноз считался вероятным, при наличии трех факторов – достоверным. В дальнейшем, если при дообследовании в стационаре острая коронарная патология отвергалась, пациент исключался из дальнейшего анализа результатов.
Критериями исключения из исследования являлись ОКСспST и наличие противопоказаний для назначения антикоагулянтов – состояний и заболеваний с высоким риском развития кровотечений: геморрагический инсульт в анамнезе, недавние желудочно–кишечное кровотечение, травма, хирургическая операция, неконтролируемая высокая артериальная гипертензия, тромбоцитопения менее 100 тыс., тяжелая печеночная и почечная недостаточность, нарушение коагуляции, прием варфарина. Окончательное решение о проведении антикоагулянтной терапии принимал врач отделения интенсивной терапии исходя из клинической ситуации.
В зависимости от назначенных антикоагулянтов пациенты были разделены на 2 группы:
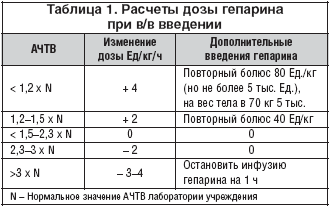
1. Гепарин (50 чел.): в/в в начальной нагрузочной дозе 80 МЕ/кг в/в болюсно (но не более 5 тыс. МЕ), с последующей постоянной в/в инфузией 18 МЕ/кг/час (но не более 1300 МЕ/час), под контролем АЧТВ. В дальнейшем расчет дозы гепарина осуществлялся по номограмме в зависимости от веса больного (табл. 1). При недостижении целевых значений АЧТВ НФГ заменяли на эноксапарин.
2. Фондапаринукс (50 чел.) в стандартной дозе 2,5 мг 1 раз в сутки (1–е сутки в/в, затем п/к).
Средняя продолжительность антикоагулянтной терапии составила для гепарина 3,2±1,1 суток, для фондапаринукса 5,0±1,2 суток.
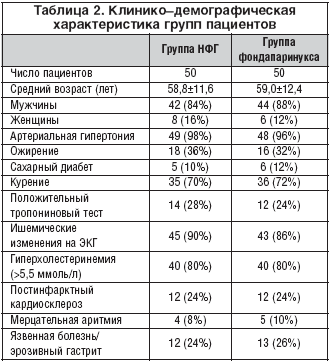
Статистически значимых различий в клинико–демографических характеристиках групп установлено не было. Подробная клинико–демографическая характеристика пациентов представлена в таблице 2.
За единицу эффективности лечения был взят процент достижения клинически значимого улучшения, который оценивался по сумме клинико–ЭКГ–лабораторных показателей: прекращение приступов стенокардии, положительная динамика ишемических изменений на ЭКГ, нормализация уровня маркеров некроза миокарда (МБ КФК, тропонин), а после перевода в палатное отделение удовлетворительная переносимость активизации. Неэффективной терапией считали случаи развития летальных исходов, инфарктов миокарда, больших геморрагий и экстренных коронарных ангиопластик. Для каждого антикоагулянта рассчитывали затраты и соотношение затраты/эффективность.
Безопасность терапии антикоагулянтами оценивали по наличию геморрагических осложнений на протяжении всего времени стационарного лечения, а также по уровню гемоглобина и количеству эритроцитов и тромбоцитов в клиническом анализе крови. Переносимость препаратов оценивалась на основании жалоб пациентов и данных физикального обследования.
Анализ затрат включал в себя расходы на пребывание пациентов в стационаре (в отделении интенсивной терапии и палатном отделении), стоимость лабораторных и инструментальных методов обследования, затраты на медикаментозное лечение. Отдельно учитывались затраты на проведение антикоагулянтной терапии и лечение осложнений. Все расчеты проводились в соответствии с тарифами «Московской страховой компании», осуществляющей контроль расходов на лечение пациентов в рамках добровольного медицинского страхования, и оптовыми ценами на препараты, поставляемые в госпиталь компаниями «Протек» и «Морон», на 1 января 2009 года.
В ходе анализа соотношения затраты/эффективность проводили сопоставление полученных на предыдущих этапах исследования данных. Для каждого антикоагулянта рассчитывали затраты и соотношение затраты/эффективность (CER) по формуле:
CER = C / Eff ,
где: C – затраты, Eff – эффективность.
Оптимальным антикоагулянтом с позиции анализа соотношения затраты/эффективность считали лекарственный препарат, имеющий наименьшее CER.
Кроме антикоагулянтов, в течение всего времени стационарного лечения все пациенты получали стандартную терапию ОКСбпST: b–блокаторы, дезагреганты (АСК + клопидогрел), в/в инфузию нитроглицерина при наличии ангинозных приступов или сохраняющейся ишемии по данным ЭКГ. Всем пациентам в первые сутки госпитализации назначались статины. При наличии артериальной гипертензии дополнительно назначались иАПФ.
Результаты
В результате первого этапа исследования установлено, что на фоне проводимого лечения у большинства пациентов были достигнуты клиническая стабилизация заболевания и целевые уровни артериального давления. Средняя продолжительность антикоагулянтной терапии составила для гепарина 3,2±1,1 суток, для фондапаринукса 5,0±1,2 суток.
В группе НФГ у 6 пациентов развились Q–инфаркты миокарда, что потребовало проведения у этих пациентов двух экстренных коронарных ангиопластик и двух системных тромболизисов альтеплазой. У 1 пациента после проведения ТЛТ развилось массивное желудочное кровотечение. Случай закончился летальным исходом. Кроме того, в группе гепарина в связи с неэффективностью терапии потребовалось проведение еще одной экстренной коронарной ангиопластики и было отмечено развитие еще одного желудочного кровотечения, которое потребовало консервативной терапии, включающей переливание свежезамороженной плазмы и продления сроков лечения в отделении интенсивной терапии. Таким образом, в группе НФГ консервативное лечение было неэффективно у 8 пациентов.
В группе фондапаринукса у 4 пациентов отмечено развитие инфарктов миокарда. Еще 2 пациентам потребовалось проведение экстренной коронарной ангиопластики. Геморрагических осложнений при лечении фондапаринуксом отмечено не было.
Сумма неблагоприятных исходов (ОИМ, летальные исходы, большие геморрагии и экстренные ангиопластики) составила для НФГ 12 случаев, для группы фондапаринукса 6 случаев. Таким образом, эффективность лечения в группе НФГ составила 76%, в группе фондапаринукса – 88%.
Аллергических реакций на применение препаратов не отмечено. При внутривенном лечении НФГ, как уже отмечалось выше, развились 2 тяжелых желудочно–кишечных кровотечения, одно из которых закончилось летально. У 4 пациентов было отмечено развитие посткатетерного флебита, потребовавшего местного лечения (компрессы). При использовании фондапаринукса побочных эффектов отмечено не было. Случаев тромбоцитопении (количество тромбоцитов менее 100 тысяч) ни в одной группе отмечено не было.
Прямые затраты на 1 пациента с учетом стоимости лечения основного заболевания, его осложнений, лечения неблагоприятных побочных реакций, «гостиничных услуг» составили в группе НФГ – 53 770 руб., а в группе фондапаринукса – 48 667 руб. Таким образом, при лечении затраты были на 9,5% меньше в группе фондапаринукса, чем в группе НФГ.
Меньшие затраты при лечении фондапаринуксом были обусловлены:
• меньшей продолжительностью нахождения в отделении интенсивной терапии: 3,4 к/дня в группе гепарина, 2,9 к/дня в группе фондапаринукса;
• меньшей продолжительностью стационарного лечения: 21,6 к/дня в группе НФГ, 20,9 к/дня в группе фондапаринукса;
• отсутствием геморрагических осложнений при использовании фондапаринукса.
Для каждого антикоагулянта был проведен анализ соотношения затраты/эффективность. Расчеты производились по формуле:
CER = C / Eff .
Оптимальным антикоагулянтом с позиции анализа затраты/эффективность считали лекарственный препарат, имеющий наименьшее CER.
В группе гепарина эффективность лечения составила 84% (0,84). Соотношение затраты/эффективность для гепарина – 53 770/0,84 = 64 012 руб. на 1 случай эффективной терапии. В группе фондапаринукса эффективность лечения составила 88% (0,88). Соотношение затраты/эффективность для фондапаринукса – 48 667/0,88 = 55 303 руб. на 1 случай эффективной терапии.
В результате сопоставления затрат и эффективности получены результаты, показывающие, что фондапаринукс оказался более фармакоэкономически приемлемым. При использовании фондапаринукса затраты на 1 случай эффективной терапии были на 9 тыс. 313 руб. (15,8%) меньше, чем при использовании НФГ.
Заключение
Современный селективный антикоагулянт фондапаринукс является эффективным, безопасным препаратом для лечения ОКСбпST. При применении фондапаринукса не требуется регулярного лабораторного контроля. Препарат вводится 1 раз в сутки в фиксированной дозе, независимо от веса тела, и его применение сопряжено с меньшим риском развития геморрагических осложнений. Это приводит к уменьшению нагрузки на медицинский персонал, снижению общей стоимости лечения и более комфортному состоянию пациентов.
С позиции анализа затраты/эффективность более предпочтительным является использование фондапаринукса, что позволяет рекомендовать более широкое его применение у пациентов с ОКСбпST.
компании «ГлаксоСмитКляйн».
Литература
1. Авксентьева М.В., Воробьев П.А., Герасимов В.Б., Горохова С.Г., Кобина С.А. Экономическая оценка эффективности лекарственной терапии (фармакоэкономический анализ). – С.: Ньюмедиамед, 2000.
2. Всероссийское научное общество кардиологов. Рекомендации по лечению острого коронарного синдрома без стойкого подъёма сегмента ST на ЭКГ. Кардиология. 2004. № 4 (приложение: 1–28).
3. ACC/AHA 2007 Guidelines for the Management of Patients With Unstable Angina/Non–ST–Elevation Myocardial Infarction. J Am Coll Cardiol, 2007; 50:652–726, doi:10.1016/j.jacc.2007.02.028 (Published online 6 August 2007).
4. Becker RC, Ball SP, Eisenberg P, et al. A randomized, multicenter trial of weight–adjusted intravenous heparin dose titration and point–of–care coagulation monitoring in hospitalized patients with active thromboembolic disease: Antithrombotic Therapy Consortium Investigators.Am Heart J 1999;137:59 –71.
5. Bertrand ME, Simoons ML, Fox KA, et al. Management of acute coronary syndromes: acute coronary syndromes without persistent ST segment elevation: recommendations of the Task Force of the European Society of Cardiology. Eur Heart J. 2000; 21:1406–1432.
6. Braunwald E. Unstable angina: an etiologic approach to management [editorial]. Circulation 1998;98:2219 –22.
7. Braunwald E. Unstable angina: a classification. Circulation 1989;80: 410–4.
8. Braunwald E, Antman EM, Beasely JW, et al. ACC/AHA 2002 guideline update for the management of patients with unstable angina and non–ST–segment elevation myocardial infarction: summary article. Circulation. 2002; 106:1893–1900.
9. Braunwald E, Mark DB, Jones RH, et al. Unstable Angina: Diagnosis and Management. 3–1–1994; AHCPR Publication No. 94–0602:1–154.
10. Cohen M, Adams PC, Hawkins L, Bach M, Fuster V. Usefulness of antithrombotic therapy in resting angina pectoris or non– Q–wave myocardial infarction in preventing death and myocardial infarction (a pilot study from the Antithrombotic Therapy in Acute Coronary Syndromes Study Group). Am J Cardiol 1990; 66:1287–92.
11. Cohen M, Adams PC, Parry G, et al. Combination antithrombotic therapy in unstable rest angina and non–Q–wave infarction in nonprior aspirin users: primary end points analysis from the ATACS trial. Antithrombotic Therapy in Acute Coronary Syndromes Re–search Group. Circulation 1994;89:81– 8.
12. Coussement PK, Bassand JP, Convens C, et al. A synthetic factor–Xa inhibitor (ORG31540/SR9017A) as an adjunct to fibrinolysis in acute myocardial infarction: the PENTALYSE study. Eur Heart J 2001;22: 1716–24.
13. Davies MJ. The pathophysiology of acute coronary syndromes. Heart 2000;83:361– 6.
14. Diuguid DL. Choosing a Paranteral Anticoagulant Agent. N Engl J Med 2001;345:18, 1340–1341.
15. Garber AM, Solomon NA. Cost–effectiveness of alternative test strategies for the diagnosis of coronary artery disease. Ann Intern Med 1999;130:719 –28.
16. Gaspoz JM, Coxson PG, Goldman PA, et al. Cost effectiveness of aspirin, clopidogrel, or both for secondary prevention of coronary heart disease. N Engl J Med 2002;346:1800 –6.
17. Gibbons RJ, Fuster V, Therapy for Patients with Acute Coronary Syndromes – New Opportunities. N Engl J Med 2006,354;1524–14.
18. Guidelines for the diagnosis and treatment of non–ST–segment elevation acute coronary syndromes. The Task Force for the Diagnisis and Treatment of non–ST–segment Elevation Acute Coronary Syndromes of the European Society of Cardiology. European Heart Jornal (2007) 28, 1598–1660 (Published online 14 June 2007).
19. Hamm CW, Braunwald E. A classification of unstable angina revisited. Circulation 2000;102:118 –22.
20. Hassan WM, Flaker GC, Feutz C, Petroski GF, Smith D. Improved anticoagulation with a weight–adjusted heparin nomogram in patients with acute coronary syndromes: a randomized trial. J Thromb Thrombolysis 1995; 2:245–9.
21. Hirsh J. Heparin. N Engl J Med 1991; 324:1565–74.
22. Hirsh J, Raschke R. Heparin and low–molecular–weight heparin: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126:188S–203S.
23. Holdright D, Patel D, Cunningham D, et al. Comparison of the effect of heparin and aspirin versus aspirin alone on transient myocardial ischemia and in–hospital prognosis in patients with unstable angina. J Am Coll Cardiol 1994; 24:39 –45.
24. Hochman JS, Wali AU, Barvila D, et al. A new regimen for heparin use in acute coronary syndromes. Am Heart J 1999;138:313– 8.
25. Kuntz KM, Fleischmann KE, Hunink MGM, Douglas PS. Cost–effectiveness of diagnostic strategies for patients with chest pain. Ann Intern Med 1999; 130:709 –18.
26. Libby P. Current concepts of the pathogenesis of the acute coronary syndromes. Circulation 2001; 104:365–72.
27. Mark DB, Cowper PA, Berkowitz SD, et al. Economic assessment of low–molecular–weight heparin (enoxaparin) versus unfractionated heparin in acute coronary syndrome patients: results from the ESSENCE randomized trial. Efficacy and Safety of Subcutaneous Enoxaparin in Non–Q wave Coronary Events [unstable angina or non–Q–wave myocardial infarction]. Circulation 1998; 97:1702–7.
28. Mehta SR, Steg PG, Granger CB at al. ASPIRE Investigators. Randomized, blinded trial comparing fondaparinux with unfractionated heparin in patients undergoing contemporary percutaneous coronary intervention: Arixtra Study in Percutaneous Coronary Intervention: a Randomized Evaluation (ASPIRE) Pilot Trial. Circulation. 2005; 111(11):1390–7.
29. Neri SG, Gensini GF, Poggesi L, et al. Effect of heparin, aspirin, or alteplase in reduction of myocardial ischaemia in refractory unstable angina. Lancet 1990; 335:615– 8.
30. Oler A, Whooley MA, Oler J, Grady D. Adding heparin to aspirin reduces the incidence of myocardial infarction and death in patients with unstable angina. A meta–analysis. JAMA 1996; 276:811–5.51.
31. Schleinitz MD, Heidenreich PA. A cost–effectiveness analysis of combination antiplatelet therapy for high–risk acute coronary syndromes: clopidogrel plus aspirin versus aspirin alone. Ann Intern Med 2005; 142:251–9.
32. Simoons ML, Bobbink IWG, Boland J at al. A Dose–Finding Study of Fondaparinux in Patients With Non–ST–Segment Elevation Acute Coronary Syndromes The Pentasaccharide in Unstable Angina (PENTUA) Study. J Am Coll Cardiol 2004; 43: 2183–90.
33. Telford AM, Wilson C. Trial of heparin versus atenolol in prevention of myocardial infarction in intermediate coronary syndrome. Lancet 1981;1: 1225– 8.
34. Theroux P, Ouimet H, McCans J, et al. Aspirin, heparin, or both to treat acute unstable angina. N Engl J Med 1988; 319:1105–11.
35. Theroux P, Waters D, Qiu S, McCans J, de Guise P, Juneau M. Aspirin versus heparin to prevent myocardial infarction during the acute phase of unstable angina. Circulation 1993;88: 2045– 8.
36. Warkentin TE, Levine MN, Hirsh J, et al. Heparin–induced thrombocytopenia in patients treated with low–molecular–weight heparin or unfractionated heparin. N Engl J Med 1995;332: 1330 –5.
37. Williams DO, Kirby MG, McPherson K, Phear DN. Anticoagulant treatment of unstable angina. Br J Clin Pract 1986; 40:114 –6.
38. Yeghiazarians Y, Braunstein J B, Askari A, Stone P H. Unstable Angina Pectoris N Engl J Med 2007,342; 101–111–2.
39. Yusuf S, Mehta SR, Chrolavicius S, et al. Comparison of fondaparinux and enoxaparin in acute coronary syndromes. The Fifth Organization to Assess Strategies in Acute Ischemic Syndromes Investigators N Engl J Med 2006; 354:1464 –76.
40. Yusuf S, Mehta SR, Chrolavicius S, et al. Effects of fondaparinux on mortality and reinfarction in patients with acute ST–segment elevation myocardial infarction: the OASIS–6 randomized trial. JAMA 2006; 295:1519 –30.








.gif)



