Биосинтез холестерина у млекопитающих – сложный процесс, включающий более 30 ферментов, среди которых гидроксиметилглутарил–КоА–редуктаза (ГМГ-КоА–редуктаза) – фермент, лимитирующий количество синтезируемого холестерина. Подавление синтеза эндогенного холестерина, в частности, ГМГ–КоА–редуктазы – основная «мишень» в войне против гиперхолестеринемии.
Эффективность и относительная безопасность статинов доказана, что делает их наиболее широко распространенными препаратами для лечения гиперхолестеринемии и связанных с ней заболеваний [1,2].
По данным исследований WOSCOPS (West of Scotland Coronary Prevention Study) и AFCAPS/TexCAPS (the Air Force/Texas Coronary Atherosclerosis Prevention Study), назначение статинов у лиц без клинических проявлений ССЗ снижает риск возникновения серьезных сердечно–сосудистых осложнений у пациентов как с повышенным (WOSCOPS), так и с близким к норме уровнем ЛПНП (AFCAPS/TexCAPS) [1].
Учитывая корреляцию между уровнем холестерина в плазме и риском развития атеросклеротического поражения коронарных сосудов, с высокой долей вероятности было предположено, что благотворное действие статинов обеспечивается именно способностью снижать уровень холестерина.
Однако данные, полученные в ряде клинических и теоретических исследований, позволяют говорить о том, что и посредством других, не зависящих от липидснижающего действия, механизмов статины могут оказывать положительное действие [1].
Плейотропное действие статины оказывают не только при ССЗ, но и при других патологических состояниях, что расширяет их терапевтический потенциал.
Первым препаратом из класса ингибиторов ГМГ–КоА–редуктазы, разрешенным к использованию, был ловастатин (США 1987 г.).
В настоящее время для клинического применения доступны 7 статинов, которые классифицируются соответственно происхождению на две основных группы. Естественные статины – производные пенициллиновых грибков и грибов Aspergillus terrens: ловастатин, правастатин, симвастатин. Симвастатин (Симгал) и правастатин – полусинтетические аналоги.
Новые статины (флувастатин, аторвастатин, розувастатин, правастатин) – синтетические производные.
Большинство препаратов этой группы показаны для лечения патологических состояний, напрямую ассоциированных с нарушениями обмена липидов и холестерина, включая дислипидемии, атеросклероз, заболевания коронарных артерий, острый коронарный синдром. Некоторые из них (симвастатин) в настоящее время проходят клиническую оценку (фаза II и III) при назначении у лиц с болезнью Альцгеймера, рассеянным склерозом, хронической сердечной недостаточностью, почечной недостаточностью [1].
Молекулярные механизмы
действия статинов
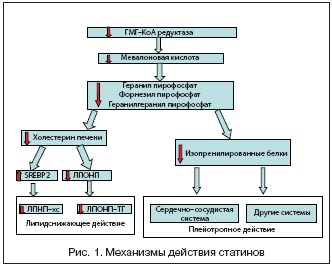
Путь биосинтеза эндогенного холестерина начинается с конденсации ацетил–КоА и ацетоацетил–КоА в ГМГ–КоА. Следующий этап – ключевой, NADPH зависимое восстановление ГМГ–КоА в мевалонат, в котором катализатором является фермент ГМГ–КоА–редуктаза.
Ингибирование ГМГ–КоА–редуктазы статинами возможно благодаря структурному сходству с естественным субстратом фермента. Все статины обладают частью, сходной с ГМГ, которая в некоторых препаратах представлена в неактивной лактоновой форме, ферментативно гидролизующейся in vivo в активную гидроксикислотную форму [1]. Эта часть встраивается в участок, связывающий ГМГ в активной части фермента, создавая большое количество водородных связей и ионных соединений, что приводит к образованию прочных, хотя и обратимых, связей.
Аффинность статинов к ГМГ–КоА–редуктазе имеет наномолярный порядок, а естественный фермент ГМГ–КоА проявляет аффинность на микромолекулярном уровне. Таким образом, блокируется доступ естественного субстрата к ферменту. Более того, статины также изменяют конформацию фермента, препятствуя образованию его функциональной структуры [1].
Ингибирование ГМГ–КоА–редуктазы приводит к уменьшению синтеза мевалоната. Это приводит к: 1) снижению содержания в печени внутриклеточного холестерина, что обеспечивает липидснижающее действие статинов; 2) уменьшению синтеза промежуточных продуктов обмена мевалоната (изопрениодного фарнезил пирофосфата и геранилгеранил пирофосфата) [1].
Уменьшение синтеза холестерина в печени активирует ряд факторов транскрипции, названных стерол–связывающими регуляторными белками (SREBPs), главным образом изоформу SREBP2 [1]. В ядре клетки SREBP2 активизирует транскрипцию нескольких холестерогенных генов, таких как ГМГ–КоА–синтаза, ГМГ-КоА–редуктаза, фарензил дифосфат синтаза, сквален синтаза, а также рецепторов ЛПНП [1].
Повышенние числа рецепторов ЛПНП в гепатоцитах приводит к увеличению захвата ЛПНП и таким образом – к снижению уровня циркулирующих ХС ЛПНП (рис. 1) [1].
Фармакокинетика
Знание фармакокинетики и фармакодинамики липидснижающих средств и механизмов их взаимодействия помогает предотвратить развитие нежелательных явлений.
Все статины назначаются в активной β–гидрокислотной форме, кроме ловастатина, симвастатина, аторвастатина, которые назначаются в виде лактоновых пролекарств и должны подвергнуться гидролизу для превращения в активную форму. Все статины биотрасформируются в печени системой микросомальных цитохромов (CYP) P450 [1,3]. Аторвастатин, ловастатин и симвастатин – преимущественно CYP3А4. Флувастатин метаболизируется изоформой CYP2C9. Правастатин биотрансформируется в цитозоле сульфатионом.
Некоторые транспортеры клеточных мембран могут оказывать влияние на распределение статинов. Например, органический полипептид, транспортирующий анионы (OATP 1B1), повышает печеночный захват статинов [4]. Генетический полиморфизм этого соединения значительно повышает концентрацию в плазме кислотной формы симвастатина, умеренно повышает таковую правастатина, но не оказывает влияния на флувастатин [4].
Сильные ингибиторы CYP3А4 (итраконазол, ритонавир) значительно (до 20 раз) повышают концентрацию в плазме симвастатина, ловастатина и их активных кислотных форм, тем самым увеличивая риск миотоксичности [4,5]. Слабые или умеренные ингибиторы CYP3А4, такие как верапамил, дилтиазем и грейпфрутовый сок, могут с острожностью использоваться вместе с низкими дозами симвастатина или ловастатина [4].
Потенциальные индукторы CYP3А4 могут значительно снижать концентрацию симвастатина и его кислотной формы, а возможно, и ловастатина и его кислотной формы [4].
Наличие аллельного варианта CYP3A4*4 повышает липидснижающее действие Симгала [6].
Хотя ловастатин метаболизируется CYP2C9, его концентрация изменяется менее чем 2 раза при использовании ингибиторов или индукторов CYP2C9 [4]. Концентрация в плазме правастатина не подвергается влиянию ингибиторов CYP и лишь незначительно изменяется под влиянием индукторов [4].
Циклоспорин и гемфиброзил повышают концентрацию статинов и их миотоксичность [4,5]. Менее всего подвержен этому флувастатин [4].
Ингибиторы OATP1B1 (циклоспорин, гемфиброзил) могут снижать эффективность симвастатина, ловастатина и правастатина, препятствуя их проникновению в гепатоциты [4].
Р–гликопротеин – белок, находящийся в пищеварительном тракте, плаценте, почках, головном мозге и печени, может иметь значение в механизмах взаимодействия статинов [7].
Результаты исследований с моделями in vitro показали, что ловастатин, симвастатин и аторвастатин являются ингибиторами Р–гликопротеина, а также могут быть субстратами для этого транспортера [7].
Правастатин и флувастатин, в свою очередь, не продемонстрировали значительной способности к ингибированию Р–гликопротеина [7].
Многие лекарства, такие как дилтиазем, верапамил, итраконазол, кетоконазол и циклоспорин, а также грейпфрутовый сок и зверобой, взаимодействуют со статинами и являются модуляторами как CYP3A4, так и P–гликопротеин [7]. Однако роль Р–гликопротеин в этих специфических лекарственных взаимодействиях остается неясной [7].
Исследования на мышах показали, что Р–гликопротеин имеет определяющее значение в ограничении проникновения кислотных форм аторвастатина, правастатина, ловастатина, симвастатина и лактоновой формы аторвастатина в головной мозг [8]. Также может ограничивать проникновение в головной мозг и лактоновых форм симвастатина и ловастатина [8].
Понимание различий в фармакокинетике и лекарственном взаимодействии статинов помогает при выборе препарата.
Статины и заболевания печени
Существует очень мало работ, в которых объединяются данные как теоретических, так и клинических исследований, посвященных изучению воздействия статинов на физиологию печени, оценке их безопасности и применения при хронических заболеваниях печени.
В настоящее время растет число лиц с хроническими заболеваниями печени, особенно с метаболическим синдромом (МС) в сочетании с неалкогольной жировой болезнью печени (НАЖБП) или метаболическими расстройствами на фоне хронического вирусного гепатита С (ХГС), вынужденных принимать статины для предотвращения ССЗ. В связи с этим клиницисты вынуждены учитывать сложные механизмы взаимодействия статинов с метаболизмом печени в данных условиях. К тому же риск ССО повышается при НАЖБП, ХГС, первичном билиарном циррозе (ПБЦ) [9,10]. Поэтому назначение статинов у лиц с этими заболеваниями может иметь важное прогностическое значение.
Сохраняет свою актуальность проблема изучения редко возникающей на фоне терапии статинами острой печеночной недостаточности. Неясным остается влияние статинов на прогрессирование фиброза печени. Нет фиксированных значений уровня аминотрансфераз, определенных для мониторинга терапии статинами.
В настоящее время нет убедительных данных о наличии связи между повышением уровня аминотрансфераз и подтвержденным гистологически повреждением печени у пациентов, принимающих статины. В связи с этим снижается ценность биохимического контроля за уровнем аминотрансфераз. Более того, их нормативные значения у пациентов с гиперлипидемией и здоровых лиц различаются.
Статины и НАЖБП
Данные клинических исследований показали, что статины у пациентов с НАЖБП и повышенным уровнем С–реактивного белка, который может служить показателем выраженности НАЖБП, оказывают более выраженное влияние на сердечно–сосудистую систему [9].
Проведенные исследования на животных и единичные данные, полученные при назначении у людей, свидетельствуют о том, что статины могут уменьшать портальную гипертензию посредством воздействия на метаболизм оксида азота [9].
Снижение уровня окисленных ЛПНП особенно актуально у пациентов с неалкогольным стеатогепатитом (НАСГ), у которых его уровень повышен. Однако это свойство статинов оказалось непостоянным: аторвастатин и правастатин подавляют перикисное окисление липидов на срок до 3 месяцев после начала лечения и имеют незначительный дополнительный эффект при продолжительном лечении [9].
Для пациентов с хроническими заболеваниями печени, такими как НАЖБП, вероятно наличие иных механизмов действия статинов, которые могут иметь большое значение, но мало изучены. Например, изменение метаболизма холестерина, возможно, воздействует на метаболизм гена sonic hedgehog (sHh) («звуковой ежик»), запускающего синтез сигнальных молекул, управляющих процессом формирования различных органов и тканей в ходе эмбрионального развития. Метаболизм этого гена является стерол–зависимым и влияет на строение тела, прогрессирование фиброза и репаративные механизмы. Ранее опубликованные результаты исследований на грызунах показали, что прямое ингибирование белков гена sonic hedgehog может снижать прирост массы тела, обусловленный диетическими привычками [9]. Данные того же исследования определяют роль sHh, как жизнеобеспечивающего аутокринного фактора для звездчатых клеток печени, а также его возможное участие в патогенезе цирроза печени [9].
НАЖБП и гиперлипидемия часто сосуществуют у одного пациента, так как оба этих состояния связаны с наличием метаболического синдрома. Гиперхолестеринемия и гипертриглицеридемия являются независимыми предвестниками стеатоза [9,10]. По данным популяционных исследований, при проведении МРТ стеатоз выявлялся у 60% пациентов со смешанной гиперлипидемией и у 83% со смешанной гиперлипидемией и повышенным уровнем АЛТ [9].
НАЖБП часто связана с целым спектром заболеваний сосудов, включая эндотелиальную дисфункцию, истончение комплекса интима–медиа, формированием атеросклеротической бляшки. Хотя установленный уровень смертности при сахарном диабете 2 типа выше при имеющемся циррозе, чем при ССЗ, а наличие диабета у пациентов с НАЖБП более чем в два раза повышает частоту обнаружения цирроза печени при биопсии (от 10 до 25%), более высокая смертность пациентов с НАСГ главным образом обусловлена ССЗ [9]. Таким образом, статины имеют все возрастающее значение в дополнительном лечении пациентов с НАЖБП.
Однако действие статинов на клетку при НАЖБП до конца не изучено. Например, существует вероятность взаимодействия статинов с основными факторами, включенными в метаболизм жиров, такими как рецепторы, активируемые пероксисомальным пролифератором (PPAR) [9]. В культуре клеток многие статины индуцировали активацию PPAR в макрофагах и моноцитах [9]. У крыс статины влияют на активацию гена PPAR и таким образом, вероятно, играют роль в активации перикисного окисления жиров [9]. В исследовании на первичных гепатоцитах крыс выявлено, что Симгал обладает защитным действием на клетки печени, увеличивая активность фактора транскрипции Nrf2, контролирующего экспрессию множества протективных генов в ответ на оксидативный стресс. Данное антиоксидантное действие является одним из плейотропных эффектов статинов [11].
Существует множество других вероятных «мишеней» для статинов на молекулярном уровне, влияя на которые они могут оказывать направленное действие на активность НАЖБП. Например, снижение уровня туморнекротизирующего фактора–альфа, интерлейкина–6 и, возможно, С–реактивного белка на фоне терапии статинами может оказаться эффективным, так как повышение уровня этих маркеров ассоциируется с прогрессированием гистологических изменений печени при НАЖБП [9]. Статины также могут оказаться эффективными при стеатозе благодаря способности уменьшать доставку свободных жирных кислот в печень или воздействию на сигнальную систему инсулина через изменение обмена адипонектина [9].
Несколько исследований на животных продемонстировали влияние статинов на апоптоз. В культуре гепатоцитов крыс правастатин запускал апоптоз большего числа клеток, по–видимому, за счет изменения митохондриальной проницаемости [9]. Однако симвастатин и ловастатин приводили к торможению апоптоза, ослабляя ответ гена супрессора опухоли p53 в ответ на повреждение ДНК в гепатоцитах крыс [9].
Несмотря на положительный и отрицательный опыт использования статинов при НАЖБП, только в 6 пилотных исследованиях произведена оценка терапевтического действия статинов у ограниченного числа пациентов, а изучение гистологической картины проведено только в трех из них [9]. Промежуточные результаты обнадеживают. В некоторых исследованиях показано улучшение гистологической картины в отношении воспаления без изменений в отношении фиброза [9]. Также показано отсутствие специфического маркера повреждения [9].
Недавно проведенные клинические исследования внесли дополнительный вклад в поддержку безопасности применения статинов у пациентов с НАЖБП. Контролируемое проспективное исследования Lewis и соавт. с применением максимальной дозы правастатина при различных заболеваниях печени, включая 64% лиц с НАЖБП, показало одинаковую эффективность в снижении ЛПНП и отсутствие различий в частоте повышения уровня аминотрасфераз [9].
Ретроспективное исследование, проведенное Ekstedt и соавт., предоставило детальные данные, основанные на гистологических исследованиях, нуждающиеся в обсуждении. Гистологическая картина 17 пациентов с НАЖБП, получавших статины в течение 16 лет, сопоставлена с таковой у 51 пациента, не получавшего статины. После сопоставимого периода наблюдения не было выявлено изменения степени фиброза у 11 из 17 пациентов (64%), получавших статины, по сравнению с 18 из 51 (37%) нелеченного статинами. У 5 из 17 (29%) пациентов, получавших статины, развился цирроз печени в конце срока наблюдения. В группе пациентов, не получавших статины, цирроз печени развился у 6 из 51 (12%), несмотря на одинаковые исходные стадии фиброза в группах. Отсюда может быть сделан вывод, что возможно существование двух подгрупп: 1) с выраженной липотоксичностью и прогрессированием фиброза, несмотря на терапевтические мероприятия (назначение статинов); 2) с риском прогрессирования фиброза в результате длительной терапии статинами посредством невыясненных механизмов [9].
Статины и некоторые другие
заболевания печени
Статины безопасны и эффективны для снижения уровня холестерина в сыворотке крови при первичном билиарном циррозе (ПБЦ), но они могут влиять на холестаз только наряду с применением УДХК [12]. Статины обладают специфическими противовоспалительными свойствами, которые могут оказывать положительное действие при ПБЦ [12].
Существует теория о том, что статины могут влиять на ангиогенез, рост опухолевых клеток, апоптоз, метастатическую активность ряда опухолей [9,13,14]. Хотя существует и противоположное мнение, что антиангиогенная активность варьирует в зависимости от действующего вещества и дозы. Статины в низких дозах в основном имеют склонность повышать проангиогенное действие сосудистого эндотелиального фактора роста, в то время как высокие дозы ингибируют активируемый им ангиогенез [9]. Статины влияют на ангиогенез путем воздействия на продукцию белка Akt и B киназ, Ras, Ras гомолога, интерлейкина 18 [9,15]. Статины также снижают продукцию геранилгеранил пирофосфата, которая ведет к снижению гибели клеток и замедляет ангиогенез [15]. И напротив, статины могут обладать проангиогенным эффектом, воздействуя на эндотелиальную синтазу оксида азота, продукцию оксида азота, стимуляцию ЭФР, снижение активности эндотелиального оксида азота [9]. Имеющиеся данные обращают внимание на возможную способность статинов предотвращать развитие опухолей, в том числе гепатоцеллюлярной карциномы (ГКЦ).
Кроме того, имеются данные о супрессивном действии статинов in vivo на вирус гепатита С, которое является умеренным, переменным и краткосрочным. Эти данные поддерживают эспериментальные данные пилотных исследований, посвященных терапии комбинированной стандартной и статинами. Статины являются безопасными в применении при гепатите С [16].
По результатам ряда исследований, назначение статинов лицам с повышенным уровнем печеночных ферментов, НАЖБП, гепатитом С, циррозом, ГЦК и пациентам после трансплантации печени оказывало благоприятное воздействие без повышения риска нежелательных явлений [9,17].
Статины у лиц с исходно высоким уровнем аминотрансфераз
Еще меньше данных о применении статинов у лиц с исходно повышенным уровнем печеночных аминотрансфераз.
В исследовании Vuppalanchi и соавт., посвященном применению ловастатина у лиц с исходно повышенным уровнем аминотрансфераз оценивалось несколько групп пациентов. Группа 1 – 135 пациентов с повышенным уровнем печеночных ферментов (АСТ>40 МЕ/мл, АЛТ>35 МЕ/мл), получающих ловастатин. Группа 2 – 620 пациентов с нормальным уровнем ферментов, получающих ловастатин. Группа 3 – 2644 пациента с повышенным уровнем ферментов, не получающих ловастатин. Повышение уровня печеночных ферментов через 12 месяцев после начала приема ловастатина оценивалось от незначительного, умеренного до тяжелого и основано на опубликованных критериях «Hy’s Rule». Частота развития незначительного, умеренного повышения и значительного повышения печеночных ферментов в группе 1 была 6,6 и 0% соответственно. По сравнению с группой 2 у лиц в группе 1 была выше частота развития умеренного повышения (6,6% против 3%; p=0,03), но не значительного (0% против 0,3%; p=0,9) [18]. По сравнению с группой 3 у пациентов из группы 1 незначительное, умеренное повышение уровней ферментов было одинаковым (6,6% против 11%; p=0,2), но была более низкая частота развития значительного повышения (0% против 5,5%; p<0,01) [17]. Ни у кого из группы 1 или 2 не отмечено повышение уровня ферментов, достигшее критериев «Hy’s Rule», в то время как 3,5% пациентов в группе 3 достигли такого уровня (p<0,05 против группы 1 или группы 2) [18].
Выводы
Статины – группа препаратов, обладающая множеством различных механизмов действия на биохимические процессы в организме. Благодаря плейотропным эффектам их применение возможно при многих патологических состояниях, в том числе не связанных ССЗ. Данные большого числа исследований позволяют говорить об эффективности и безопасности терапии статинами, в том числе при заболеваниях печени.
Частота развития нежелательных явлений на фоне приема статинов у лиц с хроническими заболеваниями печени или исходно повышенным уровнем печеночных аминотрансфераз не превышает таковую в популяции [18–20]. Однако для подтверждения этого утверждения необходимы дальнейшие проспективные исследования.
Литература
1. Alegret M., Silvestre J.S. Pleiotropic effects of statins and related pharmacological experimental approaches. // Methods Find Exp Clin Pharmacol. – 2006 Nov; 28(9): 627–56.
2. Armitage J. The safety of statins in clinical practice. // Lancet. 2007 Nov 24;370(9601):1781–90.
3. Neuvonen P.J., Niemi M., Backman J.T. Drug interactions with lipid–lowering drugs: mechanisms and clinical relevance. // Clin Pharmacol Ther. 2006 Dec;80(6):565–81.
4. Neuvonen P.J., Backman J.T., Niemi M. Pharmacokinetic comparison of the potential over–the–counter statins simvastatin, lovastatin, fluvastatin and pravastatin. // Clin Pharmacokinet. 2008;47(7):463–74.
5. Tornio A., Pasanen M.K., Laitila J., Neuvonen P.J., Backman J.T. Comparison of 3–hydroxy–3–methylglutaryl coenzyme A (HMG–CoA) reductase inhibitors (statins) as inhibitors of cytochrome P450 2C8. // Basic Clin Pharmacol Toxicol. 2005 Aug;97(2):104–8.
6. Wang A., Yu B.N., Luo C.H., Tan Z.R., Zhou G., Wang L.S., Zhang W., Li Z., Liu J., Zhou H.H. Ile118Val genetic polymorphism of CYP3A4 and its effects on lipid–lowering efficacy of simvastatin in Chinese hyperlipidemic patients.// Eur J Clin Pharmacol. 2005 Feb;60(12):843–8.
7. Holtzman C.W., Wiggins B.S., Spinler S.A. Role of P–glycoprotein in statin drug interactions. // Pharmacotherapy. 2006 Nov;26(11):1601–7.
8. Chen C., Lin J., Smolarek T., Tremaine L. P–glycoprotein has differential effects on the disposition of statin acid and lactone forms in mdr1a/b knockout and wild–type mice. // Drug Metab Dispos. 2007 Oct;35(10):1725–9.
9. Argo C.K., Loria P., Caldwell S.H., Lonardo A. Statins in liver disease: a molehill, an iceberg, or neither? // Hepatology. 2008 Aug;48(2):662–9.
10. Lowyck I., Fevery J. Statins in hepatobiliary diseases: effects, indications and risks. // Acta Gastroenterol Belg. 2007 Oct–Dec;70(4):381–8.
11. Habeos I.G., Ziros P.G., Chartoumpekis D., Psyrogiannis A., Kyriazopoulou V., Papavassiliou A.G. Simvastatin activates Keap1/Nrf2 signaling in rat liver. // J Mol Med. 2008 Sep 2. [Epub ahead of print]
12. Balmer M., Dufour J. Treatment of hypercholesterolemia in patients with primary biliary cirrhosis might be more beneficial than indicated. // Swiss Med Wkly. 2008 Jul 26;138(29–30):415–9.
13. Liu H., Liang S.L., Kumar S., Weyman C.M., Liu W., Zhou A. Statins induce apoptosis in ovarian cancer cells through activation of JNK and enhancement of Bim expression. // Cancer Chemother Pharmacol. 2008 Sep 3. [Epub ahead of print].
14. Slawinska A., Kandefer–Szerszen M. The anticancer properties of statins/ // Postepy Hig Med Dosw (Online). 2008 Aug 7;62:393–404.
15. Jakobisiak M., Golab J. Potential antitumor effects of statins (Review). // Int J Oncol. 2003 Oct;23(4):1055–69.
16. Bader T., Fazili J., Madhoun M., Aston C., Hughes D., Rizvi S., Seres K., Hasan M. Fluvastatin inhibits hepatitis C replication in humans. // Am J Gastroenterol. 2008 Jun;103(6):1383–9.
17. Martin J.E., Cavanaugh T.M., Trumbull L., Bass M., Weber F. Jr., Aranda–Michel J., Hanaway M., Rudich S. Incidence of adverse events with HMG–CoA reductase inhibitors in liver transplant patients. // Clin Transplant. 2008 Jan–Feb;22(1):113–9.
18. Vuppalanchi R., Teal E., Chalasani N. Patients with elevated baseline liver enzymes do not have higher frequency of hepatotoxicity from lovastatin than those with normal baseline liver enzymes. // Am J Med Sci. 2005 Feb;329(2):62–5.
19. Anfossi G., Massucco P., Bonomo K., Trovati M. Prescription of statins to dyslipidemic patients affected by liver diseases: a subtle balance between risks and benefits. // Nutr Metab Cardiovasc Dis. 2004 Aug;14(4):215–24.
20. Onofrei M.D., Butler K.L., Fuke D.C., Miller H.B. Safety of statin therapy in patients with preexisting liver disease. // Pharmacotherapy. 2008 Apr;28(4):522–9.








.gif)



