–Ю–ґ–Њ–≥–Є –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є —Б–µ—А—М–µ–Ј–љ—Г—О –Љ–µ–і–Є—Ж–Є–љ—Б–Ї—Г—О, —Б–Њ—Ж–Є–∞–ї—М–љ—Г—О –Є —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї—Г—О –њ—А–Њ–±–ї–µ–Љ—Г. C–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞–љ–Є–µ –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П –Њ–ґ–Њ–≥–Њ–≤ –Є –Њ–ґ–Њ–≥–Њ–≤–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ—А–Є–≤–µ–ї–Њ –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —З–∞—Б—В–Њ—В—Л —А–∞–Ј–≤–Є—В–Є—П —Б–µ–њ—Б–Є—Б–∞ –Є —Г–ї—Г—З—И–Є–ї–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–Ї–∞–Ј–∞–љ–Є—П –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –њ—А–Є –Њ–±—И–Є—А–љ—Л—Е –Њ–ґ–Њ–≥–∞—Е [1,8]. –†–∞–љ–љ–µ–µ –Є—Б—Б–µ—З–µ–љ–Є–µ –Њ–ґ–Њ–≥–Њ–≤–Њ–≥–Њ —Б—В—А—Г–њ–∞ –Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–Ј–Є–ї–Є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П —А–∞–љ–µ–≤–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М –Њ—В –Њ–ґ–Њ–≥–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е –і–≤—Г—Е –і–µ—Б—П—В–Ї–Њ–≤ –ї–µ—В [7]. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –Є–љ—Д–µ–Ї—Ж–Є—П –Є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ—Б—В–∞–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Њ–ґ–Њ–≥–Њ–≤–Њ–є –±–Њ–ї–µ–Ј–љ–Є –Є –ї–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ —Г –Њ–±–Њ–ґ–ґ–µ–љ–љ—Л—Е [5,11].
–Ю–і–љ–Є–Љ–Є –Є–Ј —Д–∞–Ї—В–Њ—А–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П —В—П–ґ–µ–ї–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є —П–≤–ї—П—О—В—Б—П –њ–Њ—Б–ї–µ–Њ–ґ–Њ–≥–Њ–≤–∞—П –Є–Љ–Љ—Г–љ–љ–∞—П –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–∞—Ж–Є—П –Є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є—П, —Б–Њ–њ—А—П–ґ–µ–љ–љ–∞—П —Б –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є —А–µ–∞–Ї—Ж–Є–µ–є, –≤—Л–Ј—Л–≤–∞—О—Й–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ [1,10]. –Э–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П –Є–ї–Є –Ї–Њ—А—А–µ–Ї—Ж–Є—П –Є–Љ–Љ—Г–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є —Б—В–∞–љ–Њ–≤–Є—В—Б—П —В–µ–Љ –±–Њ–ї–µ–µ –њ—А–Є–≤–ї–µ–Ї–∞—В–µ–ї—М–љ–Њ–є –Є–Ј––Ј–∞ –њ–Њ—П–≤–ї–µ–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—Г—Б—В–Њ–є—З–Є–≤—Л—Е —И—В–∞–Љ–Љ–Њ–≤ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤. –Ю—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ–є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –Є–Љ–Љ—Г–љ–Њ–Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ–Є –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –≤–Ї–ї—О—З–µ–љ—Л –≤ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –ї–µ—З–µ–љ–Є—О —Б–µ–њ—Б–Є—Б–∞ [2,4,12]. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –Љ—Л –Є–Ј—Г—З–Є–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ, —Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ –±–Њ–ї–µ–µ 99% –Љ–Њ–љ–Њ–Љ–µ—А–љ–Њ–≥–Њ IgG —Б –љ–µ—А–∞—Б—Й–µ–њ–ї–µ–љ–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А–Њ–є [6].
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: —Г–ї—Г—З—И–µ–љ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е, –њ–Њ—Б—В—А–∞–і–∞–≤—И–Є—Е –Њ—В –Њ–ґ–Њ–≥–Њ–≤, –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–Љ–Љ—Г–љ–Њ–Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є.
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Т –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Њ—И–ї–Є 50 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ «–Њ–ґ–Њ–≥–Њ–≤–∞—П –±–Њ–ї–µ–Ј–љ—М –≤ —Б—В–∞–і–Є–Є –Њ–ґ–Њ–≥–Њ–≤–Њ–є —В–Њ–Ї—Б–µ–Љ–Є–Є –Є –Њ–ґ–Њ–≥–Њ–≤–Њ–є —Б–µ–њ—В–Є–Ї–Њ—В–Њ–Ї—Б–µ–Љ–Є–Є». –Ш–Ј –љ–Є—Е 30 –±–Њ–ї—М–љ—Л—Е —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Г—О —В–µ—А–∞–њ–Є—О –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –і–ї—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–Є –Њ—Б–љ–Њ–≤–љ—Г—О –≥—А—Г–њ–њ—Г – 15 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–±—Й–µ–є –њ–ї–Њ—Й–∞–і—М—О –Њ–ґ–Њ–≥–Њ–≤ —Б–≤—Л—И–µ 30% –њ–ї–Њ—Й–∞–і–Є —В–µ–ї–∞ —Б —А–∞–Ј–≤–Є–≤—И–Є–Љ—Б—П —Б–µ–њ—Б–Є—Б–Њ–Љ, –Є 15 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–±—Й–µ–є –њ–ї–Њ—Й–∞–і—М—О –Њ–ґ–Њ–≥–Њ–≤ –±–Њ–ї–µ–µ 30% –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —В–µ–ї–∞ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≥–µ–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є. –Ф—А—Г–≥–Є–µ 20 –±–Њ–ї—М–љ—Л—Е –Є–Ј —Н—В–Њ–є –Њ–±—Й–µ–є –≥—А—Г–њ–њ—Л —Б–Њ—Б—В–∞–≤–Є–ї–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г –±–µ–Ј –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Г—О —В–µ—А–∞–њ–Є—О –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞. –Ю–љ–Є –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ –і–≤–µ –њ–Њ–і–≥—А—Г–њ–њ—Л –њ–Њ 10 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Ї–∞–ґ–і–Њ–є, –њ—А–Є—З–µ–Љ –њ–µ—А–≤–∞—П –њ–Њ–і–≥—А—Г–њ–њ–∞ —П–≤–ї—П–ї–∞—Б—М –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –і–ї—П –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л —Б —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ —Б–µ–њ—Б–Є—Б–∞, –∞ –≤—В–Њ—А–∞—П – –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –і–ї—П –≥—А—Г–њ–њ—Л —Б –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Њ–є –≥–µ–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є.
–Ю—Б–љ–Њ–≤–љ—Л–µ –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л–µ –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є –±—Л–ї–Є —Б—Е–Њ–і–љ—Л–Љ–Є –њ–Њ –і–Є–∞–≥–љ–Њ–Ј—Г, –њ–Њ–ї—Г –Є –≤–Њ–Ј—А–∞—Б—В—Г, –њ—А–Є—З–µ–Љ 15 –±–Њ–ї—М–љ—Л—Е —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–µ–њ—Б–Є—Б–∞ –љ–∞ —Д–Њ–љ–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ–Њ–ї—Г—З–Є–ї–Є 10––і–љ–µ–≤–љ—Л–є –Ї—Г—А—Б –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є, –∞ –і—А—Г–≥–Є–µ 15 –±–Њ–ї—М–љ—Л—Е —Б —А–Є—Б–Ї–Њ–Љ –≥–µ–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 5––і–љ–µ–≤–љ—Л–є –Ї—Г—А—Б –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ –њ–Њ 50 –Љ–ї –µ–ґ–µ–і–љ–µ–≤–љ–Њ. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –њ—А–Є–Љ–µ–љ—П–ї–Є –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є, –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є, –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј—Л, –Є–Ј—Г—З–µ–љ–Є–µ –Њ—Б—В—А–Њ—Д–∞–Ј–Њ–≤—Л—Е —А–µ–∞–Ї—В–∞–љ—В–Њ–≤, –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±–Њ–ї—М–љ—Л—Е.
–Ю–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ —Б—Г–і–Є–ї–Є, –Њ—Ж–µ–љ–Є–≤–∞—П –і–Є–љ–∞–Љ–Є–Ї—Г –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Њ–ґ–Њ–≥–Њ–≤–Њ–є –±–Њ–ї–µ–Ј–љ–Є, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –Є –Є–Љ–Љ—Г–љ–Њ–≥—А–∞–Љ–Љ—Л, —З–∞—Б—В–Њ—В—Г —А–∞–Ј–≤–Є—В–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Г—А–Њ–≤–µ–љ—М –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є.
–У–∞–±—А–Є–≥–ї–Њ–±–Є–љ – –љ–Њ—А–Љ–∞–ї—М–љ—Л–є –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ —З–µ–ї–Њ–≤–µ–Ї–∞ –і–ї—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П, —Б–Њ–і–µ—А–ґ–Є—В –≤ 50 –Љ–ї —А–∞—Б—В–≤–Њ—А–∞ 2,5 –≥ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ G. –Ъ—Г—А—Б –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–ї 5–10 –Є–љ—Д—Г–Ј–Є–є —З–µ—А–µ–Ј 24 —З. –Ш–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤—Л–њ–Њ–ї–љ—П–ї–Є –≤ –Є—Б—Е–Њ–і–љ—Л–є –њ–µ—А–Є–Њ–і –і–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞, —З–µ—А–µ–Ј 6 –Є 11 —Б—Г—В. –Њ—В –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П. –Ъ–ї–Є–љ–Є–Ї–Њ––ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г —В—П–ґ–µ–ї–Њ–Њ–±–Њ–ґ–ґ–µ–љ–љ—Л—Е –≤—Л–њ–Њ–ї–љ—П–ї–Є —З–∞—Й–µ.
–Р–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є –Ї–Є—Б–ї–Њ—А–Њ–і–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –Љ–µ—В–Њ–і–Њ–Љ —Е–µ–Љ–Є–ї—О–Љ–Є–љ–µ—Б—Ж–µ–љ—Ж–Є–Є (–•–Ы) –љ–∞ –ї—О–Љ–Є–љ–Њ–Љ–µ—В—А–µ L1251 (LKB, Sweden), —Г—Б–Є–ї–µ–љ–љ–Њ–є –і–Њ–±–∞–≤–ї–µ–љ–Є–µ–Љ 1•10–6 –Ь –ї—О–Љ–Є–љ–Њ–ї–∞ –Є 25 –Љ–Ь –ї—О—Ж–Є–≥–µ–љ–Є–љ–∞ [3], –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ј–Є–Љ–Њ–Ј–∞–љ–Њ–Љ, –Њ–њ—Б–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Б—Л–≤–Њ—А–Њ—В–Ї–Њ–є –Ј–і–Њ—А–Њ–≤—Л—Е –і–Њ–љ–Њ—А–Њ–≤ –≤ 10 –Љ–Ї–ї —Ж–µ–ї—М–љ–Њ–є –Ї—А–Њ–≤–Є –≤ —В–µ—З–µ–љ–Є–µ 30–40 –Љ–Є–љ, –≤—Л—А–∞–ґ–∞—П –µ–µ –≤ –Љ–Т/100 —Д–∞–≥–Њ—Ж–Є—В–Њ–≤ (–≤ –њ–µ—А–µ—Б—З–µ—В–µ –љ–∞ –љ–µ–є—В—А–Њ—Д–Є–ї—Л). –Ю–Ї–Є—Б–ї–µ–љ–Є–µ –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є –ї—О–Љ–Є–љ–Њ–ї–∞ –њ–Њ–Ј–≤–Њ–ї—П–ї–Њ –Њ–њ—А–µ–і–µ–ї—П—В—М –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Г—О –≥–µ–љ–µ—А–∞—Ж–Є—О –∞–Ї—В–Є–≤–љ—Л—Е —Д–Њ—А–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–∞, –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є –ї—О—Ж–Є–≥–µ–љ–Є–љ–∞ – –≤—Л—П–≤–ї—П–ї–Њ —В–Њ–ї—М–Ї–Њ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Г—О –≥–µ–љ–µ—А–∞—Ж–Є—О —Б—Г–њ–µ—А–Њ–Ї—Б–Є–і–љ–Њ–≥–Њ –∞–љ–Є–Њ–љ–∞ –Ї–Є—Б–ї–Њ—А–Њ–і–∞. –Ъ–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–Њ–≤ –Р, –Ь –Є G –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Њ–њ—А–µ–і–µ–ї—П–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Љ–Њ–љ–Њ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –∞–љ—В–Є—Б—Л–≤–Њ—А–Њ—В–Њ–Ї –Р–Ю –Э–Я–Ю «–°–Є–љ—В–µ–Ї–Њ» –Љ–µ—В–Њ–і–Њ–Љ —В—Г—А–±–Є–і–Є–Љ–µ—В—А–Є–Є –љ–∞ –њ–Њ–ї—Г–∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–µ Screen Master Plus —Д–Є—А–Љ—Л «Hospitex Diagnostics S.A.» (Switzerland) –њ—А–Є –і–ї–Є–љ–µ –≤–Њ–ї–љ—Л 340 –љ–Љ.
–§–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Є–Љ–Љ—Г–љ–Њ–Ї–Њ–Љ–њ–µ—В–µ–љ—В–љ—Л—Е –Є —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –≤—Л–њ–Њ–ї–љ—П–ї–Є –Љ–µ—В–Њ–і–Њ–Љ –њ—А–Њ—В–Њ—З–љ–Њ–є —Ж–Є—В–Њ—Д–ї—Г–Њ—А–Є–Љ–µ—В—А–Є–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л—Е –Р–Ґ (–Љ–Њ–љ–Р–Ґ) —Д–Є—А–Љ—Л «BD Biosciences, Becton, Disc–Їinson and Co.» (USA) –њ–Њ –њ—А–Њ–њ–Є—Б–Є —Н—В–Њ–є —Д–Є—А–Љ—Л, –љ–∞ –њ—А–Њ—В–Њ—З–љ–Њ–Љ —Ж–Є—В–Њ—Д–ї—Г–Њ—А–Є–Љ–µ—В—А–µ BD FACSCalibur, –Є—Б–њ–Њ–ї—М–Ј—Г—П 50 –Љ–Ї–ї —Ж–µ–ї—М–љ–Њ–є –Ї—А–Њ–≤–Є —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –µ–µ –Њ–±—А–∞–±–Њ—В–Ї–Њ–є –Љ–Њ–љ–Р–Ґ (CD3, CD4, CD8, CD16, CD21, CD11b, CD25, CD4+CD25+, CD3HLA–DR+, CD64, CD70), –Љ–µ—З–µ–љ–љ—Л–Љ–Є FITC (—Д–ї—Г–Њ—А–µ—Б—Ж–µ–Є–љ –Є–Ј–Њ—В–Є–Њ—Ж–Є–∞–љ–∞—В) –Є–ї–Є –і–≤–Њ–є–љ–Њ–є –Љ–µ—В–Ї–Њ–є FITC/PE (—Д–Є–Ї–Њ—Н—А–Є—В—А–Є–љ), –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ—А–µ–≥—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ –Є–љ–і–µ–Ї—Б–∞ CD4/CD8 –Є —Г–і–∞–ї–µ–љ–Є–µ–Љ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –ї–Є–Ј–Є—А—Г—О—Й–Є–Љ –±—Г—Д–µ—А–Њ–Љ. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –і–ї—П –Є–і–µ–љ—В–Є—Д–Є–Ї–∞—Ж–Є–Є —Б—Г–±–њ–Њ–њ—Г–ї—П—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–≤ –Є–ї–Є –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤, —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г—О—Й–Є—Е —А–∞–Ј–ї–Є—З–љ—Л–µ –Љ–∞—А–Ї–µ—А—Л, –Љ–µ—З–µ–љ–љ—Л–µ FITC, «–Њ–Ї—А–∞—И–Є–≤–∞–ї–Є» –Є—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–Љ–Є –Љ–Њ–љ–Р–Ґ CD66B –Є–ї–Є CD14, –Љ–µ—З–µ–љ–љ—Л–Љ–Є –†–Х.
–Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —Д–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Д–Њ—А–Љ—Г–ї—Г –Ї—А–Њ–≤–Є –Є –Њ–њ—А–µ–і–µ–ї—П–ї–Є –Є–љ–і–µ–Ї—Б—Л —Б–і–≤–Є–≥–∞ (–Ш–°) –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ –Ї—А–Њ–≤–Є (–Ш–°–Ы–Ъ) –Є –ї–µ–є–Ї–Њ—Ж–Є—В–∞—А–љ—Л–є –Є–љ–і–µ–Ї—Б –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є (–Ы–Ш–Ш).
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–У—А—Г–њ–њ–∞ —Б –Њ–ґ–Њ–≥–Њ–≤—Л–Љ —Б–µ–њ—Б–Є—Б–Њ–Љ
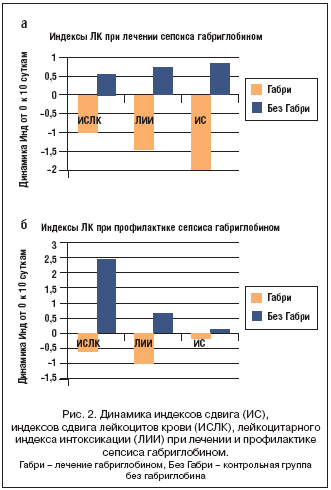
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –≤ –Є—Б—Е–Њ–і–љ—Л–є –њ–µ—А–Є–Њ–і —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е —Б –Њ–ґ–Њ–≥–Њ–≤—Л–Љ —Б–µ–њ—Б–Є—Б–Њ–Љ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —А–µ–Ј–Ї–Є–є –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј –Њ—В 13,2 –і–Њ 23,8 –Љ–ї—А–і/–ї (—Е=15,5 –Љ–ї—А–і/–ї) –Є –њ–∞–ї–Њ—З–Ї–Њ—П–і–µ—А–љ—Л–є (–њ/—П) —Б–і–≤–Є–≥ —Д–Њ—А–Љ—Г–ї—Л –Ї—А–Њ–≤–Є –≤–ї–µ–≤–Њ –і–Њ 22,5%, –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ы–Ш–Ш –≤ 3–8 —А–∞–Ј –≤—Л—И–µ –љ–Њ—А–Љ—Л. –Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ —Б –ї–µ—З–µ–љ–Є–µ–Љ —Б–µ–њ—Б–Є—Б–∞ –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ –±—Л—Б—В—А–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —Б–і–≤–Є–≥–∞ —Д–Њ—А–Љ—Г–ї—Л –Ї—А–Њ–≤–Є –≤–ї–µ–≤–Њ –Є –Ы–Ш–Ш, —В.–µ. –њ—А–µ–њ–∞—А–∞—В –≤—Л–Ј—Л–≤–∞–ї —Б–љ–Є–ґ–µ–љ–Є–µ –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (—А–Є—Б. 1, 2).
–Э–∞ —А–Є—Б—Г–љ–Ї–µ 1 –≤–Є–і–љ–Њ —З–µ—В–Ї–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–і–≤–Є–≥–∞ —Д–Њ—А–Љ—Г–ї—Л –Ї—А–Њ–≤–Є –≤–ї–µ–≤–Њ –њ–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –љ–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –њ–∞–ї–Њ—З–Ї–Њ—П–і–µ—А–љ—Л—Е –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–≤, –Њ—В—А–∞–ґ–∞—О—Й–µ–≥–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤ –Є—Б—Е–Њ–і–љ—Л–є –њ–µ—А–Є–Њ–і –±–Њ–ї—М–љ—Л—Е —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ –њ–∞–ї–Њ—З–Ї–Њ—П–і–µ—А–љ—Л—Е –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–≤ –Є –Є—Е –љ–µ—Г–Ї–ї–Њ–љ–љ–Њ–µ –љ–∞—А–∞—Б—В–∞–љ–Є–µ –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –Ї–Є–љ–µ—В–Є–Ї–∞ –±—Л–ї–∞ –Њ–±—А–∞—В–љ–Њ–є – –≤ –Є—Б—Е–Њ–і–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –љ–µ–±–Њ–ї—М—И–Њ–µ —З–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –њ–∞–ї–Њ—З–Ї–Њ—П–і–µ—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –љ–Њ –і–∞–ї–µ–µ –±–Њ–ї—М–љ—Л–µ —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ —Н—В–Є—Е –Ї–ї–µ—В–Њ–Ї –љ–µ –Њ—Б—В–∞–ї–Њ—Б—М, —В.–Ї. —Г –≤—Б–µ—Е –Њ—В–Љ–µ—З–∞–ї—Б—П –Є—Е –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М.
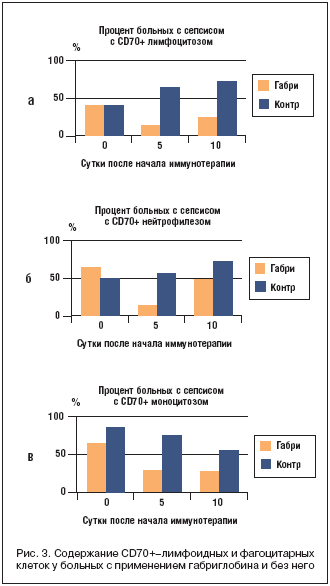
–°–љ–Є–ґ–µ–љ–Є–µ –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ —В–µ—А–∞–њ–Є–Є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ –≤—Л—П–≤–ї–µ–љ–Њ –Є –љ–∞ –њ—А–Є–Љ–µ—А–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —В—А–µ—Е —В–Є–њ–Њ–≤ –Ї–ї–µ—В–Њ–Ї —Б —Н–Ї—Б–њ—А–µ—Б—Б–Є–µ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Љ–∞—А–Ї–µ—А–∞ CD70+, –≤—Е–Њ–і—П—Й–µ–≥–Њ –≤ —Б—Г–њ–µ—А—Б–µ–Љ–µ–є—Б—В–≤–Њ —Д–∞–Ї—В–Њ—А–Њ–≤ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є – –Њ–љ–Њ —А–µ–Ј–Ї–Њ —Б–љ–Є–ґ–∞–ї–Њ—Б—М –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –Є –±—Л–ї–Њ –љ–∞–Љ–љ–Њ–≥–Њ –≤—Л—И–µ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–µ–њ—Б–Є—Б–Њ–Љ, –љ–µ –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ (—А–Є—Б. 3).
–°–љ–Є–ґ–µ–љ–Є–µ –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (—А–Є—Б. 4–∞) –Њ—В–Љ–µ—З–µ–љ–Њ –Є –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–≤ —Б —Н–Ї—Б–њ—А–µ—Б—Б–Є–µ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Љ–∞—А–Ї–µ—А–∞ CD64+: —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е —Б –Њ–ґ–Њ–≥–Њ–≤—Л–Љ —Б–µ–њ—Б–Є—Б–Њ–Љ –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ –љ–∞—А–∞—Б—В–∞–љ–Є–µ CD64+––≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–≤ –≤ —Б—А–µ–і–љ–µ–Љ (—Б—А–µ–і–љ–µ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ (%) —Н—В–Є—Е –Ї–ї–µ—В–Њ–Ї –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е – —Е=94,2%), –њ—А–Є—З–µ–Љ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Н—В–Њ–≥–Њ –Љ–∞—А–Ї–µ—А–∞ (—Е=75%), —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –Њ–љ –±—Л–ї –≤—Л—И–µ (—Е=88,7%; —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ CD64+––≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–≤ —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ї—О–і–µ–є —Б–Њ—Б—В–∞–≤–ї—П–µ—В <16%).
–Ю—З–µ–љ—М –≤–∞–ґ–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ —Г—Б—В—А–∞–љ—П–ї–Њ –Є–ї–Є –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞–ї–Њ –≥–ї—Г–±–Њ–Ї–Є–є –і–µ—Д–Є—Ж–Є—В —А—П–і–∞ –Є–Љ–Љ—Г–љ–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л. –£ 70% –Њ–±—Й–µ–є –≥—А—Г–њ–њ—Л –±–Њ–ї—М–љ—Л—Е —Б —Б–µ–њ—Б–Є—Б–Њ–Љ –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –≥–ї—Г–±–Њ–Ї–∞—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–∞—П –ї–Є–Љ—Д–Њ–њ–µ–љ–Є—П (—Б—А–µ–і–љ–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Е=8% –Њ–±—Й–Є—Е –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤), –Ї–Њ—В–Њ—А–∞—П —Г 30% –±–Њ–ї—М–љ—Л—Е —Б–Њ—З–µ—В–∞–ї–∞—Б—М —Б –∞–±—Б–Њ–ї—О—В–љ–Њ–є. –Я–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ —Г 61,5% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ–Є–Ј–Њ—И–ї–∞ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–µ–є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ, – —Г 75% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј —Н—В–Њ–є –≥—А—Г–њ–њ—Л —Б–Њ—Е—А–∞–љ—П–ї–∞—Б—М –≥–ї—Г–±–Њ–Ї–∞—П –ї–Є–Љ—Д–Њ–њ–µ–љ–Є—П (—А–Є—Б. 5–∞).
–Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ —А–µ–Ј–Ї–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —З–Є—Б–ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л—Е –Ї–Є–ї–ї–µ—А–Њ–≤ (—А–Є—Б. 5–≤), –Ї–Њ—В–Њ—А—Л—Е –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –±—Л–ї–Њ –≤ 3,6 —А–∞–Ј–∞ –±–Њ–ї—М—И–µ. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –њ–Њ—Б–ї–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ —А–µ–Ј–Ї–Њ —Б–љ–Є–ґ–∞–ї–Њ—Б—М —З–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≥–ї—Г–±–Њ–Ї–Є–Љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ –Ї–Є–ї–ї–µ—А–љ—Л—Е —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –≤–њ–ї–Њ—В—М –і–Њ –Є—Е –њ–Њ–ї–љ–Њ–≥–Њ –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—П –Ї 11 —Б—Г—В. –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е –±—Л–ї–Њ –љ–∞–Љ–љ–Њ–≥–Њ –±–Њ–ї—М—И–µ (—А–Є—Б. 5–≥).
–£ —А—П–і–∞ –±–Њ–ї—М–љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е —Б–Њ—Е—А–∞–љ—П–ї—Б—П –і–µ—Д–Є—Ж–Є—В –Ґ––Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ (–Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В—Л, –Ґ–—Е–µ–ї–њ–µ—А—Л, —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В—Л), –Њ—В–Љ–µ—З–∞–ї—Б—П –ї–µ—В–∞–ї—М–љ—Л–є –Є—Б—Е–Њ–і.
–Ю—В–Љ–µ—В–Є–Љ, —З—В–Њ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б —Б–µ–њ—Б–Є—Б–Њ–Љ –≤ –Є—Б—Е–Њ–і–љ—Л–є –њ–µ—А–Є–Њ–і —Г 53% –Њ—В–Љ–µ—З–∞–ї—Б—П –≥–ї—Г–±–Њ–Ї–Є–є –і–µ—Д–Є—Ж–Є—В HLA–DR+ –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–є –њ–Њ—Б–ї–µ –Є–Љ–Љ—Г–љ–Њ–Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є–ї—Б—П —Г 75% –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ —Б–љ–Є–ґ–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤ c —Н–Ї—Б–њ—А–µ—Б—Б–Є–µ–є HLA–DR –љ–∞–±–ї—О–і–∞–ї—Б—П —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е —Б —В–µ—А–Љ–Њ–Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–є —В—А–∞–≤–Љ–Њ–є, —З—В–Њ, –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ, —Г—Б—Г–≥—Г–±–ї—П–ї–Њ —В—П–ґ–µ—Б—В—М —Б–Њ—Б—В–Њ—П–љ–Є—П, –њ—А–Є—З–µ–Љ —Б–љ–Є–ґ–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М —Н—В–Њ–≥–Њ –Љ–∞—А–Ї–µ—А–∞ –±—Л–ї —Г 60 –Є 50% –±–Њ–ї—М–љ—Л—Е, —Г–Љ–µ—А—И–Є—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –≤ –Њ–њ—Л—В–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–∞—Е, —З—В–Њ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Њ –Є—Е –Ї—А–∞–є–љ–µ —В—П–ґ–µ–ї–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј.
–Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –і–Њ –љ–∞—З–∞–ї–∞ –≤–≤–µ–і–µ–љ–Є—П –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ —Г 80% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–∞–ї—Б—П –≥–ї—Г–±–Њ–Ї–Є–є –і–µ—Д–Є—Ж–Є—В IgG (—Е=3,98 –≥/–ї), –њ—А–Є—З–µ–Љ –±–Њ–ї–µ–µ –≥–ї—Г–±–Њ–Ї–Є–є —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–Њ—З–µ—В–∞–љ–љ—Л–Љ —В–µ—А–Љ–Њ–Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ, —В–Њ –ґ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –Є —Г –њ–Њ–≥–Є–±—И–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—А–Є—Б. 5–±). –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П IgG –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –ї–Є—И—М —Г 14%, –∞ –Ї –Ї–Њ–љ—Ж—Г –љ–∞–±–ї—О–і–µ–љ–Є—П –Њ–љ–Њ —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–Њ—Б—М —Г–ґ–µ —Г 43% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є—З–µ–Љ –Њ—З–µ–љ—М –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М IgG –Њ—В–Љ–µ—З–∞–ї—Б—П —Г 75% —Г–Љ–µ—А—И–Є—Е –±–Њ–ї—М–љ—Л—Е. –Ъ–Є–љ–µ—В–Є–Ї–∞ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П IgG –±—Л–ї–∞ —Б–Њ–≤–µ—А—И–µ–љ–љ–Њ —А–∞–Ј–љ–Њ–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ. –Ґ–∞–Ї, –µ—Б–ї–Є –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ, –њ—А–Њ—Ж–µ–љ—В –±–Њ–ї—М–љ—Л—Е —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ IgG –љ–µ—Г–Ї–ї–Њ–љ–љ–Њ –њ–Њ–≤—Л—И–∞–ї—Б—П, —В–Њ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ –Њ–љ —А–µ–Ј–Ї–Њ —Б–љ–Є–ґ–∞–ї—Б—П, –Є —Н—В–Њ –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –≤ –Є—Б—Е–Њ–і–љ—Л–є –њ–µ—А–Є–Њ–і —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л —З–Є—Б–ї–Њ –±–Њ–ї—М–љ—Л—Е —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ IgG –±—Л–ї–Њ –љ–∞–Љ–љ–Њ–≥–Њ –≤—Л—И–µ, —З–µ–Љ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є (–≤ 5,6 —А–∞–Ј–∞). –≠—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В–Њ–Љ, —З—В–Њ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Њ –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –±–Њ–ї–µ–µ —В—П–ґ–µ–ї–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–љ—В—А–Њ–ї—П.
–У—А—Г–њ–њ–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≥–µ–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є
–Ъ—А–Є—В–µ—А–Є—П–Љ–Є –≤–Ї–ї—О—З–µ–љ–Є—П –≤ —В–µ—А–∞–њ–Є—О –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ —Г —Н—В–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–ї—Г–ґ–Є–ї–Є: –њ–Њ—П–≤–ї–µ–љ–Є–µ –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј–∞ —Б–Њ —Б–і–≤–Є–≥–Њ–Љ –ї–µ–є–Ї–Њ—Д–Њ—А–Љ—Г–ї—Л –≤–ї–µ–≤–Њ –і–Њ –њ–∞–ї–Њ—З–Ї–Њ—П–і–µ—А–љ—Л—Е –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤, –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–∞—П –ї–Є–Љ—Д–Њ–њ–µ–љ–Є—П (—Е=11,3%), –њ–Њ–≤—Л—И–µ–љ–Є–µ –Љ–∞—А–Ї–µ—А–∞ CD64 –Њ—В 34 –і–Њ 99,8% (—Е=72,4%) —Г 93,2% –±–Њ–ї—М–љ—Л—Е, —А–µ–Ј–Ї–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П IgG (—Е=3,2 –≥/–ї), –∞–Ї—В–Є–≤–∞—Ж–Є—П –Ї–Є—Б–ї–Њ—А–Њ–і–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ —Г –њ–Њ–і–∞–≤–ї—П—О—Й–µ–≥–Њ —З–Є—Б–ї–∞ –±–Њ–ї—М–љ—Л—Е –і–Њ 19,35 – 40 –Љ–Т/100—Д–∞–≥–Њ—Ж–Є—В–Њ–≤ (—Е=24,65 –Ь–≤/100 —Д–∞–≥–Њ—Ж–Є—В–Њ–≤), —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–Є—П –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П.
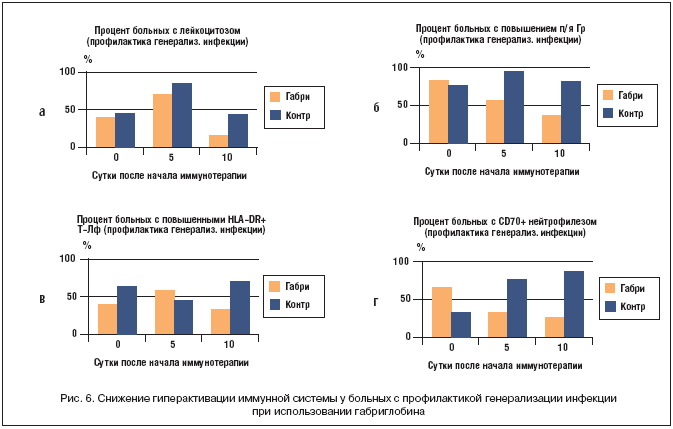
–Т –≥—А—Г–њ–њ–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≥–µ–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ —Б–Њ —Б—А–µ–і–љ–Є–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ –≤ –≥—А—Г–њ–њ–µ —Б 11,83 –і–Њ 8,38 –Љ–ї—А–і/–ї, –∞ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ (—Б—А–µ–і–љ–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ –≥—А—Г–њ–њ–µ) –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–Њ—Е—А–∞–љ—П–ї—Б—П –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј (—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ —Е=12,87 –Є 10,42 –Љ–ї—А–і/–ї), –њ—А–Є—З–µ–Љ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –Ї 10 —Б—Г—В. —Б—А–µ–і–Є –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е –±—Л–ї–Њ –ї–Є—И—М 10% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј–Њ–Љ, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≤ —В–Њ—В –ґ–µ —Б—А–Њ–Ї – 43% (—А–Є—Б. 6–∞). –У–∞–±—А–Є–≥–ї–Њ–±–Є–љ –≤—Л–Ј–≤–∞–ї –±–Њ–ї–µ–µ –±—Л—Б—В—А–Њ–µ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –љ–µ–є—В—А–Њ—Д–Є–ї—М–љ–Њ–≥–Њ —Б–і–≤–Є–≥–∞ –≤–ї–µ–≤–Њ —Б 9,6 –і–Њ 5,8%, –≤ –Ї–Њ–љ—В—А–Њ–ї–µ –Њ–љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Є–Ј–Љ–µ–љ–Є–ї—Б—П, —Б–Њ—Б—В–∞–≤–ї—П—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ —Е=12,27 –Є 10,83%, –њ—А–Є—З–µ–Љ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е –љ–∞ 10––µ —Б—Г—В. —Б —А–µ–Ј–Ї–Є–Љ —Б–і–≤–Є–≥–Њ–Љ –±—Л–ї–Њ 40%, –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є – 87% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—А–Є—Б. 6–±). –Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ 5 —Б—Г—В. –њ–Њ–і—А—П–і, —Б–љ–Є–ґ–µ–љ–Є–µ —Б—А–µ–і–љ–µ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–≤ –њ–Њ –≥—А—Г–њ–њ–µ —Б –Љ–∞—А–Ї–µ—А–Њ–Љ CD64+ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Б –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Б—А–Њ–Ї–∞ –і–Њ 10 —Б—Г—В. –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П —Б 72,74 –і–Њ 49,33% CD64+– –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–≤, –∞ –≤ –≥—А—Г–њ–њ–µ –±–µ–Ј –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –Є—Е —Б—А–µ–і–љ–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ (–њ–Њ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е) –Њ—Б—В–∞–≤–∞–ї–Њ—Б—М –≤ —Н—В–Є –ґ–µ —Б—А–Њ–Ї–Є –≤—Л—Б–Њ–Ї–Є–Љ (—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ —Е=50,02 –Є 60,02%), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —З–Є—Б–ї–Њ –±–Њ–ї—М–љ—Л—Е —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ CD64+––≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–≤ –љ–∞ 5––µ —Б—Г—В. –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–µ–њ—Б–Є—Б–∞ —Б–Њ—Б—В–∞–≤–Є–ї–Њ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–∞—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 57 –Є 100% (—А–Є—Б. 4–±).
–Т –≥—А—Г–њ–њ–µ —Б –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Њ–є –≥–µ–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ —В–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–µ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –≥—А—Г–њ–њ–Њ–є –Ї–Њ–љ—В—А–Њ–ї—П, –≤ –Ї–Њ—В–Њ—А–Њ–є –њ–∞—Ж–Є–µ–љ—В—Л –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є –Є–Љ–Љ—Г–љ–Њ–Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ. –Э–∞ 5––µ —Б—Г—В. –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Ї—Г—А—Б–∞ –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ (10––µ —Б—Г—В. –Њ—В –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є) –≤ –Њ–њ—Л—В–љ–Њ–є –≥—А—Г–њ–њ–µ –±—Л–ї–Њ 40% –±–Њ–ї—М–љ—Л—Е —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ HLA–DR+ –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –≥—А—Г–њ–њ–µ –±–µ–Ј –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –Є—Е –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М 76%, –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є CD70+––љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ —Н—В–Є —Ж–Є—Д—А—Л —Б–Њ—Б—В–∞–≤–Є–ї–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 33 –Є 88% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—А–Є—Б. 6 –≤, –≥).
–Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ —Б —Н–Ї—Б–њ—А–µ—Б—Б–Є–µ–є —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ш–Ы–2 (CD25+ –Ї–ї–µ—В–Ї–Є), –Ї–Њ—В–Њ—А—Л–µ –Њ—В—А–∞–ґ–∞—О—В –∞–Ї—В–Є–≤–∞—Ж–Є—О –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ–Њ –Ґ—Е1––Ї–ї–µ—В–Њ—З–љ–Њ–Љ—Г —В–Є–њ—Г –Є, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –Љ–Њ–≥—Г—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М—Б—П –Ї–∞–Ї –њ–Њ–Ј–Є—В–Є–≤–љ–∞—П –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–∞—П —А–µ–∞–Ї—Ж–Є—П –њ—А–Њ—В–Є–≤–Њ–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –Ј–∞—Й–Є—В—Л –≤ —Г—Б–ї–Њ–≤–Є—П—Е –і–µ—Д–Є—Ж–Є—В–∞ –≥—Г–Љ–Њ—А–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, —В–∞–Ї–ґ–µ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г 39% –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ, –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є –±–Њ–ї—М–љ—Л—Е –±–µ–Ј –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є, –≥–і–µ —В–∞–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Њ –ї–Є—И—М 12% (—А–Є—Б. 4–≤).
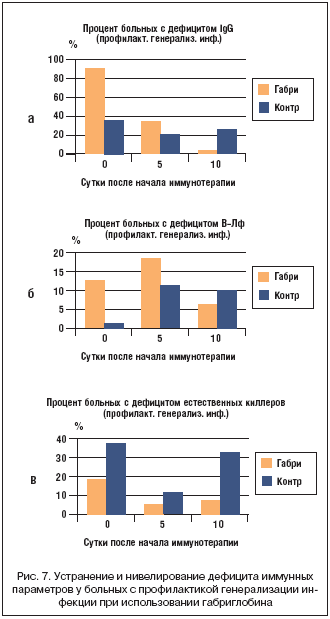
–Ъ–∞–Ї –Є –≤ –≥—А—Г–њ–њ–µ —Б —Б–µ–њ—Б–Є—Б–Њ–Љ, –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Њ–є –≥–µ–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Є–ї–Є –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ–Љ –і–µ—Д–Є—Ж–Є—В–∞ —А—П–і–∞ –Є–Љ–Љ—Г–љ–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ (—А–Є—Б. 7).
–Э–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М IgG —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≥–µ–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є –≤ –Є—Б—Е–Њ–і–љ—Л–є –њ–µ—А–Є–Њ–і –Є –≤ –Ї–Њ–љ—Ж–µ –љ–∞–±–ї—О–і–µ–љ–Є—П –Њ—В–Љ–µ—З–∞–ї—Б—П —Г 36 –Є 30% –±–Њ–ї—М–љ—Л—Е, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –Є—Б—Е–Њ–і–љ—Л–є –њ–µ—А–Є–Њ–і —Г –±–Њ–ї—М–љ—Л—Е –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –Њ–љ —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї—Б—П —Г 93%, –∞ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ –њ–Њ–ї–љ–Њ—Б—В—М—О –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є–ї—Б—П —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е (—А–Є—Б. 7–∞). –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –µ—Б–ї–Є –і–µ—Д–Є—Ж–Є—В –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л—Е –Ї–Є–ї–ї–µ—А–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є, –њ–Њ–ї—Г—З–∞–≤—И–µ–є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ, –≤ –Є—Б—Е–Њ–і–љ—Л–є –њ–µ—А–Є–Њ–і –Њ—В–Љ–µ—З–∞–ї—Б—П —Г 18% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —В–Њ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –Є—Е –Њ—Б—В–∞–ї–Њ—Б—М –ї–Є—И—М 6,7%, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –±–µ–Ј –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є —Н—В–Є –ґ–µ —Ж–Є—Д—А—Л –≤ —В–µ –ґ–µ —Б—А–Њ–Ї–Є —Б–Њ—Б—В–∞–≤–Є–ї–Є 39 –Є 35% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—А–Є—Б. 7–≤). –Т –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ —В–∞–Ї–ґ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –і–µ—Д–Є—Ж–Є—В–∞ –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –≥—А—Г–њ–њ–Њ–є –Ї–Њ–љ—В—А–Њ–ї—П –±–µ–Ј –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ (—А–Є—Б. 7–±).
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞
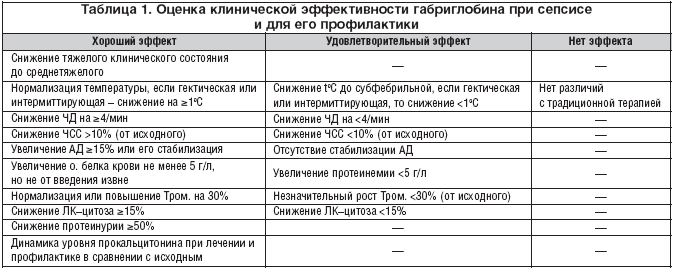
–Я—А–Є –Њ—Ж–µ–љ–Ї–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –Љ—Л –њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–µ–є —И–Ї–∞–ї—Л, —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ–Њ–є –і–ї—П —Б–µ–њ—Б–Є—Б–∞ –Є –≥–љ–Њ–є–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є [9] (—В–∞–±–ї. 1).
–£—З–Є—В—Л–≤–∞–ї–Є —Б—Г–Љ–Љ–∞—А–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М (—Е–Њ—А–Њ—И–Є–є –Є —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В) –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Н—Д—Д–µ–Ї—В–∞. –†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 8. –Ю–љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В (—А–Є—Б. 8–∞), —З—В–Њ –њ–Њ –≤—Б–µ–Љ 11 –Ї–ї–Є–љ–Є–Ї–Њ––ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –њ–Њ —Б—Г–Љ–Љ–∞—А–љ–Њ–є «—Е–Њ—А–Њ—И–µ–є –Є —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є» (–Є–Ј–Љ–µ–љ–µ–љ–Є—П —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј–∞, –њ—Г–ї—М—Б–∞ –Є —З–∞—Б—В–Њ—В—Л –і—Л—Е–∞–љ–Є—П, –Р–Ф, –Њ–±—Й–µ–≥–Њ –±–µ–ї–Ї–∞, –њ—А–Њ–Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–∞ –Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, –њ—А–Њ—В–µ–Є–љ—Г—А–Є–Є, –°–Ю–≠ –Є –њ–Њ–Ј–Є—В–Є–≤–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П) (—В–∞–±–ї. 1) –±—Л–ї–∞ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–∞—П —А–∞–Ј–љ–Є—Ж–∞ –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–Є–≤—И–Є—Е –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ –Є –љ–µ –њ–Њ–ї—Г—З–Є–≤—И–Є—Е –µ–≥–Њ. –Т –њ–µ—А–≤–Њ–Љ —Б–ї—Г—З–∞–µ 79% –±–Њ–ї—М–љ—Л—Е —Б —Б–µ–њ—Б–Є—Б–Њ–Љ –љ–∞ –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є—О –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ –Њ—В—А–µ–∞–≥–Є—А–Њ–≤–∞–ї–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤–Њ –≤—В–Њ—А–Њ–Љ –љ–∞ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –±–µ–Ј –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ – –ї–Є—И—М 32%; –≤–Њ–≤—Б–µ –љ–µ –Њ—В–≤–µ—В–Є–ї–Є –љ–∞ –ї–µ—З–µ–љ–Є–µ 21% –±–Њ–ї—М–љ—Л—Е –≤ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ –Є 68% –≤–Њ –≤—В–Њ—А–Њ–є, —В.–µ. —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є–Љ–Љ—Г–љ–Њ–Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ –њ—А–Є —Б–µ–њ—Б–Є—Б–µ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 79%. –Х—Б–ї–Є –Њ—В–Њ–±—А–∞—В—М 8 –љ–∞–Є–±–Њ–ї–µ–µ —З–µ—В–Ї–Њ –Є–Ј–Љ–µ–љ—П—О—Й–Є—Е—Б—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є (–Ї—А–Њ–Љ–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –Є –њ—А–Њ–Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–∞), —В–Њ —А–∞–Ј–љ–Є—Ж–∞ –Њ–Ї–∞–ґ–µ—В—Б—П –µ—Й–µ –±–Њ–ї–µ–µ –≤–љ—Г—И–Є—В–µ–ї—М–љ–Њ–є – —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –≤ —В–∞–Ї–Њ–Љ —Б–ї—Г—З–∞–µ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 75%, –∞ –њ—А–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є – –ї–Є—И—М 25%, –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Н—Д—Д–µ–Ї—В–∞ –Њ—В–Љ–µ—З–µ–љ–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ —Г 25 –Є 81% –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ш –і–∞–ї–µ–µ, –µ—Б–ї–Є –µ—Й–µ —Г–Љ–µ–љ—М—И–Є—В—М —З–Є—Б–ї–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –і–Њ 6 (—В–µ–Љ–њ–µ—А–∞—В—Г—А–∞, –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј, —З–∞—Б—В–Њ—В–∞ –і—Л—Е–∞–љ–Є—П, –Њ–±—Й–Є–є –±–µ–ї–Њ–Ї, –њ—А–Њ—В–µ–Є–љ—Г—А–Є—П –Є –Њ–±—Й–µ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ), —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ —Б–Њ—Б—В–∞–≤–Є—В 77%, –∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є – –ї–Є—И—М 9%.
–Ф–Њ—Б—В–∞—В–Њ—З–љ–Њ –±–ї–Є–Ј–Ї–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–ї—Г—З–µ–љ—Л –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≥–µ–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є (—А–Є—Б. 8–±). –Ю–±—Й–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞, –Њ—Ж–µ–љ–µ–љ–љ–∞—П –њ–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ (—В–∞–±–ї. 1 – «—Е–Њ—А–Њ—И–Є–є —Н—Д—Д–µ–Ї—В + —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В») —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј–∞, –њ—Г–ї—М—Б–∞ –Є —З–∞—Б—В–Њ—В—Л –і—Л—Е–∞–љ–Є—П, –Њ–±—Й–µ–≥–Њ –±–µ–ї–Ї–∞, –њ–Њ —Г–ї—Г—З—И–µ–љ–Є—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є –°–Ю–≠, —Б–Њ—Б—В–∞–≤–Є–ї–∞ 72%, –Њ–і–љ–Њ–є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є – 37%; —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –≤ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ —Г 28%, –∞ –≤–Њ –≤—В–Њ—А–Њ–є (–љ–µ –њ–Њ–ї—Г—З–∞–≤—И–µ–є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ) – —Г 63% –±–Њ–ї—М–љ—Л—Е.
–Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –≤ –≥—А—Г–њ–њ–∞—Е —Б –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ –Є –±–µ–Ј –љ–µ–≥–Њ –њ—А–Є —А–∞—Б—З–µ—В–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ —В–Њ–ї—М–Ї–Њ –њ–Њ —Б–љ–Є–ґ–µ–љ–Є—О –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј–∞ –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –≤—Л—П–≤–Є–ї–Њ —Б—Г–Љ–Љ–∞—А–љ–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 83 –Є 20% —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤ —Н—В–Є—Е –≥—А—Г–њ–њ–∞—Е. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–µ–њ—Б–Є—Б–∞ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ –њ–Њ –≤—Б–µ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –≤ —Б—А–µ–і–љ–µ–Љ –≤ 72% —Б–ї—Г—З–∞–µ–≤ (—А–∞—Б—З–µ—В –њ—А–Њ—Ж–µ–љ—В–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —П–≤–ї—П–µ—В—Б—П —Б—А–µ–і–љ–Є–Љ —З–Є—Б–ї–Њ–Љ, –≤—Л—З–Є—Б–ї–µ–љ–љ—Л–Љ –Є–Ј —Б—Г–Љ–Љ—Л –њ—А–Њ—Ж–µ–љ—В–Њ–≤ –±–Њ–ї—М–љ—Л—Е –≤ –≥—А—Г–њ–њ–∞—Е, –Є–Љ–µ—О—Й–Є—Е –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П (–Є—Б—Е–Њ–і—П –Є–Ј —В–∞–±–ї–Є—Ж—Л 1) – –њ–Њ –Ї–∞–ґ–і–Њ–Љ—Г –Є–Ј 11 –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≤ –≥—А—Г–њ–њ–µ –ї–µ—З–µ–љ–Є—П —Б–µ–њ—Б–Є—Б–∞ (—А–Є—Б. 8–∞) –Є–ї–Є –Є–Ј 7 –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≤ –≥—А—Г–њ–њ–µ –µ–≥–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є (—А–Є—Б. 8–±).
–≠—В–Њ —З–µ—В–Ї–Њ –≤–Є–і–љ–Њ –Є –њ–Њ –Є–љ–і–µ–Ї—Б–∞–Љ —Б–і–≤–Є–≥–∞ –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ –Ї—А–Њ–≤–Є (—А–Є—Б. 2), –Њ—В—А–∞–ґ–∞—О—Й–Є–Љ —Н–љ–і–Њ–≥–µ–љ–љ—Г—О –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є—О –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Т —Б–ї—Г—З–∞—П—Е –ї–µ—З–µ–љ–Є—П —Б–µ–њ—Б–Є—Б–∞ –Є–ї–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≥–µ–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є —Н—Д—Д–µ–Ї—В –±—Л–ї –∞–±—Б–Њ–ї—О—В–љ–Њ –Њ—З–µ–≤–Є–і–µ–љ – –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Ј–љ–∞—З–µ–љ–Є–є –≤—Б–µ—Е –Є–љ–і–µ–Ї—Б–Њ–≤ (–Ш–°, –Ш–°–Ы–Ъ –Є –Ы–Ш–Ш) –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ (–љ–∞ —А–Є—Б—Г–љ–Ї–µ –і–∞–љ—Л —Г—Б–ї–Њ–≤–љ–Њ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П), —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –≥—А—Г–њ–њ–∞—Е —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є —А–µ–∞–ї–Є–Ј–Њ–≤–∞–ї–∞—Б—М –Є–љ–∞—П —В–µ–љ–і–µ–љ—Ж–Є—П – –љ–µ–Є–Ј–Љ–µ–љ–љ–Њ–µ –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ (–љ–∞ —А–Є—Б—Г–љ–Ї–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П) –≤—Б–µ—Е –Є–љ–і–µ–Ї—Б–Њ–≤ (—А–Є—Б. 2–∞, –±) –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Є—Б—Е–Њ–і–љ—Л–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П —Б–µ–њ—Б–Є—Б–∞ –Є–ї–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≥–µ–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ–ґ–Њ–≥–∞–Љ–Є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –≥—А—Г–њ–њ–Њ–є –Ї–Њ–љ—В—А–Њ–ї—П –±–µ–Ј –≤–Ї–ї—О—З–µ–љ–Є—П —Н—В–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –±—Л—Б—В—А–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —Б–і–≤–Є–≥–∞ —Д–Њ—А–Љ—Г–ї—Л –Ї—А–Њ–≤–Є –≤–ї–µ–≤–Њ, —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–∞—А–Ї–µ—А–Њ–≤ –Є–Љ–Љ—Г–љ–љ–Њ–є –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–∞—Ж–Є–Є (02––Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ —Д–∞–≥–Њ—Ж–Є—В–Њ–≤, –Ї–ї–µ—В–Ї–Є —Б –Љ–∞—А–Ї–µ—А–∞–Љ–Є CD70+, CD64+, HLA–DR+ –Ґ––Ы—Д), —Б–љ–Є–ґ–∞–µ—В –Є–ї–Є —Г—Б—В—А–∞–љ—П–µ—В –і–µ—Д–Є—Ж–Є—В –Њ–±—Й–Є—Е –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, IgG, B––Ї–ї–µ—В–Њ–Ї –Є –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л—Е –Ї–Є–ї–ї–µ—А–Њ–≤, —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, —В.–µ. –Ї–Є–ї–ї–µ—А–љ–Њ–≥–Њ –Є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞. –≠—В–Є –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В, —З—В–Њ –Є–Љ–Љ—Г–љ–Њ–Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ, –љ–µ —В–Њ–ї—М–Ї–Њ –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—П –Є—Б—Е–Њ–і–љ—Л–є –і–µ—Д–Є—Ж–Є—В IgG, –љ–Њ –Є –љ–Њ—А–Љ–∞–ї–Є–Ј—Г—П –і–µ—Д–Є—Ж–Є—В –Є–ї–Є –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–∞—Ж–Є—О —Ж–µ–ї–Њ–≥–Њ —А—П–і–∞ –Ї–ї—О—З–µ–≤—Л—Е –Є–Љ–Љ—Г–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, —В–µ—А–∞–њ–Є—П –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–Њ–Љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П —В–∞–Ї–ґ–µ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –њ—А–Є –Њ—Ж–µ–љ–Ї–µ –њ–Њ –Ї–ї–Є–љ–Є–Ї–Њ––ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –і–∞–љ–љ—Л–Љ –Њ–ґ–Њ–≥–Њ–≤–Њ–≥–Њ —Б–µ–њ—Б–Є—Б–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є (–≤ —Б—А–µ–і–љ–µ–Љ –≤ 79%), –∞ –њ—А–Є –µ–≥–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ – –≤ —Б—А–µ–і–љ–µ–Љ –≤ 72% –љ–∞–±–ї—О–і–µ–љ–Є–є, –Њ–љ–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–∞—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–є –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є, —В–Њ–≥–і–∞ –Ї–∞–Ї —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –±–µ–Ј –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ —Г—Б–Є–ї–Є–≤–∞–ї–∞ –µ–µ, —З—В–Њ –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –њ–Њ –і–Є–љ–∞–Љ–Є–Ї–µ –Ј–љ–∞—З–µ–љ–Є–є –Ш–°–Ы–Ъ, –Ы–Ш–Ш, –Ш–° (—А–Є—Б. 2–∞, –±).




–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Р–ї–µ–Ї—Б–µ–µ–≤ –Р.–Р., –Ъ—А—Г—В–Є–Ї–Њ–≤ –Ь.–У., –ѓ–Ї–Њ–≤–ї–µ–≤ –Т.–Я., –Ю–ґ–Њ–≥–Њ–≤–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П. – –Ь.: –Т—Г–Ј–Њ–≤—Б–Ї–∞—П –Ї–љ–Є–≥–∞, 2010.
2. –Р–ї—М–µ—Б –Т. –§. –Ь–Њ–і—Г–ї—П—Ж–Є—П –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –њ–µ–љ—В–∞–≥–ї–Њ–±–Є–љ–Њ–Љ –њ—А–Є —Б–Є–љ–і—А–Њ–Љ–µ —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –Є —Б–µ–њ—Б–Є—Б–µ —Г –і–µ—В–µ–є —Б —В—П–ґ–µ–ї–Њ–є —В–µ—А–Љ–Є—З–µ—Б–Ї–Њ–є —В—А–∞–≤–Љ–Њ–є // –Ґ–µ–Ј. –і–Њ–Ї–ї. –Љ–µ–ґ–і. –Ї–Њ–љ—Д. «–Р–Ї—В—Г–∞–ї—М–љ—Л–µ –њ—А–Њ–±–ї–µ–Љ—Л —В–µ—А–Љ–Є—З–µ—Б–Ї–Њ–є —В—А–∞–≤–Љ—Л», –њ–Њ—Б–≤. 70––ї–µ—В–Є—О –Э–Ш–Ш —Б–Ї–Њ—А–Њ–є –њ–Њ–Љ–Њ—Й–Є –Є–Љ. –Ѓ. –Ѓ. –Ф–ґ–∞–љ–µ–ї–Є–і–Ј–µ –Є 55––ї–µ—В–Є—О –Њ–ґ–Њ–≥–Њ–≤–Њ–≥–Њ —Ж–µ–љ—В—А–∞. – –°–Я–±., 2002.– –°. 316–317.
3. –Ч–µ–Љ—Б–Ї–Њ–≤ –Т. –Ь., –С–∞—А—Б—Г–Ї–Њ–≤ –Р. –Р. –Є –і—А. –Ш–Ј—Г—З–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Д–∞–≥–Њ—Ж–Є—В–Њ–≤ —З–µ–ї–Њ–≤–µ–Ї–∞ (–Ї–Є—Б–ї–Њ—А–Њ–і–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Є –њ–Њ–і–≤–Є–ґ–љ–Њ—Б—В—М –Ї–ї–µ—В–Њ–Ї) // –Ь–µ—В–Њ–і–Є—З. —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –Ь–Ч –°–°–°–†. – –Ь.,1988. – 20 —Б.
4. –Ы–µ–±–µ–і–µ–≤ –Ь. –Ѓ., –Т–Є–ї–Ї–Њ–≤ –°. –Р., –Ъ–Њ—А–Њ—В–Ї–Њ–≤–∞ –Ґ. –Т. –Т–ї–Є—П–љ–Є–µ –њ–∞—Б—Б–Є–≤–љ–Њ–є –Є–Љ–Љ—Г–љ–Є–Ј–∞—Ж–Є–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ –≤–≤–µ–і–µ–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ –љ–∞ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≥—Г–Љ–Њ—А–∞–ї—М–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞ —Г —В—П–ґ–µ–ї–Њ–Њ–±–Њ–ґ–ґ–µ–љ–љ—Л—Е // –Ґ–µ–Ј. –і–Њ–Ї–ї. –љ–∞—Г—З. –Ї–Њ–љ—Д. «–Р–Ї—В—Г–∞–ї—М–љ—Л–µ –њ—А–Њ–±–ї–µ–Љ—Л —В—А–∞–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є –Є –Њ—А—В–Њ–њ–µ–і–Є–Є». – –Э. –Э–Њ–≤–≥–Њ—А–Њ–і, 2001.– –°. 200–201.
5. –Я–Є–≤–Њ–≤–∞—А–Њ–≤–∞ –Ы. –Я., –Р—А–Є—Б–Ї–Є–љ–∞ –Ю. –С., –Р—Б—Г—А –Ь. –Т. –Є –і—А. –Ш–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —Б—В–∞—В—Г—Б –Є –µ–≥–Њ –Ї–Њ—А—А–µ–Ї—Ж–Є—П —Г –њ–Њ—Б—В—А–∞–і–∞–≤—И–Є—Е —Б –Њ–ґ–Њ–≥–Њ–≤—Л–Љ —Б–µ–њ—Б–Є—Б–Њ–Љ // –°. –љ–∞—Г—З. —В—А. XIX c—К–µ–Ј–і–∞ —Е–Є—А—Г—А–≥–Њ–≤ –£–Ї—А–∞–Є–љ—Л. – –•–∞—А—М–Ї–Њ–≤, 2000. – –°. 337–338.
6. –Р–ї—С—И–Ї–Є–љ –Т. –Р., –Ы—О—В–Њ–≤ –Р. –У. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ –і–ї—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ / –Я–Њ–і —А–µ–і. –Т. –Р. –Р–ї—С—И–Ї–Є–љ–∞, –Р. –У. –Ы—О—В–Њ–≤–∞: –њ–Њ—Б–Њ–±–Є–µ –і–ї—П –≤—А–∞—З–µ–є. – –Ь., 2006.
7. –Ґ–∞—А–∞–љ –Т. –Ь. –†–∞–љ–љ—П—П –љ–µ–Ї—А—Н–Ї—В–Њ–Љ–Є—П –Ї–∞–Ї –Љ–µ—В–Њ–і –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П —Б–µ–њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Њ–ґ–Њ–≥–∞—Е //2––є –Ї–Њ–љ–≥—А. —Е–Є—А—Г—А–≥–Њ–≤ –£–Ї—А–∞–Є–љ—Л: —Б–±. –љ–∞—Г—З–љ. —В—А. – –Ъ–Є–µ–≤; –Ф–Њ–љ–µ—Ж–Ї, 1998.– –°. 489.
8. –§—С–і–Њ—А–Њ–≤ –Т. –Ф., –Р–ї–µ–Ї—Б–µ–µ–≤ –Р. –Р., –°–Њ–ї–Њ–≥—Г–± –Т. –Ъ., –Ы–∞–≤—А–Њ–≤ –Т. –Р. –Ю—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є–љ—Ж–Є–њ—Л –Є –њ—Г—В–Є —Г–ї—Г—З—И–µ–љ–Є—П –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —В—П–ґ–µ–ї–Њ–Њ–±–Њ–ґ–ґ–µ–љ–љ—Л—Е // –Ґ–µ–Ј. –Ф–Њ–Ї–ї. –Љ–µ–ґ–і. –Ї–Њ–љ—Д. «–Ш–љ—В–µ–љ—Б–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ —В—П–ґ–µ–ї–Њ–Њ–±–Њ–ґ–ґ–µ–љ–љ—Л—Е».– –Ь., 1992.– –°. 35–38.
9. –І–µ–ї—П–±–Є–љ—Б–Ї–∞—П –У–Њ—А–±–Њ–ї—М–љ–Є—Ж–∞ вДЦ1. –Ю—В—З—С—В –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≥–∞–±—А–Є–≥–ї–Њ–±–Є–љ–∞ –њ—А–Є —Б–µ–њ—Б–Є—Б–µ –Є –µ–≥–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ. Internet, 2011.
10. Allgower M., Schoenenberger G. A., Sparkes B. G. Burning the largest immune organ // Burns.– 1995. – Vol.21.(Suppl.1.). – –†. 45–47.
11. Diem E. Infections in burns // 7th Eur. congr. of clinical microbiology and infectious diseases: Abstr. Vienna, 1995. ––†. 15.
12. Herek O., Ozturkk H., Ozyurt M. et al. Effects of treatment with immunoglobulin on bacterial translocation in burn wound infection // Ann. Burns Fire Disasters. – 2000. – Vol. XIII. N 1. Internet.












