
Введение
Колоректальный рак — одно из самых распространенных злокачественных заболеваний, занимающее 3-е место по числу впервые выявленных случаев и 2-е — по смертности [1].
Хирургия рака прямой кишки значительно продвинулась за последние несколько десятилетий с момента введения тотальной мезоректумэктомии (ТМЭ), предложенной Биллом Хилдом в 1982 г., которая сейчас является «золотым стандартом» лечения во всем мире [2].
Малоинвазивная хирургия, в частности лапароскопия, стала новым витком развития колоректальной хирургии, поскольку она обладает рядом преимуществ по сравнению с традиционной хирургией, это: сокращение количества койко-дней, ранняя реабилитация пациента, лучший косметический эффект и уменьшение интенсивности болевого синдрома в послеоперационном периоде [3].
Тем не менее лапароскопическая хирургия рака прямой кишки технически сложна, трудна для освоения, а также имеет довольно высокий риск конверсии доступа, который, по некоторым данным, достигает 30% [4]. Однако исследование COLOR II показало, что, хотя лапароскопическая ректальная хирургия сравнима по отдаленным результатам с открытой операцией, ее выполнение занимает больше времени, и у нее по-прежнему высокий коэффициент конверсии — 17%, несмотря на большой опыт хирургической бригады [5]. Технические сложности во время операций на прямой кишке связаны с работой в ограниченном пространстве малого таза в непосредственной близости от жизненно важных структур, скованностью движений инструментов, плохой эргономикой, немаловажным также является опыт ассистентов, которые создают достаточную контракцию тканей и адекватную визуализацию [6]. Эти факторы не только обеспечивают достаточно крутую кривую обучения для начинающих хирургов, но и являются обременительными для опытных хирургов [7].
Во множестве опубликованных на данный момент исследований, в том числе многоцентровых рандомизированных, показано, что лапароскопические операции на органах малого таза сопоставимы с открытыми как по непосредственным, так и по отдаленным результатам, однако существует ряд факторов риска, повышающих сложность выполнения хирургического вмешательства на прямой кишке и, как следствие, отрицательно влияющих на непосредственные и отдаленные результаты [8].
Так, Ji Won Park et al. [9] продемонстрировали, что ожирение 2-й степени достоверно повышает частоту конверсий и увеличивает время операции при лапароскопических вмешательствах на прямой кишке. T. Akiyoshi et al. [10] установили, что индекс массы тела (ИМТ) >30 кг/м2, расстояние от анального края до дистального края опухоли статистически значимо влияли на продолжительность операции и частоту развития осложнений в раннем послеоперационном периоде.
Также в работе С. Laurent et al. [11] продемонстрировано, что мужской пол связан с большей вероятностью конверсии и развития послеоперационных осложнений при лапароскопических операциях на прямой кишке.
Роботическая хирургия позволяет нивелировать недостатки лапароскопической хирургии. Роботический комплекс обеспечивает трехмерное изображение с высоким разрешением и эффектом погружения, превосходную эргономику, оснащен бóльшим, чем при лапароскопических вмешательствах, количеством инструментов с высокой степенью свободы движений, имитирующих движения кисти хирурга, что позволяет с большим комфортом работать в ограниченных пространствах, в том числе в полости малого таза [12, 13].
Однако роботизированный подход имеет и свои ограничения. Система da Vinci — это промежуточный инструмент между хирургом и пациентом. Одним из существенных недостатков его является отсутствие тактильных ощущений и обратной связи по растяжению тканей [14]. Другим фактором, который следует учитывать, служит относительная экономическая эффективность роботизированной хирургии. Эти факторы делают роботизированный подход для всех видов колоректальных резекций спорным предложением.
Цель исследования: оценить периоперационные результаты робот-ассистированной хирургии рака прямой кишки в группе пациентов высокого операционного риска и влияние факторов хирургического риска (ожирение, мужской пол, неоадъювантная химиолучевая терапия (НаХЛТ), а также локализация опухоли менее чем в 8 см от анального края).
Материал и методы
Данная работа представляет собой ретроспективное исследование, основанное на анализе 223 историй болезни пациентов с опухолями (108 (48,43%) мужчин и 115 (51,57%) женщин), локализующимися в прямой кишке, которым выполняли робот-ассистированные операции в период с 2015 по 2021 г. в отделении абдоминальной онкологии СПб ГБУЗ «Городская больница № 40». Больные включались в исследование при наличии одного из следующих факторов: ИМТ ≥30 кг/м2, мужской пол, предоперационная химиолучевая терапия, расположение опухоли менее 8 см от анального края, предыдущие операции на органах брюшной полости. Операции выполнялись тремя хирургами, имеющими достаточный опыт в проведении роботических операций.
Предоперационное обследование
Всем больным проводили комплексное обследование, направленное на стадирование злокачественных новообразований (ЗНО), согласно клиническим рекомендациям1.
Тактика лечения пациентов обсуждалась на мультидисциплинарной комиссии с участием хирурга, радиолога, химиотерапевта, в частности, определяли целесообразность проведения НаХЛТ. Показаниями к проведению предоперационной лучевой или химиолучевой терапии были: стадия опухоли T3 (если расстояние между краем опухоли и мезоректальной фасцией было ≤5 мм) и Т4 (если опухоль локализуется в пределах 5–10 см от переходной анальной складки) или стадия N1–2 (той же локализации).
Целевой категории пациентов проводили пролонгированный курс химиолучевой терапии с разовой очаговой дозой 2 Гр до суммарной очаговой дозы 50–52 Гр ежедневно 5 раз в неделю. На фоне лучевой терапии пациентам с удовлетворительным функциональным статусом и отсутствием противопоказаний проводили химиотерапию фторпиримидинами. Использовали 3 варианта лечения: капецитабин 825 мг/м2 2 р/сут в дни облучения per os, или фторафур 400 мг/м2 2 р/сут в дни облучения per os, или 5-фторурацил 400 мг/м2 в сутки в/в в виде 24-часовой инфузии. Хирургическое вмешательство планировали через 10–12 нед. после завершения курса химиолучевой терапии.
Техника операций
Роботические оперативные вмешательства выполняли с использованием роботизированного хирургического комплекса da Vinci SI HD и da Vinci Xi («Интуитив Сурджикал, Инк.», США) в объеме: передней резекции прямой кишки, низкой передней резекции прямой кишки, брюшнопромежностной экстирпации.
Используемая нами техника роботических операций на прямой кишке описана в ранее опубликованных работах [15].
В данном исследовании оценивали связь ИМТ, проведения НаХЛТ, возраста и пола пациентов с такими параметрами, как 30-дневная послеоперационная летальность, число послеоперационных осложнений по классификации Clavien — Dindo, частота конверсий, объем интраоперационной кровопотери, продолжительность операции, качество ТМЭ, количество удаленных лимфатических узлов, частота поражения циркулярного и дистального краев резекции. Также были проверены корреляции стадий Т и N, локализации опухоли, показателя ASA и наличия операций в анамнезе с вышеописанными параметрами для того, чтобы исключить их влияние на изучаемые явления.
Статистическая обработка
Статистическую обработку данных проводили при помощи программы SPSS Statistics (IBM), версия 23. Числовые данные представлены в абсолютных цифрах и процентах. Количественные данные были обобщены и представлены в виде среднего арифметического взвешенного со среднеквадратичной ошибкой для нормально распределенных величин, в виде квартильных оценок для ненормально распределенных величин — Мe (Q1; Q3), где Мe — медиана, Q1 и Q3 — квартили.
Для статистического анализа применялись следующие методы: корреляционный анализ Спирмена, U-критерий Манна — Уитни, критерий Краскела — Уоллиса, определение отношения шансов (ОШ). Статистически значимым считалось значение р<0,05.
Результаты и обсуждение
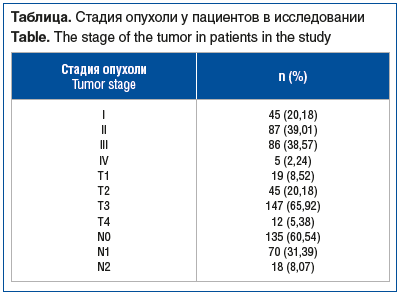
Средний возраст пациентов в исследовании составил 63,85±0,75 года. У 82 (36,77%) пациентов в анамнезе были оперативные вмешательства на органах брюшной полости, 5 (2,24%) человек соответствовали 1-му классу по ASA, 61 (27,35%) — 2-му, 147 (65,92%) — 3-му, 10 (4,48%) — 4-му. Медиана ИМТ составила 24,00 (19,40; 28,20), ожирение (ИМТ>30 кг/м2) было диагностировано у 37 (16,59%) пациентов. Результаты послеоперационного стадирования ЗНО представлены в таблице. У 84 (37,67%) пациентов опухоль располагалась в верхнеампулярном отделе прямой кишки, у 67 (30,04%) — в среднеампулярном, у 72 (32,29%) — в нижнеампулярном. Медиана койко-дней составила 7,00 (6,00; 8,00). НаХЛТ проведена 82 (36,77) пациентам. Было выполнено 97 (43,50%) передних резекций прямой кишки, 110 (49,33%) низких передних резекций, 14 (6,28%) брюшнопромежностных экстирпаций, 2 (0,90%) обструктивные резекции прямой кишки. Медиана времени операции составила 195,00 (165,00; 225,00) мин. Кровопотеря была минимальна. Конверсия доступа (в открытую операцию) была выполнена в 5 (2,24%) случаях: в 4 (1,79%) случаях причиной служило прорастание опухоли в соседние органы и ткани, в 1 (0,45%) случае — выраженный спаечный процесс.
Осложнения в раннем послеоперационном периоде зарегистрированы в 43 (19,28%) случаях, из них 10 (4,48%) были классифицированы как I класс по шкале Clavien — Dindo, 3 (1,35%) — II класс, 24 (10,76%) — III, 2 (0,90%) — IV, 4 (1,79%) — V (летальный исход). Из них несостоятельность кишечного анастомоза выявлена у 15 (6,73%) пациентов. Качество ТМЭ в 192 (86,10%) случаях было оценено как хорошее, в 26 (11,66%) — как удовлетворительное, в 5 (2,24%) случаях — как неудовлетворительное. При выполнении 216 (96,86%) операций CRM (circumferential resection margin) был определен как R0. CRM — это наименьшая дистанция от края опухоли или лимфатических узлов (циркулярный край резекции, проксимальный, дистальный и латеральный края резекции), она является одним из главных факторов риска местного рецидива. Также было оценено количество удаленных лимфатических узлов — медиана 13,00 (12,00; 17,00). Медиана расстояния от Z-линии до дистального края опухоли составила 8,10 (5,43; 12,00) см. Все 223 пациента имели дистальный край R0.
При проведении корреляционного анализа не было выявлено статистически значимых связей между факторами риска (ожирение, мужской пол, НаХЛТ) и непосредственными результатами оперативного лечения ЗНО прямой кишки (послеоперационная летальность, осложнения, несостоятельность кишечного анастомоза, интраоперационная кровопотеря, количество койко-дней, частота конверсий доступа, качество CRM, дистальный край, количество удаленных лимфатических узлов).
При применении корреляционного анализа по Спирмену были выявлены корреляции факторов риска с временем операции: время операции — пол: коэффициент корреляции (ρ) 0,25, р<0,001; время операции — ИМТ: ρ=0,23, р=0,001; время операции — НаХЛТ: ρ=0,17, р<0,01; время операции — расстояние от Z-линии: ρ=0,27, р=0,003. Медиана времени операции у мужчин составила 210,00 (180,00; 263,75) мин против 185,00 (150,00; 220,00) мин у женщин, время операции у пациентов с ИМТ>30 кг/м2 — 235,00 (200,00; 290,00) мин, с ИМТ<30 кг/м2 — 190,00 (160,00; 230,00) мин, у пациентов без НаХЛТ — 190,00 (160,00; 227,35) мин, у пациентов с НаХЛТ — 205,00 (175,00; 245,00) мин. При применении критерия Краскела — Уоллиса была выявлена статистически значимая разница (p=0,002) по времени операции между подгруппами пациентов, получивших и не получивших НаХЛТ, также выявлена статистически значимая разница по времени операции при применении критерия Манна — Уитни между подгруппами, разделенными по полу и ИМТ (p<0,001). Увеличение времени операции может быть связано с повышением риска развития послеоперационных осложнений, как было показано в исследовании L. Liu et al. [16], однако при анализе исследованной нами выборки такая зависимость не выявлена.
Также была выявлена корреляция качества CRM и расстояния до Z-линии (ρ=0,26, р=0,011). Качество ТМЭ оценено как grade 1 и 2 при наиболее низко локализованных и крупных опухолях.
Отдельно следует отметить частоту конверсий, принятую во многих исследованиях как основной маркер для определения эффективности того или иного малоинвазивного метода в раннем послеоперационном периоде. В исследовании K.R. Serin et al. [17] показано, что роботизированная хирургия прямой кишки связана со сниженным риском конверсии у пациентов с ожирением (ОШ 0,22, 95% доверительный интервал (ДИ) 0,07–0,71). В рамках данного исследования этот вывод подтвердить не удалось, так как ОШ конверсии доступа у пациентов с ИМТ>30 кг/м2 и с ИМТ<30 кг/м2 составило 3,49, 95% ДИ 0,56–21,63 — разница статистически незначима.
Для подтверждения полученных результатов требуется сравнение представленной в данной работе выборки с результатами традиционной лапароскопической хирургии пациентов с ЗНО прямой кишки.
Заключение
При выполнении роботических операций по поводу ЗНО прямой кишки не было выявлено влияния факторов хирургического риска (мужской пол, ожирение (ИМТ ≥30 кг/м2), НаХЛТ) на частоту конверсий, а также на непосредственные результаты хирургического лечения. Несмотря на это, сложность подобных операций у пациентов данной категории несомненно возрастает, что проявляется в увеличении затрачиваемого на них времени.
1Министерство здравоохранения Российской Федерации. Клинические рекомендации. Рак прямой кишки. 2022. (дата обращения: 05.01.2023).
Сведения об авторах:
Моисеев Михаил Евгеньевич — врач-онколог отделения абдоминальной онкологии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD 0000-0002-6180-6695.
Гладышев Дмитрий Владимирович — д.м.н., заместитель главного врача по хирургии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; доцент кафедры госпитальной хирургии Военно-медицинской академии имени С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6, лит. Ж; ORCID iD 0000-0001-5318-2619.
Коваленко Сергей Алексеевич — врач-онколог, заведующий отделением абдоминальной онкологии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD 0000-0002-5850-0599.
Ветошкин Вячеслав Андреевич — врач-хирург операционного отделения для противошоковых мероприятий СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD 0000-0001-5346-9257.
Свитич Вадим Юрьевич — врач-онколог отделения абдоминальной онкологии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD 0009-0002-2293-0527.
Гнедаш Сергей Сергеевич — врач-онколог отделения абдоминальной онкологии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD 0009-0003-4743-3014.
Контактная информация: Моисеев Михаил Евгеньевич, e-mail: dr.michail.moiseev@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 18.02.2023.
Поступила после рецензирования 17.03.2023.
Принята в печать 11.04.2023.
About the authors:
Mikhail E. Moiseev — oncologist of the Department of Abdominal Oncology, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0000-0002-6180-6695.
Dmitry V. Gladyshev — Dr. Sc. (Med.), Deputy Chief Officer of Surgery, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; Associate Professor of the Department of Hospital Surgery of the S.M. Kirov Military Medical Academy; 6 Zh, Lebedeva str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-5318-2619.
Sergey A. Kovalenko — oncologist of the Department of Abdominal Oncology, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0000-0002-5850-0599.
Vyacheslav A. Vetoshkin — surgeon of the operating department for anti-shock measures of St. Petersburg St. Petersburg City Hospital No. 40; 9, Borisova str., St. Petersburg, Sestroretsk, 197706, Russian Federation; ORCID iD 0000-0001-5346-9257.
Vadim Yu. Svitich — oncologist of the Abdominal Oncology Department, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0009-0002-2293-0527.
Sergey S. Gnedash — oncologist of the Department of Abdominal Oncology, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0009-0003-4743-3014. Contact information: Mikhail E. Moiseev, e-mail: dr.michail.moiseev@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 18.02.2023.
Revised 17.03.2023.
Accepted 11.04.2023.












