–Т–≤–µ–і–µ–љ–Є–µ
–Ы–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ (LVFX) – L––Є–Ј–Њ–Љ–µ—А –Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞, —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Њ—Б—В—А—Л—Е –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Є–љ—Д–µ–Ї—Ж–Є–є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞. –®–Є—А–Њ–Ї–Є–є —Б–њ–µ–Ї—В—А –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –љ–Є–Ј–Ї–∞—П, –Љ–∞–ї–Њ –Є–Ј–Љ–µ–љ—П—О—Й–∞—П—Б—П —Б–Њ –≤—А–µ–Љ–µ–љ–µ–Љ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Њ—Б–љ–Њ–≤–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є, –љ–µ –њ—А–µ–≤—Л—И–∞—О—Й–∞—П 1%, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –≤—Л—Б–Њ–Ї–Є–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –њ—А–Є –Є–љ—Д–µ–Ї—Ж–Є—П—Е —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ —Е–Њ–і–µ —В–µ—А–∞–њ–Є–Є —В—П–ґ–µ–ї–Њ–є –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є (–Т–Я) –њ—А–µ–њ–∞—А–∞—В —Б —Г—Б–њ–µ—Е–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –≤ —Б—Е–µ–Љ–∞—Е –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П.
–Ґ—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ–∞—П –і–Њ–Ј–∞ LVFX —Б–Њ—Б—В–∞–≤–ї—П–µ—В 500 –Љ–≥/—Б—Г—В. –Ф–ї–Є—В–µ–ї—М–љ—Л–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ–і—В–≤–µ—А–і–Є–ї –µ–≥–Њ –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М LVFX –њ—А–Є –Т–Я –њ—А–µ–≤—Л—И–∞–µ—В 80–95%, —З—В–Њ —Б—А–∞–≤–љ–Є–Љ–Њ —Б —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –і—А—Г–≥–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є.
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –њ–Њ–ї—Г—З–µ–љ—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–∞ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ —Б–Њ–Ї—А–∞—Й–µ–љ–љ—Л—Е, –≤—Л—Б–Њ–Ї–Њ–і–Њ–Ј–Њ–≤—Л—Е –Ї—Г—А—Б–Њ–≤ –Р–Ґ. –Ю–і–Њ–±—А–µ–љ–љ—Л–µ –≤ –°–®–Р 5 —Б—Г—В. —А–µ–ґ–Є–Љ—Л –Р–Ґ –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–Њ–Љ (LVFX) –≤ –і–Њ–Ј–µ 750 –Љ–≥/—Б—Г—В. –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В —Б—А–∞–≤–љ–Є–Љ—Г—О —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ–Є 7–10 —Б—Г—В. –Ї—Г—А—Б–∞–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –Є –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є –љ–µ—В—П–ґ–µ–ї–Њ–є –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є (–Т–Я), –Њ—Б—В—А–Њ–Љ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–Љ —А–Є–љ–Њ—Б–Є–љ—Г—Б–Є—В–µ (–Ю–С–†–°), –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є—П—Е –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є (–Ш–Ь–Т–Я) –Є –Њ—Б—В—А–Њ–Љ –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В–µ. –Ю—В–ї–Є—З–∞—П—Б—М –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В—М—О –Є –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ—Л–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–Љ, –≤—Л—Б–Њ–Ї–Њ–і–Њ–Ј–Њ–≤—Л–µ –Ї—Г—А—Б—Л, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, —П–≤–ї—П—О—В—Б—П –њ—А–Є–Њ—А–Є—В–µ—В–љ—Л–Љ–Є.
–Я–µ—А–Њ—А–∞–ї—М–љ—Л–µ —Д–Њ—А–Љ—Л –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ LVFX (–Ґ–∞–≤–∞–љ–Є–Ї®) –Њ—В–ї–Є—З–∞—О—В—Б—П –±—Л—Б—В—А–Њ–є –Є –≤—Л—Б–Њ–Ї–Њ–є, —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ–є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ–µ, –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О. –Ф–∞–љ–љ–∞—П —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–∞—П –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –±—Л—Б—В—А—Л–є –њ–µ—А–µ–≤–Њ–і –љ–∞ –њ–µ—А–Њ—А–∞–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О, –Њ—В–ї–Є—З–∞—О—Й—Г—О—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Љ–µ–љ—М—И–µ–є —Б—В–Њ–Є–Љ–Њ—Б—В—М—О –Є —Г–і–Њ–±—Б—В–≤–Њ–Љ –Ї–∞–Ї –і–ї—П –њ–∞—Ж–Є–µ–љ—В–∞, —В–∞–Ї –Є –і–ї—П –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ –њ–µ—А—Б–Њ–љ–∞–ї–∞.
–Ы–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В β––ї–∞–Ї—В–∞–Љ–Њ–≤ –Є –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –≤ —В–Ї–∞–љ—П—Е, —Д–∞–≥–Њ—Ж–Є—В–∞—Е –Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –ґ–Є–і–Ї–Њ—Б—В—П—Е, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –≤ –ґ–Є–і–Ї–Њ—Б—В–Є, –≤—Л—Б—В–Є–ї–∞—О—Й–µ–є –∞–ї—М–≤–µ–Њ–ї—Л, –ї–µ–≥–Њ—З–љ–Њ–є —В–Ї–∞–љ–Є –Є –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–Љ —Б–µ–Ї—А–µ—В–µ. –Я–Њ–і–і–µ—А–ґ–Є–≤–∞–µ–Љ–∞—П –≤ —В–µ—З–µ–љ–Є–µ —Б—Г—В–Њ–Ї –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤–њ–Њ–ї–љ–µ –і–Њ—Б—В–∞—В–Њ—З–љ–∞ –і–ї—П –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ—А–Њ—В–Є–≤ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–≥–Њ —З–Є—Б–ї–∞ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Ї –і—А—Г–≥–Є–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ. –Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ –≤—Л—Б–Њ–Ї–Њ–є –і–Њ–Ј—Л LVFX —П–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Љ–Є–љ–Є–Љ–Є–Ј–∞—Ж–Є–Є —Б–µ–ї–µ–Ї—Ж–Є–Є —Г—Б—В–Њ–є—З–Є–≤—Л—Е —И—В–∞–Љ–Љ–Њ–≤ S. pneumoniae –≤ —Е–Њ–і–µ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Р–Ґ).
–Ы–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ –Њ—В–ї–Є—З–∞–µ—В—Б—П —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≤ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –і–Њ–Ј–µ. –І–∞—Б—В–Њ—В–∞ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є (–Э–†) –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М, –љ–∞–±–ї—О–і–∞–µ–Љ—Л–є –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –Є–ї–Є –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Ј–∞—Й–Є—Й–µ–љ–љ—Л—Е –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ (–Ш–Ч–Р). –Э–∞–ї–Є—З–Є–µ —А–µ–і–Ї–Є—Е, –Ї–∞–Ї –Є –і–ї—П –≤—Б–µ—Е –і—А—Г–≥–Є—Е –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Р–С), —Б–µ—А—М–µ–Ј–љ—Л—Е –Э–†, –љ–µ —П–≤–ї—П–µ—В—Б—П –њ—А–Є—З–Є–љ–Њ–є –Њ—В–Ї–∞–Ј–∞ –Њ—В —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞. –Я–Њ–ї—М–Ј–∞ –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П LVFX –њ—А–Є —В—П–ґ–µ–ї—Л—Е –Є–ї–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е –Є–љ—Д–µ–Ї—Ж–Є—П—Е, –Ї–∞–Ї –Є –њ—А–Є –Є–љ—Д–µ–Ї—Ж–Є—П—Е, –љ–µ –њ–Њ–і–і–∞—О—Й–Є—Е—Б—П —В–µ—А–∞–њ–Є–Є –і—А—Г–≥–Є–Љ–Є –Р–С, –≤—Б–µ–≥–і–∞ –њ–µ—А–µ–≤–µ—И–Є–≤–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–є —А–Є—Б–Ї.
–§–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–∞
–Ы–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ (LVFX) –њ—А–Є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –±—Л—Б—В—А–Њ–є –Є –њ–Њ–ї–љ–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–µ–є. –Р–±—Б–Њ–ї—О—В–љ–∞—П –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М ≈99% –Њ–њ—А–µ–і–µ–ї—П–µ—В –±–Є–Њ—Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ—Б—В—М –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ–µ. –°–≤—П–Ј—Л–≤–∞–љ–Є–µ —Б –њ–ї–∞–Ј–Љ–µ–љ–љ—Л–Љ–Є –±–µ–ї–Ї–∞–Љ–Є –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 38%. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П (Csmax) –Њ—В–Љ–µ—З–∞–µ—В—Б—П —З–µ—А–µ–Ј 1–2 —З–∞—Б–∞; —Н—В–Њ –≤—А–µ–Љ—П –і–≤—Г–Ї—А–∞—В–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Љ—Г–Ї–Њ–≤–Є—Б—Ж–Є–і–Њ–Ј–Њ–Љ [1]. –Я—А–Є –њ—А–Є–µ–Љ–µ 500 –Љ–≥ Csmax –і–Њ—Б—В–Є–≥–∞–µ—В 8,5 –Љ–Ї–≥/–Љ–ї [2]. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –і–Њ–Ј–Є—А–Њ–≤–Ї–Є 750 –Љ–≥ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 12,5±4,7 (–і–Є–∞–њ–∞–Ј–Њ–љ 5,6–16,0), –≤ —В–Њ–Љ —З–Є—Б–ї–µ –љ–µ—Б–≤—П–Ј–∞–љ–љ–Њ–є —Д—А–∞–Ї—Ж–Є–Є – 8,8±3,3 –Љ–Ї–≥/–Љ–ї [3]. –Т –і—А—Г–≥–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ 750 –Љ–≥ LVFX Cmax –≤ –њ–ї–∞–Ј–Љ–µ –ґ–Є–і–Ї–Њ—Б—В–Є, –≤—Л—Б—В–Є–ї–∞—О—Й–µ–є –∞–ї—М–≤–µ–Њ–ї—Л (–Ц–Т–Р), –Є –∞–ї—М–≤–µ–Њ—Ж–Є—В–∞—Е –і–Њ—Б—В–Є–≥–ї–∞ 5,7±0,4; 28±23,6 –Є 34±18,7 –Љ–Ї–≥/–Љ–ї. –Я—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є —Г—Б—В–Њ–є—З–Є–≤–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є (–љ–∞ 10±3,8 —Б—Г—В.) –≤ –љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Њ–є —В–Ї–∞–љ–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —Б—В–Њ–њ–Њ–є –Њ–љ–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 2,3–23,2 –Љ–Ї–≥/–≥—А (—Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–∞—П 0,12–6,41 –Љ–Ї–≥/–Љ–ї) [4].
–£—З–Є—В—Л–≤–∞—П, —З—В–Њ –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Р–С –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є–µ–є –±–∞–Ї—В–µ—А–Є–є, –±—Л–ї–∞ –Є–Ј—Г—З–µ–љ–∞ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П LVFX. –°–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є (–љ–µ–є—В—А–Њ—Д–Є–ї—Л) –Є –њ–ї–∞–Ј–Љ–µ–љ–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 8,15±5,23 –Ї–∞–Ї –і–ї—П Cmax, —В–∞–Ї –Є –і–ї—П –њ–ї–Њ—Й–∞–і–Є –њ–Њ–і —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –Ї—А–Є–≤–Њ–є (–Я–§–Ъ) [5]. –Ъ–∞–ґ—Г—Й–Є–є—Б—П –Њ–±—К–µ–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П (Vd) = 59–112 –ї, –њ–µ—А–Є–Њ–і –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П (T½)=6,7–8,8 —З [2,3,6,7].
–Т—Л—Б–Њ–Ї–∞—П —Б—В–µ–њ–µ–љ—М –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –≤ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –ґ–Є–і–Ї–Њ—Б—В—П—Е –Є —В–Ї–∞–љ—П—Е, –≤ —В.—З. –≤ –Ц–Т–Р, –∞–ї—М–≤–µ–Њ—Ж–Є—В–∞—Е –Є –Љ–∞–Ї—А–Њ—Д–∞–≥–∞—Е, –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –њ–∞—А–∞–љ–∞–Ј–∞–ї—М–љ—Л—Е —Б–Є–љ—Г—Б–Њ–≤, –њ–µ—З–µ–љ–Є, –Љ—Л—И–µ—З–љ–Њ–є, –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є, –ґ–µ–ї—З–Є –Є –Љ–Њ—З–µ, —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ LVFX [8,9].
–§–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–∞ –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ –љ–µ –Ј–∞–≤–Є—Б–Є—В –Њ—В –њ–Њ–ї–∞ –Є —В—П–ґ–µ—Б—В–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Т–ї–Є—П–љ–Є–µ –≤–Њ–Ј—А–∞—Б—В–∞ –љ–∞ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї—Г –њ—А–µ–њ–∞—А–∞—В–∞ –Њ—Ж–µ–љ–µ–љ–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є A. Norredin –Є —Б–Њ–∞–≤—В. [10]. –°—А–∞–≤–љ–Є–≤–∞—П –Ї–Є–љ–µ—В–Є–Ї—Г —А–∞–Ј–ї–Є—З–љ—Л—Е –і–Њ–Ј (0,5–0,75 –Є 1,0 –≥) LVFX —Г –ї–Є—Ж —Б—В–∞—А—И–µ –Є –Љ–ї–∞–і—И–µ 65 –ї–µ—В, –∞–≤—В–Њ—А—Л —Г—Б—В–∞–љ–Њ–≤–Є–ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є Vd –њ—А–Є —Б–љ–Є–ґ–µ–љ–љ–Њ–Љ –≤ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ –Ї–ї–Є—А–µ–љ—Б–µ –Є —Г–≤–µ–ї–Є—З–µ–љ–љ–Њ–Љ T½ (9,8±2,5 —З vs. 7,4±2,5 —З). –Т –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В–Љ–µ—З–µ–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–ї—О—З–µ–≤—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є LVFX: –Я–§–Ъ0–24 –Є –Я–§–Ъ0–24/–Ь–Я–Ъ. –° –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ—Г–ї—П—Ж–Є–Є Monte Carlo –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Я–§–Ъ0–24/–Ь–Я–Ъ >30 (–њ–Њ –љ–µ—Б–≤—П–Ј–∞–љ–љ–Њ–Љ—Г –њ—А–µ–њ–∞—А–∞—В—Г) –≤ –њ–ї–∞–Ј–Љ–µ –Є –Ц–Т–Р —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (–њ—А–Є –њ—А–Є–µ–Љ–µ 500 –Љ–≥ LVFX 96% –Є 98% vs. 73% –Є 81%) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, –љ–∞ —Д–Њ–љ–µ 750/1000 –Љ–≥ LVFX, —Б–Њ—Б—В–∞–≤–Є–ї–Є 98%/99% –Є 99%/99% —Г –њ–Њ–ґ–Є–ї—Л—Е, 90%/94% –Є 95%/97% –≤ –±–Њ–ї–µ–µ –Љ–Њ–ї–Њ–і–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ. –Т–µ—А–Њ—П—В–љ–Њ—Б—В—М –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Я–§–Ъ0–24/–Ь–Я–Ъ >100 –њ–Њ –љ–µ—Б–≤—П–Ј–∞–љ–љ–Њ–є —Д—А–∞–Ї—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –Ї—А–∞–є–љ–µ –љ–Є–Ј–Ї–Њ–є, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –і–Њ–Ј—Г. –Ш—Б–Ї–ї—О—З–µ–љ–Є–µ —Б–Њ—Б—В–∞–≤–Є–ї–Є –њ–Њ–ґ–Є–ї—Л–µ –њ–∞—Ж–Є–µ–љ—В—Л, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є–µ –њ—А–µ–њ–∞—А–∞—В –≤ –і–Њ–Ј–µ 1000 –Љ–≥ (–њ–ї–∞–Ј–Љ–∞ – 79%, –Ц–Т–Р – 87%).
–° —Г—З–µ—В–Њ–Љ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є, —Е–Њ—В—П –µ—Й–µ –љ–µ –њa:2:{s:4:"TEXT";s:70132:"—А–Є–љ—П—В–Њ–є –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б—В—А–∞–љ –Љ–Є—А–∞ —В–µ–љ–і–µ–љ—Ж–Є–Є –њ–Њ –њ–µ—А–µ—Е–Њ–і—Г –љ–∞ —Б–Њ–Ї—А–∞—Й–µ–љ–љ—Л–µ –≤—Л—Б–Њ–Ї–Њ–і–Њ–Ј–Њ–≤—Л–µ —А–µ–ґ–Є–Љ—Л –Р–Ґ, –±—Л–ї–∞ –Є–Ј—Г—З–µ–љ–∞ –Ї–Є–љ–µ—В–Є–Ї–∞ LVFX –≤ –і–Њ–Ј–µ 1 –≥. –Я–Њ—Б–ї–µ–і—Г—О—Й–µ–µ —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–µ –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –њ—А–Є —Б—Г—Й–µ—Б—В–≤—Г—О—Й–µ–Љ —Г—А–Њ–≤–љ–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ Cmax/–Ь–Я–Ъ90 –Є –Я–§–Ъ/–Ь–Я–Ъ90 –≤ –Ц–Т–Р –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ 1 –≥ –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–µ–≤—Л—И–∞–µ—В —В—А–µ–±—Г–µ–Љ—Л–µ –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П –Љ—Г—В–∞—Ж–Є–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є [11–13]. –Ґ–∞–Ї–Њ–є –ґ–µ –≤—Л–≤–Њ–і —Б–і–µ–ї–∞–љ –Є –љ–∞ –Љ–Њ–і–µ–ї–Є —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є [14]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–Њ–ї—Г—З–µ–љ–Њ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–µ –Є —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–µ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Є–µ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –і–Њ 1000 –Љ–≥ –і–Њ–Ј—Л LVFX [14–17].
–°–Њ–≥–ї–∞—Б–љ–Њ –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О, –њ—А–µ–њ–∞—А–∞—В –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є (<5%) –љ–µ –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –±–Є–Њ—В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –≤ –њ–µ—З–µ–љ–Є. –Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Д–Є–ї—М—В—А—Г–µ—В—Б—П –Є —Б–µ–Ї—А–µ—В–Є—А—Г–µ—В—Б—П –њ–Њ—З–Ї–∞–Љ–Є. –Т —В–µ—З–µ–љ–Є–µ 2–3 —Б—Г—В. –≤ –Љ–Њ—З–µ, –≤ –љ–µ–Є–Ј–Љ–µ–љ–µ–љ–љ–Њ–Љ –≤–Є–і–µ, –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Њ–Ї–Њ–ї–Њ 75–87% –њ—А–Є–љ—П—В–Њ–є –і–Њ–Ј—Л. –Ь–µ–љ–µ–µ 4% –њ—А–µ–њ–∞—А–∞—В–∞ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –≤ —Е–Є–Љ—Г—Б–µ.
–Ы–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П
–Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ —Б –і—А—Г–≥–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є. –£ –ї–Є—Ж, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л, –Њ—В–Љ–µ—З–µ–љ—Л —А–µ–і–Ї–Є–µ —Н–њ–Є–Ј–Њ–і—Л –≥–Є–њ–Њ– –Є –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–Є. –Я–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Г—Б–Є–ї–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–∞ –љ–µ–њ—А—П–Љ–Њ–≥–Њ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞ –≤–∞—А—Д–∞—А–Є–љ–∞. –У–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ–∞—П –∞–±—Б–Њ—А–±—Ж–Є—П LVFX —Б–љ–Є–ґ–∞–µ—В—Б—П –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є Mg–Al–—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –∞–љ—В–∞—Ж–Є–і–Њ–≤, —Б—Г–Ї—А–∞–ї—М—Д–∞—В–∞, –Ї–∞—В–Є–Њ–љ–Њ–≤ –Љ–µ—В–∞–ї–ї–Њ–≤ (Fe, Zn, Ca17). –Я—А–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б —Б–Є—Б—В–µ–Љ–љ—Л–Љ–Є –∞–љ—В–Є–≥—А–Є–±–Ї–Њ–≤—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є (–∞–Љ—Д–Њ—В–µ—А–Є—Ж–Є–љ –Т, –Ї–∞—Б–њ–Њ—Д—Г–љ–≥–Є–љ, —Д–ї—О–Ї–Њ–љ–∞–Ј–Њ–ї –Є–ї–Є –≤–Њ—А–Є–Ї–Њ–љ–∞–Ј–Њ–ї) –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Б–Є–љ–µ—А–≥–Є–Ј–Љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є Candida albicans –Є Aspergillus fumigatus [18].
–§–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є–Ї–∞
–Ы–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–ї—О—З–µ–≤—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –Ї–ї–µ—В–Ї–Є, –њ—А–µ–Ї—А–∞—Й–∞—П —А–µ–њ–ї–Є–Ї–∞—Ж–Є—О, —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О –Є —А–µ–Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –Ф–Э–Ъ –Ј–∞ —Б—З–µ—В –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П —В–Њ–њ–Њ–Є–Ј–Њ–Љ–µ—А–∞–Ј II —В–Є–њ–∞ (–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П —В–Њ–њ–Њ–Є–Ј–Њ–Љ–µ—А–∞–Ј–∞ IV –Є –Ф–Э–Ъ –≥–Є—А–∞–Ј–∞). –У–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є–µ –і–≤—Г—Е —В–Є–њ–Њ–≤ —Д–µ—А–Љ–µ–љ—В–Њ–≤ – –Љ–Є—И–µ–љ–µ–є –і–µ–є—Б—В–≤–Є—П —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤. –Ю—Б–љ–Њ–≤–љ—Л–Љ —Д–µ—А–Љ–µ–љ—В–Њ–Љ –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є, —В–∞–Ї–Є—Е –Ї–∞–Ї Klebsiella pneumoniae, Escherichia coli, Pseudomonas aeruginosa, —П–≤–ї—П–µ—В—Б—П –Ф–Э–Ъ –≥–Є—А–∞–Ј–∞, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Г –≥—А–∞–Љ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е, –љ–∞–њ—А–Є–Љ–µ—А, S. aureus –Є S. pneumoniae – –Ф–Э–Ъ —В–Њ–њ–Њ–Є–Ј–Њ–Љ–µ—А–∞–Ј–∞ [19]. –°–Є–љ—В–µ–Ј –Є—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В—Б—П –≥–µ–љ–∞–Љ–Є gyrA –Є gyrB, parC –Є parE. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Љ–Њ–Ї—Б–Є—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞, –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–≤—П–Ј—Л–≤–∞—О—Й–µ–≥–Њ—Б—П —Б –Ф–Э–Ъ –≥–Є—А–∞–Ј–∞–Љ–Є (—В–Њ–њ–Њ–Є–Ј–Њ–Љ–µ—А–∞–Ј–∞ II), LVFX –Њ–±–ї–∞–і–∞–µ—В –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Б—А–Њ–і—Б—В–≤–Њ–Љ –Ї —В–Њ–њ–Њ–Є–Ј–Њ–Љ–µ—А–∞–Ј–µ IV —В–Є–њ–∞.
–° —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М LVFX –Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П, –Ї–∞–Ї –Ј–∞–≤–Є—Б–Є–Љ–∞—П –Њ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є. –Э–∞–Є–±–Њ–ї–µ–µ —В–Њ—З–љ—Л–є –њ—А–µ–і–Є–Ї—В–Њ—А –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Є –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є – —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –Я–§–Ъ0–24 –Є Cmax –Ї –Ь–Я–Ъ [20–22]. –Ю–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ—А–Њ—В–Є–≤ S. pneumoniae, S. aureus, K. pneumoniae –Є E. coli, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –љ–∞–ї–Є—З–Є–Є parC/E –Љ—Г—В–∞—Ж–Є–є I —Г—А–Њ–≤–љ—П, —П–≤–ї—П–µ—В—Б—П –Ј–љ–∞—З–µ–љ–Є–µ –Я–§–Ъ0–24/–Ь–Я–Ъ >100–120 [23]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –Я–§–Ъ0–24/–Ь–Я–Ъ >200–250 –њ–Њ –Њ–±—Й–µ–є —Д—А–∞–Ї—Ж–Є–Є LVFX –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –љ–∞–Є–±–Њ–ї–µ–µ –±—Л—Б—В—А—Л–є –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ—Л–є —Н—Д—Д–µ–Ї—В –Є —Б–љ–Є–ґ–µ–љ–Є–µ –Љ—Г—В–∞–≥–µ–љ–љ–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞ [24]. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –і–ї—П –љ–µ—Б–≤—П–Ј–∞–љ–љ–Њ–є —Д—А–∞–Ї—Ж–Є–Є LVFX —Б–Њ—Б—В–∞–≤–ї—П–µ—В 75, –љ–Њ –±–Њ–ї–µ–µ –љ–∞–і–µ–ґ–љ—Л–є —Н—Д—Д–µ–Ї—В –Њ—В–Љ–µ—З–∞–µ—В—Б—П –њ—А–Є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–Є >86–105 [12,25–28]. –°—Г—Й–µ—Б—В–≤—Г–µ—В –Є –і—А—Г–≥–∞—П —В–Њ—З–Ї–∞ –Ј—А–µ–љ–Є—П, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–∞—П –Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –і–ї—П —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є S. pneumoniae —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –Я–§–Ъ/–Ь–Я–Ъ –≤ –њ—А–µ–і–µ–ї–∞—Е 30 (–њ–Њ —Б–≤–Њ–±–Њ–і–љ–Њ–є —Д—А–∞–Ї—Ж–Є–Є) [23].
–Я–ї–Њ—Й–∞–і—М –њ–Њ–і —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –Ї—А–Є–≤–Њ–є (–Я–§–Ъ0–24) –њ—А–Є –њ—А–Є–µ–Љ–µ 500 –Љ–≥ LVFX —Б–Њ—Б—В–∞–≤–ї—П–µ—В 54,6 –Љ–Ї–≥×—З/–Љ–ї, –∞ –і–ї—П –љ–µ—Б–≤—П–Ј–∞–љ–љ–Њ–є —Д—А–∞–Ї—Ж–Є–Є – 38,2 –Љ–Ї–≥×—З/–Љ–ї. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —В—А–µ–±—Г–µ–Љ–Њ–≥–Њ —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Я–§–Ъ0–24/–Ь–Я–Ъ >75, –Ь–Я–ЪLVFX –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –љ–µ –і–Њ–ї–ґ–љ–∞ –њ—А–µ–≤—Л—И–∞—В—М 0,25–0,5 –Љ–Ї–≥/–Љ–ї [29–31].
–Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤, –Њ—В–ї–Є—З–∞—О—Й–µ–є –Є—Е –Њ—В –Љ–љ–Њ–≥–Є—Е –і—А—Г–≥–Є—Е –Р–С, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤, —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—В–Є–≤ –љ–Є–Ј–Ї–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ–є –њ–Њ–Ї–Њ—П—Й–µ–є—Б—П —Д–Њ—А–Љ—Л –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤. –Я—А–µ–њ–∞—А–∞—В—Л —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П —И–Є—А–Њ–Ї–Є–Љ —Б–њ–µ–Ї—В—А–Њ–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±—Л—Б—В—А—Л–Љ –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Ј–∞–≤–Є—Б—П—Й–Є–Љ –Њ—В —Б—В–µ–њ–µ–љ–Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –Њ–±—Б–µ–Љ–µ–љ–µ–љ–љ–Њ—Б—В–Є. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М –µ—Й–µ –Њ–і–љ–Њ –≤–∞–ґ–љ–Њ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ LVFX – —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Њ–Ї–∞–Ј—Л–≤–∞—В—М –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ –њ–Њ–Ї–Њ—П—Й–Є–µ—Б—П —Д–Њ—А–Љ—Л –±–∞–Ї—В–µ—А–Є–є, —Д–Њ—А–Љ–Є—А—Г—О—Й–Є—Е –±–Є–Њ–њ–ї–µ–љ–Ї–Є. –Я–Њ–і–Њ–±–љ—Л–є —Н—Д—Д–µ–Ї—В –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є P. aeruginosa [32], Stenotrophomonas maltophilia [33] –Є H. influenzae [34] – –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є —В—П–ґ–µ–ї—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –ї–µ–≥–Ї–Є—Е.
–Ы–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г–µ—В –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –≥—А–∞–Љ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е, –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –Є «–∞—В–Є–њ–Є—З–љ—Л—Е» –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤. –Т –Њ—В–љ–Њ—И–µ–љ–Є–Є S. pneumoniae, –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е Enterobacter cloacae –Є Proteus mirabilis, –∞ —В–∞–Ї–ґ–µ Chlamydophila pneumoniae, Legionella pneumophila –Є Mycoplasma pneumoniae –Ь–Я–Ъ90 –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В ≤2 –Љ–Ї–≥/–Љ–ї. –Я—А–µ–њ–∞—А–∞—В –∞–Ї—В–Є–≤–µ–љ –њ—А–Њ—В–Є–≤ S. pyogenes (–Ь–Я–Ъ 99,9% —И—В–∞–Љ–Љ–Њ–≤ =1 –Љ–Ї–≥/–Љ–ї) [35], β––≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤ (–Ь–Я–Ъ 99% —И—В–∞–Љ–Љ–Њ–≤ =0,5–1 –Љ–Ї–≥/–Љ–ї) [36]. –°—А–µ–і–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —И—В–∞–Љ–Љ–Њ–≤ H. influenzae (–Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –Ї–∞–Ј—Г–Є—Б—В–Є—З–љ—Л—Е —Б–ї—Г—З–∞–µ–≤ [37,38]), M. catarrhalis (–Ь–Я–Ъ90 ≤0,06 –Љ–Ї–≥/–Љ–ї) —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П [39–43]. –Я—А–µ–њ–∞—А–∞—В –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г–µ—В –≤—Л—Б–Њ–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—В–Є–≤ Acinetobacter baumannii –Є S. maltophilia – –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –љ–Њ–Ј–Њ–Ї–Њ–Љ–Є–∞–ї—М–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є, —А–∞–Ј–≤–Є–≤—И–µ–є—Б—П –љ–∞ —Д–Њ–љ–µ –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –ї–µ–≥–Ї–Є—Е [44–46].
–Р–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—В–Є–≤ Staphylococcus aureus (–Ь–Я–Ъ90 ≤4 –Љ–Ї–≥/–Љ–ї) –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –њ—А–µ–і–µ–ї–∞—Е –≤–µ—А—Е–љ–µ–є –≥—А–∞–љ–Є—Ж—Л —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є–ї–Є –і–∞–ґ–µ –≤ –Ј–Њ–љ–µ —Г–Љ–µ—А–µ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є; –і–Њ–ї—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 88–96%, –≤ –†–Њ—Б—Б–Є–Є – 91% [47]. –†–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї LVFX –Њ—В–Љ–µ—З–µ–љ–∞ —Г 76–81% –љ–Њ–Ј–Њ–Ї–Њ–Љ–Є–∞–ї—М–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ MRSA (–Ь–Я–Ъ90 >4 –Љ–Ї–≥/–Љ–ї) [47–51]. LVFX –Є–Љ–µ–µ—В –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є –Є–љ—Д–µ–Ї—Ж–Є—П—Е, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –Ї–Њ–∞–≥—Г–ї–∞–Ј–Њ–љ–µ–≥–∞—В–Є–≤–љ—Л–Љ–Є —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–∞–Љ–Є [48]. –Т –Њ—В–љ–Њ—И–µ–љ–Є–Є Escherichia coli (–Ь–Я–Ъ90 –Њ—В ≤0,06 –і–Њ >8 –Љ–Ї–≥/–Љ–ї) –Є Pseudomonas aeruginosa (–Ь–Я–Ъ90 0,5–64 –Љ–Ї–≥/–Љ–ї) –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≤–∞—А–Є–∞–±–µ–ї—М–љ–∞ [52,53]. –≠–љ—В–µ—А–Њ–±–∞–Ї—В–µ—А–Є–Є, —Б–Є–љ—В–µ–Ј–Є—А—Г—О—Й–Є–µ β––ї–∞–Ї—В–∞–Љ–∞–Ј —А–∞—Б—И–Є—А–µ–љ–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –Ь–Я–Ъ, —З–∞—Б—В–Њ –љ–∞—Е–Њ–і—П—Й–Є–Љ–Є—Б—П –≤ –Ј–Њ–љ–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є [54,55].
–®–Є—А–Њ–Ї–Њ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤ –њ—А–Є –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є—П—Е —Б–≤—П–Ј–∞–љ–Њ —Б –Є—Е –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є S. pneumoniae, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ —Г—Б—В–Њ–є—З–Є–≤—Л—Е —И—В–∞–Љ–Љ–Њ–≤. –†–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М S. pneumoniae –Ї LVFX –≤ –Љ–Є—А–µ –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 1%, –∞ —Б—А–µ–і–Є –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ —Г—Б—В–Њ–є—З–Є–≤—Л—Е —И—В–∞–Љ–Љ–Њ–≤ – 2–2,7%. –Ь–µ–љ–µ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–∞—П —Б–Є—В—Г–∞—Ж–Є—П, —Е–Њ—В—П –Є –љ–µ –њ–Њ–≤—Б–µ–Љ–µ—Б—В–љ–Њ, –Њ—В–Љ–µ—З–µ–љ–∞ –≤ —А—П–і–µ —Б—В—А–∞–љ –Ѓ–≥–Њ––Т–Њ—Б—В–Њ—З–љ–Њ–є –Р–Ј–Є–Є (<4–10%) [41,56–59]. –°—А–µ–і–Є –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –≤ 2001–2002 –≥–≥. 1709 –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —И—В–∞–Љ–Љ–Њ–≤ S. pneumoniae, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Г –Є –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ, –Ь–Я–Ъ90 —Б–Њ—Б—В–∞–≤–Є–ї–∞ 1 –Љ–Ї–≥/–Љ–ї, —З—В–Њ —Б–Њ–Њ—В–љ–Њ—Б–Є–ї–Њ—Б—М —Б —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –≤ –њ—А–µ–і–µ–ї–∞—Е 97,4% [60]. –Я—А–Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ –∞–љ–∞–ї–Є–Ј–µ 39495 –Ї—Г–ї—М—В—Г—А, –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –≤ –њ–µ—А–Є–Њ–і —Б 2000 –њ–Њ 2004 –≥., –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤ –љ–µ –Є–Ј–Љ–µ–љ–Є–ї–Њ—Б—М (–≤ —Б—А–µ–і–љ–µ–Љ 0,9%) [61]. –Ю–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Є –і—А—Г–≥–Є–µ –і–∞–љ–љ—Л–µ [57,62]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ –Є –љ–∞–ї–Є—З–Є–µ —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Г –Љ–∞–ї–Њ –≤–ї–Є—П—О—В –љ–∞ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї LVFX, –∞ —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ–Ї–∞ –љ–µ –њ—А–Є–≤–µ–ї–Њ –Ї –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П–Љ [57,59,61–63].
–° —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –љ–∞—Г–Ї–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П –њ—А–Є–µ–Љ–∞ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј LVFX –≤ —В–µ—З–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –≤–њ–Њ–ї–љ–µ –Њ–ґ–Є–і–∞–µ–Љ—Л. –Ю—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ –і–∞–ґ–µ —Г –і–Є–Ї–Є—Е —И—В–∞–Љ–Љ–Њ–≤ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Њ—В–Љ–µ—З–µ–љ–Њ —А–∞–Ј–≤–Є—В–Є–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ—Г—В–∞—Ж–Є–є –њ–µ—А–≤–Њ–≥–Њ (parC/E) –Є –≤—В–Њ—А–Њ–≥–Њ (+gyrA/B) —Г—А–Њ–≤–љ—П [12,62]. –І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є –њ–Њ–і–∞–≤–ї–µ–љ–Є—П «–Љ—Г—В–∞–љ—В–Њ–≤», —В–Њ —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М –і–∞–љ–љ—Л–µ —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ LVFX –≤ –і–Њ–Ј–µ 750 –Љ–≥ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В —Н—А–∞–і–Є–Ї–∞—Ж–Є—О —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Ї —Ж–Є–њ—А–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ—Г parC –Є parC+parE, –љ–Њ –љ–µ –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Є—Е [64] parC/–Х+gyrA/B –Љ—Г—В–∞–љ—В–Њ–≤. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –љ–∞ —Д–Њ–љ–µ —Б–Є–Љ—Г–ї—П—Ж–Є–Є 500 –Љ–≥ –і–Њ–Ј—Л —Н—Д—Д–µ–Ї—В–∞ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П —А–Њ—Б—В–∞ –Љ—Г—В–∞–љ—В–Њ–≤ –і–∞–ґ–µ I —Г—А–Њ–≤–љ—П –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М [13], —З—В–Њ –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –Љ—Г—В–∞—Ж–Є–є II —Г—А–Њ–≤–љ—П –Є —А–∞–Ј–≤–Є—В–Є—О –≤—Л—Б–Њ–Ї–Є—Е —Г—А–Њ–≤–љ–µ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є [65].
–≠—В–Є –і–∞–љ–љ—Л–µ, —Б —Г—З–µ—В–Њ–Љ –і–Є–љ–∞–Љ–Є–Ї–Є —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, –Ї—А–∞–є–љ–µ –≤–∞–ґ–љ—Л, —В–∞–Ї –Ї–∞–Ї —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ—П–µ–Љ–Њ–є –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б—В—А–∞–љ –Љ–Є—А–∞ –і–Њ–Ј—Л LVFX 500 –Љ–≥/—Б—Г—В. –Ф–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –Ј–∞ –≤—Б–µ –≥–Њ–і—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П LVFX —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞ –Ї –њ—А–µ–њ–∞—А–∞—В—Г –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П, –љ–∞—Е–Њ–і—П—Б—М –≤ –њ—А–µ–і–µ–ї–∞—Е 1%. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –њ–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П TRUST, —Б 2000 –њ–Њ 2005 –≥. —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –Ї –Ш–Ч–Р –≤—Л—А–Њ—Б–ї–∞ —Б 6,5 –і–Њ 12,9%, –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Г —Б 27,4 –і–Њ 28,9%, –Ї –Ї–ї–Є–љ–і–∞–Љ–Є—Ж–Є–љ—Г —Б 12 –і–Њ 19% [66,67].
–Э–µ–∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ
–Т —Б—Г–±––Ь–Я–Ъ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—Л –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—В –љ–∞ –Љ–µ–Љ–±—А–∞–љ—Л –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, —Б–љ–Є–ґ–∞—П –Є—Е —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –Ї –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ—Л–Љ —Д–∞–Ї—В–Њ—А–∞–Љ –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –Є –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤. –§—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—Л —Г—Б–Є–ї–Є–≤–∞—О—В –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ—Л–є «–≤–Ј—А—Л–≤» –≤ –љ–µ–є—В—А–Њ—Д–Є–ї–∞—Е, —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В –њ—А–Њ–і—Г–Ї—Ж–Є—О IgG –Є IgM –Ї –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –∞–љ—В–Є–≥–µ–љ–∞–Љ, –њ–Њ–≤—Л—И–∞—О—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –Ш–Ы–2 –Є –Ш–Ы–1. –§—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ –і–Є—Б—В—А–µ—Б—Б–—Б–Є–љ–і—А–Њ–Љ–∞, —А–µ–Ј–Ї–Њ —Г–≥–љ–µ—В–∞—О—Й–µ–≥–Њ —Д—Г–љ–Ї—Ж–Є—О —Д–∞–≥–Њ—Ж–Є—В–Њ–≤ [68], —Б–≤–Њ–є—Б—В–≤–µ–љ–µ–љ –њ–Њ—Б—В–∞–љ—В–Є–±–Є–Њ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ —Н—Д—Д–µ–Ї—В —Г—Б–Є–ї–µ–љ–Є—П –і–µ–є—Б—В–≤–Є—П —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ γ––Є–љ—В–µ—А—Д–µ—А–Њ–љ–∞ –љ–∞ —Д–∞–≥–Њ—Ж–Є—В–Є—А–Њ–≤–∞–љ–љ—Л–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л [69–71].
–Ю–њ—Л—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П
–њ—А–Є –Є–љ—Д–µ–Ї—Ж–Є—П—Е –љ–Є–ґ–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є
–Т–љ–µ–±–Њ–ї—М–љ–Є—З–љ–∞—П –њ–љ–µ–≤–Љ–Њ–љ–Є—П
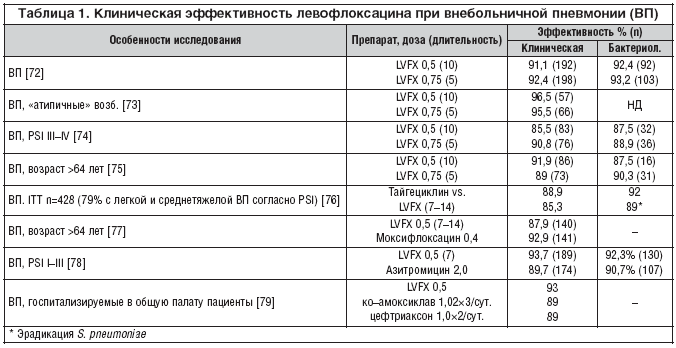
–®–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е «—А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е» —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —Б–≤—П–Ј–∞–љ–Њ —Б –њ–Њ–≤—Б–µ–Љ–µ—Б—В–љ—Л–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ–Љ —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Г –Є –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤ – –Њ—Б–љ–Њ–≤–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є. –Т–∞–ґ–љ—Г—О —А–Њ–ї—М —Б—Л–≥—А–∞–ї –Є —Б–њ–µ–Ї—В—А –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –≤–Ї–ї—О—З–∞—О—Й–Є–є «–∞—В–Є–њ–Є—З–љ—Л—Е» –Є –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ–Њ—Б–ї–µ–і–љ–Є–µ, –љ–∞—А—П–і—Г —Б S. pneumoniae, –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —З–∞—Б—В–Њ —П–≤–ї—П—О—В—Б—П –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ–Є —В—П–ґ–µ–ї–Њ–є —Д–Њ—А–Љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ –Є—Е —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –Ї LVFX –Љ–Є–љ–Є–Љ–∞–ї—М–љ–∞, –≤–њ–Њ–ї–љ–µ –њ–Њ–љ—П—В–љ—Л –њ—А–Є—З–Є–љ—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ —Г –ї–Є—Ж, —В—А–µ–±—Г—О—Й–Є—Е —Б—В–∞—Ж–Є–Њ–љ–∞—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –†—П–і –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–ґ–Є–Љ–Њ–≤ –Р–Ґ LVFX, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –≤ —В–∞–±–ї–Є—Ж–µ 1.
–Т –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–µ J. Bru –Є —Б–Њ–∞–≤—В., –≤–Ї–ї—О—З–Є–≤—И–µ–Љ 4 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М LVFX —Б—А–∞–≤–љ–Є–≤–∞–ї–∞—Б—М —Б –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–Љ–Є –≤ –ї–µ—З–µ–љ–Є–Є –Т–Я (–Ї–Њ––∞–Љ–Њ–Ї—Б–Є–Ї–ї–∞–≤, –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ, —Ж–µ—Д—В—А–Є–∞–Ї—Б–Њ–љ ± –Љ–∞–Ї—А–Њ–ї–Є–і) [80]. –Т –њ–Њ–і–≥—А—Г–њ–њ–µ, —Б–Њ—Б—В–Њ—П—Й–µ–є –Є–Ј 275 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤–Њ–є –Т–Я (86 —Б–ї—Г—З–∞–µ–≤ –±–∞–Ї—В–µ—А–Є–µ–Љ–Є–Є), –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М LVFX –≤ –і–Њ–Ј–µ 500 –Љ–≥/—Б—Г—В. –і–Њ—Б—В–Є–≥–ї–∞ 88,6%, —З—В–Њ –±—Л–ї–Њ —Б—А–∞–≤–љ–Є–Љ–Њ —Б 86,7% –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П. –Э–µ –Њ—В–ї–Є—З–∞–ї–∞—Б—М –Є —З–∞—Б—В–Њ—В–∞ —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П (90,2% vs. 90,4%).
–Я–Њ—Б–ї–µ–і—Г—О—Й–Є–є –∞–љ–∞–ї–Є–Ј J. Peterson –Є —Б–Њ–∞–≤—В., –≤—Л–њ–Њ–ї–љ–µ–љ–љ—Л–є —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ 10 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (1992–2002 –≥–≥.), –љ–µ –≤—Л—П–≤–Є–ї —Б–љ–Є–ґ–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є LVFX –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Т–Я, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ–—Г—Б—В–Њ–є—З–Є–≤—Л–Љ–Є –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞–Љ–Є (MDRS) [81]. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –≥—А—Г–њ–њ–µ MDRS —Б–Њ—Б—В–∞–≤–Є–ї–∞ 96,3% (52/54). –Т —Б–ї—Г—З–∞–µ —Б–≤—П–Ј–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б S. pneumoniae, —Г—Б—В–Њ–є—З–Є–≤—Л–Љ –љ–µ –±–Њ–ї–µ–µ —З–µ–Љ –Ї 1 –Р–С, –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –і–Њ—Б—В–Є–≥ 95,1% (347/365). –Э–µ –Њ—В–ї–Є—З–∞–ї–∞—Б—М –Є —З–∞—Б—В–Њ—В–∞ —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞, —Б–Њ—Б—В–∞–≤–Є–≤—И–∞—П 96,3 –Є 95,6%.
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –і–µ—Б—П—В–Є–ї–µ—В–Є–µ LVFX –±–ї–∞–≥–Њ–і–∞—А—П —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ–Љ—Г –њ—А–Њ—Д–Є–ї—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є —Г–і–Њ–±—Б—В–≤—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤—Б–µ —З–∞—Й–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –≤ —В–µ—А–∞–њ–Є–Є «–∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е» –Є–љ—Д–µ–Ї—Ж–Є–є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –љ–µ—В—П–ґ–µ–ї–Њ–є –Т–Я. –Ъ—А–∞–є–љ–µ –Є–љ—В–µ—А–µ—Б–љ–Њ–µ —Б–Њ–Њ–±—Й–µ–љ–Є–µ –њ–Њ –њ—А–Њ–±–ї–µ–Љ–µ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П LVFX –њ—А–Є –Т–Я –±—Л–ї–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ X. Ye –Є —Б–Њ–∞–≤—В. [82]. –°—А–∞–≤–љ–Є–≤–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Р–Ґ LVFX –≤ –і–Њ–Ј–µ 500–750 –Љ–≥/—Б—Г—В. (n=2968) –Є –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ–Є (n=4558), –∞–≤—В–Њ—А—Л –≤—Л—П–≤–Є–ї–Є —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –≤ –≥—А—Г–њ–њ–µ LVFX (p=0,003). –£–Љ–µ–љ—М—И–Є–ї–∞—Б—М –≤ –≥—А—Г–њ–њ–µ LVFX –Є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –Њ–±—А–∞—Й–µ–љ–Є—П –Ј–∞ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–є –њ–Њ–Љ–Њ—Й—М—О (p=0,009). –Э–∞–Є–±–Њ–ї—М—И–Є–µ —А–∞–Ј–ї–Є—З–Є—П –Њ—В–Љ–µ—З–µ–љ—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б—В–∞—А—И–µ 50 –ї–µ—В (p=0,049).
–Я—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є –Њ–і–љ–Њ–≥–Њ –Є–Ј —Д–∞—А–Љ–∞–Ї–Њ—Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є – –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Б—В–∞—Ж–Є–Њ–љ–∞—А–љ–Њ–≥–Њ —Н—В–∞–њ–∞ –ї–µ—З–µ–љ–Є—П LVFX –Њ–Ї–∞–Ј–∞–ї—Б—П –±–Њ–ї–µ–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ–Њ–Ї—Б–Є—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–Њ–Љ. –Я—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–≤ –і–≤–µ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–µ –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (n=1594), J. Schein –Є —Б–Њ–∞–≤—В. –≤—Л—П–≤–Є–ї–Є —А–∞–Ј–ї–Є—З–Є–µ –Ї–∞–Ї –њ–Њ –і–∞–љ–љ–Њ–Љ—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—О (5,8 vs. 6,4 –і–љ—П; p=0,02), —В–∞–Ї –Є –њ–Њ –Њ–±—Й–µ–є —Б—В–Њ–Є–Љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П (—А–∞–Ј–ї–Є—З–Є–µ = $129; p=0,75) [83], –љ–µ –љ–∞—И–µ–і—И–µ–µ, –Њ–і–љ–∞–Ї–Њ, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –≤ –і—А—Г–≥–Њ–є —А–∞–±–Њ—В–µ [84].
–Р–љ–∞–ї–Њ–≥–Є—З–љ—Г—О –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Г—О –і–Є–љ–∞–Љ–Є–Ї—Г –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≤—Л—Б–Њ–Ї–Њ–і–Њ–Ј–Њ–≤–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –Р–Ґ LVFX (750 –Љ–≥) –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є C. Frei —Б —Б–Њ–∞–≤—В. [85]. –Т –і–∞–љ–љ–Њ–Љ —Б–ї—Г—З–∞–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б—А–∞–≤–љ–µ–љ–Є—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–∞—Б—М –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Ж–µ—Д—В—А–Є–∞–Ї—Б–Њ–љ–∞ (1000 –Љ–≥/—Б—Г—В.) —Б –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ (500 –Љ–≥/—Б—Г—В.). –Т —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–µ –≤ –°–®–Р —Б 2005 –њ–Њ 2007 –≥., –≤–Ї–ї—О—З–∞–ї–Є—Б—М –њ–∞—Ж–Є–µ–љ—В—Л —Б –Т–Я, —В—А–µ–±—Г—О—Й–Є–µ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –≤ –Њ–±—Й—Г—О –њ–∞–ї–∞—В—Г. –Ю—Ж–µ–љ–Є–≤–∞—П –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ –Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Р–С, –∞–≤—В–Њ—А—Л –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ LVFX. –Ъ–∞–Ї –њ–Њ –њ–µ—А–≤–Њ–Љ—Г (4,6±0,17 vs. 5,4±0,22 –і–љ.), —В–∞–Ї –Є –њ–Њ –≤—В–Њ—А–Њ–Љ—Г (3,6±0,17 vs. 4,8±0,21 –і–љ.) –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—О —А–∞–Ј–ї–Є—З–Є—П –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ–Є (p<0,01). –Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ LVFX —Б–Њ—Е—А–∞–љ—П–ї–Є—Б—М –Є —Б—А–µ–і–Є –ї–Є—Ж —Б –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ –Є–љ–і–µ–Ї—Б–Њ–Љ PSI, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–Љ III –Є IV –Ї–ї–∞—Б—Б—Г.
–Ю–±–Њ—Б—В—А–µ–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –ї–µ–≥–Ї–Є—Е (—Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–≥–Њ –±—А–Њ–љ—Е–Є—В–∞)
–Я–Њ—Б–ї–µ–і–љ–µ–µ –і–µ—Б—П—В–Є–ї–µ—В–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ –Є–љ—В–µ—А–µ—Б–Њ–Љ –Ї —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–Љ —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П—Е —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –ї–µ–≥–Ї–Є—Е (–Њ–•–Ю–С–Ы). –Ю–±–Њ—Б—В—А–µ–љ–Є–µ – –Њ–і–Є–љ –Є–Ј —Н—В–∞–њ–Њ–≤ –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –•–Ю–С–Ы. –°–Њ—Б—В–Њ—П–љ–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –Њ—Б—В—А—Л–Љ, —Н–њ–Є–Ј–Њ–і–Є—З–µ—Б–Ї–Є –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–Љ —Г—Е—Г–і—И–µ–љ–Є–µ–Љ –≤ –≤–Є–і–µ —Г—Б–Є–ї–µ–љ–Є—П –Њ–і—Л—И–Ї–Є, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ–±—К–µ–Љ–∞ –Є/–Є–ї–Є —Е–∞—А–∞–Ї—В–µ—А–∞ –Љ–Њ–Ї—А–Њ—В—Л, —В—А–µ–±—Г—О—Й–Є–µ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –њ—А–Є–≤—Л—З–љ–Њ–є —В–µ—А–∞–њ–Є–Є [86].
–Ю—Б–љ–Њ–≤–љ—Л–µ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–Є –Њ–•–Ю–С–Ы –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л Haemophilus spp (30–70%), –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–µ—В–Є–њ–Є—А—Г–µ–Љ—Л–Љ–Є —И—В–∞–Љ–Љ–∞–Љ–Є H. influenzae [87–92]. –Э–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–µ–љ—М—И–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Њ—В–≤–Њ–і–Є—В—Б—П M. catarrhalis (8–13%) –Є S. pneumoniae (10–15%; 0–18% –њ–Њ [90]). –Ш, –љ–∞–Ї–Њ–љ–µ—Ж, –Љ–µ–љ–µ–µ —З–µ–Љ –≤ 5% —Б–ї—Г—З–∞–µ–≤ –≤—Л–і–µ–ї—П—О—В—Б—П Pseudomonas aeruginosa –Є Enterobacteriaceae, –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ Klebsiella pneumoniae –Є Escherichia coli [87,91,93–102]. –°–Є—В—Г–∞—Ж–Є—П –Љ–µ–љ—П–µ—В—Б—П –њ—А–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–≤–Њ–Ј—А–∞—Б—В >65 –ї–µ—В, –±—А–Њ–љ—Е–Њ—Н–Ї—В–∞–Ј—Л, –Ю–§–Т1≤30–35% –Њ—В –і–Њ–ї–ґ–љ–Њ–≥–Њ, ≥4 –Њ–±–Њ—Б—В—А–µ–љ–Є–є –≤ –≥–Њ–і [89], –і–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Є–µ–Љ —Б–Є—Б—В–µ–Љ–љ—Л—Е –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤, —В—П–ґ–µ–ї–∞—П —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Р–Я –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ 3 –Љ–µ—Б [98,103], –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤–∞–Ї—Ж–Є–љ–∞—Ж–Є–Є –њ—А–Њ—В–Є–≤ –≥—А–Є–њ–њ–∞ [103]). –Т –і–∞–љ–љ–Њ–Љ —Б–ї—Г—З–∞–µ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –Ј–љ–∞—З–µ–љ–Є–µ Pseudomonas spp (8–29% [89,104]) –Є —Н–љ—В–µ—А–Њ–±–∞–Ї—В–µ—А–Є–є [89,93,98,104,105].
–Я–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –Р–Я –њ—А–Є –Њ—Б–Љ–Њ—В—А–µ –њ–∞—Ж–Є–µ–љ—В–∞ —П–≤–ї—П–µ—В—Б—П –љ–∞–ї–Є—З–Є–µ ≥2 —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Њ–±–Њ—Б—В—А–µ–љ–Є—П (I –Є II —В–Є–њ) [94,106]. –°–Њ–≥–ї–∞—Б–љ–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–∞–Љ [101,107,108] –∞–і–µ–Ї–≤–∞—В–љ—Л–Љ–Є –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–Є –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є –•–Ю–С–Ы, —Б—З–Є—В–∞—О—В—Б—П –њ—А–µ–њ–∞—А–∞—В—Л, –∞–Ї—В–Є–≤–љ—Л–µ –њ—А–Њ—В–Є–≤ H. influenzae, M. catarrhalis –Є S. pneumoniae. –Ю–±–Њ—Б—В—А–µ–љ–Є—П —В—П–ґ–µ–ї–Њ–є –•–Ю–С–Ы —В—А–µ–±—Г–µ—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –∞–Ї—В–Є–≤–љ—Л—Е, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ—А–Њ—В–Є–≤ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞ –Є, —Б –і—А—Г–≥–Њ–є – –њ—А–Њ—В–Є–≤ –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є. –Ы–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Ї—А–Є—В–µ—А–Є—П–Љ «–Є–і–µ–∞–ї—М–љ–Њ–≥–Њ» –њ—А–µ–њ–∞—А–∞—В–∞, —З—В–Њ –Њ—В—А–∞–ґ–∞–µ—В—Б—П –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П.
–Т —З–∞—Б—В–љ–Њ—Б—В–Є, –≤ —А–∞–±–Њ—В–µ –Р. Ruiz–Gonzalez –Є —Б–Њ–∞–≤—В. –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ LVFX —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М –љ–∞–Є–Љ–µ–љ—М—И–µ–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —З–∞—Б—В–Њ—В–Њ–є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –Ј–∞ 6 –Љ–µ—Б. –њ–µ—А–Є–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П (34% vs. 66%) [109]. –£–і–ї–Є–љ–µ–љ–Є–µ –Љ–µ–ґ–њ—А–Є—Б—В—Г–њ–љ–Њ–≥–Њ –Є–љ—В–µ—А–≤–∞–ї–∞ –Є –±–Њ–ї–µ–µ –±—Л—Б—В—А–Њ–µ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л—Е –∞–≤—В–Њ—А–Њ–≤ [110]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ (–≤–Њ–Ј—А–∞—Б—В >64 –ї–µ—В, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В, –њ—А–Є–µ–Љ –Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤) –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ LVFX —Б—В–∞–љ–Њ–≤—П—В—Б—П –±–Њ–ї–µ–µ –Ј–∞–Љ–µ—В–љ—Л–Љ–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –і–Њ 750–1000 –Љ–≥ –і–Њ–Ј–µ [15,111–113]. –Т—Л—Б–Њ–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –±—Л–ї–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –≤ –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, —Б—А–∞–≤–љ–Є–≤–∞–≤—И–µ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М LVFX (500 –Љ–≥) –Є –Љ–Њ–Ї—Б–Є—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ (400 –Љ–≥), –њ—А–Є–љ–Є–Љ–∞–µ–Љ—Л—Е –≤ —В–µ—З–µ–љ–Є–µ 7 –Є 5 —Б—Г—В. —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –С–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Є—Б—Е–Њ–і –±—Л–ї –і–Њ—Б—В–Є–≥–љ—Г—В —Г 94 –Є 91% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Н—А–∞–і–Є–Ї–∞—Ж–Є—П –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є – –≤ 93,8 –Є 92,8% —Б–ї—Г—З–∞—П—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [114].
–Э–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ LVFX –≤ –і–Њ–Ј–µ 500 –Є 750 –Љ–≥ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є (–Э–†) –≤ 49 –Є 45,5%; —В–Њ–ї—М–Ї–Њ 7,6–8% –Є–Ј –љ–Є—Е –Њ—Ж–µ–љ–Є–≤–∞—О—В—Б—П, –Ї–∞–Ї —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –њ—А–µ–њ–∞—А–∞—В–Њ–Љ [115]. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ–Є –Э–† —П–≤–ї—П—О—В—Б—П –њ–Њ—Б–ї–∞–±–ї–µ–љ–Є–µ —Б—В—Г–ї–∞ –Є —В–Њ—И–љ–Њ—В–∞; —Б–µ—А—М–µ–Ј–љ–Њ–є, —Е–Њ—В—П –Є –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ–є –Э–†, —П–≤–ї—П–µ—В—Б—П —А–∞–Ј—А—Л–≤ —Б—Г—Е–Њ–ґ–Є–ї–Є–є, –љ–∞–±–ї—О–і–∞–µ–Љ—Л–є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ LVFX, –њ–Њ –і–∞–љ–љ—Л–Љ –±–Њ–ї—М—И–Њ–≥–Њ —З–Є—Б–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ —Г–і–ї–Є–љ–µ–љ–Є—П –Є–љ—В–µ—А–≤–∞–ї–∞ Q–T, –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О —Н–њ–Є–Ј–Њ–і–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–Є –Є –∞—А–Є—В–Љ–Є–Є [116]. –Ю–њ–Є—Б–∞–љ–љ—Л–µ —Б–ї—Г—З–∞–Є «torsade de pointes», –љ–∞–±–ї—О–і–∞–µ–Љ—Л–µ —Г –њ–Њ–ї—Г—З–∞–≤—И–Є—Е LVFX –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —П–≤–ї—П—О—В—Б—П –Ї–∞–Ј—Г–Є—Б—В–Є–Ї–Њ–є [117]. –Я—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –Р–Ґ –≤ —Б–≤—П–Ј–Є —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –Э–† —В—А–µ–±—Г–µ—В—Б—П –Љ–µ–љ–µ–µ —З–µ–Љ –≤ 2% —Б–ї—Г—З–∞–µ–≤ [115]. –Я–Њ –і—А—Г–≥–Є–Љ –і–∞–љ–љ—Л–Љ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є LVFX –њ—А–Є –Т–Я, —З–∞—Б—В–Њ—В–∞ –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 7–8,3% (750 –Є 500 –Љ–≥), –Њ–і–љ–∞–Ї–Њ —Б–ї—Г—З–∞–µ–≤ –Њ—В–Љ–µ–љ—Л, –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –њ—А–µ–њ–∞—А–∞—В–Њ–Љ, –±—Л–ї–Њ –≥–Њ—А–∞–Ј–і–Њ –Љ–µ–љ—М—И–µ [72].
–Ъ–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В—М
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ – –≤–∞–ґ–љ–Њ–µ —Б–≤–Њ–є—Б—В–≤–Њ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–µ–µ –≤—Л—Б–Њ–Ї—Г—О –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ф–∞–љ–љ–∞—П –њ—А–Њ–±–ї–µ–Љ–∞ –њ—А–Є–≤–ї–µ–Ї–∞–µ—В –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –≤—Б–µ –±–Њ–ї—М—И–µ–µ –≤–љ–Є–Љ–∞–љ–Є–µ. –Ю —В–Њ–Љ, —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —З–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞—А—Г—И–∞—О—В —А–µ–ґ–Є–Љ –Р–Ґ, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –і–∞–љ–љ—Л–µ –љ–µ–і–∞–≤–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–∞–љ–Є–µ–є –†–Ю–Ь–Ш–† –Њ–њ—А–Њ—Б–∞, –Њ—Е–≤–∞—В–Є–≤—И–µ–≥–Њ 1575 —З–µ–ї–Њ–≤–µ–Ї. –°–Њ–≥–ї–∞—Б–љ–Њ –µ–Љ—Г –Ї–∞–ґ–і—Л–є –≤—В–Њ—А–Њ–є —А–Њ—Б—Б–Є—П–љ–Є–љ –љ–µ —Б–Њ–±–ї—О–і–∞–µ—В –њ—А–µ–і–њ–Є—Б–∞–љ–љ—Г—О —В–µ—А–∞–њ–Є—О, –њ—А–Њ–њ—Г—Б–Ї–∞–µ—В –і–Њ–Ј—Г –њ—А–µ–њ–∞—А–∞—В–∞ –Є–ї–Є —Б–Њ–Ї—А–∞—Й–∞–µ—В —З–∞—Б—В–Њ—В—Г –њ—А–Є–µ–Љ–∞. –Ґ–Њ–ї—М–Ї–Њ 45% —А–µ—Б–њ–Њ–љ–і–µ–љ—В–Њ–≤ —Б–ї–µ–і—Г—О—В —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –Ї—Г—А—Б–∞ –ї–µ—З–µ–љ–Є—П, –∞ 51% – –і–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ –Љ–Њ–Љ–µ–љ—В–∞. –Т –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Є—З–Є–љ—Л –љ–Є–Ј–Ї–Њ–є –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є —Г–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–µ—Г–і–Њ–±–љ–∞—П —Б—Е–µ–Љ–∞ (19%) –Є –±–Њ–ї–µ–µ —З–µ–Љ –Њ–і–љ–Њ–Ї—А–∞—В–љ—Л–є –њ—А–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ (16%) [118,119].
–Т—Л–≤–Њ–і—Л –Њ –ї—Г—З—И–µ–є –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–µ–љ–љ–Њ–є —Б—Е–µ–Љ–µ —В–µ—А–∞–њ–Є–Є –њ—А–Є —Б–Њ–Ї—А–∞—Й–µ–љ–Є–Є –Ї–∞–Ї –Ї—А–∞—В–љ–Њ—Б—В–Є –њ—А–Є–µ–Љ–∞, —В–∞–Ї –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –љ–µ –њ–Њ–і–ї–µ–ґ–∞—В —Б–Њ–Љ–љ–µ–љ–Є—О. –Я–Њ –і–∞–љ–љ—Л–Љ J. Peshere –Є —Б–Њ–∞–≤—В., —А–µ–ґ–Є–Љ –љ–∞—А—Г—И–∞–ї—Б—П –≤ 14,9% —Б–ї—Г—З–∞–µ–≤ –њ—А–Є –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–Љ –Є –≤ 27% –њ—А–Є 3––Ї—А–∞—В–љ–Њ–Љ –Є –±–Њ–ї–µ–µ –њ—А–Є–µ–Љ–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ [119]. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Є–≤–Њ–і–Є—В P. Kardas, –Њ–±—Б–ї–µ–і–Њ–≤–∞–≤—И–Є–є –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±—А–Њ–љ—Е–Є—В–∞ [120,121]. –Я—А–Є –Њ–і–љ–Њ– –Є–ї–Є –і–≤—Г–Ї—А–∞—В–љ–Њ–Љ —Б—Г—В–Њ—З–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Г—О –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Р–Ґ –Є –Љ–µ–ґ–і–Њ–Ј–Њ–≤—Л–є –Є–љ—В–µ—А–≤–∞–ї —Б–Њ–±–ї—О–і–∞–ї–Є 80,3% vs. 68,6% –Є 74,4% vs. 56,4% –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я–Њ–і–Њ–±–љ–∞—П —В–µ–љ–і–µ–љ—Ж–Є—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ –≤ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–µ 76 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (–Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В—М 79% vs. 69%) [122].
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ы–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ (–Ґ–∞–≤–∞–љ–Є–Ї®) –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г–µ—В –≤—Л—Б–Њ–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ—Б–љ–Њ–≤–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Є–љ—Д–µ–Ї—Ж–Є–є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Т–Я –Є –Њ–•–Ю–С–Ы. –І—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞ –Ї LVFX –њ—А–µ–≤—Л—И–∞–µ—В 99%, –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Њ—В–Љ–µ—З–µ–љ –Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –і—А—Г–≥–Є—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є. –Т—Б–µ —Н—В–Њ –Њ–њ—А–µ–і–µ–ї—П–µ—В –≤—Л—Б–Њ–Ї–Є–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —А–µ–≥–Є–Њ–љ–∞—Е —Б —И–Є—А–Њ–Ї–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М—О —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤.
–≠–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ LVFX –љ–∞–Є–±–Њ–ї–µ–µ –∞—А–≥—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–Њ —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ –•–Ю–С–Ы –Є–ї–Є –Т–Я. –Т –і–∞–љ–љ–Њ–Љ —Б–ї—Г—З–∞–µ —В–∞–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞, –Ї–∞–Ї –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–≥–Њ —Б—Г—В–Њ—З–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞, –љ–∞—А—П–і—Г —Б —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О, –Є–≥—А–∞—О—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Lee CK, Boyle MP, Diener–West M, Brass–Ernst L, Noschese M, Zeitlin PL. Levofloxacin pharmacokinetics in adult cystic fibrosis. Chest. Mar 2007;131(3):796–802.
2. Nomura K, Fujimoto Y, Morimoto Y, Kanbayashi Y, Matsumoto Y, Taniwaki M. Population pharmacokinetics of levofloxacin as prophylaxis for febrile neutropenia. Internal medicine (Tokyo, Japan). 2008;47(5):375–378.
3. Nicolle L, Duckworth H, Sitar D, Bryski L, Harding G, Zhanel G. Pharmacokinetics/pharmacodynamics of levofloxacin 750 mg once daily in young women with acute uncomplicated pyelonephritis. International journal of antimicrobial agents. Mar 2008;31(3):287–289.
4. Oberdorfer K, Swoboda S, Hamann A, et al. Tissue and serum levofloxacin concentrations in diabetic foot infection patients. Journal of Antimicrobial Chemotherapy. 2004;54(4):836–839.
5. Garraffo R, Lavrut T, Durant J, et al. In vivo comparative pharmacokinetics and pharmacodynamics of moxifloxacin and levofloxacin in human neutrophils. Clinical drug investigation. 2005;25(10):643–650.
6. Peloquin CA, Hadad DJ, Molino LP, et al. Population pharmacokinetics of levofloxacin, gatifloxacin, and moxifloxacin in adults with pulmonary tuberculosis. Antimicrobial agents and chemotherapy. Mar 2008;52(3):852–857.
7. Kiser TH, Hoody DW, Obritsch MD, Wegzyn CO, Bauling PC, Fish DN. Levofloxacin pharmacokinetics and pharmacodynamics in patients with severe burn injury. Antimicrobial agents and chemotherapy. Jun 2006;50(6):1937–1945.
8. Zeitlinger MA, Traunmuller F, Abrahim A, et al. A pilot study testing whether concentrations of levofloxacin in interstitial space fluid of soft tissues may serve as a surrogate for predicting its pharmacokinetics in lung. International journal of antimicrobial agents. Jan 2007;29(1):44–50.
9. Wagenlehner FM, Kinzig–Schippers M, Sorgel F, Weidner W, Naber KG. Concentrations in plasma, urinary excretion and bactericidal activity of levofloxacin (500 mg) versus ciprofloxacin (500 mg) in healthy volunteers receiving a single oral dose. International journal of antimicrobial agents. Dec 2006;28(6):551–559.
10. Noreddin AM, Marras TK, Sanders K, Chan CK, Hoban DJ, Zhanel GG. Pharmacodynamic target attainment analysis against Streptococcus pneumoniae using levofloxacin 500 mg, 750 mg and 1000 mg once daily in plasma (P) and epithelial lining fluid (ELF) of hospitalized patients with community acquired pneumonia (CAP). International journal of antimicrobial agents. Nov 2004;24(5):479–484.
11. Conte JE, Jr., Golden JA, McIver M, Zurlinden E. Intrapulmonary pharmacokinetics and pharmacodynamics of high–dose levofloxacin in healthy volunteer subjects. International journal of antimicrobial agents. Aug 2006;28(2):114–121.
12. LaPlante KL, Rybak MJ, Tsuji B, Lodise TP, Kaatz GW. Fluoroquinolone resistance in Streptococcus pneumoniae: area under the concentration–time curve/MIC ratio and resistance development with gatifloxacin, gemifloxacin, levofloxacin, and moxifloxacin. Antimicrobial agents and chemotherapy. Apr 2007;51(4):1315–1320.
13. Lister PD. Pharmacodynamics of levofloxacin against characterized ciprofloxacin–resistant Streptococcus pneumoniae. Postgraduate medicine. Sep 2008;120(3 Suppl 1):46–52.
14. Murillo O, Pachon ME, Euba G, et al. High doses of levofloxacin vs moxifloxacin against staphylococcal experimental foreign–body infection: the effect of higher MIC–related pharmacokinetic parameters on efficacy. J Infect. Mar 2009;58(3):220–226.
15. Conte JE, Jr., Golden JA, McIver M, Little E, Zurlinden E. Intrapulmonary pharmacodynamics of high–dose levofloxacin in subjects with chronic bronchitis or chronic obstructive pulmonary disease. International journal of antimicrobial agents. Nov 2007;30(5):422–427.
16. Wagenlehner FM, Kinzig–Schippers M, Tischmeyer U, et al. Pharmacokinetics of ciprofloxacin XR (1000 mg) versus levofloxacin (500 mg) in plasma and urine of male and female healthy volunteers receiving a single oral dose. International journal of antimicrobial agents. 2006;27(1):7–14.
17. Pai MP, Allen SE, Amsden GW. Altered steady state pharmacokinetics of levofloxacin in adult cystic fibrosis patients receiving calcium carbonate. J Cyst Fibros. Aug 2006;5(3):153–157.
18. Stergiopoulou T, Meletiadis J, Sein T, et al. Comparative pharmacodynamic interaction analysis between ciprofloxacin, moxifloxacin and levofloxacin and antifungal agents against Candida albicans and Aspergillus fumigatus. The Journal of antimicrobial chemotherapy. Feb 2009;63(2):343–348.
19. Hurst M, Lamb HM, Scott LJ, Figgitt DP. Levofloxacin: an updated review of its use in the treatment of bacterial infections. Drugs. 2002;62(14):2127–2167.
20. Drusano GL, Johnson DE, Rosen M, Standiford HC. Pharmacodynamics of a fluoroquinolone antimicrobial agent in a neutropenic rat model of Pseudomonas sepsis. Antimicrobial agents and chemotherapy. 1993;37(3):483–490.
21. Preston SL, Drusano GL, Berman AL, et al. Pharmacodynamics of levofloxacin: a new paradigm for early clinical trials. Jama. 1998;279(2):125–129.
22. Scaglione F, Mouton JW, Mattina R, Fraschini F. Pharmacodynamics of levofloxacin and ciprofloxacin in a murine pneumonia model: peak concentration/MIC versus area under the curve/MIC ratios. Antimicrobial agents and chemotherapy. Sep 2003;47(9):2749–2755.
23. Odenholt I, Cars O. Pharmacodynamics of moxifloxacin and levofloxacin against Streptococcus pneumoniae, Staphylococcus aureus, Klebsiella pneumoniae and Escherichia coli: simulation of human plasma concentrations after intravenous dosage in an in vitro kinetic model. The Journal of antimicrobial chemotherapy. 2006;58(5):960–965.
24. Deryke CA, Du X, Nicolau DP. Evaluation of bacterial kill when modelling the bronchopulmonary pharmacokinetic profile of moxifloxacin and levofloxacin against parC–containing isolates of Streptococcus pneumoniae. The Journal of antimicrobial chemotherapy. Sep 2006;58(3):601–609.
25. Ambrose PG, Bhavnani SM, Rubino CM, et al. Pharmacokinetics–Pharmacodynamics of Antimicrobial Therapy: It’s Not Just for Mice Anymore. Clin Infect Dis. 2007;44(1):79–86.
26. Booker BM, Smith PF, Forrest A, et al. Application of an In Vitro Infection Model and Simulation for Reevaluation of Fluoroquinolone Breakpoints for Salmonella enterica Serotype Typhi. Antimicrobial agents and chemotherapy. 2005;49(5):1775–1781.
27. Bhavnani SM, Forrest A, Hammel JP, Drusano GL, Rubino CM, Ambrose PG. Pharmacokinetics–pharmacodynamics of quinolones against Streptococcus pneumoniae in patients with community–acquired pneumonia. Diagnostic microbiology and infectious disease. Sep 2008;62(1):99–101.
28. Drusano GL, Preston SL, Fowler C, Corrado M, Weisinger B, Kahn J. Relationship between fluoroquinolone area under the curve: minimum inhibitory concentration ratio and the probability of eradication of the infecting pathogen, in patients with nosocomial pneumonia. The Journal of infectious diseases. May 1 2004;189(9):1590–1597.
29. Defife R, Scheetz MH, Feinglass JM, Postelnick MJ, Scarsi KK. Effect of differences in MIC values on clinical outcomes in patients with bloodstream infections caused by gram–negative organisms treated with levofloxacin. Antimicrobial agents and chemotherapy. Mar 2009;53(3):1074–1079.
30. Mouton JW. Impact of pharmacodynamics on breakpoint selection for susceptibility testing. Infectious disease clinics of North America. Sep 2003;17(3):579–598.
31. Frei CR, Wiederhold NP, Burgess DS. Antimicrobial breakpoints for gram–negative aerobic bacteria based on pharmacokinetic–pharmacodynamic models with Monte Carlo simulation. The Journal of antimicrobial chemotherapy. Mar 2008;61(3):621–628.
32. Ishida H, Ishida Y, Kurosaka Y, Otani T, Sato K, Kobayashi H. In vitro and in vivo activities of levofloxacin against biofilm–producing Pseudomonas aeruginosa. Antimicrobial agents and chemotherapy. Jul 1998;42(7):1641–1645.
33. Passerini de Rossi B, Garcia C, Calenda M, Vay C, Franco M. Activity of levofloxacin and ciprofloxacin on biofilms and planktonic cells of Stenotrophomonas maltophilia isolates from patients with device–associated infections. International journal of antimicrobial agents. Sep 2009;34(3):260–264.
34. Kaji C, Watanabe K, Apicella MA, Watanabe H. Antimicrobial effect of fluoroquinolones for the eradication of nontypeable Haemophilus influenzae isolates within biofilms. The Tohoku journal of experimental medicine. Feb 2008;214(2):121–128.
35. Jones RN, Fritsche TR, Sader HS, Stilwell MG. Activity of garenoxacin, an investigational des–F(6)–quinolone, tested against pathogens from community–acquired respiratory tract infections, including those with elevated or resistant–level fluoroquinolone MIC values. Diagnostic microbiology and infectious disease. May 2007;58(1):9–17.
36. Biedenbach DJ, Toleman MA, Walsh TR, Jones RN. Characterization of fluoroquinolone–resistant beta–hemolytic Streptococcus spp. isolated in North America and Europe including the first report of fluoroquinolone–resistant Streptococcus dysgalactiae subspecies equisimilis: report from the SENTRY Antimicrobial Surveillance Program (1997–2004). Diagnostic microbiology and infectious disease. Jun 2006;55(2):119–127.
37. Bastida T, Perez–Vazquez M, Campos J, et al. Levofloxacin treatment failure in Haemophilus influenzae pneumonia. Emerging infectious diseases. Nov 2003;9(11):1475–1478.
38. Perez–Vazquez M, Roman F, Aracil B, Canton R, Campos J. Laboratory Detection of Haemophilus influenzae with Decreased Susceptibility to Nalidixic Acid, Ciprofloxacin, Levofloxacin, and Moxifloxacin Due to gyrA and parC Mutations. Journal of clinical microbiology. 2004;42(3):1185–1191.
39. Jones RN, Sader HS, Fritsche TR, Pottumarthy S. Comparisons of parenteral broad–spectrum cephalosporins tested against bacterial isolates from pediatric patients: report from the SENTRY Antimicrobial Surveillance Program (1998–2004). Diagnostic microbiology and infectious disease. Jan 2007;57(1):109–116.
40. Seral C, Suarez L, Rubio–Calvo C, et al. In vitro activity of cefditoren and other antimicrobial agents against 288 Streptococcus pneumoniae and 220 Haemophilus influenzae clinical strains isolated in Zaragoza, Spain. Diagnostic microbiology and infectious disease. Oct 2008;62(2):210–215.
41. Sahm DF, Brown NP, Thornsberry C, Jones ME. Antimicrobial susceptibility profiles among common respiratory tract pathogens: a GLOBAL perspective. Postgraduate medicine. Sep 2008;120(3 Suppl 1):16–24.
42. Gracia M, Diaz C, Coronel P, et al. Antimicrobial susceptibility of Streptococcus pyogenes in Central, Eastern, and Baltic European Countries, 2005 to 2006: the cefditoren surveillance program. Diagnostic microbiology and infectious disease. May 2009;64(1):52–56.
43. Alou L, Aguilar L, Sevillano D, et al. Levofloxacin vs. azithromycin pharmacodynamic activity against S. pneumoniae and H. influenzae with decreased susceptibility to amoxicillin/clavulanic acid. Journal of chemotherapy (Florence, Italy). Dec 2007;19(6):670–672.
44. Zhanel GG, DeCorby M, Nichol KA, et al. Antimicrobial susceptibility of 3931 organisms isolated from intensive care units in Canada: Canadian National Intensive Care Unit Study, 2005/2006. Diagnostic microbiology and infectious disease. Sep 2008;62(1):67–80.
45. Zhang J, Yu JC, Shi YG, et al. [Study of pharmacokinetics/pharmacodynamics of levofloxacin]. Zhonghua Yi Xue Za Zhi. 2005;85(27):1926–1932.
46. Yamaguchi K, Ohno A, Ishii Y, et al. [In–vitro susceptibilites to levofloxacin and various antibacterial agents of 18,639 clinical isolates obtained from 77 centers in 2004]. The Japanese journal of antibiotics. Dec 2006;59(6):428–451.
47. –Ф–µ—Е–љ–Є—З –Р–Т, –≠–є–і–µ–ї—М—И—В–µ–є–љ –Ш–Р, –Э–∞—А–µ–Ј–Ї–Є–љ–∞ –Р–Ф, et al. –≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –љ–Њ–Ј–Њ–Ї–Њ–Љ–Є–∞–ї—М–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ Staphylococcus aureus –≤ –†–Њ—Б—Б–Є–Є: —А–µ–Ј—Г–ї—М—В–∞—В—Л –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—П –Є –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–∞—П —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П. 2002;4(4):325–336.
48. Fritsche TR, Sader HS, Jones RN. Potency and spectrum of garenoxacin tested against an international collection of skin and soft tissue infection pathogens: report from the SENTRY antimicrobial surveillance program (1999–2004). Diagnostic microbiology and infectious disease. May 2007;58(1):19–26.
49. Goff DA, Dowzicky MJ. Prevalence and regional variation in meticillin–resistant Staphylococcus aureus (MRSA) in the USA and comparative in vitro activity of tigecycline, a glycylcycline antimicrobial. Journal of medical microbiology. Sep 2007;56(Pt 9):1189–1193.
50. Huband MD, Cohen MA, Zurack M, et al. In vitro and in vivo activities of PD 0305970 and PD 0326448, new bacterial gyrase/topoisomerase inhibitors with potent antibacterial activities versus multidrug–resistant gram–positive and fastidious organism groups. Antimicrobial agents and chemotherapy. Apr 2007;51(4):1191–1201.
51. Sader HS, Watters AA, Fritsche TR, Jones RN. Activity of daptomycin and selected antimicrobial agents tested against Staphylococcus aureus from patients with bloodstream infections hospitalized in European medical centers. Journal of chemotherapy (Florence, Italy). Feb 2008;20(1):28–32.
52. Lanzafame A, Bonfiglio G, Santini L, Mattina R. In vitro activity of levofloxacin against recent Gram–negative nosocomial pathogens. Chemotherapy. Mar 2005;51(1):44–50.
53. Guss J, Doghramji L, Edelstein PH, Chiu AG. Fluoroquinolone–Resistant Pseudomonas aeruginosa in Chronic Rhinosinusitis. ORL; journal for oto–rhino–laryngology and its related specialties. Sep 30 2009;71(5):263–267.
54. Paterson DL, Adams J, Doi Y. In vitro activity of PZ–601 (SMP– 601), a novel carbapenem, against extended–spectrum beta–lactamase producing organisms [poster no. F1–346]. 47th Interscience Conference on Antimicrobial Agents and Chemotherapy; 2007 Sep 17–20; Chicago (IL).
55. Rossi F, Baquero F, Hsueh PR, et al. In vitro susceptibilities of aerobic and facultatively anaerobic Gram–negative bacilli isolated from patients with intra–abdominal infections worldwide: 2004 results from SMART (Study for Monitoring Antimicrobial Resistance Trends). The Journal of antimicrobial chemotherapy. Jul 2006;58(1):205–210.
56. Hsieh YC, Chang LY, Huang YC, Lin HC, Huang LM, Hsueh PR. Circulation of international clones of levofloxacin non–susceptible Streptococcus pneumoniae in Taiwan. Clin Microbiol Infect. Sep 23 2009.
57. Sohma M, Yokozawa I, Kaneko S, Satake S. [Epidemiological study of levofloxacin–resistant Streptococcus pneumoniae isolated from 2003 through 2006 in Japan]. Kansenshogaku zasshi. Mar 2009;83(2):113–119.
58. Srifuengfung S, Tribuddharat C, Champreeda P, et al. Antimicrobial susceptibility of Streptococcus pneumoniae isolated from patients with respiratory tract infections in Thailand. The Southeast Asian journal of tropical medicine and public health. May 2008;39(3):461–466.
59. Thornsberry C, Brown NP, Draghi DC, Evangelista AT, Yee YC, Sahm DF. Antimicrobial activity among multidrug–resistant Streptococcus pneumoniae isolated in the United States, 2001–2005. Postgraduate medicine. Sep 2008;120(3 Suppl 1):32–38.
60. Brown SD, Rybak MJ. Antimicrobial susceptibility of Streptococcus pneumoniae, Streptococcus pyogenes and Haemophilus influenzae collected from patients across the USA, in 2001–2002, as part of the PROTEKT US study. Journal of Antimicrobial Chemotherapy. 2004;54(suppl_1):i7–15.
61. Jenkins SG, Brown SD, Farrell DJ. Trends in antibacterial resistance among Streptococcus pneumoniae isolated in the USA: update from PROTEKT US Years 1–4. Annals of clinical microbiology and antimicrobials. 2008;7:1.
62. Davies TA, Yee YC, Goldschmidt R, Bush K, Sahm DF, Evangelista A. Infrequent occurrence of single mutations in topoisomerase IV and DNA gyrase genes among US levofloxacin–susceptible clinical isolates of Streptococcus pneumoniae from nine institutions (1999–2003). The Journal of antimicrobial chemotherapy. Mar 2006;57(3):437–442.
63. Farrell DJ, Couturier C, Hryniewicz W. Distribution and antibacterial susceptibility of macrolide resistance genotypes in Streptococcus pneumoniae: PROTEKT Year 5 (2003–2004). International journal of antimicrobial agents. Jan 4 2008.
64. Endimiani A, Brigante G, Bettaccini AA, Luzzaro F, Grossi P, Toniolo AQ. Failure of levofloxacin treatment in community–acquired pneumococcal pneumonia. BMC infectious diseases. 2005;5:106.
65. Zheng X, Johnson C, Lu Y, et al. Clinical isolates of Streptococcus pneumoniae resistant to levofloxacin contain mutations in both gyrA and parC genes. International journal of antimicrobial agents. Oct 2001;18(4):373–378.
66. Sahm DF, Benninger MS, Evangelista AT, Yee YC, Thornsberry C, Brown NP. Antimicrobial resistance trends among sinus isolates of Streptococcus pneumoniae in the United States (2001–2005). Otolaryngol Head Neck Surg. Mar 2007;136(3):385–389.
67. Louie A, Fregeau C, Liu W, Kulawy R, Drusano GL. Pharmacodynamics of levofloxacin in a murine pneumonia model of Pseudomonas aeruginosa infection: determination of epithelial lining fluid targets. Antimicrobial agents and chemotherapy. Aug 2009;53(8):3325–3330.
68. Mascellino MT, Delogu G, Pelaia MR, Ponzo R, Parrinello R, Giardina A. Reduced bactericidal activity against Staphylococcus aureus and Pseudomonas aeruginosa of blood neutrophils from patients with early adult respiratory distress syndrome. Journal of medical microbiology. Jan 2001;50(1):49–54.
69. Scorneaux B, Ouadrhiri Y, Anzalone G, Tulkens PM. Effect of recombinant human gamma interferon on intracellular activities of antibiotics against Listeria monocyto–genes in the human macrophage cell line THP–1. Antimicrob Agents Chemother (Bethesda). 1996;40:1225–1230.
70. Delogu G, Iona E, Amati F. «Killing’’ of Pseudomonas aeruginosa isolated from patients with critical post–operative complications. Effects of various antibiotics. Annali italiani di chirurgia. 1997;68:219–224.
71. Pruul H, McDonald PJ. Lomefloxacin–induced modification of the kinetics of growth of Gram–negative bacteria and susceptibility to phagocytic killing by human neutrophils. The Journal of antimicrobial chemotherapy. 1990;25:91–101.
72. Dunbar LM, Wunderink RG, Habib MP, et al. High–dose, short–course levofloxacin for community–acquired pneumonia: a new treatment paradigm. Clin Infect Dis. Sep 15 2003;37(6):752–760.
73. Dunbar LM, Khashab MM, Kahn JB, Zadeikis N, Xiang JX, Tennenberg AM. Efficacy of 750–mg, 5–day levofloxacin in the treatment of community–acquired pneumonia caused by atypical pathogens. Current medical research and opinion. Apr 2004;20(4):555–563.
74. Shorr AF, Khashab MM, Xiang JX, Tennenberg AM, Kahn JB. Levofloxacin 750–mg for 5 days for the treatment of hospitalized Fine Risk Class III/IV community–acquired pneumonia patients. Respiratory medicine. Dec 2006;100(12):2129–2136.
75. Shorr AF, Zadeikis N, Xiang JX, Tennenberg AM, Wes Ely E. A multicenter, randomized, double–blind, retrospective comparison of 5– and 10–day regimens of levofloxacin in a subgroup of patients aged > or =65 years with community–acquired pneumonia. Clinical therapeutics. Aug 2005;27(8):1251–1259.
76. Tanaseanu C, Milutinovic S, Calistru PI, et al. Efficacy and safety of tigecycline versus levofloxacin for community–acquired pneumonia. BMC pulmonary medicine. Sep 9 2009;9(1):44.
77. Anzueto A, Niederman MS, Pearle J, Restrepo MI, Heyder A, Choudhri SH. Community–Acquired Pneumonia Recovery in the Elderly (CAPRIE): efficacy and safety of moxifloxacin therapy versus that of levofloxacin therapy. Clin Infect Dis. Jan 1 2006;42(1):73–81.
78. D’Ignazio J, Camere MA, Lewis DE, Jorgensen D, Breen JD. Novel, single–dose microsphere formulation of azithromycin versus 7–day levofloxacin therapy for treatment of mild to moderate community–acquired Pneumonia in adults. Antimicrobial agents and chemotherapy. Oct 2005;49(10):4035–4041.
79. Kalbermatter V, Bagilet D, Diab M, Javkin E. [Oral levofloxacin versus intravenous ceftriaxone and amoxicillin/clavulanic acid in the treatment of community–acquired pneumonia that requires hospitalization]. Medicina clinica. Nov 4 2000;115(15):561–563.
80. Bru JP, Leophonte P, Veyssier P. [Levofloxacine for the treatment of pneumococcal pneumonia: results of a meta–analysis]. Revue de pneumologie clinique. Dec 2003;59(6):348–356.
81. Peterson J, Yektashenas B, Fisher AC. Levofloxacin for the treatment of pneumonia caused by Streptococcus pneumoniae including multidrug–resistant strains: pooled analysis. Current medical research and opinion. Jan 30 2009.
82. Ye X, Sikirica V, Schein JR, et al. Treatment failure rates and health care utilization and costs among patients with community–acquired pneumonia treated with levofloxacin or macrolides in an outpatient setting: A retrospective claims database analysis. Clinical therapeutics. Feb 2008;30(2):358–371.
83. Schein J, Janagap–Benson C, Grant R, Sikirica V, Doshi D, Olson W. A comparison of levofloxacin and moxifloxacin use in hospitalized community–acquired pneumonia (CAP) patients in the US: focus on length of stay. Current medical research and opinion. Mar 2008;24(3):895–906.
84. Friedman H, Song X, Crespi S, Navaratnam P. Comparative Analysis of Length of Stay, Total Costs, and Treatment Success between Intravenous Moxifloxacin 400 mg and Levofloxacin 750 mg among Hospitalized Patients with Community–Acquired Pneumonia. Value Health. Aug 20 2009.
85. Frei CR, Jaso TC, Mortensen EM, et al. Medical resource utilization among community–acquired pneumonia patients initially treated with levofloxacin 750 mg daily versus ceftriaxone 1000 mg plus azithromycin 500 mg daily: a US–based study. Current medical research and opinion. Apr 2009;25(4):859–868.
86. Rodriguez–Roisin R. Toward a consensus definition for COPD exacerbations. Chest. May 2000;117(5 Suppl 2):398S–401S.
87. Alvarez–Sala JL, Kardos P, Martinez–Beltran J, Coronel P, Aguilar L. Clinical and bacteriological efficacy in treatment of acute exacerbations of chronic bronchitis with cefditoren–pivoxil versus cefuroxime–axetil. Antimicrobial agents and chemotherapy. May 2006;50(5):1762–1767.
88. Ball P. Epidemiology and treatment of chronic bronchitis and its exacerbations. Chest. Aug 1995;108(2 Suppl):43S–52S.
89. –Р–≤–і–µ–µ–≤ –°–Э, –®–∞–љ–Є–љ–∞ –Р–У, –І—Г—З–∞–ї–Є–љ –Р–У. –С–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П —Г –±–Њ–ї—М–љ—Л—Е –•–Ю–С–Ы —Б –Њ—Б—В—А–Њ–є –і—Л—Е–∞—В–µ–ї—М–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—П –Є –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–∞—П —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П. 2005;7(3):245–254.
90. –Ф–≤–Њ—А–µ—Ж–Ї–Є–є –Ы–Ш, –Ф—Г–±—А–Њ–≤—Б–Ї–∞—П –Э–Т, –У—А—Г–і–Є–љ–Є–љ–∞ –°–Р, –§–Є–ї–Є–Љ–Њ–љ–Њ–≤–∞ –Ю–Ѓ, –°–Є–і–Њ—А–µ–љ–Ї–Њ –°–Т, –ѓ–Ї–Њ–≤–ї–µ–≤ –°–Т. –Ы–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ –Є –Љ–∞–Ї—А–Њ–ї–Є–і—Л –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±—А–Њ–љ—Е–Є—В–∞. –†–µ–Ј—Г–ї—М—В–∞—В—Л –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞ –±–Њ–ї—М–љ—Л—Е. –Ш–љ—Д–µ–Ї—Ж–Є–Є –Є –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–∞—П —В–µ—А–∞–њ–Є—П. 2005;7(1).
91. van Zanten AR, Oudijk M, Nohlmans–Paulssen MK, van der Meer YG, Girbes AR, Polderman KH. Continuous vs. intermittent cefotaxime administration in patients with chronic obstructive pulmonary disease and respiratory tract infections: pharmacokinetics/pharmacodynamics, bacterial susceptibility and clinical efficacy. British journal of clinical pharmacology. Jan 2007;63(1):100–109.
92. Pfaller MA, Ehrhardt AF, Jones RN. Frequency of pathogen occurrence and antimicrobial susceptibility among community–acquired respiratory tract infections in the respiratory surveillance program study: microbiology from the medical office practice environment. The American journal of medicine. Dec 17 2001;111 Suppl 9A:4S–12S; discussion 36S–38S.
93. Miravitlles M, Espinosa C, Fernandez–Laso E, Martos JA, Maldonado JA, Gallego M. Relationship between bacterial flora in sputum and functional impairment in patients with acute exacerbations of COPD. Study Group of Bacterial Infection in COPD. Chest. Jul 1999;116(1):40–46.
94. Ram FS, Rodriguez–Roisin R, Granados–Navarrete A, Garcia–Aymerich J, Barnes NC. Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane database of systematic reviews (Online). 2006(2):CD004403.
95. Reynolds AY. Chronic bronchitis and acute infectious exacerbations. In: Mandell GL, Bennett JE, Dolin R, eds. Principles and practice of infectious diseases. 5th ed. New York: Churchill Livingstone; 2000.
96. Roede BM, Bresser P, El Moussaoui R, et al. Three vs. 10 days of amoxycillin–clavulanic acid for type 1 acute exacerbations of chronic obstructive pulmonary disease: a randomised, double–blind study. Clin Microbiol Infect. Mar 2007;13(3):284–290.
97. Sayiner A, Okyay N, Unsal I, Colpan N. Infective exacerbations of COPD. Chest. May 1999;115(5):1481.
98. Lode H, Allewelt M, Balk S, et al. A prediction model for bacterial etiology in acute exacerbations of COPD. Infection. Jun 2007;35(3):143–149.
99. Sethi S. Moxifloxacin for the treatment of acute exacerbations of chronic obstructive pulmonary disease. Clin Infect Dis. Jul 15 2005;41 Suppl 2:S177–185.
100. Alvarez F, Bouza E, Garcia–Rodriguez JA, et al. [Second consensus report on the use of antimicrobial agents in exacerbations of chronic obstructive pulmonary disease]. Arch.Bronconeumol. 2003;39(6):274–282.
101. Balter MS, La Forge J, Low DE, Mandell L, Grossman RF. Canadian guidelines for the management of acute exacerbations of chronic bronchitis. Can Respir J. Jul–Aug 2003;10 Suppl B:3B–32B.
102. Vogel F, Scholz H, al Nawas B, et al. [Rational use of oral antibiotics. Findings of an expert commission of the Paul Ehrlich Society for Chemotherapy.]. Medizinische Monatsschrift fur Pharmazeuten. 2002;25:193–204.
103. Monso E, Garcia–Aymerich J, Soler N, et al. Bacterial infection in exacerbated COPD with changes in sputum characteristics. Epidemiol Infect. Aug 2003;131(1):799–804.
104. Grassi C, Salvatori E, Rosignoli MT, Dionisio P. Randomized, double–blind study of prulifloxacin versus ciprofloxacin in patients with acute exacerbations of chron












