Введение
При проведении лекарственной терапии всегда есть риск развития неблагоприятных побочных реакций (НПР). Любой лекарственный препарат (ЛП) может стать причиной развития НПР, даже в тех случаях, если его назначают в соответствии со стандартами лечения.
Проблеме возникновения НПР как в России, так во всем мире уделяется огромное внимание. В первую очередь это связано с тем, что прием лекарственных средств (ЛС) может стать причиной развития серьезных побочных реакций, а также привести к инвалидизации, что ведет к дополнительным расходам на госпитализацию либо ее продление, а также на реабилитацию и лечение пациентов.
Для решения данной проблемы в настоящее время в России активно работает система мониторинга безопасности ЛС в соответствии с основными регламентирующими документами: Федеральным законом № 61-ФЗ «Об обращении лекарственных средств» [1] и приказом Минздравсоцразвития РФ № 757н «Об утверждении порядка осуществления мониторинга безопасности лекарственных препаратов для медицинского применения» [2].
Данные статистики НПР на ЛП анализируются и в других странах мира, такой анализ является неотъемлемой частью производства лекарственных препаратов, что подтверждает актуальность данной проблемы.
На территории Российской Федерации во многих регионах функционируют центры мониторинга безопасности ЛС. Данная система позволяет систематически получать информацию о выявленных НПР и анализировать сложившуюся ситуацию в том или ином регионе страны.
В Астраханской области функции регионального центра мониторинга возложены на ГБУ АО «Управление по экспертизе, учету и анализу обращения средств медицинского применения», где функционирует горячая линия по вопросам качества ЛС. Следует отметить, что одновременное выполнение других функций помогает анализировать поступающие сообщения об НПР:
проведение лабораторных испытаний ЛС, реализуемых населению Астраханской области, с целью установления соответствия их качества требованиям государственных стандартов и содействие предотвращению поступления в обращение ЛП, не отвечающих требованиям безопасности и качества;
информирование населения о наличии, ценах, побочных действиях и особенностях применения ЛС, находящихся в розничной продаже в аптечных организациях.
Одной из основных задач регионального центра является организация работы по эффективному выявлению НПР в регионе, что включает координацию работы с учреждениями здравоохранения и аптечными учреждениями, консультирование больных с целью рационализации проводимой фармакотерапии.
При регулярном, систематическом проведении мониторинга безопасности ЛС осуществляется сбор, обработка и анализ полученной информации о выявленных НПР и особенностях взаимодействия ЛС. Сведения об НПР ЛС поступают в виде извещений об НПР в центр мониторинга, далее в виде ежемесячного отчета направляются в Министерство здравоохранения Астраханской области, а также территориальный орган Росздравнадзора по Астраханской области.
Выявляются НПР при применении ЛП в региональном центре с помощью методов спонтанных сообщений и активного мониторинга.
Цель спонтанного мониторинга заключается в получении и анализе всей информации по стране, однако сбор необходимых данных необходимо проводить во всех регионах для получения более качественной информации. Если же активность извещения низкая и заполнение карт осуществляется некачественно, то сигнал об НПР поступает с задержкой, что приводит к недооценке масштабов проблемы.
Крайне важен тот факт, что анализ структуры спонтанных сообщений позволяет выявлять реакции, которые могут быть связаны с проблемами качества ЛС.
Задачами осуществления мониторинга безопасности ЛС являются: оценка риска и пользы ЛС, рациональное и безопасное применение ЛС, информирование о возможных рисках, обучение и информирование медициков и фармацевтов, а также пациентов.
Цель исследования: проанализировать структуру и частоту выявленных и зарегистрированных НПР на ЛП, а также проследить динамику выявления НПР на ЛП на примере Астраханской области за 2018 г.
Материал и методы
Для оценки эффективности и безопасности фармакотерапии использовали метод «спонтанных сообщений», поступивших от субъектов обращения ЛС на территории Астраханской области. Были проанализированы карты-извещения за 2018 г., проведен анализ показателей причинно-следственной связи с использованием алгоритмов, утвержденных Всемирной организацией здравоохранения, и алгоритма Наранжо [3].
Результаты исследования и их обсуждение
С момента начала функционирования регионального центра мониторинга безопасности ЛС отмечается увеличение числа выявленных НПР.
По результатам ретроспективного анализа по выявлению НПР в Астраханской области отмечается увеличение числа сообщений, что связано с проведением разъяснительной работы с врачами в регионе, а также улучшением информированности о необходимости регистрации случаев выявления НПР.
За 2018 г. поступило 577 сообщений об НПР на ЛП, в 2017 г.— 464 сообщения, в 2016 г.— 468 сообщений.
За 2018 г. выявлено 157 серьезных нежелательных реакций.
К серьезным НПР на ЛП относятся такие нежелательные реакции, которые:
создают угрозу для жизни (42 НПР за 2018 г.);
приводят к смерти (1 НПР);
являются причиной госпитализации или приводят к ее удлинению (113 НПР);
приводят к инвалидности, стойкой утрате трудоспособности, врожденным аномалиям или порокам развития (1 НПР).
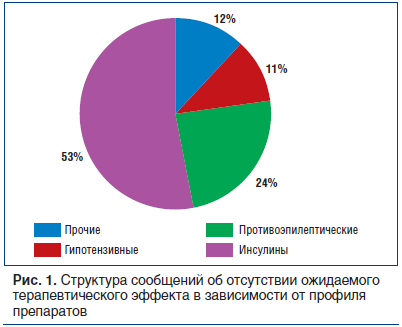
Клинически значимых случаев выявлено 96, непредвиденных (не внесенных в инструкцию по применению) — 17, сообщений об отсутствии ожидаемого терапевтического эффекта — 37. Структура сообщений об отсутствии ожидаемого терапевтического эффекта по профилю препаратов представлена на рисунке 1.
Сроки предоставления информации установлены приказом Федеральной службы по надзору в сфере здравоохранения от 15.02.2017 г. № 1071 — не позднее 15 календарных дней со дня поступления соответствующей информации. Не позднее 3 рабочих дней необходимо сообщать о серьезных нежелательных реакциях с летальным исходом или угрозой жизни.
За 2018 г. выявлено 577 сообщений об НПР, в т. ч. от: врачей — клинических фармакологов — 386, врачей других специальностей — 150, провизоров — 15, среднего медперсонала — 26. Структура источников информации об НПР представлена на рисунке 2.

Причинно-следственную связь удалось выявить для 464 реакций, из которых к числу определенных отнесено 135, вероятных — 168, возможных — 138, сомнительных — 5, условных — 1, неклассифицируемых — 17.
Характеристика нежелательных реакций:
НПР, индивидуальная непереносимость ЛП —
244 сообщения;
аллергические реакции — 220 сообщений, из них: шок анафилактический — 16, отек ангионевротический — 21, токсикодермия — 6, синдром Стивенса — Джонсона — 1, другие кожные проявления — 176.
Из приведенных данных видно, что чаще регистрируются именно аллергические реакции на применение ЛС (рис. 3).

Выводы
Эффективность выявления НПР ЛП во многом зависит от внимания к мониторингу врачей и фармацевтических работников, их готовности информировать о выявленных нежелательных реакциях.
Таким образом, в результате проведенного анализа выявлено, что чаще сообщается именно об аллергических реакциях. При этом упускаются из виду такие важные аспекты, как индивидуальная непереносимость, отсутствие эффективности ЛП, нежелательные реакции после применения ЛП (не связанные с проявлением аллергической реакции организма).
Также стоит отметить, что с момента начала функционирования регионального центра мониторинга лекарственных средств на базе ГБУ АО «УЭУАОСМП» повысилось количество и качество поступающих извещений. В настоящее время увеличилось количество ЛПУ, регистрирующих карты-извещения. Также активизируются в процессе мониторинга аптечные организации.
При анализе карт-извещений отмечается недостаточное качество их оформления (не отмечаются торговые наименования, производитель, номер серии, заболевание, для лечения которого использовался ЛП, и др.), что затрудняет определение причинно-следственной связи.
Для исключения в дальнейшем перечисленных ошибок осуществляется организационная работа с сотрудниками медицинских учреждений Астраханской области — клиническими фармакологами, ответственными за выявление нежелательных реакций при применении ЛП и выявление неблагоприятных событий при применении медицинских изделий в медицинских организациях.
Также оказывается консультативная помощь медицинским работникам учреждений здравоохранения Астраханской области в анализе и классификации НПР (встречи со специалистами, консультирование по телефону, письма по электронной почте).












