Пирацетам – первый и «эталонный» представитель класса ноотропов, до настоящего времени является наиболее часто назначаемым препаратом этой группы [5,9,10]. Первоначально он использовался для терапии двигательных нарушений, нистагма и эпилепсии [11,15,19]. Позитивный эффект этого препарата на высшие психические функции был выявлен в клинических исследованиях, что послужило основанием для предложенной Giurgea «ноотропной концепции» и дало импульс к широкому изучению ноотропов [4,6,13]. Хотя ноотропы обладают отчетливым нейрогенным эффектом, они не выявляют периферического действия, что отличает их от других классов фармакологических средств [2,3]. Например, они не обладают анальгетическим, седативным, транквилизирующим действиями, антигистаминным, антисеротонинергическим эффектами, не увеличивают моторную активность и т.д. [1,7].
В отличие от препаратов других психотропных классов, пирацетам характеризуется не селективным, а «веерным» механизмом действия, влияя на метаболические, биоэнергетические процессы в нервной клетке, повышая скорость оборота информационных макромолекул, активируя синтез белка и др. [8,14]. Механизмы действия пирацетама и связанные с ними предполагаемые клинические эффекты представлены в таблице 1.
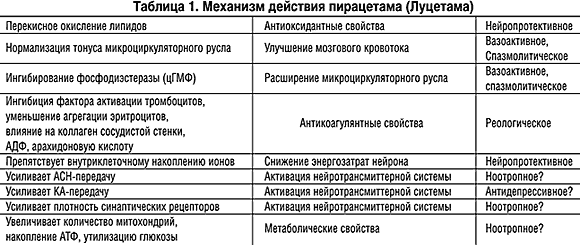
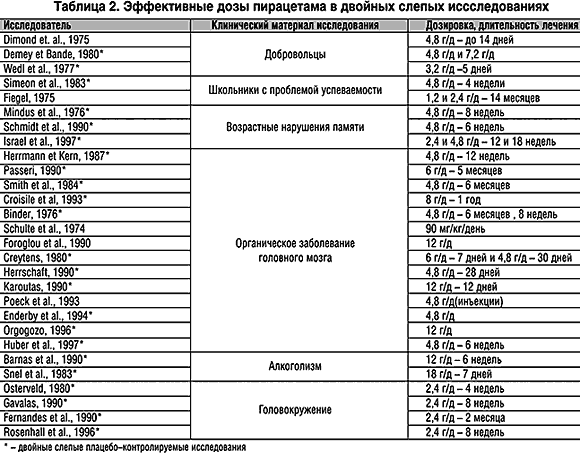
Несмотря на некоторые противоречия в самой «ноотропной» концепции эффективность пирацетама доказана в двойных слепых исследованиях у больных с различной психической патологией [17,21]. Число публикаций клинических исследований этого препарата возросло в 80–90–х годах прошлого столетия и превысило 1000 работ [20,16]. Одним из вопросов, связанных с практическим применением пирацетама и требующих самостоятельного изучения, является выбор доз препарата [18]. В нашей стране в психиатрической практике чаще всего используются невысокие дозы пирацетама – от 800 до 1200 мг. Между тем эффективные дозы этого препарата, о чем свидетельствуют результаты исследований, выполненных в подавляющем большинстве в соответствии с критериями GCP, превышают принятые у нас в стране дозировки в 4–10 раз. Это иллюстрируют данные таблицы 2, в которой представлены эффективные дозировки препарата при его исследованиях, опубликованных в ведущих медицинских журналах.
Препарат Луцетам (компания Эгис, Венгрия) позволяет решить проблемы комплаентности и экономичности лечения большими дозами.
Луцетам выпускается в трех дозировках: 400 мг, 800 мг, 1200 мг, что позволяет подобрать оптимальный режим дозирования и обеспечить удобство приема для каждого пациента индивидуально.
Перспективной областью применения ноотропов в больших дозах является шизофрения с преобладанием негативной симптоматики и нарушений когнитивного функционирования, а именно резидуальная (остаточная) шизофрения. Важность проведения таких исследований объясняется современными представлениями о когнитивном дефиците при шизофрении, основу которого, по мнению Heaton RK, Drexler M. [12], составляет «статическая» энцефалопатия, связанная с патологией определенных нейроанатомических субстратов, локализованных чаще всего в лобных и височных долях мозга.
Целью настоящего исследования являлось сравнительное клинико–фармакологическое изучение с оценкой когнитивных функций высоких и низких доз Луцетама у больных резидуальной шизофренией, длительно принимающих нейролептики. Исследование было выполнено в ПБ № 13 г. Москвы.
Критериями включения больных в исследование являлись:
1. Возраст больных 45–60 лет.
2. Диагностика остаточной шизофрении в соответствии с критериями МКБ–10.
3. Длительное применение нейролептиков в постоянных дозах.
4. Общее количество баллов по шкале PANSS > 60 баллов.
5. Согласие больного на лечение.
Критериями исключения больных из исследования являлись:
1. Аллергические реакции при применении изучаемого препарата.
2. Тяжелые или в стадии обострения соматические и неврологические заболевания.
Методы исследования включали клинико–психопатологическое обследование, шкалы CGI, PANSS, Simpson–Anqus, UKU, тест САН. Когнитивные функции оценивались с помощью интеллектуального теста Равена, теста Бушке (кратковременная и долговременная память), таблицы Шульте (степень и качество концентрации внимания), метода Крепелина (равномерность и темп концентрации внимания).
Всего в исследование было включено 80 больных, большинство из которых были мужского пола (89%), в возрасте 50–55 лет. Длительность заболевания шизофренией составляла преимущественно 5–10 лет. Все больные имели инвалидность 2 группы по психическому заболеванию, принимали нейролептики на протяжении всей болезни, а последний год – в неизменных дозах (трифлуоперазин, тиоридазин, галоперидол и др.).
Больные в произвольном порядке распределялись по трем терапевтическим группам:
1. Больные, принимающие высокие дозы Луцетама (4,8 г/д) – 30 человек.
2. Больные, принимающие обычные дозы Луцетама (1,2 г/д) – 30 человек.
3. Больные, не принимающие ноотропной терапии– 20 человек.
Длительность исследования – 6 недель была достаточной для выявления собственно ноотропного действия Луцетама. Всего проводилось 7 обследований: фоновое, на 3, 7, 14, 21, 30, 42–й день терапии.
Трое больных из 1 группы выбыли из исследования из–за обострения психотической симптоматики в течение первой недели терапии.
Результаты исследования
Оценке общей эффективности терапии в трех исследованных группах больных соответствовала динамика негативных, позитивных расстройств и общей психопатологической симптоматики (PANSS) (рис. 1).
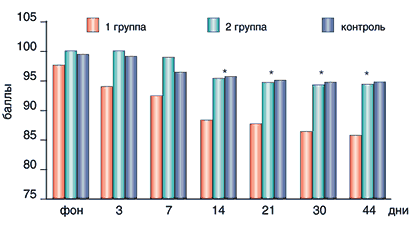
Рис. 1. Динамика PANSS при применении высоких (1), низких (2) доз Луцетама и в контрольной группе
Во всех исследованных группах наблюдалось снижение общего показателя баллов PANSS к концу терапии. Однако на 42 день лечения степень редукции баллов в первой группе больных почти в два раза превосходила аналогичный показатель у пациентов, получающих низкие дозы Луцетама и в контрольной группе, а начиная с 7 дня терапии носила статистически значимый характер (р=0,006). Так, на 7 день применения высоких доз Луцетама редукция общего балла составила 5,3% от фонового показателя, а к 42 дню уже 15,2%. По сравнению с контрольной группой статистически значимая разница наступала уже с третьего дня терапии. В группе больных, принимавших низкие дозы Луцетама, редукция общего показателя по шкале PANSS достигала статистически значимых показателей только к концу терапии (редукция на 7,8 % по сравнению с фоном) и не отличалась от контрольной группы.Таким образом, статистически достоверная редукция позитивных, негативных и общепатологических расстройств наблюдалась уже в первые дни терапии высокими дозами Луцетама и по эффективности значительно превосходила терапию низкими дозами препарата и без него. Причем эффективность высоких доз Луцетама осуществлялась в основном за счет редукции негативных расстройств (о чем свидетельствовал анализ субшкал PANSS).
Оценка редукции побочной неврологической симптоматики по шкале Simpson–Angus также показала наибольшую эффективность высоких доз Луцетама. Обратная динамика экстрапирамидной симптоматики отмечалась уже с 7 дня терапии, а к концу лечения по сравнению с фоном составляла 33,1% (p<0,05). В группе больных, принимавших низкие дозы препарата, редукция этого показателя наступала позже (с 14 дня терапии), а к концу лечения составляла всего 24,2% (р=0,002). В контрольной группе отмечалось ухудшение показателя на 14% по сравнению с фоном.
В результате применения Луцетама значительно улучшались активность и самочувствие больных: они становились более инициативными в отделении, налаживали контакты с другими больными, предъявляли желание продолжить курс лечения ноотропами. Это отражалось в показателях теста САН, терапевтическая динамика которого по подшкале «активность» была статистически достоверной только в группе больных, получающих высокие дозы Луцетама.
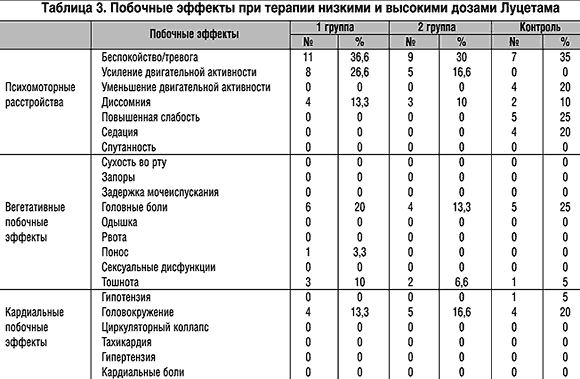
При оценке переносимости низких и высоких доз Луцетама следует отметить, что частота ряда нежелательных явлений, возникающих при применении препарата, практически не зависела от его дозы и не отличалась от контрольной группы (беспокойство и тревога, диссомния). Дозозависимыми побочными эффектами оказались головные боли, тошнота и понос, а головокружение чаще возникало у больных, принимавших низкие дозы Луцетама. В целом следует отметить хорошую переносимость высоких доз Луцетама. Данные о побочных расстройствах представлены в таблице 3.
До начала терапии отмечалось отчетливое снижение всех оцениваемых показателей когнитивного функционирования (интеллекта, внимания, краткосрочной и долгосрочной памяти) во всех группах больных.
Оценка степени и качества концентрации внимания проводилась при использовании таблицы Шульте. При фоновом обследовании во всех группах больных эти характеристики внимания были существенно снижены и на 50% превышали показатели скорости выполнения заданий в норме. В процессе терапии наблюдалось выраженное различие динамики этого показателя внимания между больными, принимающими высокие и низкие дозы Луцетама. Так, при применении высоких доз уже с 7 дня лечения наблюдалось уменьшение времени выполнения заданий, тогда как при назначении низких доз – с 14 дня. К концу терапии эти показатели уменьшились на 25,5% в сравнении с фоном в группе высоких доз Луцетама и на 20% – низких. В контрольной группе больных показатели имели тенденцию к увеличению времени выполнения заданий (на 14% по сравнению с фоном). Динамика степени и качества концентрации внимания представлена в таблице 4.

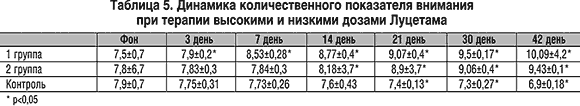
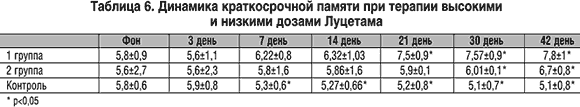
При оценке краткосрочной памяти к концу терапии наблюдалось увеличение количества воспроизводимых слов в группах больных, принимавших Луцетам, по сравнению с контрольной группой. Причем в 1 группе на 21 день терапии этот показатель достоверно улучшился на 12% по сравнению с фоном, а к концу терапии – на 34,5% и составил 7,8±1. Во 2 группе статистически значимое улучшение краткосрочной памяти наблюдалось лишь с 30 дня терапии (р=0,002) и к концу лечения составил 6,7±0,8, что отражало улучшение этого показателя всего на 19,6% по сравнению с фоном. Статистически достоверные различия по показателю краткосрочной памяти между группами больных, принимающих высокие и низкие дозы Луцетама, появлялись уже на 21 день терапии (р<0,05). Динамика краткосрочной памяти в процессе терапии Луцетамом в трех группах больных представлена в таблице 6.
Анализируя влияние высоких и низких доз Луцетама на такой интегративный показатель когнитивного функционирования как интеллект (тест Равена), следует обратить внимание на явное снижение этого показателя у всех больных до начала терапии (до 64 ед. в универсальных единицах IQ). После проведенного лечения (на 42 день терапии) показатели интеллекта улучшились в 1 группе на 5%, в 2 группе на 2%, в группе контроля наблюдалось снижение показателя коэффициента интеллекта на 9%.
Таким образом, присоединение Луцетама (в низких и высоких дозах) к традиционной нейролептической терапии больных резидуальной шизофренией приводит к существенному улучшению их состояния (в сравнении с контрольной группой пациентов, не принимающих ноотропную терапию). Использование высоких доз Луцетама существенно повышает эффективность лечения, о чем свидетельствуют результаты всех оцениваемых в настоящем исследовании показателей. Повышение эффективности сопровождается более ранней (начиная с 7 дня терапии) и более выраженной редукцией психопатологической симптоматики, в основном за счет уменьшения негативных расстройств; приводит к более существенному уменьшению выраженности экстрапирамидных расстройств и к значительному улучшению активности больных. Кроме того, отмечается существенное улучшение когнитивного функционирования больных с восстановлением количественных и качественных показателей внимания (в том числе концентрации внимания), кратковременной и долговремемнной памяти, интеллекта, Применение высоких доз Луцетама больным с резидуальной шизофренией показано в случаях преобладания в клинической картине дефицитарных расстройств с явлениями апатии, адинамии, астении, при выраженных когнитивных нарушениях. При применении высоких доз Луцетама повышение эффективности не сопровождается ухудшением переносимости препарата: частота побочных расстройств при применении высоких доз статистически не отличается от наблюдавшихся при лечении низкими дозами (тревога, инсомния). Дозозависимыми побочными эффектами являются головная боль и желудочно–кишечные расстройства.
1. Воронина Т. А., Гарибова Т. Л., Хромова И. В. и др. Диссоциация антиамнестического и притивогипоксического эффектов у ноотропных и противогипоксических препаратов// Фармакол. и токсикол.–1987.–№ 3.–с.21–24
2. Воронина Т. А. // Фармакол. и токсикол. – 1991. – Т. 54, № 2. – С. 6–11
3. Нисс А. И. Место нейрометаболических стимуляторов (церебропротекторов) в современной систематике психотропных средств и основные виды их клинической активности//Журн. Невропатол. и психиатр.–1984.–Вып.5.–с. 750– 756
4. Островская Р.У., Трофимов С. С., Цыбина Н. М. И др. Антагонизм пирацетама с пролином по мнестическому эффекту// Бюл. экспер. Биол.–1985.–№ 3.–С. 311–313
5. Руденко Г. М., Романова И. С., Бояринцева С. Д., и др. К оценке эффективности препарата пирацетам в психиатрической клинике// Вопросы психофармакологии.– М., 1976.–С.35–45.
6. Фармакология ноотропов( экспериментальное и клиническое изучение)/Под ред. А.В. Вальдмана и Т. А. Ворониной.–М.,1989.–139 с.
7. Creytens G. Piracetam in the treatment of cerebrovascular accident. Ars Med(Nivelles) 1980; 35/8: 758–766
8. 8. Deberdt W Global results treatment in elderly patients with cognitive disturbances.Symposium: Piracetam 5 year Progress in Pharmacology and Clinics. Athen 1990, 81–89
9. Dimond SJ Use of nootropic substance to increase the capacity for verbal learning and memory in normal man. 3»’ Congress of the International College of Medicine, Rome, September 1975
10. Ezzat ОН, Ibraheem ММ, Makhawy В. The effect of Piracetam on ЕСТ–Induced Memory Disturbances. British Journal of Psychiatry 1985; 147: 720–721
11. Genton P, Guerrini R, Remy С. Progressive Myoclonus Epilepsy. Piracetam Symposium, Brussels, 4 October, 1997; Abstracts: 4–5
12. Heaton RK, Drexler M.(1987) Clinical neuropsychological findings in schizophrenia and ageing. In: Miller NE, Cohen GD, ed. Schizophrenia, paranoia and schizophreniform// New York: Guildford Press.– 1987–p. 145–161
13. Israel L. Memory training programs (MTPs) combined with drug therapy in primary саге, including patients with age–associated memory impairment. Symposium: Piracetam – 5 year Ргореяя in Pharmacology and Clinics. Athen, 1990, 39–43
14. Karoutas G. А А randomized, double–blind, placebo–controlled study оf piracetam in patients with acute ischaemic cerebral infarct in the carotid territory. Symposium.’ Piracetam – 5 year Progress in Pharmacology and Clinics. Athen, 1990, 135–8
15. Koskiniemi–М; Van–Vleymen–В; Hakamies–L; Lamusuo–S; et al. Piracetam relieves symptoms in progressive myoclonus epilepsy: А multicentre, randomised, double blind, crossover study comparing the efficacy and safety оf high dosages оf piracetam with placebo Journal Neurosurgery 1987; 5: 129–139
16. Muller WE. Nootropika. Therapie der Demenz zwischen Anspruch und Wirklichkeit. Munch Med Wschr. 1988; 130 (31–32): 575–579
17. Oosterveld WJ Piracetam effectiveness in vertigo. Piracetam Symposium, Brussels, 4 October, 1997; Abstracts: 10–11 33.0rgogozo JM. Piracetam Acute Stroke Study ( PASS ) Piracetam Symposium, Brussels, 4’» October, 1997; Abstracts 2–3
18. Passeri М. А А multicentre study оf piracetam in patients with late–onset senile dementia. Symposium: Piracetam – 5 year Progress in Pharmacology and Clinics. Athen, 1990, 75–80
19. Piracetam. Drugdex Drug Evaluations (in Micromedex(r) Healthcare Series Database Volume 103; expires 03/2000)
20. Smith RC, Vroulis G, Johnson R, Morgan R. . Comparison of therapeutic response to long– term treatment with lecithin versus piracetam plus lecithin ш patients with Alzheimer’ s disease. Psychopharmacology Bulletin 1984; 20 (3): 542–545
21. Wilsher CR, Bennett D, Chase СН, Conners СК. Piracetam and dyslexia: effects on reading tests. J Clin Psychopharmacol 1987; 7(4): 230–7












