–Т–≤–µ–і–µ–љ–Є–µ
–Э–µ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–∞—П –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—П –Ї–ї–µ—В–Њ–Ї —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–µ—В–Є –Њ—А–≥–∞–љ–∞ –Ј—А–µ–љ–Є—П –≤ –Њ—В–≤–µ—В –љ–∞ –≤—Л–±—А–Њ—Б –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –љ–µ—Б–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ –њ–Њ—П–≤–ї—П—О—Й–Є—Е—Б—П —Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–µ—В–µ–є –Є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ—В–Ї–∞–љ–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А –Њ—В–љ–Њ—Б—П—В—Б—П –Ї —З–Є—Б–ї—Г –≤–µ–і—Г—Й–Є—Е –њ—А–Є—З–Є–љ —Б–ї–µ–њ–Њ—В—Л –≤ –Љ–Є—А–µ. –Ф–∞–љ–љ–∞—П —Б—В–∞—В—М—П –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –Њ–±–Њ–±—Й–µ–љ–Є–µ –∞–Ї—В—Г–∞–ї—М–љ—Л—Е –і–∞–љ–љ—Л—Е –ї–Є—В–µ—А–∞—В—Г—А—Л –Є –∞–љ–∞–ї–Є–Ј —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Њ–њ—Л—В–∞ 5-–ї–µ—В–љ–µ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ.
–Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ –±—Г–і—Г—Й–µ–≥–Њ —Д–µ–љ–Њ—В–Є–њ–∞ –Ї–Њ–љ—Ж–µ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ –њ—А–Њ—А–∞—Б—В–∞—О—Й–Є—Е —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е –Њ–њ–Њ—Б—А–µ–і—Г–µ—В—Б—П —З–µ—А–µ–Ј c–Њ—Б—Г–і–Є—Б—В—Л–є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л–є —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞ (Vascular endothelial growth factor, VEGF), –Є–љ–і—Г—Ж–Є—А—Г—П VEGFR2/3 –Є –ї–Є–≥–∞–љ–і DLL4 (delta like 4) –љ–∞ —А–∞—Б—В—Г—Й–µ–Љ –∞–њ–µ–Ї—Б–µ –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Њ—Б—Г–і–∞ (—А–Є—Б. 1) [1]. Notch –ї–Є–≥–∞–љ–і Delta like 4 (DLL4) —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ –і–ї—П —Д–µ–љ–Њ—В–Є–њ–∞ ¬Ђ–Њ–Ї–Њ–љ—З–∞–љ–Є—П¬ї –Є –Љ–Њ–ґ–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М—Б—П –Ї–∞–Ї —В—Г–Љ–±–ї–µ—А, –Ї–Њ—В–Њ—А—Л–є —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В —Б–Њ—Б—В–Њ—П–љ–Є–µ –≤–µ—В–≤–ї–µ–љ–Є—П —Б–Њ—Б—Г–і–∞ –Є–ї–Є –µ–≥–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є—П. –Ю–љ —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В—Б—П –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є –љ–∞–Ї–Њ–љ–µ—З–љ–Є–Ї–∞, –∞–Ї—В–Є–≤–Є—А—Г—П Notch —Б–Є–≥–љ–∞–ї—М–љ—Л–є –њ—Г—В—М –≤ —Б–Њ—Б–µ–і–љ–Є—Е –Ї–ї–µ—В–Ї–∞—Е, –≥–і–µ –Њ–љ –њ–Њ–і–∞–≤–ї—П–µ—В —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О DLL4. –Р–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ—Л–є Notch –і–µ–є—Б—В–≤—Г–µ—В —З–µ—А–µ–Ј Notch-–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є (NT), –њ–Њ–і–∞–≤–ї—П—П DLL4 –Є VEGFR2/3 –Є –Є–љ–і—Г—Ж–Є—А—Г—П VEGFR1 [2, 3]. –≠—В–Њ —Б–љ–Є–ґ–∞–µ—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї VEGF –Є —Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г–µ—В —Д–µ–љ–Њ—В–Є–њ –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –≤–µ—В–≤–ї–µ–љ–Є—П —Б–Њ—Б—Г–і–∞. –Ъ–Њ—Б—В–љ—Л–µ –Љ–Њ—А—Д–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –±–µ–ї–Ї–Є-–∞–Ї—В–Є–≤–∞—В–Њ—А—Л 9 –Є 10 (Bone Morphogenetic Protein 9/10, BMP9/BMP10) –≤ –њ–ї–∞–Ј–Љ–µ –і–µ–є—Б—В–≤—Г—О—В —З–µ—А–µ–Ј –Ї–Є–љ–∞–Ј–љ—Л–є —Б–Є–≥–љ–∞–ї—М–љ—Л–є –њ—Г—В—М –∞–љ–∞–њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Њ–є –ї–Є–Љ—Д–Њ–Љ—Л 1 (anaplastic lymphoma kinase 1, ALK1) –љ–∞ —Б—Е–Њ–і–љ—Л—Е –љ–Є–ґ–µ—Б—В–Њ—П—Й–Є—Е –Љ–Є—И–µ–љ—П—Е (AT-–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ), —В–∞–Ї –ґ–µ –Ї–∞–Ї Notch, –Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —Д–µ–љ–Њ—В–Є–њ—Г –≤–µ—В–≤–ї–µ–љ–Є—П [4].
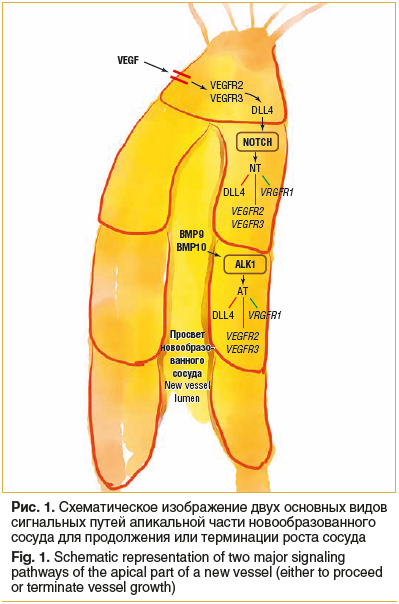
–Ш–Ј–±—Л—В–Њ—З–љ–Њ–µ –њ—А–Њ—А–∞—Б—В–∞–љ–Є–µ —Б–Њ—Б—Г–і–Њ–≤ (—А–Є—Б. 2–Р) –њ—А–Њ–Є—Б—Е–Њ–і–Є—В, –Ї–Њ–≥–і–∞ –±–ї–Њ–Ї–Є—А—Г–µ—В—Б—П –њ–µ—А–µ–і–∞—З–∞ —Б–Є–≥–љ–∞–ї–Њ–≤ Notch –Є–ї–Є ALK1 (–±–ї–∞–≥–Њ–њ—А–Є—П—В—Б—В–≤—Г—П —Д–µ–љ–Њ—В–Є–њ—Г ¬Ђ–љ–∞–Ї–Њ–љ–µ—З–љ–Є–Ї–∞¬ї). –Э–∞–њ—А–Њ—В–Є–≤, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –њ—А–Њ—А–∞—Б—В–∞–љ–Є–µ —Б–Њ—Б—Г–і–Њ–≤ (—А–Є—Б. 2–°) –Љ–Њ–ґ–µ—В –±—Л—В—М –≤—Л–Ј–≤–∞–љ–Њ —З—А–µ–Ј–Љ–µ—А–љ–Њ–є –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є BMP9. –Ю–љ —В–∞–Ї–ґ–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ —Г –ї—О–і–µ–є —Б –Љ—Г—В–∞—Ж–Є—П–Љ–Є –њ–Њ—В–µ—А–Є —Д—Г–љ–Ї—Ж–Є–Є –≤ –≤–Є–љ–≥–ї–µ—Б—Б-—Б–Є–≥–љ–∞–ї—М–љ–Њ–Љ –њ—Г—В–Є (wingless signaling pathway, WNT signaling pathway) –Є —Б –Љ—Г—В–∞—Ж–Є—П–Љ–Є —Б–Є–≥–љ–∞–ї—М–љ–Њ–≥–Њ –њ—Г—В–Є —В—А–∞–љ—Б—Д–Њ—А–Љ–Є—А—Г—О—Й–µ–≥–Њ —А–Њ—Б—В–Њ–≤–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ –±–µ—В–∞ 1 (transforming growth factor ќ≤-1 signaling pathway, TGFB1 signaling pathway).

–°—Г—Й–µ—Б—В–≤—Г—О—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –њ—А–Є —Б–Є–љ–і—А–Њ–Љ–љ–Њ–Љ –Є–ї–Є –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–Є –Њ—А–≥–∞–љ–∞ –Ј—А–µ–љ–Є—П. –Э–∞–Є–±–Њ–ї–µ–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ–Є —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –њ–Њ–Є—Б–Ї–∞ –Љ–Є—И–µ–љ–µ–є –і–ї—П —А–∞–Ј—А–∞–±–Њ—В–Ї–Є –ї–µ—З–µ–љ–Є—П —П–≤–ї—П—О—В—Б—П:
VEGF –Є —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –љ–Є–Љ —А–µ—Ж–µ–њ—В–Њ—А—Л VEGFA, –Љ–Њ–і–µ–ї—М —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –Є–Ј—Г—З–µ–љ–љ–Њ–є, —А–µ—Ж–µ–њ—В–Њ—А—Л VEGFR2 –Є –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–є –Є–Љ–Є –љ–µ–Њ–∞–љ–≥–Є–Њ–≥–µ–љ–µ–Ј –і–µ–ї–∞—О—В —Н—В—Г –Љ–Њ–ї–µ–Ї—Г–ї—Г –≤–∞–ґ–љ–Њ–є –Љ–Є—И–µ–љ—М—О.
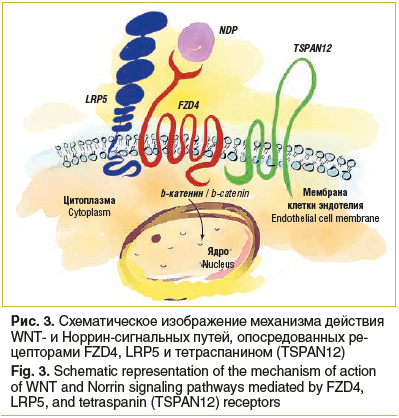
WNT- –Є –љ–Њ—А—А–Є–љ-—Б–Є–≥–љ–∞–ї—М–љ—Л–µ –њ—Г—В–Є; —В—А–∞–љ—Б–Љ–µ–Љ–±—А–∞–љ–љ—Л–µ –±–µ–ї–Ї–Є FZD4, LRP5, TSPAN12, NDP –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Љ—Г—В–∞—Ж–Є–є –≤ –љ–Є—Е –њ—А–Є–≤–Њ–і—П—В –Ї —А–∞–Ј–≤–Є—В–Є—О —Б–µ–Љ–µ–є–љ–Њ–є —Н–Ї—Б—Б—Г–і–∞—В–Є–≤–љ–Њ–є –≤–Є—В—А–µ–Њ—А–µ—В–Є–љ–Њ–њ–∞—В–Є–Є (Familial exudative vitreoretinopathy, FEVR) –Є –±–Њ–ї–µ–Ј–љ–Є –Э–Њ—А—А–Є (—А–Є—Б. 3), FZD4 —Г—З–∞—Б—В–≤—Г–µ—В –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –≥–µ–Љ–∞—В–Њ–Њ—Д—В–∞–ї—М–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±–∞—А—М–µ—А–∞ [5, 6]. –Ъ–∞–ґ–і—Л–є –Є–Ј —Н—В–Є—Е –±–µ–ї–Ї–Њ–≤ —П–≤–ї—П–µ—В—Б—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –Љ–Є—И–µ–љ—М—О –њ—А–Є –љ–∞–ї–Є—З–Є–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–≥–Њ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П –≤ –љ–µ–Љ –Њ—В –љ–Њ—А–Љ—Л.
–Ш–љ—Б—Г–ї–Є–љ–Њ–њ–Њ–і–Њ–±–љ—Л–є —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞ 1 (insulin-like growth factor 1, IGF1R) —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ—Г —А–Њ—Б—В—Г –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, –њ—А–Є –Љ—Г—В–∞—Ж–Є—П—Е –≤ –≥–µ–љ–µ IGF1R –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В (—А–Є—Б. 4).
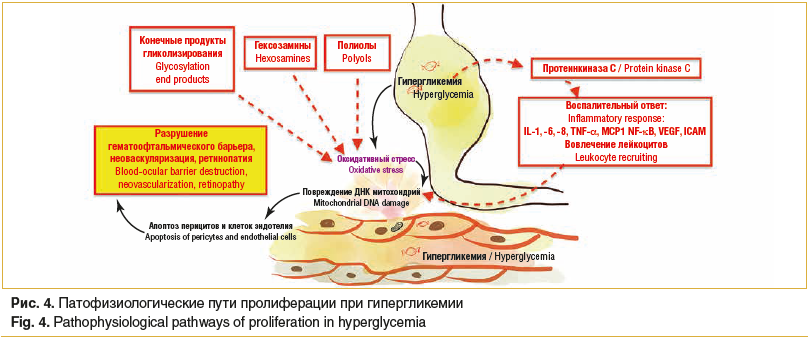
–≠–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–∞—П —Б–Є–љ—В–∞–Ј–∞ –Њ–Ї—Б–Є–і–∞ –∞–Ј–Њ—В–∞ (nitric oxide synthase, eNOS) —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј —Д–µ—А–Љ–µ–љ—В–Њ–≤, —Б–Є–љ—В–µ–Ј–Є—А—Г—О—Й–Є—Е—Б—П –њ—А–Є –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–Љ —Б—В—А–µ—Б—Б–µ, —Г—Б–Є–ї–Є–≤–∞–µ—В –љ–µ–Њ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—О –Є –≤–∞–Ј–Њ–Њ–±–ї–Є—В–µ—А–∞—Ж–Є—О.
–Ь–µ–і–Є–∞—В–Њ—А—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –≥–µ–љ—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ–Љ (–Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ—Л (interleukins, IL) -6, -7, -8, -10, -15, -1B, —Д–∞–Ї—В–Њ—А –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є-ќ± (tumor necrosis factor-ќ±, TNF-ќ±)), —В–Њ–ї–ї-–њ–Њ–і–Њ–±–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л 4 (toll-like receptors 4, TLR4), –і–µ–≤–Є–∞—Ж–Є—П –Ї–Њ—В–Њ—А—Л—Е –љ–∞–±–ї—О–і–∞–µ—В—Б—П –њ—А–Є —А–µ—В–Є–љ–Њ–њ–∞—В–Є–Є –љ–µ–і–Њ–љ–Њ—И–µ–љ–љ—Л—Е.
–Э–µ–є—А–Њ—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–є —Д–∞–Ї—В–Њ—А –Љ–Њ–Ј–≥–∞ (brain derived neurotrophic factor, BDNF).
–†–µ–љ–Є–љ-–∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≤–∞—П —Б–Є—Б—В–µ–Љ–∞ —Б–≤—П–Ј–∞–љ–∞ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–Њ—Б—Г–і–Њ–≤ —Б–µ—В—З–∞—В–Ї–Є –Є –њ–Њ—З–µ–Ї –Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –∞–љ–≥–Є–Њ–≥–µ–љ–µ–Ј–Њ–Љ. –Ь—Г—В–∞—Ж–Є–Є –≤ –≥–µ–љ–∞—Е –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–µ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ (angiotensin converting enzyme, ACE), –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≥–µ–љ–∞ (AGT) –Є —А–µ—Ж–µ–њ—В–Њ—А–∞ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≥–µ–љ–∞ 1 —В–Є–њ–∞ (angiotensin II receptor type 1, AGTR1) –Љ–Њ–≥—Г—В –±—Л—В—М –њ—А–Є—З–Є–љ–Њ–є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є.
–Р–љ–≥–Є–Њ–њ–Њ—Н—В–Є–љ—Л ANG-1 –Є ANG-2 —П–≤–ї—П—О—В—Б—П —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Њ—Б—В–∞, –Ї–Њ—В–Њ—А—Л–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–ї—П —А–∞–Ј–≤–Є—В–Є—П —Б–Њ—Б—Г–і–Њ–≤ —Б–µ—В—З–∞—В–Ї–Є –Є —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є —Б–Њ—Б—Г–і–Њ–≤.
–≠—А–Є—В—А–Њ–њ–Њ—Н—В–Є–љ, —А–µ—Ж–µ–њ—В–Њ—А—Л —Н—А–Є—В—А–Њ–њ–Њ—Н—В–Є–љ–∞ —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г—О—В—Б—П –≤ —Б–µ—В—З–∞—В–Ї–µ.
–Т—Л–Ј–≤–∞–љ–љ—Л–є –≥–Є–њ–Њ–Ї—Б–Є–µ–є —Д–∞–Ї—В–Њ—А (Hypoxia-inducible Factor, HIF-1) —А–µ–≥—Г–ї–Є—А—Г–µ—В —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О –≥–µ–љ–Њ–≤ VEGF, VEGFR1, —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ —А–Њ—Б—В–∞ (Platelet-derived growth factor, PDGF), —Д–∞–Ї—В–Њ—А–∞ —Б—В—А–Њ–Љ–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї 1 (Stromal cell-derived factor-1, SDF-1) –Є ANG2, —А–∞–Ј—А—Г—И–µ–љ–Є–µ HIF-1 –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Г—А–Њ–≤–љ—П VEGF.
–У–µ–Љ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј–∞-1 (Heme Oxygenase 1, HMOX1) –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є—П—Е, –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–Љ —Б—В—А–µ—Б—Б–µ, –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –ґ–µ–ї–µ–Ј–∞ –Є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є–Є —Б–Њ—Б—Г–і–Њ–≤.
–Ь–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј—Л (a disintegrin and metallo-proteinase domain 17, ADAM17). ADAM17-–љ–Њ–Ї–∞—Г—В–љ—Л–µ –Љ—Л—И–Є –њ–Њ–Ї–∞–Ј–∞–ї–Є –Љ–µ–љ—М—И—Г—О –љ–µ–Њ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—О –њ—А–Є –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–Љ —Б—В—А–µ—Б—Б–µ.
–Р–Ї—В—Г–∞–ї—М–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П —Б–Њ–Ј–і–∞–љ–Є–µ —Г–і–Њ–±–љ–Њ–≥–Њ –і–ї—П –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–µ–≥–Њ –≤—А–∞—З–∞ –њ–Њ–і—Е–Њ–і–∞ –і–ї—П –Њ—Ж–µ–љ–Ї–Є —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –њ—А–Њ–≥–љ–Њ–Ј–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –Њ—А–≥–∞–љ–∞ –Ј—А–µ–љ–Є—П, –њ–Њ–і–±–Њ—А–∞ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є —В–∞–Ї—В–Є–Ї–Є –Є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≤ –±—Г–і—Г—Й–µ–Љ. –Ф–ї—П —Н—В–Њ–≥–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –±—Л–ї–Њ —А–∞–Ј—А–∞–±–Њ—В–∞—В—М –Є –њ—А–Є–Љ–µ–љ–Є—В—М –њ–Њ–і—Е–Њ–і –Ї –∞–љ–∞–ї–Є–Ј—Г –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –і–∞–љ–љ—Л—Е –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –ї–Є—В–µ—А–∞—В—Г—А–љ—Л—Е –Є —Б–Њ–±—Б—В–≤–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е.
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –≤—Л—П–≤–Є—В—М –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–µ–є –Ї–ї–µ—В–Њ–Ї —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–µ—В–Є –Њ—А–≥–∞–љ–∞ –Ј—А–µ–љ–Є—П –і–ї—П –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П —В–µ—З–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –њ–Њ–і–±–Њ—А–∞ –љ–∞–Є–±–Њ–ї–µ–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
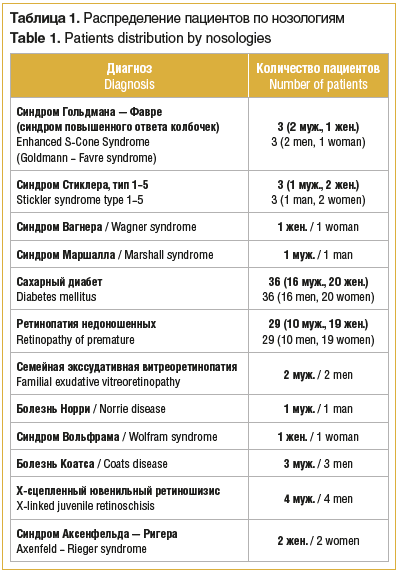
–Ш–Ј 1210 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л—Е –љ–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –љ–∞ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г —Б 2015 –њ–Њ 2020 –≥. –≤ –Ю–Ю–Ю ¬Ђ–Ю—Д—В–∞–ї—М–Љ–Є–Ї¬ї —Б –Љ–Њ–љ–Њ–≥–µ–љ–љ–Њ–є –≥–ї–∞–Ј–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є –Є–ї–Є —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ —В–∞–Ї–Њ–≤—Г—О (—Б –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ, —Ж–µ–љ—В—А–∞–ї—М–љ—Л–Љ–Є –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–Љ–Є –і–Є—Б—В—А–Њ—Д–Є—П–Љ–Є —Б–µ—В—З–∞—В–Ї–Є, —А–µ—В–Є–љ–Њ–њ–∞—В–Є–µ–є –љ–µ–і–Њ–љ–Њ—И–µ–љ–љ—Л—Е, —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ –Є –і—А.), –≤ –≥—А—Г–њ–њ—Г –Њ—В–±–Њ—А–∞ –і–ї—П –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –≤–Њ—И–ї–Є 86 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –≥–ї–∞–Ј–љ—Л–Љ–Є –Є/–Є–ї–Є —Б–Є–љ–і—А–Њ–Љ–љ—Л–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 3 –≥—А—Г–њ–њ—Л:
1-—П –≥—А—Г–њ–њ–∞ вАФ –њ–∞—Ж–Є–µ–љ—В—Л —Б –Љ–Њ–љ–Њ–≥–µ–љ–љ–Њ–є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є (21 —З–µ–ї–Њ–≤–µ–Ї (42 –≥–ї–∞–Ј–∞), 14 вАФ –Љ—Г–ґ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–∞, 7 вАФ –ґ–µ–љ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–∞, –≤–Њ–Ј—А–∞—Б—В вАФ –Њ—В 4 –Љ–µ—Б. –і–Њ 43 –ї–µ—В), –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ї–Њ—В–Њ—А—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј –Љ–Њ–љ–Њ–≥–µ–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ;
2-—П –≥—А—Г–њ–њ–∞ вАФ –њ–∞—Ж–Є–µ–љ—В—Л —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ ¬Ђ–њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–∞—П –≤–Є—В—А–µ–Њ—А–µ—В–Є–љ–Њ–њ–∞—В–Є—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞¬ї (36 —З–µ–ї–Њ–≤–µ–Ї (72 –≥–ї–∞–Ј–∞), 16 вАФ –Љ—Г–ґ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–∞, 20 вАФ –ґ–µ–љ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–∞, –≤–Њ–Ј—А–∞—Б—В вАФ –Њ—В 11 –і–Њ 56 –ї–µ—В);
3-—П –≥—А—Г–њ–њ–∞ вАФ –њ–∞—Ж–Є–µ–љ—В—Л —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ ¬Ђ—А–µ—В–Є–љ–Њ–њ–∞—В–Є—П –љ–µ–і–Њ–љ–Њ—И–µ–љ–љ—Л—Е¬ї (29 —З–µ–ї–Њ–≤–µ–Ї (58 –≥–ї–∞–Ј), 10 вАФ –Љ—Г–ґ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–∞, 19 вАФ –ґ–µ–љ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–∞, –≤–Њ–Ј—А–∞—Б—В вАФ –Њ—В 3 –Љ–µ—Б. –і–Њ 12 –ї–µ—В). –°—А–Њ–Ї –љ–∞–±–ї—О–і–µ–љ–Є—П –Ј–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є —Б–Њ—Б—В–∞–≤–Є–ї –Њ—В 6 –і–Њ 36 –Љ–µ—Б.
–Я—А–Є–Љ–µ–љ—П–ї–Є—Б—М –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ-–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Њ–±–Њ—А—Г–і–Њ–≤–∞–љ–Є–µ –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Њ–±—Й–µ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –∞–љ–∞–ї–Є–Ј–Њ–≤, –≤—Л—Б–Њ–Ї–Њ–њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї—М–љ—Л–µ —Б–µ—А–≤–µ—А—Л –і–ї—П –Њ–±—А–∞–±–Њ—В–Ї–Є –≥–µ–љ–Њ–Љ–љ—Л—Е –і–∞–љ–љ—Л—Е –Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—З–µ—В–Њ–≤. –Я—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Њ—Б–Љ–Њ—В—А —В–µ—А–∞–њ–µ–≤—В–Њ–Љ, –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є—П –≥–µ–љ–µ—В–Є–Ї–∞, —Б–±–Њ—А —Б–µ–Љ–µ–є–љ–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞, –∞–љ–∞–Љ–љ–µ–Ј–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (—Б —Г—В–Њ—З–љ–µ–љ–Є–µ–Љ –≤–Њ–Ј—А–∞—Б—В–∞ –µ–≥–Њ –љ–∞—З–∞–ї–∞ –Є —Б–Ї–Њ—А–Њ—Б—В–Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П), —Д–Є–Ј–Є–Ї–∞–ї—М–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –Є–Ј–Љ–µ—А–µ–љ–Є–µ —А–Њ—Б—В–∞, –Љ–∞—Б—Б—Л —В–µ–ї–∞, —А–∞—Б—З–µ—В –Є–љ–і–µ–Ї—Б–∞ –Љ–∞—Б—Б—Л —В–µ–ї–∞, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —В–Є–њ–∞ —В–µ–ї–Њ—Б–ї–Њ–ґ–µ–љ–Є—П. –°–±–Њ—А –Є —Д–Є–Ї—Б–∞—Ж–Є—П —Б–µ–Љ–µ–є–љ–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М —Б–µ—А—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–Љ –њ–Њ—Б–ї–µ –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є—П –Њ–±—Г—З–µ–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ –Њ–±—А–∞–Ј–Њ–≤–∞—В–µ–ї—М–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ http://www.genome.gov —Б –њ–Њ–Љ–Њ—Й—М—О –њ—А–Њ–≥—А–∞–Љ–Љ–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ Microsoft Power Point, Corel Draw –Є–ї–Є Invitae family history tool.
–Ю—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л–є –Њ—Б–Љ–Њ—В—А –≤–Ї–ї—О—З–∞–ї —Б–ї–µ–і—Г—О—Й–Є–µ –њ—А–Њ—Ж–µ–і—Г—А—Л: –≤–Є–Ј–Њ–Љ–µ—В—А–Є—П, —А–µ—Д—А–∞–Ї—В–Њ–Љ–µ—В—А–Є—П, –±–Є–Њ–Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—П, –Њ–њ—В–Є—З–µ—Б–Ї–∞—П –Ї–Њ–≥–µ—А–µ–љ—В–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П, –њ–µ—А–Є–Љ–µ—В—А–Є—П, –Љ–Є–Ї—А–Њ–њ–µ—А–Є–Љ–µ—В—А–Є—П, –њ–љ–µ–≤–Љ–Њ—В–Њ–љ–Њ–Љ–µ—В—А–Є—П, –Њ—Д—В–∞–ї—М–Љ–Њ—Б–Ї–Њ–њ–Є—П (—Б —Д–Њ—В–Њ—Д–Є–Ї—Б–∞—Ж–Є–µ–є, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ 1 –≥–Њ–і–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ Retcam –њ–Њ–і –Њ–±—Й–µ–є –∞–љ–µ—Б—В–µ–Ј–Є–µ–є), —Н–ї–µ–Ї—В—А–Њ—А–µ—В–Є–љ–Њ–≥—А–∞—Д–Є—П, –Є–Ј–Љ–µ—А–µ–љ–Є–µ –Ј—А–Є—В–µ–ї—М–љ—Л—Е –≤—Л–Ј–≤–∞–љ–љ—Л—Е –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–≤, —В–µ–Љ–љ–Њ–≤–∞—П –∞–і–∞–њ—В–Њ–Љ–µ—В—А–Є—П, –∞—Г—В–Њ—Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—Ж–Є—П, —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—В–љ–∞—П –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П, –њ—А–Њ–≤–µ—А–Ї–∞ —Ж–≤–µ—В–Њ–≤–Њ—Б–њ—А–Є—П—В–Є—П –њ–Њ —В–∞–±–ї–Є—Ж–∞–Љ –†–∞–±–Ї–Є–љ–∞ –Є —В–µ—Б—В—Г –§–∞—А–љ—Б—Г–Њ—А—В–∞/–•—М—О).
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є, –Њ–±—Й–Є–є –∞–љ–∞–ї–Є–Ј –Љ–Њ—З–Є, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є, –∞–љ–∞–ї–Є–Ј –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є—В—Л, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –љ–∞ –Њ—А–љ–Є—В–Є–љ, –Љ–Є–Ї—А–Њ¬≠—Н–ї–µ–Љ–µ–љ—В—Л, –Є—Б–Ї–ї—О—З–µ–љ–Є–µ –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є –Њ–±–Љ–µ–љ–∞.
–Ь–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Њ –њ–Њ–ї–љ–Њ—Н–Ї–Ј–Њ–Љ–љ–Њ–µ —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ WES (whole exome sequencing) –Є NGS (next generation sequencing) –њ–∞–љ–µ–ї–Є, —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ –Њ—В–і–µ–ї—М–љ—Л—Е –≥–µ–љ–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –њ—Г—В–µ–Љ –Ј–∞–±–Њ—А–∞ 5 –Љ–ї –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –≤–µ–љ–Њ–Ј–љ–Њ–є –Ї—А–Њ–≤–Є, –≤—Л–і–µ–ї–µ–љ–Є—П –Ф–Э–Ъ. –Ф–ї—П –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–Є –±–Є–±–ї–Є–Њ—В–µ–Ї –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М —А–µ–∞–≥–µ–љ—В—Л Nextera Rapid Capture Exome v1.2 (Illumina). –°–Є–Ї–≤–µ–љ—Б –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –љ–∞ –њ—А–Є–±–Њ—А–µ Illumina NextSeq 500 —Б–Њ —Б—А–µ–і–љ–Є–Љ –њ–Њ–Ї—А—Л—В–Є–µ–Љ 70X. –С–Њ–ї—М—И–Є–µ —Е—А–Њ–Љ–Њ—Б–Њ–Љ–љ—Л–µ –∞–љ–Њ–Љ–∞–ї–Є–Є –Є—Б–Ї–ї—О—З–∞–ї–Є—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —Е—А–Њ–Љ–Њ—Б–Њ–Љ–љ–Њ–≥–Њ –Љ–Є–Ї—А–Њ–Љ–∞—В—А–Є—З–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ (XMA; Affymetrix CytoScan HD array). –°–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ –°—Н–љ–≥–µ—А—Г –њ—А–Њ–≤–Њ–і–Є–ї–Є, —З—В–Њ–±—Л –њ–Њ–і—В–≤–µ—А–і–Є—В—М –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є. –Ґ–∞–Ї–ґ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є –∞–љ–∞–ї–Є–Ј —Б–µ–≥—А–µ–≥–∞—Ж–Є–Є –і–ї—П –і–Њ—Б—В—Г–њ–љ—Л—Е —З–ї–µ–љ–Њ–≤ —Б–µ–Љ—М–Є, —Б–ї–µ–і—Г—П –њ—А–Њ—В–Њ–Ї–Њ–ї—Г Malaichamy [7].
–С–Є–Њ–Є–љ—Д–Њ—А–Љ–∞—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Є –∞–љ–љ–Њ—В–∞—Ж–Є—П –≤–∞—А–Є–∞–љ—В–Њ–≤ –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –Є –њ—А–Њ–њ—А–Є–µ—В–∞—А–љ—Л—Е –∞–ї–≥–Њ—А–Є—В–Љ–Њ–≤. GATK (Genome Analysis ToolKit) –Є –њ–Њ–ї—М–Ј–Њ–≤–∞—В–µ–ї—М—Б–Ї–Є–µ –±–∞–Ј—Л –і–∞–љ–љ—Л—Е –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М –і–ї—П –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—П –Ї–∞–Ї –Њ–і–љ–Њ–љ—Г–Ї–ї–µ–Њ—В–Є–і–љ—Л—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ (single nucleotide variation, SNV), –Љ–∞–ї—Л—Е –≤—Б—В–∞–≤–Њ–Ї/–і–µ–ї–µ—Ж–Є–є, —В–∞–Ї –Є –≤–∞—А–Є–∞—Ж–Є–є —З–Є—Б–ї–∞ –Ї–Њ–њ–Є–є–љ–Њ—Б—В–Є (copy number variation, CNV). –≠–≤–Њ–ї—О—Ж–Є–Њ–љ–љ—Г—О —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–љ—Л—Е –Њ—Б—В–∞—В–Ї–Њ–≤ –Њ–њ—А–µ–і–µ–ї—П–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤ webPRANK, CDD/SPARCLE –Є MOTIF Search.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
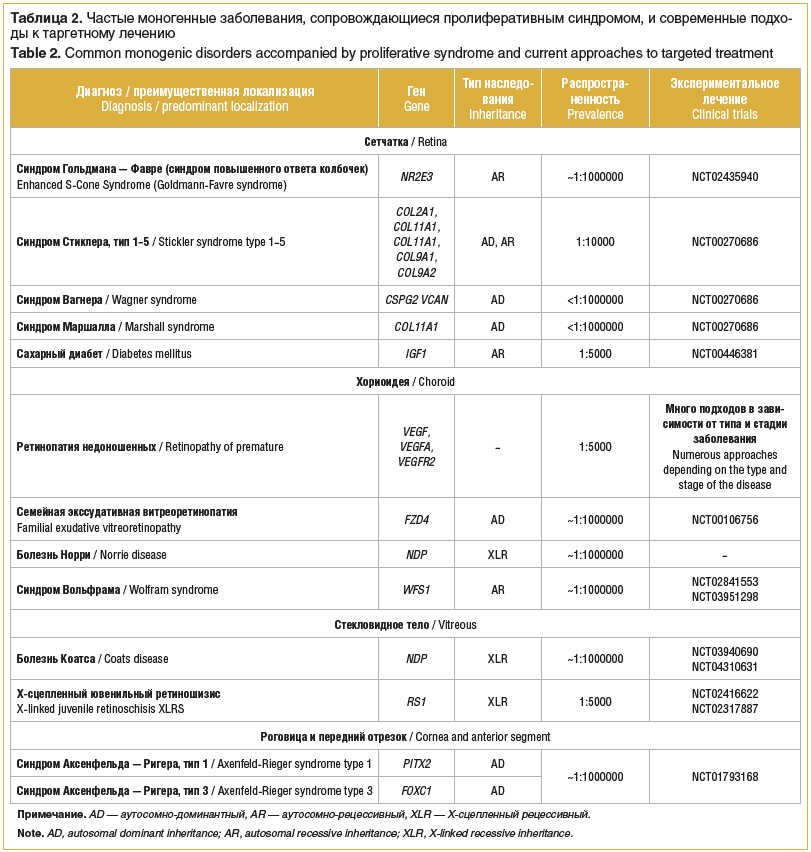
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —Г 21 –њ–∞—Ж–Є–µ–љ—В–∞ –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –і–Є–∞¬≠–≥–љ–Њ–Ј –Љ–Њ–љ–Њ–≥–µ–љ–љ–Њ–≥–Њ –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–µ—В—З–∞—В–Ї–Є (—В–∞–±–ї. 1). –°–Њ–≥–ї–∞—Б–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–Љ—Г –і–Є–∞–≥–љ–Њ–Ј—Г –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Ї–Њ–љ—Б—Г–ї—М—В–Є—А–Њ–≤–∞–љ–Є–µ –Є –і–∞–љ—Л —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–Њ–ї—Г—З–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –≤ –±—Г–і—Г—Й–µ–Љ (—В–∞–±–ї. 2).
–Р–љ–∞–ї–Є–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ—Л—Е –Љ—Г—В–∞—Ж–Є–є –≤–Њ 2-–є –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ ¬Ђ–њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–∞—П –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П –≤–Є—В—А–µ–Њ—А–µ—В–Є–љ–Њ–њ–∞—В–Є—П¬ї –≤—Л—П–≤–Є–ї –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ -509C>T –≤ –≥–µ–љ–µ TGFB1 —Г 2 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ c.3174G>A –≤ –≥–µ–љ–µ IGF1R —Г 3 –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Я—А–Є –∞–љ–љ–Њ—В–∞—Ж–Є–Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ 3-–є –≥—А—Г–њ–њ—Л —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ ¬Ђ—А–µ—В–Є–љ–Њ–њ–∞—В–Є—П –љ–µ–і–Њ–љ–Њ—И–µ–љ–љ—Л—Е, III –Є–ї–Є IV —Б—В–∞–і–Є—П¬ї –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ–Є –±—Л–ї–Є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ—Л +13553C>T (5 –њ–∞—Ж–Є–µ–љ—В–Њ–≤) -634G>C, +405G>C (rs2010963) (3 –њ–∞—Ж–Є–µ–љ—В–∞), -460C>T (rs833061) (2 –њ–∞—Ж–Є–µ–љ—В–∞) –≤ –≥–µ–љ–µ VEGFA.
–Т –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–є –њ–Њ–і—Е–Њ–і –±—Л–ї –≤–Ї–ї—О—З–µ–љ –∞–љ–∞–ї–Є–Ј –љ–∞–ї–Є—З–Є—П –Љ—Г—В–∞—Ж–Є–є –≤ –≥–µ–љ–∞—Е, –њ—А—П–Љ–Њ –Є–ї–Є –Ї–Њ—Б–≤–µ–љ–љ–Њ —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –∞–љ–≥–Є–Њ–≥–µ–љ–µ–Ј–∞, –Є –Њ—Б–љ–Њ–≤–љ—Л—Е —Б–Є–≥–љ–∞–ї—М–љ—Л—Е –њ—Г—В–µ–є. –І–∞—Б—В–Є—З–љ–Њ —Б–њ–Є—Б–Њ–Ї –≥–µ–љ–Њ–≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –≤ —В–∞–±–ї–Є—Ж–µ 3. –Ь–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –≤ —А–∞–Љ–Ї–∞—Е –≤–љ—Г—В—А–Є–ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ —В–µ—Б—В–∞ –Є –Є–Љ–µ–ї —Б–≤–Њ–Є –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–Љ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є–Є.

–° —Г—З–µ—В–Њ–Љ —А–∞–Ј–≤–Є–≤–∞—О—Й–Є—Е—Б—П –њ–Њ–і—Е–Њ–і–Њ–≤ –≥–µ–љ–љ–Њ–≥–Њ —А–µ–і–∞–Ї—В–Є—А–Њ–≤–∞–љ–Є—П [8], –≥–µ–љ–љ–Њ–≥–Њ –Ј–∞–Љ–µ—Й–µ–љ–Є—П, —Г—Б–Є–ї–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –≥–µ–љ–Њ–≤, –∞ —В–∞–Ї–ґ–µ —Б —Г—З–µ—В–Њ–Љ –њ–Њ—П–≤–ї–µ–љ–Є—П –†–Э–Ъ-–њ–Њ–і—Е–Њ–і–Њ–≤ –Ї –ї–µ—З–µ–љ–Є—О [9] –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ –і–µ–є—Б—В–≤–µ–љ–љ–∞—П –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–∞—П –њ–Њ–Љ–Њ—Й—М –≤ —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –≤ –±–ї–Є–ґ–∞–є—И–Є–µ –≥–Њ–і—Л, –њ–Њ—Н—В–Њ–Љ—Г –≤–∞–ґ–љ–Њ –і–Њ–≤–Њ–і–Є—В—М –і–Њ –Ї–Њ–љ—Ж–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г, —З—В–Њ–±—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Њ –±–Њ–ї—М—И–µ —И–∞–љ—Б–Њ–≤ –љ–∞ –ї–µ—З–µ–љ–Є–µ –Є–ї–Є —Г—З–∞—Б—В–Є–µ –≤ —Д–Є–љ–∞–ї—М–љ—Л—Е —Д–∞–Ј–∞—Е –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–Т –±—Г–і—Г—Й–µ–Љ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –ї–Є–і–Є—А—Г—О—Й–µ–≥–Њ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—Г—В–Є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є —Г –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –±—Г–і–µ—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –±–ї–Њ–Ї–∞—В–Њ—А (–Є–ї–Є –∞–Ї—В–Є–≤–∞—В–Њ—А –Є–љ–≥–Є–±–Є—В–Њ—А–∞) –њ—А–Є—З–Є–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П, –Ї–∞–Ї —Б–µ–≥–Њ–і–љ—П —Г—Б–њ–µ—И–љ–Њ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П anti-VEGF –Є anti-PIGF —В–µ—А–∞–њ–Є—П, –Є–Ј–≤–µ—Б—В–љ–Њ —В–∞–Ї–ґ–µ –Њ–± —Г—Б–њ–µ—И–љ—Л—Е –њ–Њ–њ—Л—В–Ї–∞—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П AGX51 [10]. AGX51 —П–≤–ї—П–µ—В—Б—П –њ–µ—А–≤—Л–Љ –≤ —Б–≤–Њ–µ–Љ –Ї–ї–∞—Б—Б–µ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–Љ —Б–µ–Љ–µ–є—Б—В–≤–∞ –Ф–Э–Ъ-—Б–≤—П–Ј—Л–≤–∞—О—Й–Є—Е/–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—Й–Є—Е –±–µ–ї–Ї–Њ–≤ (pan inhibitor of differentiation). AGX51 –Є–љ–≥–Є–±–Є—А—Г–µ—В –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ Id1-E47, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–±–Є–Ї–≤–Є—В–Є–љ-–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–є –і–µ–≥—А–∞–і–∞—Ж–Є–Є, –Ј–∞–і–µ—А–ґ–Ї–µ —А–Њ—Б—В–∞ –Ї–ї–µ—В–Њ–Ї –Є —Б–љ–Є–ґ–µ–љ–Є—О –Є—Е –ґ–Є–Ј–љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є, –Є–љ–≥–Є–±–Є—А—Г–µ—В –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –љ–µ–Њ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—О –≥–ї–∞–Ј–∞.
–Т –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є—Б—М –Љ–Є—А–Њ–≤—Л–µ –і–∞–љ–љ—Л–µ –Њ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–Њ–≤ -509C>T –≤ –≥–µ–љ–µ TGFB1 –Є c.3174G>A –≤ –≥–µ–љ–µ IGF1R —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —А–µ—В–Є–љ–Њ–њ–∞—В–Є–µ–є. –Я—А–Њ–≤–µ–і–µ–љ–Є–µ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–Њ–є —Б—В–∞–і–Є–µ–є –і–Є–∞–±–µ—В–∞ [11вАУ13] –њ–Њ–Ј–≤–Њ–ї–Є—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М —Н—В–Є —Б–ї—Г—З–∞–Є –Є –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –Љ—Г—В–∞—Ж–Є–є –і–∞–≤–∞—В—М –±–Њ–ї–µ–µ —В–Њ—З–љ—Л–µ –њ—А–Њ–≥–љ–Њ–Ј—Л –Њ —В–µ—З–µ–љ–Є–Є –Є —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ–≤–Њ–і–Є—В—М –Љ–µ–і–Є–Ї–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ –Є –Є—Е —Б–µ–Љ—М—П–Љ –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г —З–ї–µ–љ–Њ–≤ —Б–µ–Љ—М–Є –љ–∞—А—П–і—Г —Б –њ–Њ–і—Е–Њ–і–∞–Љ–Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ–і–∞–Ї—В–Є—А–Њ–≤–∞–љ–Є—П.
–Ґ–∞–Ї–ґ–µ –Љ—Л –≤–Є–і–Є–Љ, —З—В–Њ —А–µ—В–Є–љ–Њ–њ–∞—В–Є—П –љ–µ–і–Њ–љ–Њ—И–µ–љ–љ—Л—Е –Є–Љ–µ–µ—В –±–Њ–ї–µ–µ —В—П–ґ–µ–ї–Њ–µ —В–µ—З–µ–љ–Є–µ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Њ–і–љ–Њ–є –Є–Ј —З–µ—В—Л—А–µ—Е –љ–∞–Є–±–Њ–ї–µ–µ –њ–∞—В–Њ–≥–µ–љ–љ—Л—Е –Љ—Г—В–∞—Ж–Є–є (+13553C>T, -634G>C, +405G>C (rs2010963), -460C>T (rs833061)) –≤ –≥–µ–љ–µ VEGFA [14вАУ16].
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ф–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П, –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –њ–ї–∞–љ–Є—А—Г–µ—В—Б—П —А–∞—Б—И–Є—А–Є—В—М —Б–њ–µ–Ї—В—А –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ–Љ—Л—Е –љ–Њ–Ј–Њ–ї–Њ–≥–Є–є. –°–Њ–≤–Љ–µ—Б—В–љ—Л–µ —Г—Б–Є–ї–Є—П —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ –Є–Ј —А–∞–Ј–љ—Л—Е —Б—В—А–∞–љ –і–∞—О—В –љ–∞–і–µ–ґ–і—Г –љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–µ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–µ–є –Ї–ї–µ—В–Њ–Ї —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–µ—В–Є –Њ—А–≥–∞–љ–∞ –Ј—А–µ–љ–Є—П.
–Ф–ї—П —Г—В–Њ—З–љ–µ–љ–Є—П –њ—А–Њ–≥–љ–Њ–Ј–∞ —В–µ—З–µ–љ–Є—П –Є —В—П–ґ–µ—Б—В–Є –њ—А–Њ—Ж–µ—Б—Б–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –Њ—А–≥–∞–љ–∞ –Ј—А–µ–љ–Є—П [17, 18], –њ–Њ–і–±–Њ—А–∞ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є —В–∞–Ї—В–Є–Ї–Є –Є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —В–∞—А–≥–µ—В–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —Б–њ–µ—Ж–Є–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є—П —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Г—Б–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Ї –∞–љ–∞–ї–Є–Ј—Г –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е.
–§–Є–љ–∞–љ—Б–Є—А–Њ–≤–∞–љ–Є–µ/Funding
–Я—А–Њ–µ–Ї—В —Д–Є–љ–∞–љ—Б–Є—А–Њ–≤–∞–ї—Б—П –Є–Ј —Б–Њ–±—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –Ю–Ю–Ю ¬Ђ–Ю—Д—В–∞–ї—М–Љ–Є–Ї¬ї –Є –Э–Я ¬Ђ–Ь–Э–Я–¶–Я–Ґ¬ї.
Sources of funding: the project is supported by own means of LLC "Oftalmic" and International Scientific and Practical Center for Tissue Proliferation.
–С–ї–∞–≥–Њ–і–∞—А–љ–Њ—Б—В—М/Acknowledgement
–Ф–∞–љ–љ–∞—П —А–∞–±–Њ—В–∞ –љ–µ –Љ–Њ–≥–ї–∞ –±—Л –±—Л—В—М –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –±–µ–Ј —Б–Њ–і–µ–є—Б—В–≤–Є—П –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Њ–≤, –≥–µ–љ–µ—В–Є–Ї–Њ–≤, –љ–µ–≤—А–Њ–ї–Њ–≥–Њ–≤, –њ–µ–і–Є–∞—В—А–Њ–≤, —Б –Ї–Њ—В–Њ—А—Л–Љ–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є–Є –њ–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ—Г –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤: –Р–≤–∞–љ–µ—Б–Њ–≤–∞ –Ґ.–Р. (–Ь–Њ—Б–Ї–≤–∞), –С—С–Љ–µ –Р.–Р. (–Ь–Њ—Б–Ї–≤–∞), –С–Њ–љ–і–∞—А—М –Т.–Р. (–Ь–Њ—Б–Ї–≤–∞), –Т—Г—А–і–∞—Д—В –Р.–Х. (–Ь–Њ—Б–Ї–≤–∞), –У–∞–є—Б–Є–љ –Х.–Т. (–£—Д–∞), –У–Є–≥–Є–љ–µ–Є—И–≤–Є–ї–Є –Ф.–Э. (–Ь–Њ—Б–Ї–≤–∞), –У–Њ—А–≥–Є—И–µ–ї–Є –Ъ.–Т. (–Ь–Њ—Б–Ї–≤–∞), –У—Г—А–Є–љ–Њ–≤–∞ –Х.–Х. (–ѓ–Ї—Г—В—Б–Ї), –Ц–µ–≥—Г–ї–Є–љ–∞ –Ш.–Ю. (–Ь–Њ—Б–Ї–≤–∞), –Ц—Г—А–Ї–Њ–≤–∞ –Э.–Т. (–Ь–Њ—Б–Ї–≤–∞), –Ц—Г—З–µ–љ–Ї–Њ –Э.–Р. (–Ь–Њ—Б–Ї–≤–∞), –Ч–Њ–ї—М–љ–Є–Ї–Њ–≤–∞ –Ш.–Т. (–Ь–Њ—Б–Ї–≤–∞), –Ъ—А–µ—З–Љ–∞—А –Ь.–Т. (–°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥), –Ь–∞—А–Ї–Њ–≤–∞ –Ґ.–Т. (–Ь–Њ—Б–Ї–≤–∞), –Э–Є–Ї–Њ–ї–∞–µ–≤–∞ –Р.–Т. (–£–ї–∞–љ-–£–і—Н), –Э—Г—А–≥–∞–ї–Є–µ–≤–∞ –Ы.–†. (–£—Д–∞), –°—Г—Е–∞–љ–Њ–≤–∞ –Э.–Т. (–Ь–Њ—Б–Ї–≤–∞), –•–∞—Ж–µ–љ–Ї–Њ –Ш.–Х. (–Ь–Њ—Б–Ї–≤–∞), –®–µ—Б—В–Њ–њ–∞–ї–Њ–≤–∞ –Х.–Р. (–Ь–Њ—Б–Ї–≤–∞).
This work could not have been done without the assistance of ophthalmologists, geneticists, neurologists, pediatricians, who were consulted on differential diagnosis and clinical examination of patients: Avanesova T.A. (Moscow), Boehme A.A. (Moscow), Bondar V.A. (Moscow), Vurdaft A.E. (Moscow), Gaisin E.V. (Ufa), Gigineishvili D.N. (Moscow), Gorgisheli K.V. (Moscow), Gurinova E.E. (Yakutsk), Zhegulina I.O. (Moscow), Zhurkova N.V. (Moscow), Zhuchenko N.A. (Moscow), Zolnikova I.V. (Moscow), Krechmar M.V. (St. Petersburg), Markova T.V. (Moscow), Nikolaeva A.V. (Ulan-Ude), Nurgalieva L.R. (Ufa), Sukhanova N.V. (Moscow), Khatsenko I.E. (Moscow), Shestopalova E.A. (Moscow).
–°–≤–µ–і–µ–љ–Є—П –Њ–± –∞–≤—В–Њ—А–∞—Е:
1–Т–Є–љ–µ—А –Ь–∞—А–Є–∞–љ–љ–∞ –Х–≤–≥–µ–љ—М–µ–≤–љ–∞ вАФ –Ї.–Љ.–љ., —А—Г–Ї–Њ–≤–Њ–і–Є—В–µ–ї—М; ORCID iD 0000-0002-1089-4293.
2,3–С–∞–Ї—Г–љ–Є–љ–∞ –Э–∞—В–∞–ї—М—П –Р–ї–µ–Ї—Б–∞–љ–і—А–Њ–≤–љ–∞ вАФ –Ї.–Љ.–љ., –≤—А–∞—З-–Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥; ORCID iD 0000-0002-1148-5184.
4–°–∞–ї–Љ–∞—Б–Є –Ц–µ–∞–љ –Ь—Г—Б—В–∞—Д–∞–µ–≤–Є—З вАФ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А, –Ј–∞–≤–µ–і—Г—О—Й–Є–є –Ї–∞—Д–µ–і—А–Њ–є –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є–Є; ORCID iD 0000-0001-8524-0019.
4–Я–Њ—А—П–і–Є–љ –У–µ–љ–љ–∞–і–Є–є –Т–∞—Б–Є–ї—М–µ–≤–Є—З вАФ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А, —З–ї–µ–љ-–Ї–Њ—А—А. –†–Р–Э, –њ–Њ—З–µ—В–љ—Л–є –Ј–∞–≤–µ–і—Г—О—Й–Є–є –Ї–∞—Д–µ–і—А–Њ–є –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є–Є; ORCID iD 0000-0003-2010-3296.
1–С–∞—А—Е –Ф–µ–±–Љ–∞–ї–∞ вАФ PhD, –±–Є–Њ–Є–љ—Д–Њ—А–Љ–∞—В–Є–Ї; ORCID iD 0000-0002-2557-7768.
2–Ъ—Г–Ј–љ–µ—Ж–Њ–≤–∞ –Ѓ–ї–Є—П –Ф–Љ–Є—В—А–Є–µ–≤–љ–∞ вАФ –≤—А–∞—З-–Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥, ORCID iD 0000-0002-4715-5873.
2,4–С–∞–ї–∞—И–Њ–≤–∞ –Ы–∞—А–Є—Б–∞ –Ь–∞—А–∞—В–Њ–≤–љ–∞ вАФ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А, —А—Г–Ї–Њ–≤–Њ–і–Є—В–µ–ї—М; ORCID iD 0000-0001-9349-7092.
1–Ю–Ю–Ю ¬Ђ–Ю—Д—В–∞–ї—М–Љ–Є–Ї¬ї. 125167, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, –Ы–µ–љ–Є–љ–≥—А–∞–і—Б–Ї–Є–є –њ—А-—В, –і. 47/3.
2–Э–Я ¬Ђ–Ь–Э–Я–¶–Я–Ґ¬ї. 119034, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Я—А–µ—З–Є—Б—В–µ–љ–Ї–∞, –і. 29/14.
3–У–Ъ–С вДЦ 1 –Є–Љ. –Э.–Ш. –Я–Є—А–Њ–≥–Њ–≤–∞. 119049, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, –Ы–µ–љ–Є–љ—Б–Ї–Є–є –њ—А-—В, –і. 8.
4–†–Э–Ш–Ь–£ –Є–Љ. –Э.–Ш. –Я–Є—А–Њ–≥–Њ–≤–∞ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є. 117997, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Ю—Б—В—А–Њ–≤–Є—В—П–љ–Њ–≤–∞, –і. 1.
–Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –Т–Є–љ–µ—А –Ь–∞—А–Є–∞–љ–љ–∞ –Х–≤–≥–µ–љ—М–µ–≤–љ–∞, e-mail: info@oftalmic.ru.
–Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤: –Т–Є–љ–µ—А –Ь.–Х., –С–∞—А—Е –Ф. —П–≤–ї—П—О—В—Б—П —Б–Њ—В—А—Г–і–љ–Є–Ї–∞–Љ–Є –Ю–Ю–Ю ¬Ђ–Ю—Д—В–∞–ї—М–Љ–Є–Ї¬ї. –С–∞–ї–∞—И–Њ–≤–∞ –Ы.–Ь., –С–∞–Ї—Г–љ–Є–љ–∞ –Э.–Р., –Ъ—Г–Ј–љ–µ—Ж–Њ–≤–∞ –Ѓ.–Ф. —П–≤–ї—П—О—В—Б—П —Б–Њ—В—А—Г–і–љ–Є–Ї–∞–Љ–Є
–Э–Я ¬Ђ–Ь–Э–Я–¶–Я–Ґ¬ї. –Ю—Б—В–∞–ї—М–љ—Л–µ –∞–≤—В–Њ—А—Л –Ј–∞—П–≤–ї—П—О—В –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Ї–Њ–љ—Д–ї–Є–Ї—В–∞ –Є–љ—В–µ—А–µ—Б–Њ–≤.
–°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 13.07.2020.
About the authors:
1Marianna E. Weener вАФ C. Sc. (Med.), Head; ORCID iD 0000-0002-1089-4293.
2,3Natalia A. Bakunina вАФ C. Sc. (Med.), ophthalmologist; ORCID iD 0000-0002-1148-5184.
4Jean M. Salmasi вАФ Dr. Sc. (Med.), Professor, Head of the Department of Pathophysiology; ORCID iD 0000-0001-8524-0019.
4Gennadiy V. Poryadin вАФ Dr. Sc. (Med.), Professor, Corresponding Member of the RAS, Honorary Head of the Department of Pathophysiology; ORCID iD 0000-0003-2010-3296.
1Debmalya Barh вАФ PhD, bioinformatician; ORCID iD 0000-0002-2557-7768.
2Yulia D. Kuznetsova вАФ ophthalmologist, ORCID iD 0000-0002-4715-5873.
2,4 Larisa M. Balashova вАФ Dr. Sc. (Med.), Professor, Head; ORCID iD 0000-0001-9349-7092.
1LLC "Oftalmic", 47/3, Leningradskiy av., Moscow, 125167, Russian Federation.
2Non-profit partnership "International Scientific and Practical Center for the Proliferation of Tissues of Russia", 29/14, Prechistenka str., Moscow, 119034, Russian Federation.
3N.I. Pirogov City Clinical Hospital No. 1, 8, Leninskiy av., Moscow, 119049, Russian Federation.
4Pirogov Russian National Research Medical University, 1, Ostrovityanov str., Moscow, 117997, Russian Federation.
Contact information: Marianna E. Weener, e-mail: info@oftalmic.ru.
Financial Disclosure: Marianna E. Weener and Debmalya Barh are employees of the LLC "Oftalmic". Larisa M. Balashova, Natalia A. Bakunina, and Yulia D. Kuznetsova are employees of the International Scientific and Practical Center for Tissue Proliferation. Other authors declare no conflict of interests.
Received 13.07.2020.








.gif)



