Методы: пациенты с регматогенной отслойкой сетчатки прооперированы по предложенному нами способу с применением биоматериала Аллоплант (основная группа), а в группе контроля проведено пломбирование склеры по общепринятой методике с применением имплантата из губчатого силикона. Сроки наблюдения составили от 6 до 12 мес. в обеих группах.
Результаты: в исследование включен 71 пациент с регматогенной отслойкой сетчатки, 36 из них вошли в основную группу (Аллоплант), а 35 – в группу контроля. Прилегание сетчатки достигнуто у 31 пациента в основной группе и 30 пациентов в контрольной. Послеоперационный период в контрольной группе отличался от такового основной группы более выраженной реакцией тканей в зоне пломбирования и в одном случае осложнился инфицированием и отторжением имплантата. В обеих группах достигнуто существенное повышение остроты зрения. При этом степень послеоперационной аметропии в основной группе постепенно снижалась в связи с уменьшением высоты вала вдавления за счет резорбции биоматериала.
Заключение: предложенный способ хирургического лечения регматогенной отслойки сетчатки с применением биоматериала Аллоплант является эффективным и позволяет достичь существенного улучшения зрительных функций.
Ключевые слова: отслойка сетчатки, пломбирование склеры, биоматериал.
Abstract
The results of scleral buckle with alloplant biomaterial vs. silicone sponge in rhegmatogenous retinal detachment
Moshetova L.K., Galinova A.B., Gareev E.M.
GBOU DPO Russian Medical Academy of postdiploma education, Moscow
FGBU All-Russian Center of Eye and plastic surgery, Ufa
Purpose: to evaluate the results of a scleral buckle with Alloplant biomaterial vs. silicone sponge in rhegmatogenous retinal detachment.
Мethods. Patients with rhegmatogenous retinal detachment were operated on using biomaterial (study group) and using silicone sponge (control group). The follow-up period lasted 6-12 months in both groups.
Results. Overall 71 patients were enrolled, the main group (Alloplant) consisted of 36 patients and the control one – of 35. Retinal adaptation was achieved in 3 of 36 patients in the study group and in 30 of 35 patients in the control group. There was mild tissue reaction and good tolerability of biomaterial. In control group moderate tissue reaction and 1 case of implant infection and rejection was observed. Significant improvement in visual acuity was achieved in both groups. Postoperative ametropy in study group gradually decreased due to buckle height reduction following resorption of the biomaterial.
Conclusion. Scleral buckling with biomaterial is an effective method of surgery in retinal detachment, providing a significant visual improvement.
Key-words: retinal detachment, scleral buckle, biomaterial, silicone sponge.
Введение. Пломбирование склеры является патогенетически обоснованным методом лечения регматогенной отслойки сетчатки. В основе его – блестящая идея E. Custodis: пломба из эластичного материала, с натяжением подшитая к склере в проекции ретинального разрыва, создает вал вдавления, который тампонирует дефект сетчатки, после чего хориоидальная помпа резорбирует субретинальную жидкость, и сетчатая оболочка прилегает. При этом необходимость в тампонирующем эффекте исчезает после формирования вокруг разрыва сетчатки хориоретинальной спайки. В то же время длительное давление пломбы на глазное яблоко может приводить к экструзии или миграции имплантата, дистрофическим изменениям склеры (вплоть до некроза) в зоне пломбирования, нарушению местного кровообращения, повышению внутриглазного давления, изменению рефракции, глазодвигательным нарушениям.
Исследователи все чаще обращаются к возможности применения биологических или синтетических биорезорбируемых материалов для создания временного вала вдавления, который после формирования вокруг разрыва сетчатки хориоретинальной спайки подвергался бы постепенной резорбции. Наше внимание привлекли биоматериалы серии Аллоплант, изготавливаемые в лаборатории консервации тканей ФГБУ «Всероссийский центр глазной и пластической хирургии» Минздрава России. Биоматериалы Аллоплант широко применяются в офтальмологии и пластической хирургии и характеризуются крайне низкой иммуногенностью, исключающей возможность отторжения трансплантата, регенеративными свойствами [6], обеспечивающими профилактику дистрофических изменений склеры в зоне пломбирования, способностью к медленному поэтапному замещению соединительной тканью [3], легкостью моделирования, а также способностью к формированию дозированного по высоте, надежного вала вдавления [4]. Эти свойства позволили разработать способ хирургического лечения регматогенной отслойки сетчатки с применением биоматериала Аллоплант (патент на изобретение «Способ хирургического лечения отслойки сетчатки» № 2463999 от 12 апреля 2011 г.).
Цель: оценка результатов пломбирования склеры биоматериалом Аллоплант и губчатым силиконовым имплантатом при регматогенной отслойке сетчатки.
Материал и методы. Под нашим наблюдением находился 71 пациент с регматогенной отслойкой сетчатки, 36 из них прооперированы предложенным нами способом с применением биоматериала Аллоплант (основная группа), 35 пациентам (группа контроля) проведено пломбирование склеры по общепринятой методике с применением имплантата из губчатого силикона. Сроки наблюдения составили от 6 до 12 мес. в обеих группах. Контрольные осмотры проводили на 7-е сут, через 1, 6 и 12 мес. после операции.
Всем пациентам проводили стандартное офтальмологическое обследование, включавшее сбор анамнеза, визометрию, рефрактометрию, исследование поля зрения, тонометрию, электрофизиологические методы исследования, ультразвуковое В-сканирование, эхобиометрию, биомикроскопию, осмотр глазного дна.
Необходимость сравнительной оценки зрительных функций различного уровня требовала их выражения в рамках единой шкалы. С этой целью нами была использована ранговая шкала оценки зрения [5]. При отсутствии предметного зрения зрительные функции могли быть отнесены к одной из 7 качественных категорий (рангов): 1 – «слепота», 2 – «неправильная светопроекция», 3 – «правильная светопроекция», 4 – «движение рук у лица», 5 – «счет пальцев у лица», 6 – «счет пальцев на расстоянии менее 25 см от лица», 7 – «счет пальцев на расстоянии 25–50 см». Чтение первой строки таблицы Сивцева с дистанции 50 см (условная граница предметного и непредметного зрения) соответствовало 8 рангу. В области предметного зрения ранги нарастали с шагом в 0,01 (при остроте зрения 0,01–0,1) или 0,1 (при остроте зрения выше 0,1), что формировало единую 37-балльную шкалу оценки зрительных функций в интервале от полной слепоты до остроты зрения 2,0.
Основным инструментом статистической обработки данных служил метод двухфакторного дисперсионного анализа по Фишеру [2, 7]. В качестве контролируемых факторов выступали сроки наблюдения и принадлежность к основной и контрольной группам. Оценку значимости различий в показателях внутри групп и между группами проводили с помощью Fd-критерия, t-критерия для независимых выборочных совокупностей и непараметрического критерия Манна – Уитни. Значимыми считали различия при р<0,05 и р<0,001. В силу того, что метод дисперсионного анализа требует наличия строгой (без перерывов) последовательности измерений, нами были использованы данные, ограниченные полугодом после операции. Расчеты производили с помощью пакета прикладных программ Statistica for Windows v.7.0 (StatSoft Inc.).
Результаты и обсуждение. Прилегание сетчатки достигнуто у 31 из 36 пациентов, прооперированных предложенным нами способом, и у 30 из 35 пациентов, прооперированных по традиционной методике. Остальным пациентам выполнена задняя закрытая витрэктомия с тампонадой силиконовым маслом или циркулярное пломбирование склеры, что позволило достичь анатомического эффекта во всех случаях. В одном случае в основной группе задняя закрытая витрэктомия выполнена по поводу гемофтальма. Эти пациенты были исключены из анализа, поскольку силиконовая тампонада витреальной полости и наличие циркляжной ленты формировали специфические рефракционные нарушения. Таким образом, нами проанализированы результаты хирургического лечения 30 пациентов в основной группе и 30 – в контрольной.
Ранний послеоперационный период в основной группе характеризовался слабовыраженной реакцией тканей в зоне пломбирования. На протяжении всего периода наблюдений (до 12 мес.) отмечалась хорошая переносимость биоматериала, отсутствовали случаи инфицирования или отторжения трансплантата. В контрольной группе ранний послеоперационный период отличался более выраженной реакцией тканей в зоне пломбирования и в одном случае осложнился инфицированием и отторжением имплантата. В двух случаях силиконовая пломба была удалена по причине жалоб пациентов на чувство инородного тела и выбухание под конъюнктивой, возникших в сроки 3–10 мес. после операции.
У двух пациентов в основной группе возникли рецидивы отслойки сетчатки. Ранний вызван разблокированием разрыва сетчатки вследствие нарастающей витреоретинальной тракции. Поздний – формированием нового разрыва сетчатки на фоне миопии высокой степени, осложненной периферической витреохориоретинальной дистрофией. Усиление вала вдавления в первом случае и циркулярное пломбирование склеры во втором позволили восстановить анатомическое положение сетчатки. В контрольной группе рецидивы отслойки сетчатки возникли у 4 пациентов. Ранние рецидивы вызваны формированием нового разрыва сетчатки на фоне миопии слабой степени, осложненной периферической витреохориоретинальной дистрофией, и разблокированием разрыва сетчатки вследствие отторжения силиконовой пломбы. Пациентам проведено дополнительное пломбирование склеры, а в случае отторжения силиконового имплантата – удаление пломбы и задняя закрытая витрэктомия, что позволило достичь прилегания сетчатки. Поздний рецидив отслойки сетчатки сопровождался массивной витреоретинальной пролиферацией и потребовал проведения задней закрытой витрэктомии с тампонадой силиконовым маслом.
Функциональный результат операции во многом зависит от сохранности макулярной зоны, длительности существования отслойки макулы и степени миопии [1, 8]. Необходимо отметить, что отслойка центральной зоны сетчатки произошла у 17 пациентов в основной группе и лишь у 12 – в контрольной. Средняя длительность существования отслойки макулы у пациентов в основной группе (12 ± 6,9 сут) была значимо больше, чем в контрольной группе (7,6 ± 4,2 сут) (t = 2,3, p<0,05), что свидетельствовало о более значительном повреждении макулярной зоны у пациентов основной группы. Кроме того, у подавляющего большинства пациентов основной группы (80%) и у половины пациентов контрольной группы (50%) отслойка сетчатки произошла на фоне миопии. При этом частота встречаемости миопии высокой и средней степени в основной группе составила 36 и 27%, а в контрольной группе – 10 и 23% соответственно.
Наряду с сохранностью макулярной зоны и длительностью существования отслойки макулы существенное влияние на функциональный результат операции оказывает исходное состояние зрительных функций. В связи с этим важным этапом нашего исследования стало выявление возможных различий между группами в функциональном состоянии органа зрения до операции.
Средний уровень остроты зрения с коррекцией (ОЗ) в обеих группах значимо не различался, составив 18,25 ± 6,75 балла в основной и 17,75±7,75 балла в контрольной группе (t = 0,16, p>0,87), что соответствует 0,1 по таблице Сивцева. Разброс индивидуальных значений ОЗ в обеих группах был крайне велик: от 4 баллов («движение руки у лица») до 27 баллов (1,0 по таблице Сивцева). При этом доля случаев остаточного и не поддающегося оптической коррекции зрения в основной и контрольной группах оказалась весьма высокой (40 и 43% соответственно). А доля слабого, но полностью (до границ нормы) корригируемого зрения, напротив, крайне мала (13 и 10% соответственно). Дополнительное сравнение показателей с помощью критерия Манна – Уитни подтвердило, что распределение ОЗ в группах практически не различалось (Z = 0,14, p>0,98).
Объективно измеряемый интегральный показатель «сферический эквивалент рефракции» (СЭР), являясь физической величиной (диоптрии, D), без оговорок допускал усреднение и сравнение с помощью параметрического критерия Стьюдента. Средний уровень СЭР в основной группе составил -3,3 D ± 4,5 D, а в контрольной – –1,4 D ± 2,8 D. Двукратная разница в показателях была статистически значимой (t = 2,04, p<0,05). Существенно выше в основной группе оказался и размах межиндивидуальной вариации СЭР: 0D ÷ -18D в сравнении с 0D ÷ -10D в контрольной группе. Более высокая степень случайного разброса (Sd) СЭР в основной группе была подтверждена критерием Фишера: F = 2,59, p<0,02.
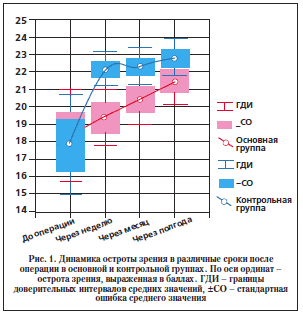
Анализ последовательных изменений зрительных функций показал: уже на 7-е сут после операции средний уровень ОЗ в контрольной группе значимо возрос (p<0,0001), достигнув 22 ± 3 балла (0,5 по таблице Сивцева), и оставался практически на том же уровне до конца срока наблюдений (23 ± 3 балла, или 0,6 по таблице Сивцева) (рис. 1). В основной группе ОЗ медленно, но неуклонно возрастала, достигая к полугоду после операции среднего уровня 21,5 ± 3,5 балла (0,4–0,5 по таблице Сивцева), который значимо превышал исходный (p<0,02). К этому времени разница в показателях между группами стала незначимой (p>0,11). Следует отметить, что к полугоду после операции доля пациентов, зрение которых не поддавалось оптической коррекции, в обеих группах значимо снизилась – с 40–43 до 10% (p<0,01 по критерию tφ). Таким образом, повышение ОЗ в группах происходило за счет увеличения доли пациентов, зрение которых поддавалось оптической коррекции, что отражало процесс функционального восстановления зрительной системы.
Средний уровень СЭР в контрольной группе несколько возрос в ранние сроки после операции (за счет деформации глазного яблока пломбой), составив -1,9D ± 3D (p>0,34), и в дальнейшем практически не изменялся (F = 0,42, p>0,72). Средний уровень СЭР в основной группе был выше, чем в контрольной на протяжении всего периода наблюдений, что, очевидно, связано с высокой частотой встречаемости миопии средней и высокой степени среди пациентов. При этом в раннем послеоперационном периоде средний уровень СЭР в основной группе медленно возрастал, достигая к 1 мес. после операции максимального значения (-5,9D ± 4,4D), которое значимо превышало исходное (p<0,03), а в дальнейшем несколько снижался, приближаясь к исходному уровню к 12 мес. после операции. При этом высота вала вдавления постепенно уменьшалась с 5,53 ± 0,77 мм на 7-е сут после операции до 3,86 ± 1,08 мм к полугоду после операции (p<0,0001) и 3,63 ± 1,19 мм к концу периода наблюдения (p<0,001).
Таким образом, в контрольной группе ОЗ значимо повышалась уже на 7-е сут после операции и оставалась практически на том же уровне до конца срока наблюдения. Подобный характер изменения ОЗ, очевидно, обусловлен быстрым восстановлением функциональной способности сетчатки после ее непродолжительной отслойки. Следует принять во внимание тот факт, что изменения зрительных функций у пациентов контрольной группы происходили на фоне минимального нарушения рефракции, при этом степень аметропии несколько увеличивалась в раннем послеоперационном периоде (в связи с деформацией глазного яблока пломбой). В основной группе ОЗ медленно, но неуклонно возрастала (за счет медленного восстановления зрительных функций после длительной отслойки макулы), приближаясь к полугоду после операции к показателям в контрольной группе. Высокая частота встречаемости миопии средней и высокой степени среди пациентов группы обусловливала большую, чем в контрольной группе, степень нарушения рефракции. При этом степень аметропии в основной группе повышалась в раннем послеоперационном периоде (вследствие деформации глазного яблока пломбой) и постепенно возвращалась к исходному уровню (в связи с уменьшением высоты вала вдавления за счет резорбции биоматериала).
Заключение. Предложенный способ хирургического лечения регматогенной отслойки сетчатки с применением биоматериала Аллоплант является эффективным и позволяет достичь существенного повышения зрительных функций, сопоставимого с функциональным результатом операции по общепринятой методике, даже при более значительном повреждении центральной зоны сетчатки у пациентов основной группы. Более того, простота исполнения, благоприятное течение раннего послеоперационного периода и отсутствие осложнений, характерных для большинства эписклеральных вмешательств, являются безусловными преимуществами предложенного метода и обусловливают предпочтительность его применения при регматогенной отслойке сетчатки.
Литература
1. Байбородов Я.В., Джусоев Т.М. Прогнозирование функциональных исходов хирургического лечения отслойки сетчатки // Офтальмохирургия и терапия. 2002. № 2. С. 54–60.
2. Бенерджи А. Медицинская статистика понятным языком. М.: Практическая медицина, 2007. 287 с.
3. Галимова А.Б., Мусина Л.А., Родионов О.В. Биосовместимость материалов для эписклерального пломбирования (экспериментально-морфологическое исследование) // Офтальмологические ведомости. 2012. Т. 4. С. 22–25.
4. Галимова А.Б., Первушин Ю.С. Оценка способности материалов к формированию надежного вала вдавления на основании их механических свойств // Вестник Оренбургского государственного университета. 2012. № 12 (148). С. 32–36.
5. Гареев Е.М., Юсупов Р.Г. Реакции зрительной системы слабовидящих на длительное лечение. Ч. I. Скрытая структура группы и динамика ее трансформаций. Сенсорные системы. 1999. Т. 13. № 3. С. 195–200.
6. Мулдашев Э.Р., Булатов Р.Т., Салихов А.Ю. и др. Аллоплант – новое поколение пересадочных материалов для глазной и пластической хирургии // Здравоохранение Башкортостана. 1993. № 1. С. 1–5.
7. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ Statistica. М.: МедиаСфера, 2002. 312 с.
8. Abouzeid H., Wolfensberger T. Macular recovery after retinal detachment // Acta Opgthalmologica Scandinavica. 2006. Vol. 84. P. 597–605.












