Частота нарушений нутритивного
статуса у детей со злокачественными новообразованиями
Частота НН у детей со злокачественными новообразованиями различна. Имеющиеся в доступной литературе данные существенно варьируют в зависимости от применяемых способов оценки, нозологической и возрастной структуры обследованных групп больных и применяемых способов лечения. Имеются данные, что недостаточность питания наблюдается менее чем у 10% детей с острым лимфобластным лейкозом (ОЛЛ) [3], но у детей с солидными опухолями частота НН намного выше и может достигать 50% в зависимости от вида опухоли и стадии заболевания [4]. Некоторые исследователи утверждают, что недостаточность питания не является заметной проблемой у детей со впервые диагностированным ОЛЛ [5]; другие сообщают о трехкратном увеличении частоты НН у этих пациентов по сравнению со здоровыми сверстниками [3]. Особенно разноречивы результаты исследований нутритивного статуса детей с онкозаболеваниями в динамике программной полихимиотерапии (ПХТ). Достоверное снижение массы тела установлено у больных с ОЛЛ в первый год после начала терапии, особенно у пациентов высокого риска, проходящих агрессивную химиотерапию [6]. Тем не менее на втором году лечения наблюдается диспропорциональное нарастание веса по сравнению с ростом, что предрасполагает к ожирению [7–9]. Этот риск связан с возрастающими пищевыми потребностями пациентов, получающих стероиды [7], недостаточностью гормона роста вследствие краниального облучения [8] и/или уменьшением энерготрат из–за ограниченной физической активности [9].
У большинства детей с солидными опухолями, в отличие от ОЛЛ, НН является существенной проблемой уже при постановке диагноза. Это очевидно у 20–50% пациентов в зависимости от типа опухоли и стадии заболевания [10–12]. Однако возможна недооценка НН у детей с солидными опухолями, если используются только результаты взвешивания в соотношении с другими антропометрическими показателями [13]. Кроме того, у части детей со злокачественными новообразованиями костей и мягких тканей при оценке нутритивного статуса необходимо учитывать значительный объем выполненной ампутации. Хотя, по оценкам ведущих исследователей, распространенность недостаточности питания у детей в дебюте онкологического заболевания заметно различается, большинство авторов сходится во мнении, что современная химиотерапия в ее длительной динамике негативно влияет на нутритивный статус пациентов. Чаще всего это наблюдается из–за серьезных поражений желудочно–кишечного тракта [1,2,14,15]
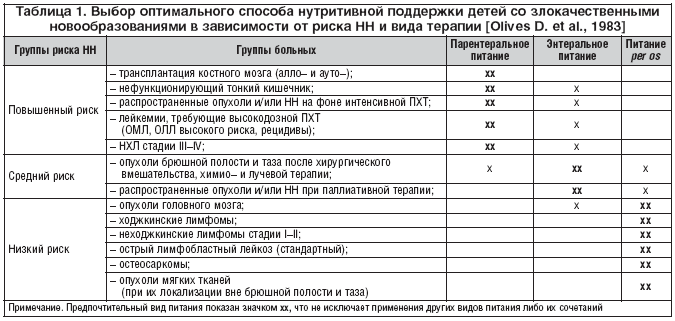
В одной из самых ранних публикаций по проблеме НН у детей со злокачественными новообразованиями [16] частота НН оценивалась с учетом ее тяжести и в контексте групп нутритивного риска. Авторы одними из первых ввели критерии стратификации больных на три группы нутритивного риска и оценили частоту НН в каждой из них. Первая группа (явная НН) была выделена с помощью центильных таблиц по следующим критериям: масса/ рост/возраст/пол ≤80% от 50 центиля, или потеря массы ≥10% за последний месяц, и/или уровень сывороточного альбумина ≤30 г/л. К моменту установления диагноза в эту группу относили около 10% всех поступающих больных. Вторая группа (начальные проявления НН и больные с риском тяжелой НН в ближайшее время) выделялась по критериям: масса/рост между 81 и 90% от 50–го перцентиля, или недавняя потеря 5–10% массы тела, и/или уровень сывороточного альбумина 32–35 г/л.
Однако даже при отсутствии у больного этих объективных критериев авторы рекомендовали учитывать менее значимые факторы риска: возраст менее 2 лет, снижение аппетита, текущие и анамнестические расстройства пищеварения, инфекционные осложнения, недавние операции на органах брюшной полости, применение лучевой терапии, особенно в абдоминальной области, высокодозная ПХТ. К моменту установления диагноза в эту группу было отнесено до 40% первичных больных. Пациенты третьей группы (хороший нутритивный статус и отсутствие существенного нутритивного риска) в дебюте онкозаболевания составили до 50% больных. Таким образом, было предложено обоснование для риск–адаптированного текущего мониторинга НН у больных на фоне программной химиотерапии и стратифицированного подхода к нутритивной поддержке (табл. 1).
Этиопатогенетические аспекты НН
Метаболические механизмы НН полиэтиологичны и включают: повышение уровня основного обмена [17]; повышение интенсивности белкового метаболизма [18]; мобилизацию жира и липолиз со снижением запасов жира [19]; нарушения обмена углеводов в результате энергозатратных метаболических процессов [20]. Помимо этого, фактор некроза опухоли (TNF) и кахектин могут подавлять активность различных липогенетических энзимов [19], а интерлейкин–1 и интерлейкин–6 – негативно влиять на белковый обмен путем повышения катаболизма и снижения синтеза белка, результатом чего является кахексия [20].
Гастроинтестинальные нарушения – один из важнейших механизмов развития НН на фоне интенсивной ПХТ, и в особенности в динамике различных режимов трансплантации костного мозга (ТКМ). Так, из 47 детей, проходящих режим кондиционирования, диарея, рвота и лихорадка были отмечены у 57, 40 и 57% пациентов соответственно, что снижало нутритивный статус больных и ухудшало результаты ТКМ [21].
Диарея, тошнота и рвота – общеизвестные побочные эффекты интенсивной ПХТ, формирующие НН наряду с нарушениями вкуса, отвращением к пище, снижением ее потребления вплоть до анорексии. Последнее нередко обусловлено мукозитом полости рта и пищевода, болью и дисфагией [2]. Цитотоксические агенты, облучение и иммунодепрессия как важнейшие причины поражения желудочно–кишечного тракта могут рассматриваться в качестве основных факторов риска развития НН. Кроме того, некоторые компоненты сопроводительной терапии (иммуносупрессивные агенты, антибиотики) также могут обусловить нежелательный дисбаланс нормальной микрофлоры кишечника, избыточный рост патогенных микроорганизмов или нозокомиальные кишечные инфекции.
Широко распространенным осложнением ПХТ является гипоальбуминемия, происхождение которой полиэтиологично. В ранних работах по изучению метаболических основ НН в динамике ПХТ у больных описаны сниженный белковый синтез [22] и возрастающие потери белка с калом [16], обусловленные протеин–теряющей энтеропатией [23]. В литературе имеются многочисленные утверждения о том, что сывороточный преальбумин является более достоверным показателем белково–калорийной недостаточности на фоне инфекции или лихорадки, чем альбумин. Изменения уровня сывороточного альбумина или трансферрина в этом контексте рассматривались как не отражающие истинные запасы белка у детей [24].
Дефицит микроэлементов, витаминов и минералов также является одним из этиопатогенетических звеньев НН у онкологических пациентов. Достоверное снижение уровней витамина А и ретинол–связывающего белка описано у детей в дебюте злокачественных новообразований по сравнению со здоровыми детьми [25]. Кроме того, описаны нарушения обмена витамина Д и магния у детей с ОЛЛ [26], дефицит цинка и селена [27] у детей с различными злокачественными новообразованиями как в дебюте, так и в динамике ПХТ.
Клинико–экономические
последствия недостаточности питания
У детей с онкологическими заболеваниями нутритивная недостаточность негативно влияет на некоторые клинические исходы (табл. 2). Точное происхождение этой взаимосвязи подробно не изучено [28]. Однако известно, что поддержание адекватного питания на фоне химиотерапии повышает ее толерантность и снижает подверженность инфекциям [29]. Кроме того, описаны взаимосвязи между уровнем недостаточности питания и частотой рецидивов у детей с ОЛЛ [30]. Достоверно меньшая продолжительность ремиссии описана у детей с недостаточностью питания, получающих лечение по поводу ОЛЛ [31] и нейробластомы [32]. Считается доказанным, что стабильные показатели нутритивного статуса прямо коррелируют с более короткими госпитализациями, снижением количества осложнений, более низкой стоимостью лечения и снижением риска летального исхода [33].
У детей после ТКМ скорость восстановления гемопоэза также положительно коррелирует с показателями их нутритивного статуса к моменту установления диагноза [34]. Кроме того, показано, что у детей в процессе ТКМ низкие показатели нутритивного статуса ассоциированы с большей частотой эпизодов лихорадки и рвоты и более длительной госпитализацией [35].
Влияние НН на выживаемость является дискуссионным. Некоторые исследователи сообщили о снижении выживаемости у пациентов со злокачественными новообразованиями и НН [36,37]. Другие же работы не обнаружили подобной взаимосвязи [38,39]. Среди детей с ОЛЛ было установлено, что лишь 26% пациентов с НН достигли 5–летней общей выживаемости по сравнению с 59% пациентов без нарушений нутритивного статуса [36]. Другие исследования выявили, что риск летального исхода возрастает параллельно с тяжестью недостаточности питания [37]. Бесспорно, что раннее выявление пациентов группы риска по развитию НН и их нутритивная поддержка оказывают положительный эффект в отношении ряда клинических исходов [40].
В некоторых зарубежных публикациях изучены экономические аспекты недостаточности питания у детей с онкологическими заболеваниями. Установлено, что лечение пациента с недостаточностью питания и наличием тяжелого клинического осложнения стоит в 4 раза дороже, чем пациента с неосложненным течением [41]. В другом исследовании сообщается, что недостаточность питания ассоциирована более чем с двухкратным увеличением больничных расходов из–за более длительной госпитализации [42]. Таким образом, большинством исследователей признается как неоспоримый факт, что ранняя диагностика и терапия НН имеют большое значение в онкопедиатрической практике и должны быть включены в протоколы сопроводительного лечения.
Оценка нутритивного статуса
В исследованиях нутритивного статуса детей со злокачественными новообразованиями используются многочисленные антропометрические показатели, отражающие изменения составляющих тела (body composition). Однако некоторые из этих показателей должны интерпретироваться с осторожностью. Например, применение весо–ростовых показателей может ограничиваться гипергидратацией на фоне инфузионной терапии или дегидратацией, обусловленной диареей и/или рвотой. Аналогичным образом у детей с солидными опухолями опухолевая масса может маскировать истинный дефицит массы тела и наличие НН. В этом контексте окружность средней трети плеча (mid arm circumference) более пригодна для оценки нутритивного статуса, чем весо–ростовые показатели [43]. Кроме того, резерв мышечных белков может быть оценен сонографическим измерением толщины квадрицепса [44]. Следует признать, что в публикациях по оценке нутритивного статуса детей со злокачественными опухолями используется неоправданное разнообразие антропометрических и биохимических параметров НН и отсутствует стандартизованный подход к их оценке и клинической трактовке.
Нутритивная поддержка
Основные цели нутритивного вмешательства (nutritional intervention) у детей со злокачественными новообразованиями – это коррекция истощения и поддержание достаточного нутритивного статуса на фоне терапии. Показания к проведению нутритивной поддержки изложены в таблице 3 [45].
Общеизвестно, что энтеральное питание (ЭП) физиологичнее, дешевле и проще в обеспечении, чем парентеральное питание (ПП). Кроме того, проведение ЭП имеет финансовые преимущества в виде сокращения длительности госпитализации и снижения частоты осложнений. У детей со злокачественными новообразованиями такой вариант нутритивной поддержки, как питание через назогастральный зонд, энтеральное зондовое питание, NTF (nasogastric tube feeding), было описано как хорошо переносимое и положительно влияющее на нутритивный статус [51].
Более поздние исследования подтвердили эффективность питания через гастростому в купировании недостаточности питания и поддержании нутритивного статуса у детей со злокачественными новообразованиями [52]. Описанные осложнения были немногочисленными, в основном проблемы касались воспалительных изменений вокруг гастростомического отверстия в период тяжелой нейтропении, что требовало местного или системного применения антибиотиков.
Имеется ряд публикаций, оценивающих значение супплементации ЭП специфическими субстратами у пациентов, получающих ПХТ. Особое значение при этом уделяется глутамину. Этот важный метаболический субстрат для быстро пролиферирующих клеток (в частности, энтероцитов) обладает множественными механизмами влияния на белковый обмен, иммунную систему и функцию тонкого кишечника у онкобольных [53]. Кроме того, обнаружено достоверное снижение тяжести химиотерапевтического мукозита у взрослых и детей, получающих глутамин перорально. Предполагается, что данный эффект связан либо с его цитопротективным и антиоксидантным действием, либо с использованием этой аминокислоты эпителиоцитами в качестве источника энергии [54]. Несмотря на многочисленные установленные преимущества перорального применения глутамина у онкологических больных, его применение у детей со злокачественными новообразованиями остается эпизодичным [55].
Психологические аспекты НН
Онкологическое заболевание и его терапия существенно нарушают пищевое поведение и приводят к многочисленным нутритивным проблемам более чем у 47% детей [46,47]. Для большинства родителей обеспечение адекватного питания становится одним из немногих путей непосредственного участия в лечении их ребенка [48]. Когда пищевой паттерн ребенка и его аппетит на фоне ПХТ резко изменяются, родители могут невротически сфокусироваться на процессе питания и использовать стратегии принуждения ребенка к еде. Такое поведение взрослых может вызвать детское сопротивление к приему пищи и даже снизить ее потребление. C другой стороны, некоторые родители совсем не ограничивают пищевые пристрастия ребенка на фоне ПХТ, рассчитывая улучшить его аппетит, и повышают риск ожирения. Психологическими исследованиями установлено, что родители рассматривают питание как очень важный элемент для выживания их ребенка во время химиотерапии [49], но боятся ответственности за качество питания, особенно если больной упорно отказывается от еды из–за основного заболевания и/или побочных эффектов терапии. Однако в исследовании родительского восприятия нутритивных проблем ребенка на фоне ПХТ [50] c использованием опросника AYCE–R вопреки первоначальной исследовательской гипотезе было установлено, что влияние онкозаболевания на характер внутрисемейного взаимодействия в процессе принятия пищи оказалось минимальным по сравнению с контрольной группой здоровых детей. Не исключено, что данные результаты, полученные для семей пациентов со средним сроком длительности проведения ПХТ 1,72 года и средним возрастом 12,1 года, не могут быть экстраполированы на другие возрастные и клинические группы. Однако безусловно, что поиск оптимальных способов оказания нутритивной поддержки и достижения достаточного пищевого комплайенса пациентов сопровождается значительным увеличением числа публикаций по психологическим аспектам нутритивной поддержки.
Мультидисциплинарные команды
нутритивной поддержки
В зарубежной литературе преобладает мнение о том, что для обеспечения безопасной и эффективной нутритивной поддержки онкологических больных необходим мультидисциплинарный командный подход. Роль команд нутритивной поддержки заключается в идентификации пациентов «групп риска» по НН, оценке нутритивного статуса, обеспечении специализированной нутритивной поддержки, ведении клинического и биохимического follow–up пациентов, обучении медперсонала и семей пациентов, а также в проведении научных исследований. Такие команды должны включать клинициста, специально подготовленного по диетологии, специалиста в области сестринского дела, биохимика и диетолога. Было показано, что командный подход достоверно улучшает качество нутритивной поддержки и снижает расходы, связанные с госпитализацией [56]. Опубликованные преимущества работы команд нутритивной поддержки включают снижение частоты катетер–ассоциированного сепсиса и механических катетер–ассоциированных повреждений, снижение частоты метаболических нарушений, связанных с парентеральным питанием, и более частое использование ЭП по сравнению с ПП [57].
Заключение
Недостаточность питания является распространенным, но часто недооцениваемым осложнением у детей со злокачественными новообразованиями. Развитие НН полиэтиологично и обусловлено первичными метаболическими проявлениями основного заболевания и/или побочными эффектами проводимой терапии. Ухудшение показателей нутритивного статуса неблагоприятно влияет на исход основного онкологического заболевания. Поэтому раннее выявление пациентов из группы риска по НН имеет большое клиническое значение, а нутритивная реабилитация и поддержка должна быть включена в протоколы лечения как обязательный компонент сопроводительной терапии (табл. 4). Для ее успешного проведения принципиально важна организация мультидисциплинарных команд (бригад) нутритивной поддержки.



Литература
1. Майорова О.А., Румянцев А.Г. Особенности желудочно–кишечного тракта у пациентов с онкологическими заболеваниями и при проведении цитостатической терапии (клинико–морфологические и функциональные изменения) // Российский педиатрический журнал. – 2001. – №6. – C. 44–48.
2. Румянцев А.Г., Масчан А.А., Самочатова Е.В. Сопроводительная терапия и контроль инфекций при гематологических и онкологических заболеваниях. Руководство для врачей. – М.: Медпрактика–М, 2006. – 504 c.
3. Reilly J.J., Weir J., Mc Coll J.H., Gibson B.E. Prevalence of protein–energy malnutrition at diagnosis in children with acute lymphoblastic leukaemia // J. Pediatr.Gastroenterol. Nutr., 1999, vol. 29, P.193–197.
4. Carter P., Carr D., van Eys J., Goody D. Nutritional parameters in children with cancer // J. Am. Diet. Assoc., 1983, vol.82, P. 616–622.
5. Uderzo C., Rovelli A., Bonomi M. et al. Nutritional status in untreated children with acute lymphoblastic leukaemia as compared with children without malignancy // J. Pediatr. Gastroenterol. Nutr., 1996, vol. 23, P. 34–37.
6. Halton J.M., Atkinson S.A., Barr R.D. Growth and body composition in response to chemotherapy in children with acute lymphoblastic leukaemia // Int. J. Cancer Suppl., 1998, vol. 11, P. 81–84.
7. Reilly J.J., Brougham M., Montgomery C. et al. Effect of glucocorticoid therapy on energy intake in children treated for acute lymphoblastic leukaemia // J. Clin. Endocrinol. Metab., 2001, vol. 86, P. 3742–3745.
8. Sklar C.A., Mertens A.G., Walter A. et al. Changes in body mass index and prevalence of over weight in survivors of childhood acute lymphoblastic leukaemia: role of cranial irradiation // Med. Pediatr.Oncol., 2000, vol. 35, P. 91–95.
9. Mayer E.L., Reuter M., Dopfer R.E. et al. Energy expenditure, energy intake and prevalence of obesity after therapy for acute lymphoblastic luekemia during childhood // Hormone Res 2000; vol. 53, P. 193–194.
10. Oguz A., Karadeniz C., Pelit M., Hasanoglu A. Arm anthropometry in evaluation of malnutrition in children with cancer // Pediatr Hematol Oncol, 1999; vol. 16, P. 35–41.
11. Wessels G., Hesseling P.B., van Ommeren K.H., Boonstra V. Nutrition, morbidity and survival in South African children with Wilm’s tumor // Pediatr Oncol Hematol, 1999; vol. 16, P. 321–327.
12. Lahorra J.M., Gin–Pease M.E., King D.R. The prognostic significance of basic anthropometric data in children with advanced solid tumors // Nutr Cancer 1989; vol.12, P.361–369.
13. Smith D.E., Stevens M.C., Booth I.W. Malnutrition at diagnosis of malignancy in childhood: common but mostly missed // Eur J Pediatr, 1991; vol.150, P. 318–322.
14. Bernstein I.L., Webster M.N., Bernstein I.D. Food aversions in children receiving chemotherapy for cancer // Cancer, 1982; vol. 50, P. 2961–2963.
15. Papadopoulou A., Nathavitharana K.A., Williams M.D. et al. Diarrhoea and weight loss following bone marrow transplantation in children // Pediatr Haematol Oncol 1994; vol. 11, P.601–611.
16. Olive D., Morali A., Benz–Lemoine E. et al. Les troubles nutritionnels et digestifs en oncologie pediatrique // Arch. Fr. Pediatr. 1983, vol.40, P.421–428.
17. Den Broeder E., Oeseburg B., Lippens R.J. et al. Basal metabolic rate in children with a solid tumor // Eur J Clin Nutr; 2001, vol. 55, P. 673–81.
18. Attatd–Montalto S.P., Camacho–Hubner C., Cotterill A.M. et al. Changes in protein turnover, IgF–1 and IgF binding proteins in children with cancer // Acta Paediatr; 1998, vol.87, P.54–60.
19. McAndrew P.F. Fat metabolism and cancer // Surg Clin North Am; 1989, vol.66, P.1003–1012.
20. Picton S.V. Aspects of altered metabolism in children with cancer // Int J Cancer Suppl; 1998, vol. 11, P. 62–64.
21. Papadopoulou A., Lloyd D.R., Williams M.D. et al. Gastrointestinal and nutritional sequale of bone marrow transplantation // Arch Dis Child; 1996, vol. 75, P. 208–213.
22. Hermann V.M., Sarnick M.B., Moore F.D. et al. Effect of cytotoxic agents on protein kinetics in patients with metastatic cancer // Surgery; 1981, vol. 90, P. 381–387.
23. Weisdorf S.A., Salati J.A., Longsdorf N.K.C., Sharp H.L. Graft–versus–host disease of the intestine: a protein losing enteropathy characterized by faecal alfa–1–antitrypsin // Gastroenterology; 1983, vol. 85, P. 1076–1081.
24. Brennan B.M.D. Sensitive measures of nutritional status in children with cancer in hospital and in the field // Int J Cancer; 1998, Suppl. 11, P.10–13.
25. Fiore P., Castagnola E., Marchese N. et al. Retinol (vitamin A) and retinal–binding protein serum levels in children with cancer at onset // Nutrition; 1997, vol.13, P. 17–20.
26. Atkinson S.A., Halton J.M., Bradley C. et al. Bone and mineral abnormalities in childhood acute lymphoblastic leukaemia: influence of disease, drugs and nutrition // Int J Cancer Suppl; 1998, vol. 11, P. 35–39.
27. Papadopoulou A., Nathavitharana K.A., Williams M.D. et al. Diagnosis and clinical associations of zinc deficiency following bone marrow transplantation // Arch Dis Child; 1996, vol. 74, P. 328–331.
28. Taj M.M., Pearson A.D., Mumford D.B., Price L. Effect of nutritional status on the incidence of infection in childhood cancer // Pediatr Haematol Oncol; 1993, vol. 10, P. 283–287.
29. Schiavetti A., Fornari C. Bonci E. et al. Nutritional status in childhood malignancies // Nutr Cancer, 2002, vol. 44, P. 153–155.
30. Viana M.B., Murao M., Ramos G. et al. Malnutrition as a prognostic factor in lymphoblastic leukaemia: a multivariate analysis /












