НПВП–энтеропатия – патология тонкой кишки, возникающая в связи с приемом НПВП и характеризующаяся нарушением проницаемости кишечной стенки с экссудацией белка и диапедезом эритроцитов, приводящих к железодефицитной анемии и гипоальбуминемии, а также к повреждению СО с развитием эрозий, язв и их осложнениями – кровотечением и перфорацией, появлением циркулярных стриктур и нарушением проходимости кишечника [2,5,9]. По данным энтероскопии и капсульной эндоскопии у больных, длительно принимающих НПВП, видимое повреждение слизистой тонкой кишки отмечается более чем в 40% случаев, косвенные признаки воспаления – в 40–70% случаев [5,9]. Более того, есть данные, свидетельствующие о том, что НПВП-энтеропатия не только сопоставима по распространенности с НПВП-ассоциированной патологией верхних отделов ЖКТ, но даже превосходит ее [1,2,9,16]. Так, в исследовании Maiden L. et al. (2005) с использованием капсульной эндоскопии и определением калпротектина поражение тонкой кишки было выявлено у 75% здоровых добровольцев, принимавших в течение 2 недель стандартную дозу ретардной формы диклофенака [9]. Следует подчеркнуть, что энтеропатия при этом развилась на фоне параллельного приема стандартных доз ингибитора протонной помпы омепразола.
В соответствии с недавно полученными данными, преимущественно на экспериментальных моделях, НПВП-индуцированная энтеропатия представляется этапным процессом, включающим прямое поражение СО (прием кишечнорастворимых форм препаратов), повреждение митохондрий, нарушения межклеточных контактов энтероцитов с последующей транслокацией бактериальной флоры и компонентов бактерий в кишечную стенку с развитием хронического воспаления [3,7,10,12]. Негативное влияние НПВП на энтероциты определяется снижением синтеза ПГЕ2 и простациклина, блокадой ферментных систем митохондрий, нарушением микроциркуляции вследствие блокады NO–синтетазы и др. [1,10,12,16]. Риск развития патологии тонкой кишки увеличивается при наличии дивертикулов кишечника, а также хронических воспалительных заболеваний кишечника (таких как язвенный колит и болезнь Крона).
Вопросы профилактики и лечения НПВП-энтероколопатии, с позиций доказательной медицины, не разработаны. Кроме того, не верифицированы факторы риска развития этой патологии. Несомненно, лучшим способом лечения является полная отмена НПВП, однако это не всегда возможно. Установлено, что используемые для профилактики и в лечении НПВП-гастропатий ингибиторы протонной помпы и мизопростол в данном случае оказались малоэффективными [4,11,14,15]. Для лечения НПВП-энтероколопатий предлагаются сульфасалазин, метронидазол [3,10,14,15], рифаксимин [14]. Достаточно эффективным, хотя и не предотвращающим повреждение кишечника полностью, оказалось применение коксибов [11,12].
На сегодня имеются неоспоримые доказательства, что питание влияет на функции многих органов и систем, неспецифическую защиту и иммунитет, процессы регенерации и репарации. Оно прямо и непосредственно влияет на характер течения патологического процесса. Следовательно, лечебное питание является, по сути, самостоятельно и эффективно воздействующим лечебным фактором. При этом следует подчеркнуть, что в настоящее время речь идет о нозологически ориентированной терапии питанием (нутриционная терапия). В частности, в аспекте рассматриваемой патологии, о введении в протокол терапии больного НПВП-энтеропатией энтерального искусственного питания с использованием питательных смесей «Модулен IBD» и «Пептамен». Выбор конкретных питательных смесей обусловлен характеристиками препаратов клинического питания (ПКП).
Так, «Модулен IBD» (М) – специфическая полимерная смесь для перорального применения, предназначенная для лечебного питания при воспалительных заболеваниях кишечника (ВЗК). Белковый компонент продукта (3,6 г/100 мл) представлен казеинами, обработанными таким образом, чтобы сохранить специфические факторы роста (TGF b2), которые содержатся в молоке, но разрушаются при обычных способах его обработки. Высокое качество белка позволяет добиться высокой степени ретенции азота, регулирует воспалительный ответ организма и способствует более быстрому достижению ремиссии активной фазы ВЗК.
Источником жирового компонента продукта являются молочный жир, среднецепочечные триглицериды (МСТ), кукурузное масло и соевый лецитин. МСТ представляют 26% общих липидов смеси. Общее количество липидов смеси – 4,7 г/100 ккал. Общее количество углеводов смеси – 11 г/100 мл. Энергетическая плотность смеси составляет 1,0 ккал/мл. Осмолярность – 312 мосм/л. Продукт содержит адекватное количество витаминов, минеральных веществ. Принципиальной особенностью выбранного ПКП является то, что М содержит естественные противовоспалительные факторы роста (TGF b2), обладающие цитопротективным эффектом.
«Пептамен» (П) – сбалансированная питательная смесь для энтерального зондового и перорального питания. При стандартном разведении 16% энергии обеспечивается белками, 33% – жирами, 51% – углеводами. Белковый компонент представлен пептидами, полученными при гидролизе сывороточного белка, которые быстро всасываются в ЖКТ и являются оптимальным источником азота. Следует отметить, что у больных с нарушенной функцией ЖКТ пептиды более благоприятны по сравнению с цельным белком и свободными аминокислотами. Жировой компонент смеси представлен 70% МСТ, углеводный (для поддержания невысокой осмолярности продукта) – мальтодекстрином. Эссенциальные жирные кислоты обеспечивают 5% общей энергетической плотности смеси (соотношение омега-6 к омега-3 равно 7). Вышеуказанные не содержат лактозу и глютен.
Данные по патогенезу НПВП-энтеропатий немногочисленны и противоречивы, а ПКП в лечении НПВП-энтеропатий ранее не использовались. Для обоснования включения в протокол ведения ПКП было проведено настоящее пилотное исследование.
Цель исследования: изучить клиническую эффективность лечебного комплекса, включающего НПВП и ПКП (П и М), в комбинированной терапии больных с остеоартрозами (ОА), осложненными НПВП-энтеропатиями. Нулевая гипотеза: поэтапное, последовательное включение в лечебный комплекс больных с ОА, осложненными НПВП-энтеропатиями, П и М в суточной дозе 500 ккал, в виде энтерального приема в межпищеварительном периоде, при 4–недельной курсовой терапии будет сопровождаться быстрым купированием клинических проявлений НПВП-энтеропатий, качественным восстановлением СО ДПК, модификацией нутритивного статуса.
Дизайн исследования. На первом этапе: комплексное обследование 56 больных с ОА, получающих НПВП в течение 12 и более недель. У 24 (42,8%) больных (19 женщин и 5 мужчин, средний возраст составил 53,8±9,7 года) выявлена эрозивная НПВП-энтеропатия и нутритивная недостаточность (НН) легкой и средней степени тяжести. Второй этап – сравнительное продольное параллельное рандомизированное исследование двух групп больных с ОА и НПВП-энтеропатиями (1 и 2) с оценкой клинической эффективности 4–недельной курсовой терапии: НПВП и НПВП + ПКП. Больные группы 1 (n=12) получали диклофенак (100 мг утром) в течение 4 недель, больные группы 2 (n=12) – диклофенак (100 мг утром) в течение 4 недель и ПКП. ПКП принимались в изоосмолярном разведении в межпищеварительный период по схеме: П в суточной дозе 500 ккал – 20 дней, далее М в суточной дозе 500 ккал., в течение последующих 10 дней. В ходе исследования при необходимости пациенты могли принимать парацетамол (количество принятого парацетамола документировалось в индивидуальной регистрационной карте пациента). При развитии у больных диспепсии до момента проведения контрольного эндоскопического исследования допускался прием антацидов в режиме «по требованию». В качестве терапии сопровождения разрешался прием хондропротекторов.
Критерии включения в исследование: больные с ОА, принимающие НПВП не менее 12 недель с клинико-эндоскопическими признаками НПВП-энтеропатии и НН.
Критерии исключения:
1. Непереносимость препаратов клинического питания.
2. Подозрение на объемный процесс в гастродуоденальной зоне.
3. Язвенная болезнь желудка и/или 12–перстной кишки с формированием стеноза.
4. Клинические маркеры желудочно–кишечного кровотечения.
Наряду с общепринятыми клинико-лабораторными тестами обследуемым больным проводились специальные методы исследования. Степень НН оценивалась на 1 этапе с использованием мини-шкал и опросников (MUST, NRS 2002), на 2 этапе дополнялась антропометрическими, лабораторными (общий белок (г/л), альбумин (г/л), абсолютное число лимфоцитов (тыс. в мкл)) показателями. Эффективность проводимой терапии оценивалась полуколичественно с использованием визуально-аналоговых шкал и опросников (ВАШ боли, SODA, шкала общего клинического впечатления), среднего дня купирования клинических проявлений заболевания, макроскопических маркеров НПВП-энтеропатии по данным видеодуоденоскопии (активность дуоденита, число и размер язв и эрозий) и морфологическим параметрам при исследовании дуоденобиоптатов (активность воспаления, дистрофии, атрофии).
Результаты исследования. Из 24 больных, включенных в исследование, 23 больных полностью выполнили протокол 4–недельной терапии, 1 пациент 1 группы выбыл из исследования в связи с неявкой на контрольное эндоскопическое исследование.
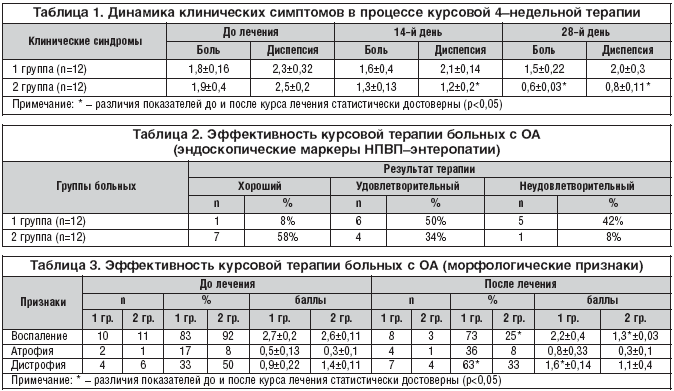
До лечения у всех больных с ОА имели место умеренный болевой и диспептический синдромы, степень выраженности которых суммарно составила 1,9±0,3 и 2,4±0,22 балла соответственно. В процессе курсовой терапии в исследовательской группе 2 регистрировалось более значимое снижение клинических проявлений НПВП-энтеропатии (табл. 1).
К концу второй недели лечения интенсивность абдоминальной боли во второй группе больных снизилась у 7 (58,3%) больных, в среднем на 35%, и составила по группе 1,3±0,13 балла. В группе контроля у подавляющего количества больных сохранялся умеренной интенсивности болевой синдром 1,7±0,4 балла. Более существенные различия в динамике болевого синдрома констатированы к 4–й неделе лечения. В основной исследовательской группе интенсивность абдоминальной боли уменьшилась в 3 раза и составила по группе 0,6±0,03 балла (p<0,05). Аналогичные изменения были зарегистрированы при оценке динамики регресса диспептического синдрома. Симптомы диспепсии к 14–му дню лечения в основной группе купировалась у 5 (42%) больных, интенсивность составила 1,2±0,2 балла. К моменту завершения лечения клинически значимые симптомы диспепсии регистрировались лишь у 3 (25%) больных, а выраженность их в целом уменьшилась более чем в 4 раза и составила по группе 0,8±0,11 балла (p<0,05).
При динамической видеодуоденоскопии эффективность курсовой терапии оценивалась по эндоскопическим маркерам НПВП-энтеропатии. В качестве основных критериев хорошего результата проводимой терапии были приняты: полная эпителизация эрозий, уменьшение интенсивности отека и гиперемии СО ДПК. Результаты, представленные в таблице 2, свидетельствуют о высоком энтеропротективном эффекте 4–недельного приема ПКП. Так, к 4–й неделе наблюдения хороший и удовлетворительный результат лечения на основании видеоэндоскопической оценки изменений СО ДПК в основной группе наблюдения зарегистрирован в 7 (58%) и 4 (34%) случаях соответственно. В группе контроля позитивные изменения СО ДПК были констатированы лишь в 1 (8%) и 6 (50%) случаях.
В 5 (42%) случаях сохранялись макроскопические маркеры эрозивной НПВП-энтеропатии (множественные афтозные эрозии на всем протяжении осмотра ДПК, контактная кровоточивость и выраженный отек СО).
Анализ результатов динамического морфологического исследования дуоденобиоптатов также констатировал положительный цитопротективный эффект предложенного лечебного комплекса НПВП и ПКП (табл. 3).
Так, во 2 группе больных при исходно высоком уровне воспалительно-дистрофических изменений (2,6±0,11 балла) в динамике наблюдения регистрировалось статистически значимое уменьшение морфологических маркеров воспаления. В целом по группе признаки активного воспаления к концу 4–й недели лечения регистрировались лишь у 3 (25%) больных, а при полуколичественном анализе по группе в целом были вдвое меньше выражены (p<0,05).
В свою очередь, в группе больных, получавших в качестве базисной терапии только НПВП, зарегистрировано увеличение в 2 раза частоты регистрации атрофическо-дистрофических изменений СО ДПК. В среднем по группе 1,6±0,14 балла (p<0,05).
Заключение. Включение в комплексную терапию больных с НПВП-энтеропатией ПКП сопровождается позитивной динамикой клинических, эндоскопических и морфологических признаков заболевания.
Препаратами выбора из ПКП для лечения НПВП-энтеропатий могут быть Модулен IBD и Пептамен с учетом их противовоспалительного и энтеропротективного эффекта, обусловленного, с одной стороны, особенностями состава препаратов, а с другой стороны – механизмами повреждения тонкой кишки при длительном приеме НПВП.
Литература
1. Ахмедов В.А., Винжегина В.А., Судакова А.Н., Розенблит Е.И. Гастропатия, обусловленная нестероидными противовоспалительными препаратами: от понимания механизмов развития к разработке стратегии лечения и профилактики // Тер. архив. – 2007. – № 2. – С. 81–85.
2. Каратеев А.Е., Насонова В.А. Энтеропатия, индуцированная нестероидными противовоспалительными препаратами // Тер. архив. – 2004. – № 2. – С. 79–82.
3. Насонов Е.Л., Лазебник Л.Б., Мареев В.Ю. и сотр. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. Москва, 2006.
4. Маев И.В., Вьючнова Е.С., Лебедева Е.Г. Место ингибиторов протонной помпы в терапии гастропатий, индуцированных приемом нестероидных противовоспалительных препаратов // Клинические перспективы гастроэнтерологии, гепатологии. – 2006. – № 6. – С. 16–23.
5. Передерий В.Г., Ткач С.М., Марусанич Б.Н. От Маастрихта 1–1996 до Маастрихта 3–2005: десятилетний путь революционных преобразований в лечении желудочно–кишечных заболеваний // Сучасна гастроентерологія. – 2005. – № 6. – С. 4–8.
6. Пономарев А.А., Куликов Е.П. Необычные язвы желудка и двенадцатиперстной кишки. – Рязань: Узорочье, 2003.
7. Шостак Н.А., Рябкова А.А., Савельев В.С., Малярова Л.П. Желудочно–кишечные кровотечения как осложнения гастропатий, связанных с приемом нестероидных противовоспалительных препаратов // Тер. архив. – 2003. – № 5. – С. 70–73.
8. Brandt K. Diagnosis and nonsurgical management of osteoarthritis. 2000, «Professional communications, Inc.», p. 304.
9. Goldstein J., Eisen G., Lewis B., et al. Video capsule endoscopy to prospectively assess small bowel injury with celecoxib, naproxen plus omeprazole, and placebo. Clin. Gastroenterol. Hepatol., 2005, 3–13.
10. Hippisley–Cox J., Coupland C., Logan R. Risk of adverse gastrointestinal outcomes in patients taking cyclo–oxygenase–2 inhibitor or conventional non–steroidal anti–inflammatory drugs: population based nested case–control analysis. BMJ 2005; 331: 1310–1316.
11. Lai K, Chu K, Hui W, et al. Celecoxib compared with lansoprazole and naproxen to prevent gastrointestinal ulcer complications. Am J Med 2005; 118: 1271–1278.
12. Lanas A., Garsia–Rodriguez L., Arroyo M., et al. Risk of upper gastrointestinal ulcer bleeding associated with selective COX–2 inhibitors, traditional non–steroidal non–aspirin NSAID, aspirin, and combinations. Gut published online 10 may 2006; doi: 10.1136/gut.2005.080754
13. Moore R., Derry S., Makinson G., McQuay H. Tolerability and adverse events in clinical trials of celecoxib in osteoarthritis and rheumatoid arthritis: systemic review and meta–analysis on information from company clinical reports. Arthritis Res Ther 2005; 7: 644–665.
14. Rostom A., Dube C., Wells G. Prevention of NSAID–induced gastroduodenal ulcers (Cochrane Review). The Cochrane Library. – 2004; Issue 2. Chichester, UK, John Wiley & Son, Ltd.
15. Simon L., Weaver A., Graham D. Anti–inflammatory and upper gastrointestinal effects of celecoxib in rheumatoid arthritis: a randomized control trial. JAMA 1999; 282;1921–1928.
16. Tannenbaum H., Bombardier C., Davis P., Russel A.S. An evidence–based approach to prescribing nonsteroidal antiiflammatory drugs. Third Canadian Consensus Conference. J. Rheumatol 2006; 33: 140–157.








.gif)



