Оказалось, что при монотерапии статинами произошло самое значительное снижение общей смертности – на 47%. АСК – вторая по значимости: она снизила смертность на 41% (на 6% меньше, чем статины). При добавлении к этой паре веществ β–блокаторов или ингибиторов АПФ снижение смертности достигало апогея – 83 и 71% соответственно!
Следует добавить, что британским больным выписывали рецепт на получение лекарств каждые 2 мес., что отражалось в электронной базе аптеки. Видимо, частое общение британских больных с врачом способствовало высокой приверженности лечению и, соответственно, его высокой эффективности. Повторяем, что больше половины этого эффекта приходилось на долю статинов.
Если бы и в России существовала такая высокая организация лечебного процесса и со стороны врачей, и со стороны больных, смертность в когорте кардиологических больных была бы гораздо ниже. Тем более, что один из статинов последней генерации – розувастатин – выступил эффективным средством для первичной профилактики коронарного атеросклероза и его осложнений (табл. 1).
Первичная профилактика и статины
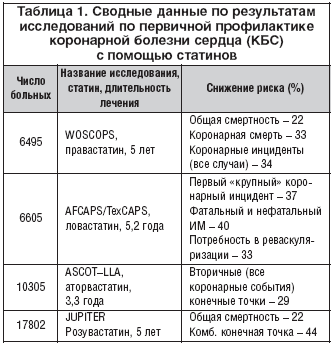
Представленные в таблице 1 первые 3 исследования широко известны [2–5]. Представляет особый интерес исследование JUPITER, в котором объектом воздействия явилась не гиперхолестеринемия, а асептическое слабовыраженное воспаление (по данным изучения уровня С–реактивного белка (СРБ) с помощью высокочувствительного метода).
Основной целью исследования JUPITER [2] стало изучение способности розувастатина предотвращать сердечно–сосудистые происшествия у практически здоровых лиц среднего возраста с низким или нормальным уровнем холестерина липопротеидов низкой плотности (ХС ЛНП) (<3,0 ммоль/л), но с высокими уровнями СРБ (≥2 мг/л). Велось длительное наблюдение (5 лет) в рандомизированном плацебо–контролируемом исследовании. Больные принимали либо 20 мг розувастатина, либо плацебо. Систолическое артериальное давление (САД) больных обеих групп было одинаковым и равнялось 134 мм рт. ст., диастолическое (ДАД) – 80 мм рт. ст. Биохимические параметры крови обеих групп больных достоверно не отличались и находились в пределах нормы или ниже. Курили 15,7 и 16,0% пациентов соответственно, ИБС в семейном анамнезе отмечена в 11,2 и 11,8% случаев, метаболический синдром выявлен у 41,0 и 41,8% больных, АСК принимали 16,6 и 16,0% больных соответственно в группе плацебо и розувастатина.
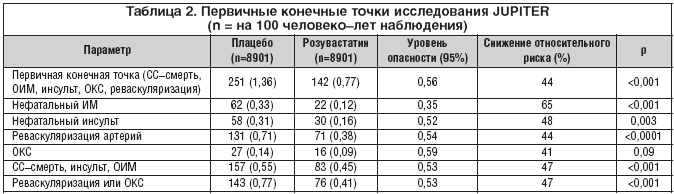
В основную группу были включены 8857 пациентов, в контрольную – 8864. Иначе говоря, различий между сравниваемыми группами больных не отмечалось. Первичные конечные точки представлены в таблице 2.
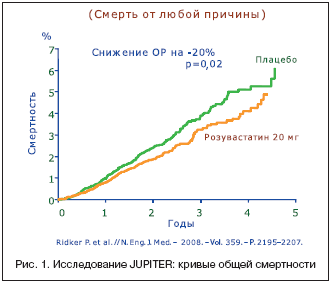
На рисунке 1 представлены кривые общей смертности. Как видно, расхождение кривых начинается через 1 год и достигает к концу наблюдения 20% в пользу больных, получавших розувастатин.
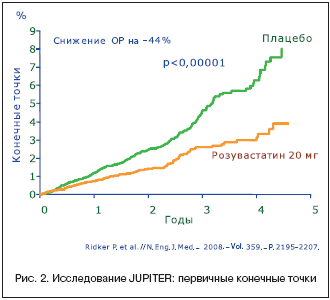
Комбинированная конечная точка представлена на рисунке 2. Видно, что сумма случаев СС–смерти, нефатального ОИМ, нефатального инсульта, ОКС, реваскуляризации артерий снизилась за период наблюдения на 44%, т.е. почти вдвое!
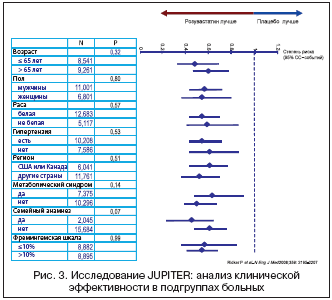
Весьма важная информация содержится на рисунке 3, где представлены различия между больными разных клинических подгрупп. Речь идет о половой принадлежности, возрасте, наличии артериальной гипертензии (АГ), метаболического синдрома, семейной предрасположенности к ИБС, о высоком и низком риске по системе фремингемской шкалы. Из левой части рисунка видно, что у сопоставляемых подгрупп больных результаты лечения были одинаковы (все значения p>0,05). Это означает, что розувастатин одинаково помогает больным всех представленных подгрупп. Что касается значений снижения риска СС–событий во всех подгруппах, то они лежат в полосе между 0,6–0,4 ед. При переводе на проценты это означает, что относительный риск сердечно–сосудистых событий был снижен на 40–60%. Эти цифры впечатляют и свидетельствуют об очень высокой эффективности розувастатина в предупреждении атеросклеротических осложнений при первичной профилактике. Напомним, что в исследование включали практически здоровых людей с низким или нормальным уровнем ХС ЛНП, но с повышенным уровнем СРБ (4,2 мг/л в группе розувастатина, 4,3 мг/л – в контрольной).
Рассмотрим, как изменились основные биохимические параметры больных в процессе наблюдения. В конце исследования разница между группами розувастатина и плацебо по уровню ХС ЛНП составила (–50%), по уровню триглицеридов (–17%), по уровню холестерина липопротеидов высокой плотности (ХС ЛВП) – 4%, а по уровню СРБ – (–37%).
Как видно из таблицы 1, в первых двух исследованиях по первичной профилактике КБС с совокупным числом больных более 13 000 человек, имеющих факторы риска, применялись правастатин и ловастатин. В исследовании с правастатином (Западно–шотландское исследование WOSCOPS [3]) общая смертность от всех причин за 5 лет снизилась на 22%, собственно коронарная смертность – на 33%. Примерно такие же результаты получены и в известном американском техасском исследовании с ловастатином. За 5 лет фатальный и нефатальный инфаркты миокарда сократились в наблюдаемой популяции на 40%, потребность в реваскуляризации – на 33%, а первый крупный коронарный инцидент происходил на 37% реже, чем в группе плацебо.
В предпоследнем крупном исследовании по первичной профилактике ИБС – ASCOT–LLA – в связи с наличием АГ и гиперлипидемии 10 305 больных были рандомизированы на прием 10 мг аторвастатина или плацебо сроком на 5 лет, но Наблюдательный совет по безопасности и эффективности исследования в сентябре 2002 г. сообщил, что LLA ветвь ASCOT показала статистически высокодостоверное снижение первичных конечных точек и инсульта (снижение на 29%, p<0,0005). Координационный комитет исследования решил приостановить исследование досрочно (через 3,3 года) ввиду явного преимущества у больных группы лечения аторвастатином.
Вторичная профилактика и статины
Число больных, страдающих манифестированной КБС, в России исчисляется миллионами, и среди них практически не проводится вторичная профилактика.
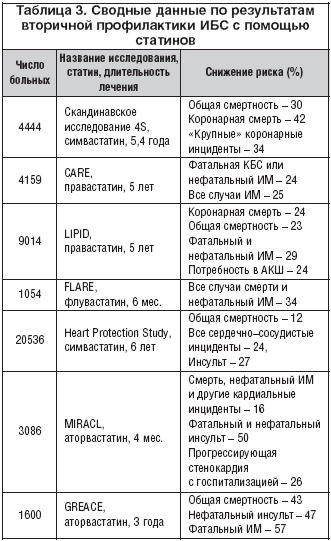
Как видно из таблицы 3, в исследованиях по вторичной профилактике, проведенных по правилам медицины, основанной на доказательствах, с общим числом включенных в исследование более 40 000 больных с КБС, установлено, что произошло снижение риска смертности от КБС в пределах 24–42%, общей смертности от всех причин – на 12–43%. Отмечалось также значительное уменьшение случаев фатального и нефатального ИМ и инсульта, потребности в АКШ [6–12].
Таким образом, установлено, что все статины обладают свойством достоверно и существенно снижать не только риск коронарных событий, включая смерть от них, но и общую смертность.
Антиатерогенное действие статинов, установленное в упоминавшихся выше исследованиях, приводит в конечном итоге к самому главному эффекту лечения больных атеросклерозом – к достоверному снижению смертности от ишемической болезни сердца и головного мозга. Причем статины эффективны как при первичной профилактике у людей с факторами риска, так и при вторичной профилактике, т.е. у больных с манифестированными заболеваниями атеросклеротического характера.
Влияние статинов
на коронарный атероматоз
Существует более 10 исследований по изучению динамики регресса коронарного атеросклероза под влиянием гиполипидемических средств с помощью повторной коронарографии. Самым впечатляющим среди них является исследование ASTEROID с применением розувастатина.
Это единственный препарат, который уменьшил объем бляшек коронарной артерии и увеличил диаметр пораженной артерии у 64–78% пациентов при применении разных методических подходов по данным повторного интракоронарного УЗИ сердца [34].
По данным исследования ASTEROID, в котором применялся метод внутрикоронарного УЗИ высокого разрешения [13], 507 больных из 53 центров США, Канады, Европы и Австралии исследовались с интервалом в 24 мес., получая в течение этого времени розувастатин в дозе 40 мг/сут. Было отмечено снижение уровня ХС ЛНП с 130,4 мг/дл до 60,8 мг/дл (снижение на 53,2%, p<0,001), значительно выросло содержание ХС ЛВП (на 14,7%, p<0,001). Объем атероматозных бляшек в среднем уменьшился на 0,79%. В месте наибольшего сужения артерии объем бляшки уменьшился на 6,1 мм3, (p<0,001), а общий объем бляшек снизился на 6,8% (p<0,001).
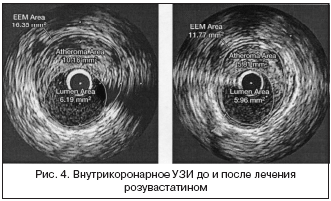
На рисунке 4 представлена оригинальная картинка УЗИ конкретного участника исследования. Левая часть рисунка представляет вид артерии изнутри с наличием атеромы, площадь которой (на рис. Atheroma Area) равна 10,16 мм2 до лечения розувастатином, а правая часть – ту же артерию с атеромой через 24 мес. Площадь бляшки уменьшилась до 5,81 мм2 (–43%). Площадь наружной эластичной мембраны (EEM) сократилась с 16,35 до 11,77 мм2 [13].
Таким образом, новейший статин – розувастатин – оказался весьма эффективным антиатеросклеротическим средством.
Плейотропные эффекты статинов
Почему гиполипидемический препарат розувастатин мог сыграть такую важную роль? Ответ на этот вопрос был получен в 80–е годы прошлого столетия.
Дело в том, что у всех статинов выявлены благоприятные терапевтические эффекты, не связанные с их гиполипидемическим действием. Эти эффекты являются неожидаемыми, дополнительными. Это богатый дар природы нашим больным и врачам. Благодаря этим эффектам спектр терапевтических возможностей статинов (т.е. гиполипидемических средств) увеличивается многократно [14].
В таблице 4 в самом кратком изложении представлено многообразие плейотропных эффектов статинов, выявленных к настоящему времени. Несмотря на то, что эти свойства присущи всей группе статинов, имеются некоторые различия в их проявлении со стороны отдельных представителей группы.
Поскольку плейотропные эффекты проявляют свою эффективность в ближайшие дни и недели от начала болезни, они играют ключевую роль в стабилизации так называемых «нестабильных атероматозных бляшек». При этом статины:
– уменьшают объем большого липидного ядра, состоящего из полужидких эфиров холестерина за счет их резорбции;
– подавляют воспалительный процесс, обязательно сопутствующий нестабильной атероме за счет снижения выделения активированными макрофагами цитокинов, медиаторов воспаления (тканевой фактор некроза), интерлейкина–1 и интерлейкина–6;
– предохраняют фиброзную оболочку бляшки от разрушения металлопротеазами, продуцируемыми активированными макрофагами;
– подавляют склонность к тромбообразованию на локальном и системном уровнях;
– увеличивают сосудорасширяющий резерв артерий. Тем самым статины способствуют стабилизации нестабильной атеромы в течение ближайших 6–14 нед., предотвращая драматические (острый ИМ, нестабильная стенокардия, инсульт) и трагические клинические (внезапная смерть) исходы.
Каковы сроки наступления плейотропных эффектов? Значение этого вопроса состоит в том, что достижение с помощью статинов тех или иных клинических результатов может быть ранним или поздним, а это имеет практическое значение.
Например, для ангиографически диагностируемого торможения коронарного атеросклероза и его частичного регресса требуется 2–3 года непрерывного лечения статинами. Этот эффект – самый главный для статинов, он зависит от основного их свойства – достижения и длительного поддержания гиполипидемии [15].
Для стабилизации нестабильных бляшек требуется не менее 4–6 мес. лечения. Этот феномен главным образом зависит от суммы плейотропных эффектов, объединяющих частные эффекты: восстановление (улучшение) функции эндотелия, противовоспалительная активность, предотвращение выработки металлопротеаз, разрушающих соединительнотканную основу покрышки атероматозной бляшки, антиоксидантное действие и, видимо, другие эффекты.
Один из главных эффектов статинов – улучшение нарушенной функции эндотелия, приводящее к сосудорасширяющему эффекту и предотвращению патологического вазоспазма под влиянием введения ацетилхолина, развивается уже через 24 ч после приема разовой дозы статина [16]. Антиишемический эффект статинов в группе больных ИБС со стабильной стенокардией отчетливо обнаруживается по результатам суточного мониторирования электрокардиограммы и нагрузочной пробы уже через 2 мес. от начала лечения [17]. При назначении больным всего лишь 5 мг симвастатина через 4 нед. концентрация оксида азота (NO) – основного сосудорасширяющего вещества – возросла на 35%, а через 12 нед. – на 69% (p<0,02) [18]. Эффект целиком обусловлен плейотропными свойствами статинов, хотя на более позднем этапе (к 3–му мес. лечения) он усиливается под влиянием развившихся к этому времени липидных изменений в крови.
Следует отметить, что при патологии сердца, не связанной с атеросклерозом (сердечная недостаточность при идиопатической кардиомиопатии), улучшение состояния кровотока плечевой артерии при введении в нее ацетилхолина, увеличение кровотока, снижение концентрации вазоконстрикторного фактора эндотелина–1, а также предсердного натрийуретического пептида произошли через 6 нед. лечения аторвастатином в дозе 40 мг/сут. [19].
Установлено, что кроме увеличения концентрации NО под влиянием статинов происходит (через 2 нед. от начала лечения) улучшение биоусвояемости продуцируемых эндотелием NO [20].
Важно отметить, что для поддержания достигнутого улучшения функции эндотелия требуется продолжение приема статинов. Через 36 ч после прекращения приема аторвастатина его вазодилатирующий эффект исчезал [21].
Другой важный общеклинический эффект статинов – противовоспалительный, также развивается быстро – через 2 нед. [22].
Этот срок достижения плейотропного эффекта статинов нельзя считать абсолютно объективным, поскольку авторы не выполняли последовательного серийного анализа исследуемых показателей с 1–го дня, а следовали срокам, принятым протоколом исследования (обычно через 2, 4, 6, 12, 24 нед. и т.д.)
Если бы исследование изучаемых параметров производилось более часто и с первых дней, то можно было бы выявить и более ранние сроки наступления эффектов. Так, A. Link и соавт. [23] изучали динамику ряда показателей воспаления у больных с ОКС через 1, 3 и 42 дня с момента поступления больных в стационар. Оказалось, что уже через 72 ч розувастатин достоверно снижал уровни противовоспалительных цитокинов: тканевого α–фактора некроза, интерферона–γ и стимулировал продукцию важного иммуномодулятора – Т–лимфоцитов.
Существует ли дозозависимость в развитии плейотропных эффектов статинов? Да, существует. Это определенно установлено в отношении вазодилатирующего потенциала эндотелия [24,25], подавления асептического воспаления интимы, способности подавления нестабильности атероматозной бляшки.
Заслуживает более подробного упоминания исследование бостонских авторов [26], изучавших клиническое значение повышенного уровня СРБ, определяемого высокочувствительным методом у 3813 больных с разными формами ОКС. Выживаемость больных, получавших более высокие дозы симвастатина и включенных в группу лечения симвастатином раньше, была выше, а степень снижения концентрации СРБ у них была значительно больше, чем у больных, получавших меньшую дозу статина и приступивших к лечению в поздние сроки.
Примерно к таким же выводам пришли Г.П. Арутюнов и соавт. [22] при лечении 211 больных с ОКС. При максимальной дозе аторвастатина достоверное снижение уровня СРБ наступало уже к 14–му дню лечения, чего не было отмечено при приеме минимальной дозы.
Еще более впечатляют результаты 4–летнего лечения и наблюдения за 889 пациентами с ИМ, с момента поступления в стационар рандомизированно получавшими симвастатин или плацебо [27]. Смертность больных в группе статинов была достоверно меньше, чем в группе плацебо. Но особенно впечатляющими оказались результаты применения статинов у больных ОИМ, отнесенных к пятой, самой высокой, квинтили уровня СРБ. Если у подобных больных в группе плацебо смертность достигала 18,5% за 4 года, то у больных, получавших симвастатин, она была в 4 раза ниже (4,6%).
У женщин в пре– и постменопаузе малая доза аторвастатина (10 мг/сут.) снижала уровень СРБ на 47 и 58% через 3 и 6 мес. лечения соответственно. Одновременно уменьшалось отношение «тканевый активатор плазминогена/ингибитор тканевого активатора плазминогена–1» на 31 и 40% соответственно. Снижение этого показателя имеет отношение к усилению антикоагуляционного потенциала крови, оно также было дозозависимым [28].
Свободные радикалы кислорода (СРК) играют весьма негативную роль в функционировании сердечно–сосудистой системы. Основным источником СРК является активизация оксидазы никотинамиддинуклеофосфата (НАДФ).
Увеличение количества СРК ведет к целому ряду явлений, которые вносят свой вклад в развитие атеросклероза, гипертонии, сахарного диабета, нарушений ритма сердца и т.д. С точки зрения кардиологии наиболее важными последствиями усиления образования СРК, ведущими к так называемому «оксидативному стрессу», являются избыточное образование окисленных ЛНП, подавление биоактивности NO, ремоделирование различных тканей, в том числе миокарда. При этом стимулируются гиперплазия, пролиферация или апоптоз клеток. Под влиянием СРК активизируются ЛНП, стимулируя злокачественное течение атеросклероза с быстро наступающими осложнениями, происходят активация тромбоцитов, лейкоцитов, моноцитов и их превращение в макрофаги; нарушается функция мембран клеток, в том числе проводящей системы сердца. СРК являются следствием оксидативного стресса и сами стимулируют формирование ионов кислорода (О2–). Таким образом создается порочный круг самовоспроизведения негативных факторов, угрожающих сердечно–сосудистой системе [29]. Этот порочный круг может быть прерван антиоксидантами.
Надежды на теоретически возможное благоприятное воздействие естественных антиоксидантов на оксидативный стресс, к сожалению, не оправдались. Отрицательные результаты применения α–токоферола, β–каротина, аскорбиновой кислоты и других так называемых «естественных антиоксидантов» широко известны.
К счастью, оказалось, что статины являются действенным средством подавления оксидативного стресса. Еще в 1993 г. было показано, что симвастатин, добавленный к предварительно активированным моноцитам/макрофагам человека, дозозависимо подавлял их способность к окислению липидов. При добавлении к симвастатину мевалоната, т.е. при восстановлении синтеза ХС через образование мевалоновой кислоты (как это происходит в естественных условиях), восстанавливалась способность активизированных макрофагов к окислению ЛНП. Это является прямым доказательством антиоксидантной эффективности статинов [30]. Об этом же свидетельствуют результаты экспериментов с кроликами, которых кормили пищей, богатой ХС. Половина из них получали флувастатин. Концентрация О2 в стенке аорты кроликов из группы статинов была достоверно меньше, чем у кроликов контрольной группы [31]. В другом исследовании флувастатин предотвратил атероматоз аорты кроликов, уменьшил выраженность оксидативного стресса [32].
При разовом приеме 40 мг розувастатина за 24 ч до процедуры внутрикоронарного баллонирования предотвращалось ишемическое повреждение миокарда. Об этом свидетельствовало достоверно более низкое значение креатинфосфокиназы (КФК) и тропонина I у больных, получавших розувастатин [33].
У больных с АГ и дислипидемией розувастатин достоверно снижал концентрацию интерлейкина–6, тканевого a–фактора некроза опухоли, глутатионредуктазы, глутатионпероксидазы и супероксиддисмутазы (все значения p<0,05). Иначе говоря, он одновременно подавлял и воспаление, и оксидативный стресс. Поскольку при этом наблюдался выраженный гиполипидемический эффект (снижение ХС ЛНП на 63%), авторы допускают возможность комбинированного воздействия гиполипидемического и плейотропного эффектов розувастатина [34]. У больных с ХСН розувастатин оказал комплексное положительное воздействие одновременно на циркулирующие эндотелиальные прогениторные клетки (+224%, p<0,04) и плотность мышечных капилляров (на 14%, p<0,001). Это сопровождалось возросшим хоумингом (homing) CD34+ стволовых клеток. Наблюдалось также усиление кровотока плеча на 163% при манжеточной пробе (p<0,001).
Таким образом, впервые с помощью розувастатина получены данные, свидетельствующие об одновременном разнонаправленном благоприятном влиянии препарата на предшественники эндотелиальных клеток, возможность хоуминга стволовых клеток, улучшение эндотелиальной и усиление насосной функций сердца у пациентов с ХСН с низкой фракцией выброса (ФВ<30%) [35]. Розувастатин оказывает благоприятное влияние на кожный кровоток при 18–недельном лечении больных СД 2 типа с нейропатическими расстройствами. Под влиянием лечения произошло снижение баллов нейропатии с 8,34±1,26 до 6,00±0,9. Кроме того, у больных было выявлено усиление кожного кровотока, возросшего с 6,81±0,42 до 9,92±0,78 мл/мин. (p<0,001). Эти данные позволяют допустить, что розувастатин оказывает нейропротективное действие у больных СД 2 типа через механизм улучшения микроциркуляции [36]. Более того, получены сведения о том, что розувастатин сокращает сроки амнезии и дезориентации при травматическом поражении мозга (снижение риска амнезии по сравнению с контрольной группой на 46%, p<0,04) [37].
Недавно в России зарегистрирован генерический розувастатин фармацевтической компании «Эгис» под названием Розулип. Появление генерика компании, хорошо зарекомендовавшей себя в России, безусловно, увеличит число пациентов, принимающих статины, и поможет в лечении и профилактике основных кардиоваскулярных заболеваний и их серьезных осложнений.
![Таблица 4. Плейотропные эффекты статинов [Д.М. Аронов, 2008]](/data/articles/Image/t20/n14/698-8.gif)
Литература
1. Hippisly–Cox J., Coupland C. Effect of combinated of drugs on all cause mortality: nested case–control analysis // BMJ. – 2005. – Vol. 330. – P. 1059–1063.
2. Ridker P.M., Danielson E., Fonseca F.A. et al. Rosuvastatin to prevent vascular events in men and women with elevated C–reactive protein // N. Engl. J. Med. – 2008. – Vol. 359 (21). – P. 2195–2207.
3. Shepherd J., Cobbe S.M., Ford I., Isles C.G. et al. For the West of Scotland Coronary Prevention Study Group Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia // N. Engl. J. Med. – 1995. – Vol. 333 (20). – P. 1301–1307.
4. Downs G.R., Clearfield M., Weis S. et al. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: Results of Air Force Texas coronary Atherosclerosis Study // JAMA. – 1998. – Vol. 279. – P. 1615–1622.
5. Sever P.S., Dahlof B., Poulter N.R. et al. For the ASCOT Investigations. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower–than–average cholesterol concentrations, in the Anglo–Scandinavian Cardiac Outcomes Trial–Lipid Lowering Arm (ASCOT–LLA): a multicentre randomized controlled trial // Lancet. – 2003. – Vol. 361. – P. 1149–1158.
6. Scandinavian Simvastatin Survival Study Group. Randomized trial of cholesterol lowering in 4444 patients with coronary heart disease the Scandinavian Simvastatin Survival Study (4S) // Lancet. – 1994. – Vol. 344. – P. 1383–1389.
7. Ridker P.M., Rifai N., Pfeffer M.A. et al. Cholesterol and Recurrent Events (CARE) investigators: inflammation, pravastatin and the risk of coronary events after myocardial infarction in patients with average cholesterol levels // Circulation. – 1998. – Vol. 98. – P. 839–844.
8. Lipid Study groop // Атеросклероз. – 242. – C.401.
9. 4. MRC/BHF Heart Protection Study of cholesterol lowering with Simvastatin in 20 536 high–risk individuals: a randomized placebo controlled trial // Lancet. – 2002. – Vol. 360. – P. 7–22.
10. Athyros V.G., Papageorgiou A.A., Mercouris B.R. et al. Treatment with atorvastatin to the National Cholesterol Educational Program goal versus «usual» care in secondary coronary heart disease prevention. The GREek Atorvastatin and Coronary–heart–disease Evaluation (GREACE) study // Curr. Med. Res. Opin. – 2002. – Vol. 18 (4). – P. 220–228.
11.Schwartz G.G., Olsson A.G., Ezekowitz M.D. et al. Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes. The MIRACL Study : a randomized controlled trial // JAMA. – 2001. – Vol. 285. – P. 1711–1718.
12. Serruys P.W., Foley D.P., Jackson G. et al. A randomized placebo–controlled trial of fluvastatin for prevention of restenosis after successful coronary ballon angioplasty; final results of the Fluvastatin Angioplastic Restenosis (FLARE) trial // Eur. Heart. J. – 1999. – Vol. 20. – P. 58–69.
13. Nissen S.E., Nicholls S.J., Sipahi I. et al. Effect of very high–intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial // JAMA. – 2006. – Vol. 295 (13). – P. 1556–1565.
14. Аронов Д.М. Плейотропные эффекты статинов // Кардиология. – 2008. – № 8. – С. 60–68.
15. Аронов Д.М. Лечение и профилактика атеросклероза. – М.: Триада–Х, 2000. – С. 411.
16. Boven van A., Jukema J.W., Zwinderman A.N. et al. on behalf of the REGRESS Study Group Reduction of transient myocardial ischemia with pravastatin in addition of the Conventional treatment in patients with angina pectoris // Circulation. – 1996. – Vol. 94. – P. 1503–1505.
17. Wassmann S., Faul A., Hennen B. et al. Rapid effect of 3–hydroxy–3–methylglutaryl coenzyme a reductase inhibition on coronary endothelial function // Circ. Res. – 2003. – Vol. 31. – P. 98–103.
18. Nakashima Y., Toyokawa T., Tanaka S. et al. «Simvastatin increases plasma NO2– and NO3–levels in patients with hypercholesterolemia» // Atherosclerosis. – 1996. – Vol. 127. – P. 43–47.
19. Strey C.H., Voung J.M. et al. Short–term statin treatment improves endothelial function and neurohormonal imbalance in normocholesterolaemic patients with non–ischaemic heart failure // Heart. – 2006. – Vol. 92 (11). – P. 1603–1609.
20. John S., Delles C., Jacobi J., Schlaich M.P. Rapid improvement of nitric oxide biovailability after lipid–lowering therapy with cerivastatin within two weeks // J. Am. Coll. Cardiol. – 2001. – Vol. 37 (5). – P. 1351–8135.
21. Taneva E., Borucki K., Wiens L. Early effects on endothelial function of atorvastatin 40 mg twice daily and its withdrawal // Am. J. Cardiol. – 2006. – Vol. 97 (7). – P. 1002–1006.
22. Арутюнов Г.П., Карцева Т.П., Воеводина Н.Ю. и др. Влияние агрессивной терапии симвастатином у больных с острым коронарным синдромом и исходно нормальным уровнем ХС ЛПНП на сердечно–сосудистые исходы (ЛАОКООН), пилотное рандомизированное исследование // Тер. арх. – 2005. – № 9. – С. 53–60.
23. Link A., Ayadhi T. et al. Rapid immunomodulation by rosuvastatin in patients with acute coronary syndrome // Eur. Heart. J. – 2006. – Vol. 27. – P. 2945–2955.
24. Fichtischerer S., Schmidt–Lucke C. et al. Differential effects of shot–term lipid lowering with ezetimibe and statins on endothelial function in patients with CAD clinical evidence for «pleotropic» functions of statin therapy // Eur. Heart. J. – 2006. – Vol. 27 (10). – P. 1182–1190.
25. Eto M., Rathgeb L., Cosentino F. et al. Statins blunt thrombin–induced down–regulation of endothelial nitric oxide synthase expression in human endothelial cells // J. Cardiovasc. Pharmacol. – 2006. – Vol. 45 (5). – P. 663–667.
26. Morrow D.A., de Lemos J.A. et al. Clinical relevance of C–reactive protein during follow–up of patients with acute coronary syndromes in the Aggrastat–to–Zocor Trial // Circulation. – 2006. – Vol. 114: 4. – P. 281–288.
27. Muhlestein J.B., Anderson J.L., Horne B.D. et al. Intermountain Heart Collaborative Study Group. Early effects of statins in patients with coronary artery disease and high C–reactive protein // Am. J. Cardiol. – 2004. – Vol. 94 (9). – P. 1107–1112.
28. Ushiroyama T., Nosaka S., Ueki M. Short–term effects of low–dose atorvastatin on inflammatory status and lipid profiles in perimenopausal hypercholesterolemic hypertriglyceridemic women // Int. J. Cardiol. – 2006. – Vol. 113 (1). – P. 66–75.
29. Galle J., Hansen–Hagge T. et al. Impact of oxidized low density lipoprotein on vascular cells // Atherosclerosis. – 2006. – Vol. 7. – P. 219–226.
30. Giroux L.M., Davignon J., Naruszewicz M. Simvastatin inhibits the oxidation of low–density lipoproteins by activated human monocyte–derived macrophages // Biochim. Biophys. Acta. – 1993. – Vol. 1165 (3). – P. 335–338.
31. Sumi D., Hayashi T., Thakur N.K. et al. A HMG–CoA reductase inhibitor possesses a potent antiatherosclerosis effect other than serum lipid lowering effects – the relevance of endothelial nitric oxide synthase and superoxide anion scavenging action // Atherosclerosis. – 2001. – Vol. 155 (2). – P. 347–357.
32. Rikitake Y., Kawashima S. et al. Anti–oxidative properties of fluvastatin, an HMG–CoA reductase inhibitor, contribute to prevention of atherosclerosis in cholesterolfed rabbits // Atherosclerosis. – 2001. – Vol. 154 (1). – P. 87–96.
33. Cay S., Cagirci G., Sen N. et al. Prevention of peri–procedural myocardial injury using a single high loading dose of rosuvastati // Cardiovasc. Drugs Ther. – 2010. – Vol. 24 (1). – P. 41–47.
34. Gomez–Garcia A., Martinez Torres G., Ortega–Pierres L.E. et al. Rosuvastatin and metformin decrease inflammation and oxidative stress in patients with hypertension and dyslipidemia // Rev. Esp. Cardiol. – 2007. – Vol. 60 (12). – P. 1242–1249.
35. Erbs S., Beck E.B., Linke A. et al. High–dose rosuvastatin in chronic heart failure promotes vasculogenesis, corrects endothelial function, and improves cardiac remodeling–results from a randomized, double–blind, and placebo–controlled study // Int. J. Cardiol. – 2011. – Vol. 146 (1). – P. 56–63
36. Parson H.K., Bundy M.A., Dublin C.B. et al. Pleiotropic effects of rosuvastatin on microvascular function in type 2 diabetes // Diabetes Metab. Syndr. Obes. – 2010. – Vol. 3. – P. 19–26.
37. Tapia–Perez J.H., Sanchez–Aguilar M., Torres–Corzo J.G. et al. Effect of rosuvastatin on amnesia and disorientation after traumatic brain injury (NCT003229758) // J. Neurotrauma. – 2008. – Vol. 25 (8). – P. 1011–1017.












