Введение
В последние годы наблюдается значительный рост аллергических заболеваний (АЗ), в т. ч. и бронхиальной астмы (БА). Несмотря на значительные успехи фармакологии, достичь полного контроля БА у ряда пациентов не удается [1]. Аллерген-специфическая иммунотерапия (АСИТ) является единственным высокоэффективным методом лечения АЗ, воздействующим на все патогенетически значимые процессы аллергического воспаления. Более чем 100-летний опыт применения данного метода показал его безопасность и значительную эффективность у больных с АЗ [2–4].АСИТ предотвращает развитие астмы, переход легких форм в более тяжелые формы АЗ и развитие других видов сенсибилизации. В основе метода лежит формирование клинической и иммунологической толерантности к этиотропным аллергенам [5, 6]. Повышение эффективности АСИТ в последние десятилетия идет в направлении разработки качественных методов диагностики сенсибилизации, как и применение молекулярной диагностики, внедрение новых стандартизированных форм аллергенов. Молекулярная диагностика позволяет не только качественно выявить сенсибилизацию к мажорному аллергену, но и оптимально и экономично контролировать состояние пациента и прогнозировать эффективность АСИТ [7, 8]. Проводятся исследования и внедряются в клиническую практику новые виды аллергенов и адъювантов, более безопасных и удобных в применении [9]. Наиболее перспективным способом введения аллергенов является сублингвальный (СлАСИТ). Эффективность СлАСИТ подтверждена в многочисленных международных и российских клинических исследованиях [10, 11]. Удобство, простота применения, высокая эффективность делают этот способ предпочтительным при выборе метода терапии. Проведение АСИТ с учетом мажорных аллергенов повышает эффективность лечения в значительной степени [8].
Сенсибилизация к бытовым аллергенам является одной из распространенных, наблюдается более чем у 50% пациентов с аллергическим ринитом (АР) и БА, хотя в сравнении с другими видами сенсибилизации клинически является менее очевидной [12, 13]. Наиболее значимыми бытовыми аллергенами являются клещи домашней пыли (КДП): Dermatophagoides farinae (D. farinae) и Dermatophagoides pteronyssinus (D. pteronyssinus) [14, 15]. Подтверждение сенсибилизации аллергоанамнезом часто бывает недостаточным, т. к. пациенты не замечают прямого воздействия бытовых аэроаллергенов при хороших жилищных условиях [16, 17]. Только у 1/3 пациентов удается собрать яркий аллергоанамнез с наличием в классических проявлениях симптомов при контакте с пылью во время уборки квартиры, при пребывании в старых деревянных домах. Наиболее часто атопия к КДП проявляется персистирующим течением заболевания без значимых сезонных обострений. Пациенты могут отмечать частые простудные заболевания — более 5–6 в год, без повышения температуры и признаков инфекционного процесса. Зачастую таким пациентам многократно проводится антибиотикотерапия, увеличиваются дозы стероидов. При тщательном опросе удается установить, что на первое место выходят признаки сенсибилизации к бытовым аллергенам, клинически проявляющиеся БА и АР.
Проведение специфической аллергодиагностики позволяет идентифицировать вид атопии. В настоящее время известно несколько мажорных белков КДП: Der p 1, Der p 2
и Der p 23, Der f 1, Der f 2. Тропомиозин (Der р 10) проявляется перекрестными реакциями с пищевой непереносимостью креветок, ракообразных, атопией к тараканам. Данный белок участвует в клинике, формируя АЗ к перекрестным аллергенам, но не является определяющим в проведении АСИТ. Использование молекулярной диагностики в установлении сенсибилизации к КДП является важным этапом подбора пациентов для АСИТ, особенно в случаях с полисенсибилизацией и нечеткими данными аллергологического обследования. В реальной клинической практике это не всегда доступно практическим врачам, поэтому пациентам с аллергоанамнезом, положительными результатами кожного тестирования можно назначать АСИТ, ориентируясь на эти данные [6, 7, 17, 18].
Цель исследования: оценить эффективность сублингвальной аллерген-специфической иммунотерапии препаратом Сталораль «Аллерген клещей» у больных БА с бытовой сенсибилизацией.
Материал и методы
Под наблюдением находилось 47 больных с диагнозом «аллергическая форма бронхиальной астмы» (АБА), обусловленная атопией к КДП (D. farinae и D. pteronyssinus), из них мужчин было 19 (40,4%), женщин — 28 (59,6%). Возраст обследованных представлен в виде медианы (Ме) и квартилей [Р25%; Р75%] и составил 31,50 [18,00; 57,00] года. Длительность заболевания — 3,4 [3,900; 10,21] года. Диагноз БА установлен в соответствии с Федеральными клиническими рекомендациями (2013 г.) и Глобальной стратегией: диагностика, лечение и профилактика БА (GINA, 2015) [1, 2]. Контроль течения БА оценивался по частоте и выраженности дневных, ночных симптомов астмы, кратности применения короткодействующих бронхолитиков, толерантности к физической нагрузке и частоте обострений (GINA, 2015). Применялась шкала контроля БА: полный контроль (1 балл), неполный контроль (2 балла), отсутствие контроля (3 балла). Оценка контроля астмы проведена в баллах для удобства статистической обработки результатов. Оценку функции внешнего дыхания проводили по стандартной методике, определяли объем форсированного выдоха за 1 с (ОФВ1). Сенсибилизация к КДП подтверждена данными аллергологического анамнеза, результатами специфических IgE-антител методом ИФА и ImmunoСAP (asIgE), скарификационными кожными тестами к D. farinae и D. pteronyssinus. 2/3 пациентов имели сочетанную патологию в виде БА и АР. Лабораторное исследование проводили в одной из сетевых лабораторий. Клиническое наблюдение пациентов и обследование выполнялись на кафедре аллергологии и иммунологии ПИУВ — филиала ФГБОУ ДПО РМАНПО Минздрава России и в клинике ООО «МедМикс Плюс».Дизайн исследования: ретроспективное, сравнительное, контролируемое. Проведено ретроспективное изучение эффективности СлАСИТ в сравнении со стандартной базисной терапией у больных АБА с сенсибилизацией к КДП.
Критерии включения в исследование: больные с диагнозом АБА (GINA, 2015) вне обострения, как минимум со сроком подтверждения диагноза более 2-х лет, возраст больных — от 18 до 65 лет, наличие симптомов астмы, несмотря на проводимую базисную терапию ингаляционными глюкокортикостероидами (ИГКС), наличие положительных результатов исследования специфических IgЕ антител не менее 2-х классов реакции (более 0,35 кU/мл) и кожного тестирования с аллергенами клещей не менее 2-х баллов (более 5 мм в диаметре), информированное согласие испытуемых, ОФВ1 — более 70% от должных величин.
Критерии исключения: тяжелая и крайне тяжелая степень тяжести БА; хроническая обструктивная болезнь легких (ХОБЛ), психические заболевания; туберкулез любой локализации в активной фазе и в анамнезе; тяжелые и декомпенсированные заболевания печени, почек, сердечно-сосудистой, эндокринной систем; аутоиммунные заболевания; онкологические заболевания; беременность и период лактации; нежелание участвовать в исследовании.
Пациенты были разделены на 2 группы: 1-я группа — 30 человек с диагнозом АБА получали АСИТ сублингвальным методом (СлАСИТ) препаратом Сталораль «Аллерген клещей», 2-ю группу составили 17 человек с таким же диагнозом, которые получали стандартную базисную противовоспалительную терапию ИГКС. Группы были сопоставимы по полу, возрасту, степени тяжести БА и результатам аллерго-иммунологического тестирования (р>0,05). Все пациенты получали противовоспалительную терапию в соответствии с рекомендациями GINA. 16 (30,4%) человек получали низкие, 31 (69,6%) — средние дозы ИГКС согласно российским и международным клиническим рекомендациям.
Исследование аsIgЕ антител к КДП проводили методом иммуноферментного анализа (ИФА) и с помощью молекулярной диагностики для уточнения наличия молекулярного белка Der p 1, Der p 2 методом ImmunoСАР. При отборе пациентов для уточнения вида сенсибилизации вначале проводилось исследование панели специфических IgЕ антител (домашняя пыль, клещ домашней пыли D. pteronyssinus, клещ домашней пыли D. farinae, таракан рыжий), при положительных результатах выше 2 класса (от 0,7 до 3,5 и выше kUA/l) выполнялось уточнение наличия антител к мажорным аллергенам, что позволило провести отбор пациентов для СлАСИТ и прогнозировать ее эффективность. Скарификационные кожные пробы выполнены стандартным методом с отечественными лечебно-диагностическими аллергенами D. farinae и D. pteronyssinus согласно инструкции к препарату.
Сублингвальную иммунотерапию проводили лечебным препаратом Сталораль «Аллерген клещей» производства Stallergenes (Франция) согласно инструкции по применению препарата [19]. Аллерген вводили сублингвально утром натощак: начальный курс набора дозы проводился с 1 до 4 нажатий, начиная с дозы 10 ИР/мл, далее с 1 до 4 нажатий дозы 300 ИР/мл, поддерживающий курс проводили в дозе 300 ИР/мл в режиме 4 нажатия по 3 раза в неделю в течение 3-х лет. Пациенты проходили плановые осмотры аллерголога в 1-й год терапии — 1 раз в 3 мес., далее 1 раз в 6 мес. для оценки контроля течения основного заболевания, оценки побочных эффектов и переносимости препарата, пересмотра базовой противовоспалительной терапии (срок наблюдения — 3 года). Наблюдение пациентов
из группы сравнения проходило с той же частотой. Клиническую эффективность СлАСИТ оценивали в конце каждого года наблюдения, учитывая клинические эффекты течения БА (снижение частоты обострений и выраженности клинических симптомов, уменьшение объема базисной терапии и потребности в симптоматических препаратах, повышении контроля БА). Результаты оценивались как отличные (не отмечено обострений, клинические симптомы отсутствуют или выражены незначительно, значительно уменьшился объем применяемых медикаментов, существенно повысился контроль БА), хорошие (редкие обострения, сохранение клинических симптомов меньшей интенсивности, уменьшение объема применяемых медикаментов, повышение контроля БА), удовлетворительные (сохранение частоты обострений, незначительное уменьшение выраженности клинических симптомов и потребности в медикаментах, контроль БА прежний) и неудовлетворительные (клиническое течение БА без изменений или ухудшилось).
Статистическая обработка материала проводилась с помощью пакета прикладных программ Statistica 6.0 на персональном компьютере. При сравнении групп между собой использовали критерий Маnn — Whithey, до и после терапии — тест Wilcocson. Показатели представлены в виде медианы (Ме) и квартилей [Р25%; Р75%]. Исследование взаимосвязи между изучаемыми показателями проводилось с помощью метода корреляционного анализа по Спирмену с вычислением коэффициента корреляции (r). Критической величиной уровня значимости принято р<0,05.
Результаты и обсуждение
Все пациенты, включенные в исследование, закончили курс АСИТ. Отмечена хорошая терапевтическая переносимость СлАСИТ препаратом Сталораль «Аллерген клещей». У 5 пациентов (16,5%) наблюдались нежелательные явления (НЯ) в виде местных реакций: зуд (n=3, 10,0%), першение в горле (n=4, 13,3%), отек язычка и неба (n=1, 3,3%). Они возникали в течение 20–30 мин после приема препарата и наблюдались, как правило, в начале курса СлАСИТ и в период набора дозы. Только у 2 пациентов местные реакции сохранялись на протяжении всего срока наблюдения. Наблюдаемые реакции не потребовали отмены терапии, изменения дозы и режима введения аллергена. 5 пациентам по поводу НЯ были назначены антигистаминные препараты 2 поколения по потребности. При проведении СлАСИТ у 3 (10,0%) пациентов наблюдалось обострение АР средней тяжести, потребовавшее назначения топических стероидов и применения антигистаминных препаратов. У 1 (3,3%) пациента при наборе дозы аллергена зарегистрировано обострение БА, потребовавшее увеличения объема противовоспалительной терапии и кратности приема бронхолитиков. СлАСИТ у данных пациентов была приостановлена до купирования обострения АР и БА и повторно назначена с прежней дозы. Пациенты с НЯ наблюдались ежемесячно.По истечении курса терапии и срока наблюдения проведен анализ клинических и аллерго-иммунологических показателей (табл. 1).
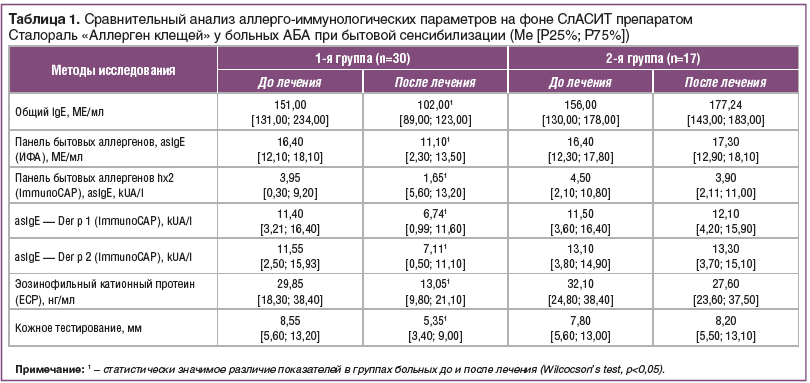
Анализ аллерго-иммунологических параметров до и после проведения СлАСИТ (табл. 1) показал значительную положительную динамику регресса значений после терапии (р<0,05). У больных, получавших СлАСИТ, значительно снизилась интенсивность эозинофильного воспаления. Значения ЕСР (эозинофильный катионный белок) уменьшились в 2,3 раза (с 29,85 до 13,05 нг/мл) после завершения курса иммунотерапии (р<0,05). ЕСР отражает активность эозинофилов, участвующих в аллергическом воспалении, и его интенсивность. Снижение уровня ЕСР отражает состояние аллергической реактивности организма и показывает положительное влияние СлАСИТ на снижение активности аллергического воспаления.
Уровень специфических IgЕ — антител к аллергенам может являться одним из маркеров эффективности АСИТ [7, 20]. В большей степени произошло снижение уровня asIgE к КДП, определяемых методом ImmunoCAP. В нашем исследовании мы наблюдали снижение уровня общего IgЕ в 1,7 раза (р<0,05), asIgE к Der p 1 — в 3 раза, к Der р 2 — в 1,8 раза (р<0,05). Уменьшилась интенсивность кожных тестов с причинными аллергенами в 1,6 раза (с 8,55 до 5,35 мм) после его окончания (р<0,05). В группе пациентов, получавших ИГКС, динамики интенсивности asIgE и кожных тестов не наблюдалось (р>0,05). СлАСИТ уменьшает выраженность и интенсивность специфического аллергического воспаления, оказывая патогенетически направленное действие, и способствует формированию иммунологической толерантности.
У всех пациентов, получавших СлАСИТ, наблюдалось улучшение клинического течения БА. Частота обострений БА до начала лечения составила 1,7 раза в год у пациентов в 1-й группе и 1,8 раза в год во 2-й соответственно (р>0,05). На фоне проведения СлАСИТ отмечено значительное снижение частоты рецидивов БА — в 2,7 раза. После лечения частота обострений БА составила 0,7 раза в год (р<0,05) у больных, получавших СлАСИТ. У пациентов 2-й группы частота обострений осталась на прежнем уровне, несмотря на проведение базисной терапии ИГКС (2,00 раза в год, р>0,05). За период наблюдения в течение 3-х лет ни у одного пациента не было зарегистрировано тяжелого обострения БА, не было госпитализаций по поводу БА и/или АР.
СлАСИТ привела к уменьшению объема противовоспалительной терапии. До начала курса лечения средние дозы ИГКС получали 22 (73,3%) пациента, через 3 года наблюдения — 15 (50%) человек. У пациентов 2-й группы значимых изменений терапии отмечено не было. Кроме того,
у 6 (35,3%) пациентов было отмечено повышение доз применяемых ИГКС до средних и высоких.
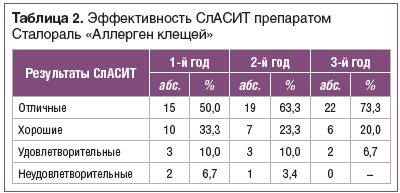
Клиническая эффективность СлАСИТ с учетом отличных и хороших результатов составила за 1-й год наблюдения 83,3%, за 2-й — 86,6%, за 3-й — 93,3% (табл. 2). Длительность курса СлАСИТ имеет значение для эффективности терапии, наиболее оптимальным является курс лечения в течение 3-х лет.
После проведения СлАСИТ у больных повысился контроль БА с 2,0 баллов до 1,0 (р<0,05), у пациентов 2-й группы, не получавших СлАСИТ, контроль астмы остался на прежнем уровне — с 2,0 баллов до 2,1 балла (р>0,05). Кроме того, улучшилось клиническое течение сопутствующего АР, 5 пациентам была отменена терапия назальными топическими стероидами. В группе пациентов, получавших только базисную терапию, в большинстве случаев клиническое течение БА осталось на прежнем уровне.
Лучшая клиническая эффективность получена у пациентов с исходно высокими значениями аsIgЕ к Der p 1 и Der p 2
(от 3,5 до 17,5 kUA/l и выше) и результатами кожных проб (более 5–10 мм). Выявлена значимая корреляция эффективности СлАСИТ с аsIgЕ уровнем Der p 1 (r=0,41; р=0,02), Der p2 (r=0,42; р=0,02) и результатами кожного тестирования (r=0,54; р=0,002).
Заключение
Таким образом, СлАСИТ является безопасным высокоэффективным методом иммунотерапии АБА. Для назначения АСИТ необходимо точно идентифицировать значимый аллерген, вызывающий клинические симптомы. Молекулярная диагностика может быть использована практическими врачами для отбора пациентов для СлАСИТ. Наряду с применением молекулярных методов кожные тесты с причинно-значимыми аллергенами остаются обоснованным методом диагностики сенсибилизации в решении вопроса проведения АСИТ у пациентов с сенсибилизацией к КДП. Таким пациентам АСИТ может быть проведена успешно и эффективно.Клиническая эффективность СлАСИТ выражается в снижении интенсивности аллергического воспаления, изменении клинических симптомов астмы и ринита, повышении контроля заболевания, снижении частоты рецидивов и уменьшении объема противовоспалительной терапии.












