–Ъ–Њ–Љ–Њ—А–±–Є–і–љ–Њ—Б—В—М –≤—Л—П–≤–ї—П–µ—В—Б—П —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –±–Њ–ї–µ–≤—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ (–С–°) (—А–Є—Б. 1). –Ы–Є–і–Є—А—Г—О—Й–Є–µ –њ–Њ–Ј–Є—Ж–Є–Є –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ —З–∞—Б—В–Њ—В—Л –Њ–±—А–∞—Й–µ–љ–Є–є –Ј–∞ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й—М—О –Ј–∞–љ–Є–Љ–∞—О—В –Є–Љ–µ–љ–љ–Њ –±–Њ–ї—М –Є –С–°, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–ґ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Є –Ї–∞–Ї —Б–Є–Љ–њ—В–Њ–Љ, –Є –Ї–∞–Ї —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ—Г—О –±–Њ–ї–µ–Ј–љ—М. –Ю–і–љ–∞–Ї–Њ –Њ—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –±–Њ–ї—М –Ї–∞–Ї –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —Д–µ–љ–Њ–Љ–µ–љ —П–≤–ї—П–µ—В—Б—П —Ж–µ–ї–Њ–є —Ж–µ–њ—М—О –Є–Ј–Љ–µ–љ–µ–љ–Є–є –љ–∞ —А–∞–Ј–љ—Л—Е —Г—А–Њ–≤–љ—П—Е –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ [2].
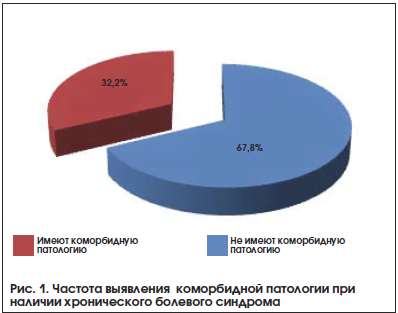
–С–Њ–ї—М –Є –С–° —П–≤–ї—П—О—В—Б—П –њ—А–Є—З–Є–љ–Њ–є –љ–µ–њ—А–Є—П—В–љ—Л—Е –Њ—Й—Г—Й–µ–љ–Є–є –Є —Н–Љ–Њ—Ж–Є–є (–Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –±–Њ–ї–Є, IASP, 1992), –∞ —В–∞–Ї–ґ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–є —А–µ–∞–Ї—Ж–Є–µ–є –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –Њ—А–≥–∞–љ–Њ–≤ –Є —Б–Є—Б—В–µ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Ґ–∞–Ї, –С–° –∞–Ї—В–Є–≤–Є—А—Г–µ—В —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї—Г—О –љ–µ—А–≤–љ—Г—О —Б–Є—Б—В–µ–Љ—Г, —З—В–Њ —Г—З–∞—Й–∞–µ—В —З–Є—Б–ї–Њ —Б–µ—А–і–µ—З–љ—Л—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є, –Р–Ф, —Б–µ—А–і–µ—З–љ—Л–є –≤—Л–±—А–Њ—Б –Є –Љ–Њ–ґ–µ—В –њ—А–Њ–≤–Њ—Ж–Є—А–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ –Є—И–µ–Љ–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞. –Ш–Ј–≤–µ—Б—В–љ—Л —Б–ї—Г—З–∞–Є —А–∞–Ј–≤–Є—В–Є—П –≥–Є–њ–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Є—Е –њ–љ–µ–≤–Љ–Њ–љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –С–° –њ—А–Є —Й–∞–і—П—Й–µ–Љ —А–µ–ґ–Є–Љ–µ –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –Є —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Њ–±—К–µ–Љ–∞ –≤—Л–і–Њ—Е–∞ –Є –ґ–Є–Ј–љ–µ–љ–љ–Њ–є –µ–Љ–Ї–Њ—Б—В–Є –ї–µ–≥–Ї–Є—Е. –°–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–∞—П –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–∞—Ж–Є—П –њ–Њ–≤—Л—И–∞–µ—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Љ–Њ—З–µ–≤—Л—Е —Б—Д–Є–љ–Ї—В–µ—А–Њ–≤, —З—В–Њ –Љ–Њ–ґ–µ—В —П–≤–Є—В—М—Б—П –њ—А–Є—З–Є–љ–Њ–є –Њ—Б—В—А–Њ–є –Ј–∞–і–µ—А–ґ–Ї–Є –Љ–Њ—З–µ–Є—Б–њ—Г—Б–Ї–∞–љ–Є—П –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –С–°. –Ш–Љ–µ–љ–љ–Њ –њ–Њ—Н—В–Њ–Љ—Г –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є–µ –њ—А–Є–Ј–љ–∞–љ–Њ —А–µ—И–µ–љ–Є–µ–Љ –њ—А–Њ–±–ї–µ–Љ—Л —Е—А–Њ–љ–Є–Ј–∞—Ж–Є–Є –С–°, –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Є –љ–µ–њ—А–Є—П—В–љ—Л—Е –Њ—Й—Г—Й–µ–љ–Є–є, –Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ. –Э–µ–і–∞—А–Њ–Љ –≤ –∞–љ–≥–ї–Њ—П–Ј—Л—З–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ —В–µ—А–Љ–Є–љ treatment (–ї–µ—З–µ–љ–Є–µ) –Ј–∞–Љ–µ–љ—П–µ—В—Б—П –љ–∞ management pain (–≤–µ–і–µ–љ–Є–µ/—Г–њ—А–∞–≤–ї–µ–љ–Є–µ –±–Њ–ї—М—О). –Ю–і–љ–∞–Ї–Њ —Г –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Ж–µ–ї–Њ–є –њ–∞–ї–Є—В—А–Њ–є —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ–Є –Ї—А–Є—В–µ—А–Є—П–Љ–Є –≤—Л–±–Њ—А–∞ —Б—В–∞–љ–Њ–≤—П—В—Б—П –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П.
–°–∞–Љ—Л–Љ —З–∞—Б—В—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –Ї–∞–Ї –Њ—Б—В—А—Л—Е, —В–∞–Ї –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –С–° –≤ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Є –Љ–Є—А–Њ–≤–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —П–≤–ї—П—О—В—Б—П –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–Э–Я–Т–Я). –≠—В–Њ –Ї–Њ—А—А–µ—Б–њ–Њ–љ–і–Є—А—Г–µ—В –Є —Б –†–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –њ–Њ –≤–µ–і–µ–љ–Є—О —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є (An Updated Report by the American Society of Anesthesiologists Task Force on Chronic Pain Management and the American Society of Regional Anesthesia and Pain Medicine Anesthesiology, 2010). –Я—А–Є –≤—Л–±–Њ—А–µ –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –Э–Я–Т–Я –≤—А–∞—З –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –і–Њ–ї–ґ–µ–љ –≤–Ј–≤–µ—И–Є–≤–∞—В—М –≤—Б–µ —А–Є—Б–Ї–Є –Є –њ–Њ–ї—М–Ј—Г –Њ—В –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞.
–І–µ–Љ –ґ–µ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Б–µ–≥–Њ–і–љ—П –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є –Э–Я–Т–Я? –Ю—В–≤–µ—В, –Њ—З–µ–≤–Є–і–љ–Њ, –ї–µ–ґ–Є—В –≤ –Њ–±–ї–∞—Б—В–Є –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Э–∞–њ—А–Є–Љ–µ—А, —А–Є—Б–Ї –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ (–≤ —В. —З. –Э–Я–Т–Я-–≥–∞—Б—В—А–Њ–њ–∞—В–Є–Є) –µ—Б—В—М —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–і–µ–ї–µ–љ–Є–є –љ–µ–Њ—В–ї–Њ–ґ–љ–Њ–є –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є–Є. –Я—А–Є—З–µ–Љ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ—М—О, —Б–Њ—Б—В–∞–≤–ї—П—О—В –ї–Є—И—М –љ–µ–±–Њ–ї—М—И—Г—О —З–∞—Б—В—М –≤—Б–µ—Е –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є (–Ц–Ъ–Ъ) –≤ —Б—В—А—Г–Ї—В—Г—А–µ —Б–Љ–µ—А—В–µ–ї—М–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —П–≤–Є–≤—И–Є—Е—Б—П –њ—А–Є—З–Є–љ–Њ–є –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ (—А–Є—Б. 2).
![–†–Є—Б. 2. –°—В—А—Г–Ї—В—Г—А–∞ –ї–µ—В–∞–ї—М–љ—Л—Е –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є (–њ–Њ –і–∞–љ–љ—Л–Љ –њ–∞—В–Њ–ї–Њ–≥–Њ–∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є—Е –Ј–∞–Ї–ї—О—З–µ–љ–Є–є (–Ч–∞–є—А–∞—В—М—П–љ—Ж –Ю.–Т., –Т–µ—А—В–Ї–Є–љ –Р.–Ы. –Є —Б–Њ–∞–≤—В., 2006) [3] –†–Є—Б. 2. –°—В—А—Г–Ї—В—Г—А–∞ –ї–µ—В–∞–ї—М–љ—Л—Е –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є (–њ–Њ –і–∞–љ–љ—Л–Љ –њ–∞—В–Њ–ї–Њ–≥–Њ–∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є—Е –Ј–∞–Ї–ї—О—З–µ–љ–Є–є (–Ч–∞–є—А–∞—В—М—П–љ—Ж –Ю.–Т., –Т–µ—А—В–Ї–Є–љ –Р.–Ы. –Є —Б–Њ–∞–≤—В., 2006) [3]](/upload/medialibrary/e33/1683-2.png)
–Т —А—Г—В–Є–љ–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —Г —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е —А–Є—Б–Ї –Ц–Ъ–Ъ –љ–µ —Б—В—А–∞—В–Є—Д–Є—Ж–Є—А—Г–µ—В—Б—П, –Є–Љ –љ–µ –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –∞–і–µ–Ї–≤–∞—В–љ–∞—П –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–∞—П —В–µ—А–∞–њ–Є—П вАУ –љ–Є –≤ —Ж–µ–ї—П—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ц–Ъ–Ъ –љ–∞ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–Љ —Н—В–∞–њ–µ, –љ–Є –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–Є –Ш–С–° –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ. –Ш–≥—А–∞–µ—В —Б–≤–Њ—О —А–Њ–ї—М –Є –∞–Ї—В–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–∞–Љ–Є –њ—А–Є –Њ—Б—В—А–Њ–Љ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є –±–µ–Ј–∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Э–Я–Т–Я —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ —Б—А–Њ–Ї–Њ–≤ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є/–Є–ї–Є –Є—Е –і–Њ–Ј –Њ—Б—В–∞–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–є –≤–µ–і–µ–љ–Є—П –С–°.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –Є–Ј–Њ—Д–Њ—А–Љ —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л (–¶–Ю–У) –≤ —А–∞–Ј–≤–Є—В–Є–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Э–Я–Т–Я –њ—А–Є–≤–µ–ї–Є –Ї —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –Є –≤–љ–µ–і—А–µ–љ–Є—О –≤ —И–Є—А–Њ–Ї—Г—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г, –љ–∞—А—П–і—Г —Б ¬Ђ–Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–Љ–Є¬ї, –≤—Л—Б–Њ–Ї–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –¶–Ю–У-2 –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤. –≠—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –Љ–µ–љ—М—И—Г—О –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М. –Ю–і–љ–∞–Ї–Њ –њ–Њ—П–≤–Є–ї–Є—Б—М –і–∞–љ–љ—Л–µ –Њ –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е —А–Є—Б–Ї–∞—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤—Л—Б–Њ–Ї–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П VIGOR, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Б–Њ–њ–Њ—Б—В–∞–≤–ї—П–ї–Є—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞ –Є —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–±–∞ –≤ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–≥–Њ –∞—А—В—А–Є—В–∞, –Ј–∞—Б—В–∞–≤–Є–ї–Є –њ–µ—А–µ—Б–Љ–Њ—В—А–µ—В—М –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–µ –Њ —А–Њ–ї–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –¶–Ю–У-–Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤. –Т—Л—П—Б–љ–Є–ї–Њ—Б—М, —З—В–Њ –њ—А–Є –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Њ–є —З–∞—Б—В–Њ—В–µ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–±, —З–∞—Б—В–Њ—В–∞ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –≤ —Н—В–Њ–є –≥—А—Г–њ–њ–µ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 0,4% –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б 0,1% —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞ [4]. –Ґ–∞–Ї–ґ–µ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–±–∞ –≤—Л—П–≤–ї–µ–љ–Њ –Ј–љ–∞—З–Є–Љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–Є—Б–Ї–∞ –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ї–∞—В–∞—Б—В—А–Њ—Д –Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є APPROVe [5]. –Я–Њ—Н—В–Њ–Љ—Г –Є–љ—В–µ—А–µ—Б –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –Є –Ї–ї–Є–љ–Є—Ж–Є—Б—В–Њ–≤ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Э–Я–Т–Я –њ—А–Є –Њ—Б—В—А–Њ–є –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є —Б–Љ–µ—Й–∞–µ—В—Б—П –Ї –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—П–Љ –Ї–ї–∞—Б—Б–∞ —Б–Њ —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –¶–Ю–У. –Ю—Б–Њ–±–µ–љ–љ–Њ —Н—В–Њ –≤–∞–ґ–љ–Њ –і–ї—П –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ґ–∞–Ї–Є–Љ –Э–Я–Т–Я, –Њ–±–ї–∞–і–∞—О—Й–Є–Љ —Г–Ї–∞–Ј–∞–љ–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є, —П–≤–ї—П–µ—В—Б—П –ї–Њ—А–љ–Њ–Ї—Б–Є–Ї–∞–Љ, –Ї–Њ—В–Њ—А—Л–є —Б—З–Є—В–∞–µ—В—Б—П –Є –Њ–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –Љ–Њ—Й–љ—Л—Е –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –Э–Я–Т–Я. –Я–Њ –і–∞–љ–љ—Л–Љ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –ї–Њ—А–љ–Њ–Ї—Б–Є–Ї–∞–Љ –њ–Њ —Б–Є–ї–µ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–µ–≥–Њ –Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–Њ–≤ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –Ї–µ—В–Њ—А–Њ–ї–∞–Ї, –Ї–µ—В–Њ–њ—А–Њ—Д–µ–љ, —В—А–∞–Љ–∞–і–Њ–ї [6вАУ8].
–Х—Й–µ –Њ–і–љ–Є–Љ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ–Љ –ї–µ—З–µ–љ–Є—П –±–Њ–ї–Є –њ—А–Є–Ј–љ–∞–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –і–µ–є—Б—В–≤–Є–µ –Ї–Њ—В–Њ—А—Л—Е –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –Є –љ–∞ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —А–∞–Ј–≤–Є—В–Є—П, –Є –љ–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –С–°. –Ш—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –Ї–Њ—В–Њ—А—Л–µ –Њ–±–ї–∞–і–∞—О—В —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –∞ –Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–≤—П–Ј–∞–љ–∞ c –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –љ–∞ –Ї–ї—О—З–µ–≤—Л–µ –Ј–≤–µ–љ—М—П –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –С–°.
–Я–Њ–і–Њ–±–љ–Њ–є –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ—Б—В—М—О –і–µ–є—Б—В–≤–Є—П –њ—А–Є –±–Њ–ї—П—Е —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ –Њ–±–ї–∞–і–∞—О—В –љ–µ–є—А–Њ—В—А–Њ–њ–љ—Л–µ –≤–Є—В–∞–Љ–Є–љ—Л –≥—А—Г–њ–њ—Л B. –Ґ—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Ї —В–∞–Ї–Њ–≤—Л–Љ –Њ—В–љ–Њ—Б—П—В —В–Є–∞–Љ–Є–љ (B1), –њ–Є—А–Є–і–Њ–Ї—Б–Є–љ (–Т6), —Ж–Є–∞–љ–Њ–Ї–Њ–±–∞–ї–∞–Љ–Є–љ (B12). –Ю–±—К–µ–і–Є–љ—П–µ—В –Є—Е –≤ —Н—В—Г –≥—А—Г–њ–њ—Г –Ј–љ–∞—З–Є–Љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є. –Ш–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ –њ–Њ—В–µ–љ—Ж–Є—А–Њ–≤–∞–љ–Є–Є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Э–Я–Т–Я –≤–Є—В–∞–Љ–Є–љ–∞–Љ–Є –≥—А—Г–њ–њ—Л –Т –Є –Є—Е –≤—Л—Б–Њ–Ї–Њ–і–Њ–Ј–љ—Л–Љ–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П–Љ–Є [9]. –≠—В–Є –≤–Є—В–∞–Љ–Є–љ—Л —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В –њ—А–Њ—Ж–µ—Б—Б—Л, —Г–ї—Г—З—И–∞—О—Й–Є–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ —Д—Г–љ–Ї—Ж–Є–Є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є —Г–Љ–µ–љ—М—И–∞—О—Й–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–Њ–є –Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є. –Ґ–Є–∞–Љ–Є–љ –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Њ–±–Љ–µ–љ–µ –≥–ї—О–Ї–Њ–Ј—Л, —Г–ї—Г—З—И–∞—П –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –љ–µ–є—А–Њ–љ–Њ–≤. –Т –Љ–µ–Љ–±—А–∞–љ–∞—Е –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Њ–љ –Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г–µ—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є–Њ–љ–љ—Л—Е –Ї–∞–љ–∞–ї–Њ–≤, —Б–љ–Є–ґ–∞—П –њ–Њ–≤—Л—И–µ–љ–љ—Г—О –≤–Њ–Ј–±—Г–і–Є–Љ–Њ—Б—В—М –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—П —В–Њ—А–Љ–Њ–ґ–µ–љ–Є—О –±–Њ–ї–µ–≤–Њ–є –Є–Љ–њ—Г–ї—М—Б–∞—Ж–Є–Є –љ–∞ —Г—А–Њ–≤–љ–µ –Ј–∞–і–љ–Є—Е —А–Њ–≥–Њ–≤ —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є —В–∞–ї–∞–Љ—Г—Б–∞. –Я–Є—А–Є–і–Њ–Ї—Б–Є–љ —П–≤–ї—П–µ—В—Б—П –Ї–ї—О—З–µ–≤—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ —Б–Є–љ—В–µ–Ј–∞ –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤-–љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А–Њ–≤: –∞–і—А–µ–љ–∞–ї–Є–љ–∞, –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–∞, –і–Њ–њ–∞–Љ–Є–љ–∞ –Є —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞. –Т–Є—В–∞–Љ–Є–љ –Т12 —Г—З–∞—Б—В–≤—Г–µ—В –≤ –Њ–±–Љ–µ–љ–µ –ґ–Є—А–Њ–≤ –Є –љ—Г–Ї–ї–µ–Є–љ–Њ–≤—Л—Е –Ї–Є—Б–ї–Њ—В, —З—В–Њ —В–∞–Ї–ґ–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ—А–Њ—Ж–µ—Б—Б–∞–Љ —А–µ–≥–µ–љ–µ—А–∞—Ж–Є–Є –≤ —В–Ї–∞–љ–Є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Т–Є—В–∞–Љ–Є–љ –Т12 –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–љ–Њ–Љ –Њ–±–Љ–µ–љ–µ, —Б–Є–љ—В–µ–Ј–µ –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ–∞, –∞ —В–∞–Ї–ґ–µ –≤ –њ—А–Њ—Ж–µ—Б—Б–∞—Е –Љ–Є–µ–ї–Є–љ–Є–Ј–∞—Ж–Є–Є –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Ж–Є–∞–љ–Њ–Ї–Њ–±–∞–ї–∞–Љ–Є–љ —Г–ї—Г—З—И–∞–µ—В –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —Б–Є–≥–љ–∞–ї–∞ –њ–Њ –љ–µ—А–≤–љ—Л–Љ –≤–Њ–ї–Њ–Ї–љ–∞–Љ, –∞ —В–∞–Ї–ґ–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Є—Е —Б—В—А—Г–Ї—В—Г—А–љ–Њ-—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є —А–µ–≥–µ–љ–µ—А–∞—Ж–Є–Є.
–†–∞–љ–µ–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Њ—Б—М –њ–Њ–њ–µ—А–µ–Љ–µ–љ–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ —А–∞—Б—В–≤–Њ—А–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Т1, –Т6 –Є –Т12 —З–µ—А–µ–Ј –і–µ–љ—М —Б —З–µ—А–µ–і–Њ–≤–∞–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ 2вАУ4 –љ–µ–і. –Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л —Б—В–∞–ї–Є –∞–Ї—В–Є–≤–љ–Њ –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П —В—А–µ—Е–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ—Л–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б—Л, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Т1, –Т6 –Є –Т12 –≤ 1 —В–∞–±–ї–µ—В–Ї–µ –Є–ї–Є –∞–Љ–њ—Г–ї–µ [10, 11]. –Я—А–Є–Љ–µ—А–Њ–Љ –Њ—Д–Є—Ж–Є–љ–∞–ї—М–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —В–∞–Ї–Њ–≥–Њ —А–Њ–і–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В –Э–µ–є—А–Њ–±–Є–Њ–љ.
–Т —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П, –Є –Њ—В–і–µ–ї—М–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –≤–Є—В–∞–Љ–Є–љ–Њ–≤ B1, –Т6 –Є –Т12 –Њ–±–ї–∞–і–∞—О—В –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–Љ [12]. –Я–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –∞–љ—В–Є–љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В —В–∞–Ї–Њ–≥–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Б–Є–љ—В–µ–Ј–∞ –Є/–Є–ї–Є –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–Є–µ–Љ –і–µ–є—Б—В–≤–Є—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ [13]. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –≥—А—Г–њ–њ—Л –Т —Г—Б–Є–ї–Є–≤–∞–µ—В –і–µ–є—Б—В–≤–Є–µ –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–∞ –Є —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ вАУ –≥–ї–∞–≤–љ—Л—Е ¬Ђ–∞–љ—В–Є–љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л—Е¬ї –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤. –Я–Њ—В–µ–љ—Ж–Є—А—Г—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –≥—А—Г–њ–њ—Л –Т –њ—А–Є –Є–љ—В–µ–љ—Б–Є–≤–љ—Л—Е –±–Њ–ї—П—Е –≤ —Б–њ–Є–љ–µ –љ–∞ –∞–љ—В–Є–љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –Э–Я–Т–Я –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –≤ —А—П–і–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [14вАУ16].
–Ю–і–љ–Є–Љ –Є–Ј –Ї—А—Г–њ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –і–∞–љ–љ–Њ–Љ—Г –≤–Њ–њ—А–Њ—Б—Г, —Б—В–∞–ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ DOLOR [17]. –С—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –љ–µ–є—А–Њ—В—А–Њ–њ–љ—Л—Е –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є –Э–Я–Т–Я –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–ї–∞ –±–Њ–ї–µ–µ –Љ–Њ—Й–љ–Њ–µ –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ, –∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є–ї–∞ —В–∞–Ї–Њ–≤—Г—О –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Э–Я–Т–Я. –Э–µ –≤—Л—П–≤–ї–µ–љ–Њ —А–∞–Ј–ї–Є—З–Є–є –≤ –њ—А–Њ—Д–Є–ї–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Љ–µ–ґ–і—Г –і–≤—Г–Љ—П –≥—А—Г–њ–њ–∞–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ю—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Э–Я–Т–Я –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –љ–µ–є—А–Њ—В—А–Њ–њ–љ—Л—Е –≤–Є—В–∞–Љ–Є–љ–Њ–≤ —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є. –Т–∞—А–Є–∞–љ—В–Њ–Љ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —В–∞–Ї–Њ–≥–Њ —А–Њ–і–∞ —П–≤–ї—П–µ—В—Б—П —Б–Њ—З–µ—В–∞–љ–Є–µ –ї–Њ—А–љ–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –Є –Э–µ–є—А–Њ–±–Є–Њ–љ–∞. –≠—В–∞ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ–њ—А–∞–≤–і–∞–љ–љ–∞ –њ—А–Є —Б–Љ–µ—И–∞–љ–љ–Њ–є –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–Є—А–Њ–і–µ –С–° (–њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–Њ–є –Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є —Б–Њ—Б—В–∞–≤–ї—П—О—Й–µ–є). –≠—В–∞ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Г—Б–Є–ї–Є—В—М –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–Є–є —Н—Д—Д–µ–Ї—В –ї–Њ—А–љ–Њ–Ї—Б–Є–Ї–∞–Љ–∞, —Г–Љ–µ–љ—М—И–Є—В—М —Б—А–Њ–Ї–Є –Є –њ–Њ–≤—Л—Б–Є—В—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –С–°.
–Э–∞—И –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ–Њ–і–Њ–±–љ—Л—Е —Б—Е–µ–Љ –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ –љ–∞–±–ї—О–і–µ–љ–Є–Є 90 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Њ–±—А–∞—В–Є–≤—И–Є—Е—Б—П –Ј–∞ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й—М—О –њ–Њ –њ–Њ–≤–Њ–і—Г –±–Њ–ї–µ–є –≤ –љ–Є–ґ–љ–µ–є —З–∞—Б—В–Є —Б–њ–Є–љ—Л. –£ –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є—Б–Ї–ї—О—З–∞–ї–Є—Б—М –Ј–љ–∞—З–Є–Љ—Л–µ –њ—А–Є—З–Є–љ—Л –±–Њ–ї–µ–є –≤ –љ–Є–ґ–љ–µ–є —З–∞—Б—В–Є —Б–њ–Є–љ—Л: –∞–љ–µ–≤—А–Є–Ј–Љ–∞ –±—А—О—И–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –∞–Њ—А—В—Л, –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П —В–µ–ї –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤, –Њ—Б—В–µ–Њ–њ–Њ—А–Њ—В–Є—З–µ—Б–Ї–Є–µ –њ–µ—А–µ–ї–Њ–Љ—Л, –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –Є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј. –£ –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є—Б–Ї–ї—О—З–µ–љ–Њ –љ–∞–ї–Є—З–Є–µ –≥—А—Л–ґ–Є –Љ–µ–ґ–њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Њ–≥–Њ –і–Є—Б–Ї–∞.
–Я–∞—Ж–Є–µ–љ—В—Л –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –≤ 3 –≥—А—Г–њ–њ—Л –њ–Њ 30 —З–µ–ї–Њ–≤–µ–Ї (—В–∞–±–ї. 1).
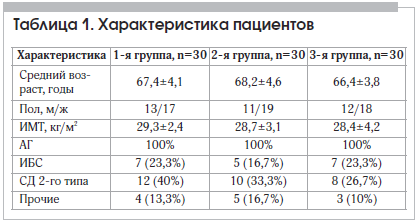
–Я–∞—Ж–Є–µ–љ—В—Л –≤ –≥—А—Г–њ–њ–∞—Е –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –њ–Њ –≤–Њ–Ј—А–∞—Б—В—Г, –њ–Њ–ї—Г, –Є–љ–і–µ–Ї—Б—Г –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ш–Ь–Ґ), –Њ—Б–љ–Њ–≤–љ—Л–Љ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ. –£ –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤—Л—П–≤–ї–µ–љ–∞ –Ї–Њ–Љ–Њ—А–±–Є–і–љ–∞—П —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П, —З—В–Њ –±—Л–ї–Њ –Ї–ї—О—З–µ–≤—Л–Љ –Љ–∞—А–Ї–µ—А–Њ–Љ –і–ї—П –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –њ–Њ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–Є –≤ –≥—А—Г–њ–њ–∞—Е –њ–Њ –≤–Є–Ј—Г–∞–ї—М–љ–Њ–є –∞–љ–∞–ї–Њ–≥–Њ–≤–Њ–є —И–Ї–∞–ї–µ (–Т–Р–®) –≤ –Љ–Њ–Љ–µ–љ—В –Њ–±—А–∞—Й–µ–љ–Є—П –Ї –≤—А–∞—З—Г –љ–µ –±—Л–ї–Њ. –£ –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М, –∞ —В–µ–Ї—Г—Й–Є–є —А–µ—Ж–Є–і–Є–≤ –±–Њ–ї–Є вАУ –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ —З–µ—В–≤–µ—А—В—Л–є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ.
–Ґ–µ—А–∞–њ–Є—П –≤ –≥—А—Г–њ–њ–∞—Е —Б—А–∞–≤–љ–µ–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 2.

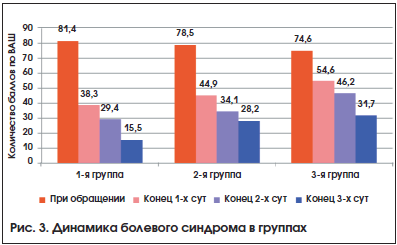
–Т –Ї–∞—З–µ—Б—В–≤–µ –Ї—А–Є—В–µ—А–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –С–° –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–∞ –Њ—Ж–µ–љ–Ї–∞ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–Є –њ–Њ –Т–Р–®: –њ—А–Є –Њ–±—А–∞—Й–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞ –Є –≤ –Ї–Њ–љ—Ж–µ 1вАУ3-—Е —Б—Г—В —В–µ—А–∞–њ–Є–Є. –Ґ–∞–Ї–ґ–µ –Њ—Ж–µ–љ–µ–љ–∞ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —А–µ—Ж–Є–і–Є–≤–∞ –±–Њ–ї–Є: –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –і–љ–µ–є –Њ—В –і–µ–±—О—В–∞ –С–° –і–Њ –µ–≥–Њ –њ–Њ–ї–љ–Њ–≥–Њ –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—П.
–Т–Њ –≤—Б–µ—Е –≥—А—Г–њ–њ–∞—Е –Ї –Ї–Њ–љ—Ж—Г 1-—Е —Б—Г—В –ї–µ—З–µ–љ–Є—П –і–Њ—Б—В–Є–≥–љ—Г—В —А–µ–≥—А–µ—Б—Б –С–°. –Ъ –Ї–Њ–љ—Ж—Г 3-—Е —Б—Г—В –≤–Њ –≤—Б–µ—Е –≥—А—Г–њ–њ–∞—Е –і–Є–љ–∞–Љ–Є–Ї–∞ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –±–Њ–ї–Є —Б—В–∞–љ–Њ–≤–Є–ї–∞—Б—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–є (—А–Є—Б. 3). –Ю–і–љ–∞–Ї–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 1-–є –≥—А—Г–њ–њ—Л –Ї –Ї–Њ–љ—Ж—Г 1-—Е —Б—Г—В –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –±–Њ–ї–Є –±—Л–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Љ–µ–љ—М—И–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О c –≥—А—Г–њ–њ–∞–Љ–Є 2 –Є 3. –Р–љ–∞–ї–Њ–≥–Є—З–љ–∞—П —В–µ–љ–і–µ–љ—Ж–Є—П —Б–Њ—Е—А–∞–љ–Є–ї–∞—Б—М –Є –і–∞–ї–µ–µ, –Ї –Ї–Њ–љ—Ж—Г 3-—Е —Б—Г—В —В–µ—А–∞–њ–Є–Є (—А<0,05 –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –≥—А—Г–њ–њ–∞–Љ–Є 2 –Є 3).
–Я—А–Є –Њ—Ж–µ–љ–Ї–µ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —А–µ—Ж–Є–і–Є–≤–∞ –С–° –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –љ–∞–Є–Љ–µ–љ—М—И–Є–є —Б—А–Њ–Ї –≤—Л—П–≤–ї–µ–љ –≤ 1-–є –≥—А—Г–њ–њ–µ (—А–Є—Б. 4), —Б–Њ—Б—В–∞–≤–Є–≤ –≤ —Б—А–µ–і–љ–µ–Љ 11,4¬±2,3 –і–љ—П, –∞ –≤ 3-–є –≥—А—Г–њ–њ–µ вАУ 17,2¬±5,3 (—А<0,05).

–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞—И–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –≤–Ї–ї—О—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –Э–µ–є—А–Њ–±–Є–Њ–љ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ c –±–Њ–ї—М—О –≤ –љ–Є–ґ–љ–µ–є —З–∞—Б—В–Є —Б–њ–Є–љ—Л –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –±–Њ–ї–µ–µ –±—Л—Б—В—А—Л–є –Є –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–Њ–Ї—А–∞—Й–µ–љ–Є—О –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —А–µ—Ж–Є–і–Є–≤–∞ –±–Њ–ї–Є.
–Ф–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В –Ї–Њ–љ—Ж–µ–њ—Ж–Є—О –њ–Њ—В–µ–љ—Ж–Є—А–Њ–≤–∞–љ–Є—П –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є—П –Э–Я–Т–Я –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П–Љ–Є –љ–µ–є—А–Њ—В—А–Њ–њ–љ—Л—Е –≤–Є—В–∞–Љ–Є–љ–Њ–≤. –°—В—А–∞—В–µ–≥–Є—П –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–Њ–Ї—А–∞—Й–∞—В—М —Б—А–Њ–Ї–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Э–Я–Т–Я, —З—В–Њ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б –±–Њ–ї—М—И–µ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М—О, —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є –њ—А–Є –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–Є –С–° —Г –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤.








.gif)



