Введение
Муковисцидоз (МВ) — это самое частое полиорганное моногенное заболевание с большой генетической и фенотипической гетерогенностью. Симптоматика развивается вследствие мутаций в гене МВТР (муковисцидозный трансмембранный регулятор проводимости) [1], который является хлорным каналом на поверхности эпителиальных клеток [2]. На сегодняшний день в гене МВТР выявлено более 2100 мутаций [3, 4]. У большинства больных развиваются хроническое поражение бронхолегочной системы, экзокринная недостаточность поджелудочной железы и повышение уровня хлоридов потовой жидкости [5]. Гетерогенность клинической картины вызвана не только гетерогенностью аллелей гена, но и эффектами других модифицирующих генов и факторов окружающей среды [6, 7]. Так, тяжесть поражения дыхательной системы разнится даже среди гомозигот по мутации F508del [7–9].
Предыдущие исследования показали связь «тяжелых» генотипов с типичной полиорганной формой МВ, тогда как «мягкие» варианты коррелируют со стертыми (в основном легочными) вариантами и/или манифестацией в позднем возрасте [10].
В последние несколько лет регистрируется увеличение количества взрослых больных МВ: в 2020 г. в Регистре пациентов с МВ в Российской Федерации (далее — Регистр) состояло 986 взрослых больных, из них 37% с «мягким» генотипом [11], однако корреляция генотипа и фенотипа остается недостаточно изученной. Исследование этой зависимости позволит прогнозировать тяжесть течения МВ и повысить качество терапии. Именно тяжесть поражения бронхолегочной системы является причиной летальности больных МВ [12].
Цель исследования: представить гено- и фено-типическую характеристику взрослой когорты больных МВ в Санкт-Петербурге и установить влияние тяжести генотипа и чувствительности к карбапенемам штаммов Achromobacter xylosoxidans на динамику нутритивного и функционального статуса взрослых пациентов с МВ.
Материал и методы
Изучены генотипы и клинико-функциональные данные 54 больных МВ Санкт-Петербурга, наблюдавшихся в СПб ГБУЗ «ГМПБ № 2». Использованы данные пациентов в соответствии с подписанным добровольным информированным согласием. Клиническая картина, положительная потовая проба и генотип из двух патогенных мутаций МВТР были основанием установления диагноза1. Для генетического подтверждения диагноза использовали реакцию ПЦР и секвенирование гена МВТР.
Пациенты разделены на 2 группы в зависимости от тяжести мутации. В группу «тяжелого» генотипа включены больные с двумя мутациями I–III класса, к «мягкому» генотипу — с наличием хотя бы одной мутации IV–VI класса.
Выделена подгруппа из 15 пациентов с МВ с хроническим инфицированием резистентным к карбапенемам штаммом A. xylosoxidans.
Нутритивный статус определялся как лучший за год индекс массы тела (ИМТ). Функциональный статус оценивался по лучшему за год показателю объема форсированного выдоха за 1-ю секунду (ОФВ1).
Забор мокроты, транспортировка образцов биоматериала и микробиологические методы исследования проводились согласно методическим рекомендациям2. Результаты культуральных посевов образцов мокроты подтверждены на масс-спектрометре MALDI-TOF.
Статистический анализ полученных данных проведен с помощью языка программирования Python. Результаты представлены в виде средних значений ± стандартное отклонение или ошибка средней арифметической. После определения нормальности распределения по Колмогорову — Смирнову статистическая обработка проводилась с помощью критериев Манна — Уитни и Фишера для непараметрических переменных и критерия Стьюдента для параметрических переменных. Показатели считались статистически значимыми при уровне значимости p<0,05.
Результаты и обсуждение
Охват генетическим обследованием в Санкт-Петербурге самый высокий в РФ и, согласно Регистру, составил в 2021 г. 99%. При анализе генетического статуса пациентов закономерно преобладание «тяжелых» генотипов (n=30 (55,6%)), однако доля «мягких» генотипов (n=24 (45,4%)) в регионе оказалась выше среднего показателя по Регистру (36%).
Средний возраст диагностики заболевания у пациентов с «мягким» генотипом — 20,36±2,18 года, что статистически значимо выше (p=0,042), чем в группе с «тяжелым» генотипом (6,27±1,53 года).
Отмечено большое разнообразие «мягких» мутаций у больных МВ в Санкт-Петербурге и Ленинградской области по сравнению с другими регионами. Среди обследованных преобладали мутации F508del / не F508del (n=34 (63,4%)), далее следовали мутации не F508del / не F508del (n=14 (25%)), и самую малую группу составили пациенты с генотипом гомозиготы по F508del (n=7 (11,6%)). «Мягкий» генотип у взрослых пациентов с МВ в Санкт-Петербурге характеризуется значительным разнообразием: 59% взрослых пациентов обладают уникальным для региона «мягким» генотипом — D1152H, L1093P, p.Lys1468Asn, F1286S, Q98R, 2789+5G>A , E217G.
При распределении генотипа по возрастам отмечено уменьшение количества гомозигот по F508del в возрасте до 30 лет, что связано со смертью части пациентов. Генотипы F508del / не F508del представлены в среднем на одном уровне во всех группах наблюдения. Исключение составляет малочисленная группа пациентов в возрасте от 36 лет до 41 года, у которых представлены только генотипы не F508del / не F508del.
В Регистре [11] в 2019 г. доля взрослых пациентов из Санкт-Петербурга составила 27,6%, а общая доля таких пациентов из Санкт-Петербурга среди всех российских больных — 5,1%, это второй показатель после Москвы. Количество взрослых пациентов с МВ в регионе выросло с 26 до 54, в 2,19 раза (на 119%) за 6 лет (с 2016 по 2021 г). Рост числа взрослых пациентов с МВ происходил как за счет передачи больных МВ из детского Центра, так и за счет выявления не диагностированного ранее МВ у пациентов уже во взрослом возрасте. Наибольшие темпы прироста пациентов наблюдались в 2018 г. (+10 пациентов), 2019 г. (+8 пациентов) и 2020 г. (+8 пациентов). При оценке динамики возрастной структуры по годам отмечен неуклонный рост среднего возраста взрослых пациентов с 26,78±1,71 года в 2016 г. до 31,33±1,33 года в 2021 г. Необходимо отметить, что выросла также медиана возраста пациентов с 24 до 29 лет в те же годы. Надо отметить, что 2 пациента были пенсионного возраста 62 и 64 лет. Среди исследованных больных мужчины составляли 55% (n=30), женщины — 45% (n=24).
Большинству пациентов диагноз был установлен в детском возрасте: средний возраст установления диагноза составил 11 лет, медиана — 8,69 года. В группе «тяжелых» мутаций средний возраст выявления заболевания был меньше и составил 3,44 года, в то время как в группе «мягких» мутаций — 11,58 года. Также обращает на себя внимание значительный разброс возраста выявления заболевания от 0 до 39,6–43 лет в обеих исследуемых группах. Однако возраст верификации диагноза достоверно отличался в группах с «тяжелыми» и «мягкими» мутациями.
Наиболее стабильной по численности была группа пациентов в возрасте 18–23 лет, другие диапазоны возрастов демонстрировали увеличение численности пациентов ежегодно, особенно группа пациентов в возрасте от 42 лет. При анализе динамики возрастной структуры по годам (рис. 1) отмечено увеличение возраста пациентов большинства наблюдаемых групп. Так, в 2016 г. наблюдалась группа пациентов 18–29 лет, к 2021 г. возраст увеличился и составил 18–35 лет. Таким образом, несмотря на ежегодный прирост пациентов за счет перехода из детской сети (младший пациент выборок сохраняется в возрастном диапазоне 18–19 лет), ежегодно пропорционально растет и основной пул взрослых пациентов 22–32 лет.

Это нарастание числа взрослых больных доказывает улучшение оказания медицинской помощи больным МВ, что ведет к повышению их выживаемости (увеличение числа перешедших из детской сети во взрослую), и улучшение диагностики — повышение верификации МВ во взрослом возрасте.
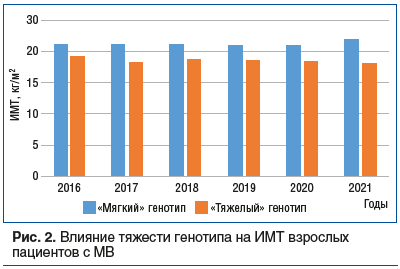
Нутритивный статус исследуемых пациентов не подвергся убедительным изменениям: медиана значений ИМТ (кг/м2) оставалась примерно одинаковой за период наблюдения: 20,71 (2016 г.), 18,1 (2017 г.), 19,45 (2018 г.), 19,60 (2019 г.), 19,67 (2020 г.), 20,23 (2021 г.).
В группе пациентов с «мягким» генотипом за время наблюдения сохранялся более высокий ИМТ (кг/м2), чем в группе с «тяжелыми» мутациями: в 2016 г. 21,14±3,55 против 19,28±3,13 (p=0,163); в 2017 г. 21,27±3,43 против 18,31±2,05 соответственно (p=0,123); в 2018 г. 21,17±4,00 против 18,80±2,12 соответственно (p=0,025); в 2019 г. 21,01±4,20 против 18,55±2,53 соответственно (p=0,049); в 2020 г. 20,94±4,12 против 18,41±2,15 (p=0,050). Таким образом, за последние 3 года ИМТ существенно различался в двух группах. Пациенты с «мягкими» мутациями имели достоверно более высокий ИМТ (в среднем на 2 кг/м2) во все года наблюдения, чем пациенты с «тяжелыми» мутациями (рис. 2).
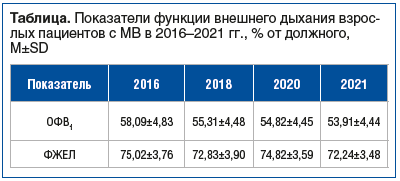
При оценке респираторной функции по показателю ОФВ1 отмечено прогрессивное уменьшение среднего показателя с 58,09% (2018 г.) до 53,91% (2021 г.) для всех пациентов вне зависимости от генотипа. В то время как среднее значение показателя форсированной жизненной емкости легких (ФЖЕЛ) изменилось менее значительно — с 75,02% (2018 г.) до 72,24% (2021 г.) (см. таблицу).
Генотип оказывает влияние на выживаемость пациентов: наблюдается рост количества пациентов с «мягкими» мутациями в возрастных группах 24–29 лет и 30–35 лет, в то время как в группе «тяжелых» мутаций происходит снижение количества пациентов: с 14 в группе 24–29 лет до 0 в группе старше 39 лет. Также в группе «мягких» мутаций средний возраст взрослых пациентов оказался выше — 31,6 года против 28,3 года в группе «тяжелых» мутаций.
Мониторинг динамики микрофлоры за исследуемый период показал ведущую роль хронической колонизации Pseudomonas aeruginosa (50,0–54,1% пациентов). Анализ интермиттирующей синегнойной инфекции показал постепенное ее снижение с 16,6 до 8,3%, что характерно для взрослых пациентов с МВ. Необходимо отметить, что за последние 5 лет увеличилась выявлеяемость A. xylosoxidans с 16,6 до 37,5%. Общая доля неферментирующих грамотрицательных бактерий из всех выделенных изолятов составила 49,9%. Доля Achromobacter spp. составила 9,8%, что является самым высоким показателем в сравнении с другими регионами РФ. Согласно данным литературы распространенность A. xylosoxidans среди пациентов с МВ в последние годы во всем мире увеличивается3. Доля выявления Burkholderia spp. была меньше и составила максимально 16,6%, а доля выявления MRSA была одинакова у всех на протяжении наблюдения, возбудитель стабильно высевался у 8,3% пациентов.
Большая часть пациентов с хроническим инфицированием P. aeruginosa mucoid и A. xylosoxidans имели «тяжелый» генотип (71,4 и 64,2% соответственно), в то время как пациенты с немукоидным штаммом P. aeruginosa имели «тяжелый» генотип только в 37,5% случаев, что достоверно ниже, чем в других двух группах (p<0,05).
Прогрессия применения антибиотиков может быть одним из факторов, повышающих персистенцию резистентных микроорганизмов. Для оценки региональных особенностей проведен анализ чувствительности изолятов синегнойной инфекции и A. xylosoxidans к тобрамицину и карбапенемам соответственно. Тобрамицин является стандартным антисепдомональным антибиотиком, но его эффективность снижается из-за ограниченной проницаемости биопленки. Значительная доля (90,8%) штаммов P. aeruginosa оказалась чувствительной к тобрамицину. Мукоидные штаммы P. aeruginosa показали меньшую чувствительность, чем немукоидные, однако оказались в 86,7% случаев чувствительны к тобрамицину.
При сравнительном анализе чувствительность A. xylosoxidans к карбапенемам в период 2016–2018 гг. была на уровне 50–53,8%, но в последующих 2019 и 2020 гг. значительно снизилась до 37,5 и 30,7% соответственно.
Группа резистентного штамма быстрее теряла уровень ОФВ1 (p<0,05) ежегодно в течение 6 лет в сравнении с группой чувствительного штамма [13].
Назначаемая согласно клиническим рекомендациям многокомпонентная терапия МВ обусловила значительное продление и повышение качества жизни больных, что привело к увеличению количества взрослых пациентов. В настоящее время микробное поражение дыхательной системы в основном определяет тяжесть течения заболевания. Современная антибактериальная терапия меняет как статус пациента, так и характер микробиома хронического воспаления в легких, что заставляет оперативно проводить мониторинг микробиома и его чувствительности к антибиотикам, динамики микробного процесса в легких и модифицировать терапию.
В литературе подчеркивается, что во всем мире у больных МВ в последние годы особую значимость приобретает A. xylosoxidans3. В 2020 г., по данным Регистра, частота выявления этой инфекции у взрослых достигла 14,6%. Среди наших наблюдаемых пациентов выявление A. xylosoxidans возросло с 9,8 до 20%.
Несмотря на значимо более позднее (в среднем на 14 лет) установление диагноза и начало терапии, продолжительность жизни пациентов с «мягким» генотипом оказалась выше, чем с «тяжелым». У больных МВ с «мягкими» мутациями отмечался более высокий нутритивный статус и не регистрировалось достоверного снижения ОФВ1 в динамике. Функциональные нарушения у больных с «тяжелым» генотипом прогрессировали вплоть до крайне тяжелой дыхательной недостаточности. Полученные результаты согласуются с данными литературы [4]. Отмеченный в исследовании двукратный рост инфицирования A. xylosoxidans сопровождался снижением чувствительности возбудителя к карбапенемам.
Заключение
Изучение особенностей генотипов взрослых пациентов с МВ и выявление корреляции клинических и функциональных показателей в зависимости от спектра патогенной микрофлоры у различных по аллельным вариантам генотипов в исследуемых группах дадут возможность совершенствовать терапевтические и санитарно-эпидемиологические меры для снижения обсеменения больных и повышения продолжительности и качества их жизни. Мониторинг антибиотикоустойчивости клинически значимых неферментирующих грам-отрицательных бактерий поможет оптимизировать схемы противомикробной терапии.
1Кистозный фиброз (муковисцидоз). Клинические рекомендации.2021. (Электронный ресурс.) URL:https://cr.minzdrav.gov.ru/recomend/372_2 (дата обращения: 01.02.2024).
2Техника сбора и транспортирования биоматериалов в микробиологические лаборатории: Методические указания . М .: Федеральный центр гигиены и эпидемиологии Роспотребнадзора; 2006. (Электронный ресурс.) URL:https://ohranatruda.ru/upload/iblock/b8a/4293758559.pdf. (дата обращения: 01.02.2024).
3European Cystic Fibrosis Society.ECFS patient registry annual data report. (Electronic resource.) URL: https://www.ecfs.eu/sites/default/files/ECFSPR_Report_2020 _v1 .0 (access date: 02.02.2024).












