Широкое применение ингаляционной терапии стимулировало создание разнообразных устройств для эффективной доставки препаратов к точке их действия. Лекарственные препараты для ингаляций выпускают в виде растворов для небулайзеров, дозированных аэрозольных ингаляторов (ДАИ) в баллончиках под давлением, содержащих пропеллент (вещество–носитель), и порошковых ингаляторов.
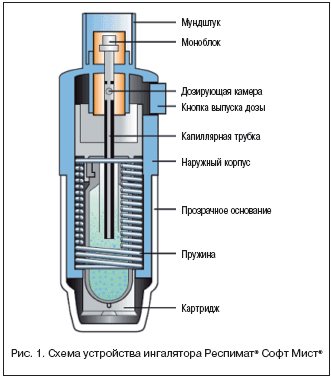
Одной из последних технических новинок в области ингаляционной терапии стал Респимат® Софт Мист® – устройство, позволяющее получить ультратонкодисперсный «мягкий» аэрозоль (soft–mist) [1,2]. Ингалятор Респимат® Софт Мист®, разработанный компанией Boehringer Ingelheim, функционирует за счет механической энергии, генерируемой сжимаемой пружиной, не нуждается в источнике питания и не содержит пропеллента. Схема устройства ингалятора Респимат® Софт Мист® показана на рисунке 1.
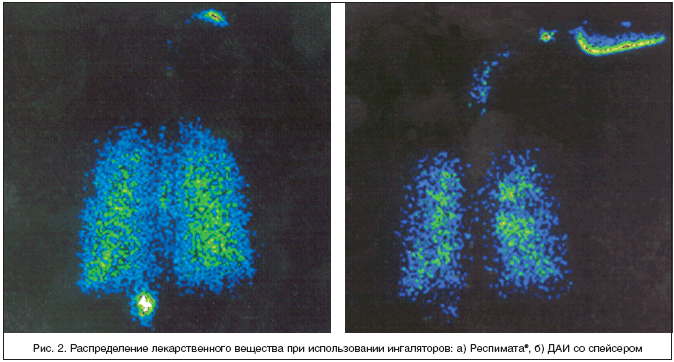
Раствор для ингаляции содержится в картридже вместимостью 4,5 мл, соединенном через капиллярную трубку с моноблоком – ключевым элементом, который производит аэрозоль. Отмеренный объем (14,9 мкл) жидкости высвобождается из дозирующей камеры, когда пружина давит на микроклапан. Фракция частиц аэрозоля размерами менее 5,8 мкм в диаметре составляет 65% дозы, что в 2,5 раза выше аналогичного показателя при использовании ДАИ и обусловливает лучшую доставку действующего вещества в легкие (рис. 2).
По сравнению с другими существующими в настоящее время ингаляторами Респимат® Софт Мист® обладает целым рядом преимуществ. Он обеспечивает:
• генерацию медленно перемещающегося и длительно существующего аэрозольного облака, что позволяет улучшить координацию с дыханием;
• высокую фракцию мелких частиц (65% дозы составляют частицы размерами <5,8 мкм);
• возможность отказаться от использования пропеллента;
• высокий уровень депонирования препарата в легких и его незначительное осаждение в ротоглотке;
• возможность снизить дозу препарата за счет улучшения его доставки в организм;
• стабильную доставку в организм одинаковых доз в течение всего срока годности;
• снижение частоты парадоксального бронхоспазма, вызываемого вспомогательными веществами.
Респимат® Софт Мист® можно использовать при проведении искусственной вентиляции легких (ИВЛ). В эксперименте было показано, что включенный в контур ИВЛ Респимат® Софт Мист® позволяет добиться более высокого уровня депонирования фракции мелких частиц в легких, чем ДАИ [3].
Первоначально ингалятор Респимат® Софт Мист® был использован с комбинацией бронходилататоров короткого действия – антихолинергика ипратропия и β–агониста фенотерола (беродуала). Сравнительные исследования препарата в ДАИ и ингаляторе Респимат® показали, что последний позволял добиться скорости распыления в 5 раз меньшей, а времени распыления – в 10 раз большего, что характеризовало высокую стойкость производимого аэрозоля. Аналогичное сравнение фенотерола показало, что ингалятор Респимат® обеспечивал депонирование в легких 39,2% препарата, а в ротоглотке – 37,1%, в то время как ДАИ – 11 и 71,7% соответственно.
Применение комбинации бронходилататоров ипратропия и фенотерола (беродуала) в ингаляторе Респимат® показало хорошие результаты, и следующим шагом стало создание ингалятора Спирива® Респимат®, содержащего в качестве действующего вещества тиотропий – бронходилататор длительного антихолинергического действия.
Ингаляционным бронходилататорам длительного действия принадлежит центральное место в лечении ХОБЛ [4]. В истекшем десятилетии был накоплен богатый опыт применения длительно действующих антихолинергических средств, β–агонистов и их комбинаций в качестве поддерживающей терапии пациентов с ХОБЛ. Многочисленные международные крупномасштабные длительные исследования, проведенные по правилам доказательной медицины, показали, что тиотропий имел существенные преимущества перед другими бронходилататорами длительного действия. Его применение у больных ХОБЛ II–IV стадий по 18 мкг 1 раз/сут. в виде порошкового ингалятора на протяжении до 4 лет стойко и достоверно улучшало показатели проходимости дыхательных путей, качества жизни, уменьшало частоту и тяжесть обострений ХОБЛ, потребность в госпитализации пациентов по поводу обострений и, наконец, смертность [5–7].
В рамках программы клинической разработки ингалятора Спирива® Респимат® Софт Мист® были проведены 9 клинических испытаний.
В клинических испытаниях фазы I оценивали клиническую безопасность, переносимость и фармакокинетику широкого диапазона доз препарата у здоровых добровольцев. Было установлено, что тиотропий, вдыхаемый ежедневно 1 раз/сут. через ингалятор Респимат® Софт Мист® в дозах до 40 мкг, не оказывал влияния на артериальное давление, частоту пульса, частоту дыхания, ЭКГ и стандартные лабораторные показатели. Единственными неблагоприятными реакциями были сухость во рту, слизистой носа и горла в группе пациентов, получавших максимальную дозу 40 мкг, вследствие снижения слюноотделения.
Специальное исследование проводили для оценки опасности попадания тиотропия в глаза при неправильном использовании ингалятора Респимат® Софт Мист®. Однократное введение в глаза как плацебо, так и высоких доз тиотропия с помощью упомянутого ингалятора не влияло на внутриглазное давление, аккомодацию, диаметр и рефлекс зрачка [8].
Наблюдение за 1990 пациентами с ХОБЛ, на протяжении 48 нед. получавших 5–10 мкг тиотропия или плацебо с помощью ингалятора Респимат® Софт Мист®, показало, что случаи парадоксального бронхоспазма были очень редки и чаще возникали у пациентов, получавших плацебо, чем у пациентов, получавших тиотропий [9].
В исследовании фазы II у пациентов с ХОБЛ определяли фармакодинамические и фармакокинетические профили тиотропия в дозах 1,25; 2,5; 5; 10 и 20 мкг, доставлявшихся с помощью Респимат® Софт Мист®, по сравнению с порошковой формой Спирива® ХэндиХалер® 18 мкг и плацебо (в виде ингаляторов Респимат® Софт Мист® и ХэндиХалер®).
Ежедневное однократное применение тиотропия в дозах 5, 10 и 20 мкг через ингалятор Респимат® Софт Мист® и 18 мкг через ХэндиХалер® позволяло достигнуть достоверного улучшения показателей минимальных ОФВ1 и форсированной жизненной емкости легких (ФЖЕЛ) по сравнению с плацебо. Положительная динамика максимальной объемной скорости выдоха (МОСВ) в группах Спирива® ХэндиХалер® 18 мкг и тиотропия в дозах 10 и 5 мкг, вводившегося через Респимат® Софт Мист®, также была сходной.
Разница средних значений потребления препаратов экстренной помощи в группах тиотропия 5, 10 и 20 мкг и соответствующих значений в группах плацебо была статистически значимой (p<0,05).
Частота, степень тяжести и тип неблагоприятных реакций при использовании Спирива® Респимат® Софт Мист®, Спирива® ХэндиХалер® и плацебо были сопоставимы. Результаты фармакокинетического анализа позволили сделать заключение об эквивалентности дозы тиотропия 5 мкг, введенной через Респимат® Софт Мист®, и 18 мкг порошка тиотропия, введенного через ХэндиХалер®.
Результаты клинического испытания фазы II позволили сделать вывод, что доза 5–10 мкг тиотропия, введенного с помощью Респимат® Софт Мист®, по эффективности и системному воздействию была сопоставима с дозой, введенной через Спирива® ХэндиХалер® [10].
В рамках фазы III клинической разработки препарата Спирива® Респимат® было проведено 6 многоцентровых рандомизированных двойных слепых, с двойной маскировкой, перекрестных, с плацебо– и активным контролем исследований: два продолжительностью по 4 нед., два – по 12 нед. и два – по 48 нед. В общей сложности в рамках клинических испытаний фазы III лечение тиотропием через Респимат® Софт Мист® получили 2050 больных ХОБЛ. В ходе клинических испытаний оценивали эффекты двух доз препарата Спирива® Респимат® (5 и 10 мкг). Фармакодинамический эффект дозы 5 мкг оказался таким же, как и дозы 10 мкг, однако системное воздействие более низкой дозы было вполовину меньше, что определяло количество неблагоприятных эффектов лечения.
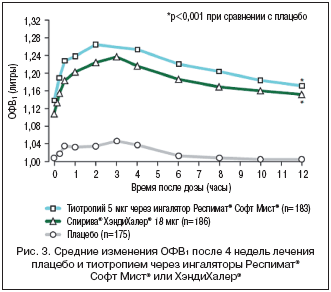
Безопасность и эффективность однократных ежедневных ингаляций тиотропия в дозе 5 мкг через Респимат® Софт Мист® изучали у больных ХОБЛ на протяжении 4 нед. в двух исследованиях, проводившихся по одному и тому же протоколу. В их ходе Спирива® Респимат® сравнивали с плацебо и Спирива® ХэндиХалер® (18 мкг тиотропия). В общей сложности в исследования были включены 207 больных со стабильной среднетяжелой и тяжелой обструкцией дыхательных путей (ОФВ1 до бронходилатации ≤60% от должных значений и ОФВ1/ФЖЕЛ ≤70%).
После 4 нед. терапии у больных, которые получали Спирива® Респимат®, было отмечено статистически значимое улучшение минимального ОФВ1 по сравнению с плацебо (+126 мл) и 18 мкг Спирива® ХэндиХалер® (+29 мл). В целом бронходилатационные эффекты 5 мкг тиотропия, вводимого через Респимат® Софт Мист®, были сопоставимыми или превышали эффекты 18 мкг порошкового тиотропия, вдыхаемого через ХэндиХалер® (рис. 3).
Это исследование также продемонстрировало сопоставимость плазменных концентраций тиотропия после ингаляции 5 мкг препарата через Респимат® Софт Мист® и 18 мкг через ХэндиХалер®.
Таким образом, результаты применения тиотропия по 5 мкг через Респимат® Софт Мист® и по 18 мкг через ХэндиХалер® у больных со стабильной среднетяжелой и тяжелой ХОБЛ на протяжении 4 нед. оказались эквивалентными по безопасности и эффективности [11].
В двух 12–недельных исследованиях эффективность и безопасность тиотропия в дозе 5 мкг через Респимат® Софт Мист® 1 раз/сут. сравнивали с плацебо и ипратропия бромидом через ДАИ по 36 мкг 4 раза/день у 719 больных ХОБЛ. Кроме того, изучали степень удовлетворенности пациентов использованием обоих ингаляционных устройств.
Тиотропий, применявшийся с помощью Респимат® Софт Мист® в дозе 5 мкг, оказался таким же безопасным, как и короткодействующий холиноблокатор, вдыхавшийся через ДАИ в более высокой дозе, что полностью согласовывалось с данными предыдущих исследований. Спирива® Респимат® достоверно превосходил плацебо и ипратропия бромид в ДАИ по своему влиянию на минимальный ОФВ1 на протяжении 12 нед. Аналогичные результаты были получены для минимальной ФЖЕЛ, пиковых ОФВ1 и ФЖЕЛ, утренней и вечерней МОСВ. Пациенты, принимавшие ингаляции тиотропия через Респимат® Софт Мист®, чаще жаловались на сухость во рту, чем пациенты в группах ипратропия бромида и плацебо. Неблагоприятные явления в группе тиотропия наблюдались реже, чем в двух других группах. Наконец, больше пациентов отдали предпочтение ингалятору Респимат® Софт Мист®, чем ДАИ [12].
В двух 30–недельных многоцентровых рандомизированных двойных слепых, с двойной маскировкой, перекрестных, с плацебо– и активным контролем исследованиях 207 пациентов со среднетяжелой и тяжелой ХОБЛ было также показано, что по безопасности, эффективности и фармакокинетике результаты применения тиотропия как в дозе 5 мкг через Респимат® Софт Мист®, так и 18 мкг через ХэндиХалер® были аналогичны [13].
Наконец, для оценки влияния Спирива® Респимат® с 5 мкг тиотропия на основные показатели клинического течения среднетяжелой и тяжелой ХОБЛ (функцию внешнего дыхания, одышку, качество жизни, обострения и госпитализации в связи с обострениями) были проведены два исследования эффективности и безопасности препарата в сравнении с плацебо продолжительностью по 1 году.
В качестве первичных конечных точек в конце 48–недельного периода в обоих исследованиях были выбраны 4 показателя: эффективность бронходилатации (по ОФВ1); интенсивность одышки (по ИТО); качество жизни, связанное с состоянием здоровья (по респираторному опроснику Св. Георгия), и количество обострений.
Вторичные конечные точки включали изменения минимальных показателей ОФВ1 и ФЖЕЛ по сравнению с исходным уровнем на протяжении испытания, а также утренние и вечерние значения МОСВ, оценку симптомов ХОБЛ, показатели обострений и госпитализаций в связи с ними. Кроме того, безопасность терапии отслеживали путем сбора данных о неблагоприятных явлениях и контроля артериального давления, частоты пульса и ЭКГ.
В результате лечения Спирива® Респимат® по сравнению с плацебо было отмечено:
• стойкое на протяжении года улучшение функции внешнего дыхания (минимальных и пиковых показателей ОФВ1 и ФЖЕЛ);
• клинически значимое (более 1 балла) уменьшение интенсивности одышки;
• достоверное повышение качества жизни;
• достоверное сокращение количества больных с обострениями и достоверное увеличение длительности периода до первого обострения;
• достоверное сокращение потребления бронходилататора короткого действия для экстренной помощи;
• достоверное улучшение оценки общего состояния как самими пациентами, так и врачами на протяжении года.
Частота возникновения хотя бы одного неблагоприятного явления в сравниваемых группах была сопоставимой. Чаще всего больные жаловались на сухость во рту (7,2% из числа получавших Спирива® Респимат® и 2,1% из числа принимавших плацебо). ЭКГ и холтеровское мониторирование не выявили никаких угрожающих признаков. Не было зарегистрировано случаев парадоксального бронхоспазма и тахифилаксии [14,15].
Дополнительное изучение динамики физической активности по анкете PF–10 (сокращенный вариант анкеты SF–36) выявило значимое (на 10 и более пунктов) улучшение состояния у 61,5% из 1230 пациентов с ХОБЛ после 6 нед. ингаляционной терапии 5 мг тиотропия в форме Спирива® Респимат® [16].
Мета–анализ исследований тиотропия у больных ХОБЛ, проведенных после UPLIFT, подтвердил, что препарат как в порошковом ингаляторе, так и в форме Спирива® Респимат® безопасен и высокоэффективен в качестве средства поддерживающей терапии, способствует уменьшению обструкции дыхательных путей и гиперинфляции легких [17].
Таким образом, данные многочисленных исследований эффективности, безопасности и фармакокинетики подтвердили, что применение тиотропия в дозе 5 мкг 1 раз/сут. в виде Спирива® Респимат® Софт Мист® безопасно и на протяжении до 1 года оказывает благоприятное влияние на клиническое течение ХОБЛ, что позволяет рекомендовать его использование для длительной поддерживающей терапии у больных ХОБЛ.
Литература
1. Laube B.L., Janssens H.M., de Jongh F.H. et al. What the pulmonary specialist should know about the new inhalation therapies // Eur. Respir. J. 2011. Vol. 37. Р. 1308–1331.
2. Современные ингаляционные устройства для лечения респираторной патологии: отчет рабочей группы Европейского респираторного общества и Международного общества по использованию аэрозолей в медицине // Пульмонология. 2011. Vol. 6. Р. 17–41.
3. Dellweg D., Wachtel H., Hohn E. et al. In vitro validation of a Respimat® adapter for delivery of inhaled bronchodilators during mechanical ventilation // J. Aerosol. Med. Pulm. Drug. Deliv. 2011. Vol. 24. Р. 285–292.
4. Global Initiative for Chronic Obstructive Lung Disease (GOLD) National Heart, Lung, and Blood Institute. Bethesda National Health Institute (updated 2011).
5. Tashkin D.P., Cooper C.B. The Role of Long–Acting Bronchodilators in the Management of Stable COPD // Chest. 2004. Vol. 125. Р. 249–251.
6. Tashkin D.P. Impact of tiotropium on the course of moderate–to–very severe chronic obstructive pulmonary disease: the UPLIFT trial // Expert. Rev. Respir. Med. 2010. Vol. 4. Р. 279–289.
7. Tashkin D.P., Celli B., Senn S. et al. UPLIFT Study Investigators. A 4–year trial of tiotropium in chronic obstructive pulmonary disease // N. Eng. J. Med. 2008. Vol. 359. Р. 1543–1554.
8. Feifel U., Wallenstein G., Rominger K.L. et al. Pharmacokinetics and tolerability (Study 1) with particular reference to ocular safety (Study 2) of tiotropium Respimat soft mist inhaler: findings from two dose–ranging studies in healthy men // Int. J. Chron. Obstruct. Pulmon. Dis. 2008. Vol. 3. Р. 397–403.
9. Hodder R., Pavia D., Lee A., Bateman E. Lack of paradoxical bronchoconstriction after administration of tiotropium via Respimat® Soft Mist™ Inhaler in COPD // Int. J. Chron. Obstruct. Pulmon. Dis. 2011. Vol. 6. Р. 245–251.
10. Caillaud D., Le Merre C., Martinat Y. et al. A dose–ranging study of tiotropium delivered via Respimat Soft Mist Inhaler or HandiHaler in COPD patients // Int. J. Chron. Obstruct. Pulmon. Dis. 2007. Vol. 2. Р. 559–565.
11. Ichinose M., Fujimoto T., Fukuchi Y. Tiotropium 5 microg via Respimat and 18 microg via HandiHaler; efficacy and safety in Japanese COPD patients // Respir. Med. 2010. Vol. 104. Р. 228–236.
12. Voshaar T., Lapidus R., Maleki–Yazdi R. et al. A randomized study of tiotropium Respimat Soft Mist inhaler vs. ipratropium pMDI in COPD // Respir. Med. 2008. Vol. 10. Р. 232–241.
13. Van Noord J.A., Cornelissen P.J., Aumann J.L. et al. The efficacy of tiotropium administered via Respimat Soft Mist Inhaler or HandiHaler in COPD patients // Respir. Med. 2009. Vol. 103. Р. 22–29.
14. Bateman E., Singh D., Smith D. et al. Efficacy and safety of tiotropium Respimat SMI in COPD in two 1–year randomized studies // Int. J. Chron. Obstruct. Pulmon. Dis. 2010. Vol. 5. Р. 197–208.
15. Bateman E.D., Tashkin D., Siafakas N. et al. A one–year trial of tiotropium Respimat plus usual therapy in COPD patients // Respir. Med. 2010. Vol. 104. Р. 1460–1472.
16. Rau–Berger H., Mitfessel H., Glaab T. Tiotropium Respimat® improves physical functioning in chronic obstructive pulmonary disease // Int. J. Chron. Obstruct. Pulmon. Dis. 2010. Vol. 10. Р. 367–373.
17. Santus P., Di Marco F., Radovanovic D., Centanni S. Tiotropium: what came after the UPLIFT study // Expert Opin. Pharmacother. 2012. Vol. 13. Р. 613–618.








.gif)



