Лечебный эффект гормональных контрацептивов основан на механизме их действия – способности избирательно ингибировать продукцию центральных тропных гормонов гипофиза (фолликулостимулирующего и лютеинизирующего), что сопровождается возникновением ановуляции и подавлением секреторной трансформации эндометрия. Доказано непосредственное тормозящее действие КОК на функцию яичников, эндометрия, маточных труб и биохимический состав слизи цервикального канала шейки матки. Таким образом, эстроген–гестагенные препараты являются чрезвычайно важными и востребованными в клинической практике лекарственными средствами [1,2].
При отсутствии генетически детерминированных ферментопатий уровень андрогенов в крови женщины не повышен, а внешние проявления вирилизации носят расовый или конституциональный характер. Тем не менее, внешние проявления андрогензависимых изменений кожи у молодых женщин являются серьезным косметическим дефектом и могут приводить к серьезным эмоциональным и психологическим проблемам. В связи с этим представляет несомненный клинический интерес группа гормональных контрацептивов, обладающих антиандрогенными свойствами, которые не только подавляют эндогенную продукцию андрогенов, но и обладают выраженным локальным антиандрогенным эффектом [2,3,7].
В эндокринологической гинекологии понятие «гиперандрогения» (ГА) обозначает патологическое состояние, обусловленное продукцией избыточного уровня андрогенов в организме женщины. Являясь результатом серьезных нарушений в системе гипоталамус–гипофиз–яичники–надпочечники, данное состояние сопровождается патологией метаболических процессов, нарушением менструального цикла и репродуктивной функции [2,6]. Помимо этого, страдает и внешний облик таких пациенток, поскольку клиническими проявлениями ГА являются гирсутизм, себорея и угревая сыпь (акне). Даже легкая степень выраженности подобных явлений ведет к эмоциональным дистрессам. При выраженных косметических дефектах кожи у многих женщин развиваются невротические и депрессивные состояния [8], которые усугубляют нарушения репродуктивной функции, создавая классический «порочный круг» патофизиологических изменений. По данным литературы, у 10–30% женщин в мире имеются те или иные признаки ГА. С этой проблемой, безусловно, прежде всего обращаются к врачу–гинекологу, т.к. ГА является наиболее частой причиной хронической ановуляции (35%) и бесплодия. К врачу–дерматологу обращаются с кожными проявлениями ГА, такими как aкнe, себорея, гирсутизм.
Возникновение себореи и акне у женщин связано с изменением соотношений между андрогенами и эстрогенами, чаще всего имеет место сочетание ГА и гиперэстрогении. В патогенезе aкнe одним из основных звеньев является генетически обусловленная ГА, которая может быть как абсолютной (увеличение уровня андрогенов в крови), так и относительной (повышенная чувствительность рецепторов кожи при нормальном уровне андрогенов) [4,9,10].
Абсолютная ГА развивается при заболеваниях, сопровождающихся увеличением выработки андрогенов в яичниках и/или надпочечниках:
• андрогенпродуцирующие опухоли яичников или надпочечников;
• синдром поликистозных яичников (СПКЯ) и гипертекоз яичников;
• врожденная гиперплазия коры надпочечников.
Себорея – это болезненное состояние кожи, связанное с гиперсекрецией сальными железами кожного сала измененного химического состава. Вульгарные угри (аcne vulgaris) – мультифакторное заболевание, проявляющееся нарушением процесса ороговения в устье волосяного фолликула и поверхности кожи с перифолликулярной воспалительной реакцией [3,4,10]. Основное значение в развитии aкнe придается нарушению функции половых желез с ГА (овариального и/или надпочечникового генеза), увеличению количества гормональных рецепторов в коже, повышению чувствительности сальных желез к андрогенным стимулам. Это приводит к нарушению функции сальных желез с гиперсекрецией и изменением физико–химических свойств кожного сала, накоплению свободных жирных кислот, обладающих раздражающими свойствами и способствующих образованию комедонов.
С началом андрогенной активности, примерно на 8–м году жизни, секреция сальных желез резко повышается. Основным гормоном, вовлеченным в регуляцию деятельности сальной железы, является тестостерон. Он влияет на пролиферативную активность сальной железы и липогенез. Указанные процессы достигают своего пика активности в возрасте от 12 до 25 лет. Это объясняется детерминизмом пубертатных сдвигов, когда первостепенное значение в развитии организма принадлежит андрогенам, определяющим пик роста, созревание длинных трубчатых костей, замыкание диафизарно–эпифизарных хрящей, появление оволосения по женскому типу. Андрогены в этот период являются основным источником эстрогенов, в последующем – со снижением чувствительности гипоталамуса к воздействию эстрогенов происходит постепенный рост уровня гонадотропин–рилизинг–гормонов с повышением секреции лютеинизирующего и фолликулостимулирующего гормонов, становлением гормонального гомеостаза. После 25 лет и далее признаки ГА наблюдаются у 5–30% женщин [10,13], и в последние годы ее частота возрастает.
Некоторые другие эндокринопатии могут сопровождаться увеличением фракции свободного (активного) тестостерона крови при общей нормальной продукции тестостерона. Это связано с тем, что в печени снижается продукция транспортного белка, связывающего тестостерон в крови, – половые стероиды связывающего глобулина (ПССГ), в результате чего большее количество тестостерона в крови остается свободным, а следовательно, активным (так называемая транспортная ГА). Она может возникать при следующих заболеваниях:
• синдроме Кушинга;
• гипер– или гипотиреозе;
• нарушении жирового обмена;
• сахарном диабете типа 2;
• гиперпролактинемии.
ГА может также быть ятрогенной, т.е. развиться при приеме препаратов, обладающих андрогенной активностью. Однако чаще врачи сталкиваются с относительной ГА, когда уровень андрогенов крови нормальный, но в себоцитах под воздействием фермента 5a–редуктазы типа 1 происходит превращение тестостерона в его высокоактивный метаболит дигидротестостерон, который в свою очередь активизирует процесс роста и созревания себоцитов и образования кожного сала. Другой возможной причиной развития относительной ГА может быть повышенная плотность ядерных дигидротестостерон–рецепторов в клетках сального фолликула.
Поэтому проблема диагностики и коррекции андрогензависимых состояний является чрезвычайно актуальной в современных условиях.
В связи с вышесказанным этиопатогенетической терапией для течения aкнe, связанных с ГА, являются препараты, оказывающие антиандрогенное воздействие.
КОК снижают продукцию гонадотропных гормонов гипофиза, вследствие чего блокируется развитие фолликула и резко снижается выработка андрогенов в яичниках. Кроме того, в состав некоторых КОК входят прогестагены (синтетические аналоги прогестерона) с антиандрогенной активностью. Эти прогестагены блокируют связывание андрогенов со специфическими рецепторами, находящимися в сально–волосяном фолликуле, что приводит к уменьшению продукции кожного сала и замедлению роста волос.
Помимо известных ОК с антиандрогенным эффектом перспективным представляется эстроген–гестагенный препарат Белара – гормональный контрацептив, содержащий 30 мкг этинилэстрадиола и 2 мг хлормадинона ацетата (ХМА). ХМА – производное природного прогестерона – 17α–ацетокси–6–хлор–6,7–дегидро–прогестерона (рис. 1).
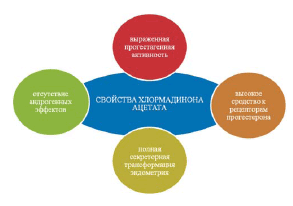
Высоким сродством ХМА к рецепторам прогестерона обеспечивается его значительная прогестагенная активность и выраженное воздействие на эндометрий (почти на 1/3 выше, чем у натурального прогестерона).
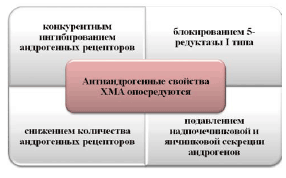
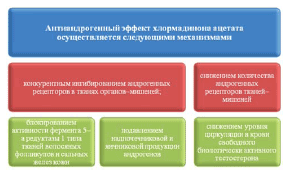
В отличие от натурального прогестерона выраженный прогестагенный и антиэстрогенный эффект ХМА сочетается с антиандрогенной активностью без антиминералокортикоидного действия. Антиандрогенные свойства ХМА реализуются путем конкурирования с андрогенами за связывание с рецепторами в клетках–мишенях, в том числе в тканях волосяных фолликулов и сальных желез кожи, что приводит к снижению выраженности себореи, aкнe, алопеции, гирсутизма и других проявлений вирилизации. Кроме этого, ХМА снижает синтез андростендиона и дигидроэпиандростерона сульфата в яичниках и надпочечниках, уменьшая тем самым уровень циркуляции в крови этих наиболее активных фракций андрогенов. Важным биологическим эффектом ХМА является его блокирующий эффект на активность фермента 5α–редуктазы I типа, контролирующего чувствительность клеток тканей волосяных фолликулов и сальных желез кожи к влиянию эндогенных фракций андрогенов [3,12,14]. Сочетание ХМА с этинилэстрадиолом в препарате Белара приводит к активации продукции печенью белков (глобулинов), связывающих ГСПС, и повышению их уровня в плазме крови, что приводит к снижению абсолютного содержания циркулирующего свободного биологически активного тестостерона крови в 2–3 раза в течение 6 мес. приема [6,11].
ХМА не оказывает значительного влияния на метаболизм липопротеинов. В результате не происходит угнетения позитивных изменений липидного профиля, обусловленных эстрогенным компонентом (снижение уровня липопротеинов низкой плотности – ЛПНП и увеличение уровня липопротеинов высокой плотности – ЛПВП).
В отличие от прогестерона выраженный прогестагенный и антиэстрогенный эффект ХМА не сопровождается андрогенным действием, а, напротив, обладает антиандрогенными свойствами без антиминералокортикоидного воздействия.
ХМА является антиандрогеном, который уменьшает кожные проявления андрогенизации. Антиандрогены конкурируют с андрогенами за связывание с рецепторами тестостерона клеток–мишеней, например волосяного фолликула, тем самым снижая себорею, aкнe, алопецию и гирсутизм.
Кроме того, эстрогенный компонент препарата Белара вызывает повышение уровня белков, связывающих половые стероиды в плазме крови, вследствие активации их синтеза в печени. Такое повышение уровня этих белков в плазме крови приводит к снижению количества свободного, биологически активного тестостерона.
Помимо антиандрогенного эффекта Белара обладает высокоэффективным контрацептивным действием у женщин фертильного возраста, стабилизирует менструальный цикл, хорошо переносится и не вызывает отрицательных влияний на обмен веществ и массу тела [11].
Таким образом, ХМА является активным прогестагеном, его комбинация с этинилэстрадиолом в препарате Белара обеспечивает выгодное сочетание высокого контрацептивного и лечебного эффектов у пациенток с конституциональными проявлениями вирилизации. Многоцентровое исследование эффективности, переносимости и приемлемости эстроген–гестагенного препарата Белара [9] свидетельствует о его высокой контрацептивной эффективности: индекс Перля, рассчитываемый как количество беременностей у 100 пациенток в течение 1 года контрацепции, колеблется от 0,04 до 0,269. Для сравнения: по сводным литературным данным, эффективность других монофазных гормональных контрацептивов II и III поколений, содержащих 30–35 мкг этинилэстрадиола, составляет 0–1,2 на 100 жен–лет [1].
Естественно, что в каждом индивидуальном случае и врач, и пациентка стремятся найти «свой» препарат, максимально удовлетворяющий особенностям конкретного организма.
Таким образом, эстроген–гестагенный препарат Белара является высокоэффективым гормональным контрацептивом, содержащим низкую (30 мкг) дозу этинилэстрадиола в сочетании с уникальным прогестагеном – хлормадинона ацетатом. Антиандрогенные биологические свойства ХМА позволяют реализовывать не только контрацептивный, но и лечебный эффект Белары, благоприятно влиять на состояние кожи и волос пациенток. Сбалансированность эстрогенного и прогестагенного компонентов в препарате Белара обеспечивает стабильность менструального цикла во время применения ОК, практически не влияет на параметры веса пациенток, обеспечивает высокую приемлемость этого препарата, не оказывает неблагоприятных системных влияний на организм женщины. Более 95% пациенток, использующих Белару в течение 6 мес., чувствуют себя комфортно и оценивают переносимосить ОК как хорошую или очень хорошую. Указанные биологические свойства препарата Белара позволяют рекомендовать его к использованию не только в контрацептивных, но и в лечебных целях у пациенток с нарушениями менструального цикла, дисменореей, в программах прегравидарной подготовки и реабилитации в послеабортном и послеродовом периодах, у пациенток с доброкачественными гиперпластическими процессами эндометрия и миометрия, функциональными кистами яичников и т.д.




Литература
1. Прилепская В.Н., Шулятьева Н.Н. Клинические аспекты применения оральных контрацептивов с антиандрогенным действием // Гинекология. – 2005. – № 7 (2). – С. 49–53.
2. Роговская С.И., Телунц А.В., Савельева И.С. Акне как проявление синдрома гиперандрогении: методы коррекции // Consilium Provisorum. – 2002. – Т. 02, № 8.
3. Серов В.Н. Белара – новый низкодозированный оральный контрацептив с антиандрогенным эффектом // Гинекология. – 2003. – № 5 (5). – С. 217–221.
4. Хамошина М.Б. Коррекция гиперандрогенных нарушений – практика гинеколога // Гинекология. – 2010 (экстравыпуск).
5. Шилин Д.Е. Гиперандрогенные состояния: под прицелом хлормадинона ацетата // Гинекология. – 2010. – № 1. – Т. 12.
6. Шилин Д.Е. Синдром поликистозных яичников: международный диагностический консенсус (2003 г.) и современная идеология терапии // Consilium Medicum. – 2004. – № 6 (9). – С. 683–689.
7. De Leo V., Di Sabatino A., Musacchio M.C. et al. Effect of oral contraceptives on markers of hyperandrogenism and SHBG in women with polycystic ovary syndrom // Contraception. 2010. Vol. 82(3). P. 276–280.
8. GOmez Vazquez M., Navarra Amayuelas R. et al. //Amer. J. Clin. Dermatol. 2011. Vol. 12 (Suppl 1). P. 13–19.
9. Goretzlehner G., Waldmann–Rex S., Schramm G.A. Extended cycles with the combined oral contraceptivechlormadinone acetate2 mg/ethinylestradiol0.03 mg: pooled analysis of data from three large–scale, non–interventional, observational studies // Clin. Drug. Investig. 2011. Vol. 31(4). P. 269–277.
10. Guerra–Tapia A., Sancho Perez B. Ethinylestradiol/Chlormadinone acetate: dermatological benefits //Amer. J. Clin. Dermatol. 2011. Vol. 12 (Suppl 1). P.3–11. Review.
11. Guido M., Romualdi D., Campagna G. et al. Ethinylestradiol–chlormadinone acetatecombination for the treatment of hirsutism and hormonal alterations of normal–weight women with polycystic ovary syndrome: evaluation of the metabolic impact // Reprod. Sci. 2010. Vol.17(8). P. 767–775.
12. Hadji P., Biskup J., Boekhoff J. et al. Evaluation of efficacy, safety and effects on symptoms of androgenization of a generic oral contraceptive containingchlormadinone acetate2 mg/ethinylestradiol0.03 mg // Contraception. 2012. Vol. 86(4). P. 359–365.
13. Kerscher M., Reuther T., Krueger N., Buntrock H. Effects of an oral contraceptive containingchlormadinone acetateandethinylestradiolon hair and skin quality in women wishing to use hormonal contraception // J. Eur. Acad. Dermatol. Venereol. 2012.
14. Uras R., Orru M., Pani F. et al. Endocrinological, metabolic and clinical features of treatment with oral contraceptive formulation containingethinylestradiolpluschlormadinone acetatein nonobese women with polycystic ovary syndrome // Contraception. 2010. Vol. 82(2). P. 131–138.








.gif)



