–†–∞–Ј–≤–Є—В–Є–µ –љ–∞–Є–±–Њ–ї–µ–µ —Б–Њ—Ж–Є–∞–ї—М–љ–Њ –Ј–љ–∞—З–Є–Љ—Л—Е –°–°–Ч, –≤ –Њ—Б–љ–Њ–≤–µ –Ї–Њ—В–Њ—А—Л—Е –ї–µ–ґ–Є—В –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ —Б –і–∞–ї—М–љ–µ–є—И–Є–Љ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ–Љ –µ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ 15 –ї–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П —Б –њ–Њ–Ј–Є—Ж–Є–є «—Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ—Г—Г–Љ–∞». –≠—В–∞ –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П, –≤–њ–µ—А–≤—Л–µ –≤—Л—Б–Ї–∞–Ј–∞–љ–љ–∞—П V. Dzau –Є E. Braunwald –≤ 1991 –≥. [2], –љ–∞ —Б–µ–≥–Њ–і–љ—П –љ–µ —В–Њ–ї—М–Ї–Њ —Б—В–∞–ї–∞ –Њ–±—Й–µ–њ—А–Є–Ј–љ–∞–љ–љ–Њ–є, –љ–Њ –њ–Њ —Б—Г—В–Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –Ї—А–∞–µ—Г–≥–Њ–ї—М–љ—Л–є –Ї–∞–Љ–µ–љ—М, –љ–∞ –Ї–Њ—В–Њ—А–Њ–Љ –Ј–Є–ґ–і–µ—В—Б—П –љ–∞—И–µ –њ–Њ–љ–Є–Љ–∞–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –≤–∞–ґ–љ–µ–є—И–Є—Е –°–°–Ч. –°–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–є –Ї–Њ–љ—В–Є–љ—Г—Г–Љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –љ–µ–њ—А–µ—А—Л–≤–љ—Г—О —Ж–µ–њ—М –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ–µ –Њ—В –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞, —З–µ—А–µ–Ј –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –°–°–Ч –і–Њ —А–∞–Ј–≤–Є—В–Є—П —В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б–µ—А–і—Ж–∞ –Є —Б–Љ–µ—А—В–µ–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ [3]. –Я–Њ–Ј–і–љ–µ–µ –±—Л–ї –њ—А–µ–і–ї–Њ–ґ–µ–љ «–≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Є–є –Ї–∞—Б–Ї–∞–і» —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ—Г—Г–Љ–∞, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Ж–µ–љ—В—А–∞–ї—М–љ—Г—О —А–Њ–ї—М –Є–≥—А–∞–µ—В —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П (–Р–У) –Є –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ —Б–µ—А–і—Ж–∞, –њ—А–Є–≤–Њ–і—П—Й–µ–µ –≤ —Д–Є–љ–∞–ї–µ –Ї —А–∞–Ј–≤–Є—В–Є—О –љ–µ–Њ–±—А–∞—В–Є–Љ—Л—Е —В–µ—А–Љ–Є–љ–∞–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, –Љ–Є–љ—Г—П —Б—А–∞–Ј—Г –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Н—В–∞–њ–Њ–≤ –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ—Г—Г–Љ–∞ [4] (—А–Є—Б. 1).
–Э–µ–њ—А–µ—А—Л–≤–љ–∞—П —Ж–µ–њ—М –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б—В—А—Г–Ї—В—Г—А—Л –Є —Д—Г–љ–Ї—Ж–Є–Є —Б—А–∞–Ј—Г –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Њ—А–≥–∞–љ–Њ–≤ –Є —Б–Є—Б—В–µ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –≤ —А–∞–Љ–Ї–∞—Е –Ї–Њ–љ—В–Є–љ—Г—Г–Љ–∞ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В –љ–∞–ї–Є—З–Є–µ –Њ–±—Й–Є—Е –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Њ—А–≥–∞–љ–љ—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є. –Т –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤—Б–µ –Љ–љ–Њ–≥–Њ–Њ–±—А–∞–Ј–Є–µ –њ–Њ–і–Њ–±–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤–µ–і–µ–љ–Њ –Ї –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ, –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–Љ –Є –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ—Л–Љ —Д–∞–Ї—В–Њ—А–∞–Љ. –°—А–µ–і–Є –њ–Њ—Б–ї–µ–і–љ–Є—Е –Њ–і–љ–∞ –Є–Ј —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е —А–Њ–ї–µ–є –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є —А–µ–љ–Є–љ––∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ––∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л (–†–Р–Р–°), –Ї–Њ—В–Њ—А–∞—П –њ—А–Њ—Б–ї–µ–ґ–Є–≤–∞–µ—В—Б—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–∞ –≤—Б–µ—Е —Н—В–∞–њ–∞—Е —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ—Г—Г–Љ–∞.
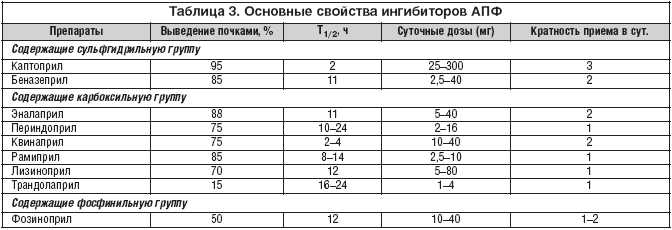
–Ш—Б—В–Њ—А–Є—П –Є–Ј—Г—З–µ–љ–Є—П –†–Р–Р–° –±–µ—А–µ—В —Б–≤–Њ–µ –љ–∞—З–∞–ї–Њ –≤ 1898 –≥., –Ї–Њ–≥–і–∞ —Д–Є–љ—Б–Ї–Є–є —Д–Є–Ј–Є–Њ–ї–Њ–≥ Tigelstedt –Є –µ–≥–Њ —Б—В—Г–і–µ–љ—В Bergman –≤—Л–і–µ–ї–Є–ї–Є –Є–Ј –њ–Њ—З–µ—З–љ–Њ–є —В–Ї–∞–љ–Є –њ–µ—А–≤—Л–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В –†–Р–Р–° – —А–µ–љ–Є–љ, —В–Њ–≥–і–∞ –µ—Й–µ –љ–µ –њ–Њ–і–Њ–Ј—А–µ–≤–∞—П, –Ї–∞–Ї—Г—О —А–Њ–ї—М —Н—В–Њ—В —Д–∞–Ї—В —Б—Л–≥—А–∞–µ—В –≤ —А–∞–Ј–≤–Є—В–Є–Є –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є–Є, –Љ–µ–і–Є—Ж–Є–љ—Л –Є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є –≤ XX –≤–µ–Ї–µ. –Э–Њ –ї–Є—И—М —Б–µ–≥–Њ–і–љ—П, –±–Њ–ї–µ–µ —Б—В–∞ –ї–µ—В —Б–њ—Г—Б—В—П, —Б—В–∞–љ–Њ–≤–Є—В—Б—П –≤—Б–µ –±–Њ–ї–µ–µ –њ–Њ–љ—П—В–љ–∞ —Ж–µ–љ—В—А–∞–ї—М–љ–∞—П —А–Њ–ї—М –†–Р–Р–° –Є –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –≥–Њ–Љ–µ–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–є —А–µ–≥—Г–ї—П—Ж–Є–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–Р–Ф), –њ–µ—А—Д—Г–Ј–Є–Є —В–Ї–∞–љ–µ–є, –±–∞–ї–∞–љ—Б–∞ –ґ–Є–і–Ї–Њ—Б—В–Є –Є —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤, –љ–Њ –Є –≤ —И–Є—А–Њ–Ї–Њ–Љ —Б–њ–µ–Ї—В—А–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤. –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞—Е –†–Р–Р–° –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 2.
–†–Р–Р–° –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —Г–љ–Є–Ї–∞–ї—М–љ—Г—О —А–µ–≥—Г–ї—П—В–Њ—А–љ—Г—О —Б–Є—Б—В–µ–Љ—Г, –≤ –Ї–Њ—В–Њ—А–Њ–є –∞–Ї—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В–Њ—А –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ II (–Р–љ–≥ II) –≤—Л—А–∞–±–∞—В—Л–≤–∞–µ—В—Б—П –≤ –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–Љ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ –њ—Г—В–µ–Љ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—В–µ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—Й–µ–њ–ї–µ–љ–Є—П –µ–≥–Њ –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤.
–Я—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–Љ –Р–љ–≥ II —П–≤–ї—П–µ—В—Б—П –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≥–µ–љ (–Р–љ–≥) – –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Є–љ–µ—А—В–љ—Л–є –≥–ї–Њ–±—Г–ї–Є–љ, —Б–Є–љ—В–µ–Ј–Є—А—Г–µ–Љ—Л–є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤ –њ–µ—З–µ–љ–Є (—Н–Ї—Б–њ—А–µ—Б—Б–Є—П –Љ–†–Э–Ъ –Р–љ–≥ –±—Л–ї–∞ —В–∞–Ї–ґ–µ –≤—Л—П–≤–ї–µ–љ–∞ –≤ –њ–Њ—З–Ї–∞—Е, —Б–µ—А–і—Ж–µ, –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ, —Б–Њ—Б—Г–і–∞—Е, –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞—Е, —П–Є—З–љ–Є–Ї–∞—Е, –њ–ї–∞—Ж–µ–љ—В–µ –Є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є) [5]. –Ъ–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Р–љ–≥ –≤ –Ї—А–Њ–≤–Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Б—В–∞–±–Є–ї—М–љ–∞. –†–µ–љ–Є–љ, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–є —Б–Њ–±–Њ–є –Ї–Є—Б–ї—Г—О –њ—А–Њ—В–µ–∞–Ј—Г, –≤—Л–і–µ–ї—П–µ—В—Б—П –≤ –Ї—А–Њ–≤—М —О–Ї—Б—В–∞–≥–ї–Њ–Љ–µ—А—Г–ї—П—А–љ—Л–Љ –∞–њ–њ–∞—А–∞—В–Њ–Љ –њ–Њ—З–µ–Ї –≤ –≤–Є–і–µ –њ—А–Њ–≥–Њ—А–Љ–Њ–љ–∞ – –њ—А–Њ—А–µ–љ–Є–љ–∞, –љ–∞ –і–Њ–ї—О –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ—А–Є—Е–Њ–і–Є—В—Б—П –і–Њ 70–90% –≤—Б–µ–≥–Њ –Є–Љ–Љ—Г–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ —А–µ–љ–Є–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є. –Э–µ–і–∞–≤–љ–Њ –Њ–њ–Є—Б–∞–љ—Л —А–µ—Ж–µ–њ—В–Њ—А—Л –њ—А–Њ—А–µ–љ–Є–љ–∞, –Є—Е —А–Њ–ї—М —Г—В–Њ—З–љ—П–µ—В—Б—П. –†–µ–љ–Є–љ –Љ–Њ–ґ–µ—В —В–∞–Ї–ґ–µ –≤—Л–і–µ–ї—П—В—М—Б—П –љ–µ–Ї–Њ—В–Њ—А—Л–Љ–Є –і—А—Г–≥–Є–Љ–Є —В–Ї–∞–љ—П–Љ–Є (–Љ–Њ–Ј–≥–Њ–Љ, —Б–µ—А–і—Ж–µ–Љ, —Б–Њ—Б—Г–і–∞–Љ–Є). –†–µ–љ–Є–љ –≤–Њ–Ј–і–µ–є—Б—В–≤—Г–µ—В –љ–∞ –Р–љ–≥ –Є –Њ—В—Й–µ–њ–ї—П–µ—В –Њ—В –љ–µ–≥–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї–Њ–љ—Ж–µ–≤—Л—Е —Д—А–∞–≥–Љ–µ–љ—В–Њ–≤, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ I (–Р–љ–≥ I) –Є–ї–Є –Р–љ–≥–(1–10). –Ш–Љ–µ–љ–љ–Њ —Н—В–Њ—В –њ—А–Њ—Ж–µ—Б—Б —П–≤–ї—П–µ—В—Б—П —Б–Ї–Њ—А–Њ—Б—В—М––ї–Є–Љ–Є—В–Є—А—Г—О—Й–Є–Љ –≤–Њ –≤—Б–µ–Љ –Ї–∞—Б–Ї–∞–і–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –†–Р–Р–°. –Р–љ–≥ I –Њ–±–ї–∞–і–∞–µ—В –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Є –Љ–Њ–ґ–µ—В –і–µ–є—Б—В–≤–Њ–≤–∞—В—М –Ї–∞–Ї –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А. –Р–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–Є–є —Д–µ—А–Љ–µ–љ—В (–Р–Я–§) –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —Н–Ї–Ј–Њ–њ–µ–њ—В–Є–і–∞–Ј—Г, –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Г—О –љ–∞ –Љ–µ–Љ–±—А–∞–љ–∞—Е —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї (—Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е, —Н–њ–Є—В–µ–ї–Є–Њ—Ж–Є—В–Њ–≤ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –њ–Њ—З–µ—З–љ—Л—Е –Ї–∞–љ–∞–ї—М—Ж–µ–≤, –љ–µ–є—А–Њ—Н–њ–Є—В–µ–ї–Є–Њ—Ж–Є—В–Њ–≤) –Є –≤ –љ–µ–Ї–Њ—В–Њ—А–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є. –Р–Я–§ –Њ—В—Й–µ–њ–ї—П–µ—В –Њ—В –Р–љ–≥ I –Ї–Њ–љ—Ж–µ–≤–Њ–є –і–Є–њ–µ–њ—В–Є–і, –Ї–Њ–љ–≤–µ—А—В–Є—А—Г—П –Р–љ–≥ I –≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ II (–Р–љ–≥ II) –Є–ї–Є –Р–љ–≥–(1–8) – –≥–ї–∞–≤–љ—Л–є —Н—Д—Д–µ–Ї—В–Њ—А –†–Р–Р–°. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Р–Я–§ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В –±—А–∞–і–Є–Ї–Є–љ–Є–љ –Є –Ї–∞–ї–ї–Є–Ї—А–µ–Є–љ –і–Њ –љ–µ–∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ [6].
–Я–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ —Н–љ–і–Њ–њ–µ–њ—В–Є–і–∞–Ј, –љ–∞–є–і–µ–љ–љ—Л—Е –≤ –Љ–Њ–Ј–≥–µ –Є –њ–Њ—З–Ї–∞—Е, –Є–Ј –Р–љ–≥ II –Њ–±—А–∞–Ј—Г—О—В—Б—П –Р–љ–≥ III –Є –Р–љ–≥ IV. –Я–Њ—Б–ї–µ–і–љ–Є–є, –≤–µ—А–Њ—П—В–љ–Њ, –і–µ–є—Б—В–≤—Г–µ—В –≤ –Љ–Њ–Ј–≥–µ —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б –Р–љ–≥ II –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—О –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–Р–Ф) [7].
–°—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –љ–µ–і–∞–≤–љ–Њ –≤—Л–і–µ–ї–µ–љ –љ–Њ–≤—Л–є —Д–µ—А–Љ–µ–љ—В –Є–Ј –Ї–ї–∞—Б—Б–∞ —Н–љ–і–Њ–њ–µ–њ—В–Є–і–∞–Ј, –њ–Њ–ї—Г—З–Є–≤—И–Є–є –љ–∞–Ј–≤–∞–љ–Є–µ –Р–Я–§2. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Р–Я–§, –Њ–љ –љ–µ –Ї–Њ–љ–≤–µ—А—В–Є—А—Г–µ—В –Р–љ–≥ I –≤ –Р–љ–≥ II –Є –љ–µ –њ–Њ–і–∞–≤–ї—П–µ—В—Б—П –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Р–Я–§ (–Є–Р–Я–§). –Я–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –Р–Я–§2 [8] –Є–Ј –Р–љ–≥ I –Њ–±—А–∞–Ј—Г–µ—В—Б—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –љ–µ–∞–Ї—В–Є–≤–љ—Л–є –Р–љ–≥–(1–9), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –Р–љ–≥–(1–7) –Њ–±—А–∞–Ј—Г–µ—В—Б—П –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ —В–Ї–∞–љ—М–—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е —Н–љ–і–Њ–њ–µ–њ—В–Є–і–∞–Ј –Є –Є–Ј –Р–љ–≥ II –њ—А–Є —Г—З–∞—Б—В–Є–Є –Р–Я–§2. –Р–љ–≥–(1–7) –Љ–Њ–ґ–µ—В –і–∞–ї—М—И–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А–Њ–≤–∞—В—М—Б—П –њ—А–Є —Г—З–∞—Б—В–Є–Є –Р–Я–§ –і–Њ –Р–љ–≥–(1–5), –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ–Њ–Ї–∞ –љ–µ –≤—Л—П—Б–љ–µ–љ–∞. –≠—Д—Д–µ–Ї—В—Л –Р–љ–≥–(1–7) –≤–Ї–ї—О—З–∞—О—В –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є—О, —Г—Б–Є–ї–µ–љ–Є–µ –і–Є—Г—А–µ–Ј–∞ –Є –љ–∞—В—А–Є–є—Г—А–µ–Ј–∞, –∞–љ—В–Є—В—А–Њ—Д–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ, —З—В–Њ —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П —З–µ—А–µ–Ј —Б—В–Є–Љ—Г–ї—П—Ж–Є—О –ї–Є–±–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –ї–Є–±–Њ MAS–—А [9]. –°—В–Є–Љ—Г–ї—П—Ж–Є—П –њ–Њ—Б–ї–µ–і–љ–Є—Е –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О –њ—А–Њ–і—Г–Ї—Ж–Є–Є NO –Є –њ—А–Њ—Б—В–∞—Ж–Є–Ї–ї–Є–љ–∞. –°–µ–≥–Њ–і–љ—П –Р–љ–≥–(1–7) —А–∞—Б—Ж–µ–љ–Є–≤–∞—О—В, –Ї–∞–Ї –љ–∞—В—Г—А–∞–ї—М–љ—Л–є –Є–Р–Я–§. –Я–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –Р–љ–≥–(1–7) –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –Њ–і–Є–љ –Є–Ј –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Њ–±—А–∞—В–љ–Њ–є —Б–≤—П–Ј–Є –≤ —А–∞–Љ–Ї–∞—Е –†–Р–Р–°, –Њ–Ї–∞–Ј—Л–≤–∞—П –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ–µ –Р–љ–≥ II –і–µ–є—Б—В–≤–Є–µ. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–µ—В—Б—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є –±–∞–ї–∞–љ—Б –Љ–µ–ґ–і—Г –њ—А–µ—Б—Б–Њ—А–љ—Л–Љ–Є/—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є –Р–љ–≥ II –Є –і–µ–њ—А–µ—Б—Б–Њ—А–љ—Л–Љ–Є/–∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є –Р–љ–≥–(1–7).
–Ю—Б–љ–Њ–≤–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ—А–Њ–Љ –†–Р–Р–° —П–≤–ї—П–µ—В—Б—П –Р–љ–≥ II, –і–µ–є—Б—В–≤–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П —З–µ—А–µ–Ј —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л (–Р–Ґ–—А). –Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –Љ–Њ–Љ–µ–љ—В—Г –≤—Л–і–µ–ї–µ–љ—Л 4 –њ–Њ–і—В–Є–њ–∞ –Р–Ґ–—А. –Э–∞–Є–±–Њ–ї—М—И–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В –Р–Ґ1–—А, —З–µ—А–µ–Ј —Б—В–Є–Љ—Г–ї—П—Ж–Є—О –Ї–Њ—В–Њ—А–Њ–≥–Њ —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Ї–∞–Ї —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е, —В–∞–Ї –Є –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Р–љ–≥ II (—В–∞–±–ї. 1).
–Р–Ґ1–—А –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ—Л –≤ –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л—Е —Б–Њ—Б—Г–і–∞—Е, —Б–µ—А–і—Ж–µ, –њ–Њ—З–Ї–∞—Е, –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞—Е, –њ–µ—З–µ–љ–Є, –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –Є –ї–µ–≥–Ї–Є—Е. –Р–Ґ2–—А. —И–Є—А–Њ–Ї–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ –Љ–Њ–Ј–≥–µ, –њ–Њ—З–Ї–∞—Е –Є –і—А—Г–≥–Є—Е —В–Ї–∞–љ—П—Е –њ–ї–Њ–і–∞, –Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤ –њ–Њ—Б—В–љ–∞—В–∞–ї—М–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ —А–µ–Ј–Ї–Њ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –Р–Ґ2–—А, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –Є–≥—А–∞—О—В –Ї–Њ–љ—В—А—А–µ–≥—Г–ї—П—В–Њ—А–љ—Г—О —А–Њ–ї—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Р–Ґ1–—А. (—В–∞–±–ї. 1), —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –≤ —Е–Њ–і–µ –Є—Е –±–ї–Њ–Ї–∞–і—Л —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–Љ PD 123319. –§—Г–љ–Ї—Ж–Є–Є –Р–Ґ3–—А –љ–µ –Є–Ј—Г—З–µ–љ—Л, –∞ —Б—В–Є–Љ—Г–ї—П—Ж–Є—П –Р–Ґ4–—А –Р–љ–≥ II, –Р–љ–≥ III –Є –Р–љ–≥ IV –Љ–Њ–і—Г–ї–Є—А—Г–µ—В —Б–Є–љ—В–µ–Ј –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞ (PAI–1) [10]. –Э–µ–і–∞–≤–љ–Њ –≤—Л—П–≤–ї–µ–љ—Л —В–∞–Ї–ґ–µ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –њ—А–Њ—А–µ–љ–Є–љ–∞, –Є—Е —А–Њ–ї—М —Г—В–Њ—З–љ—П–µ—В—Б—П. –Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –Є—Е —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—Д—А–Њ–њ–∞—В–Є–Є [11].
–Т—Л–і–µ–ї–µ–љ–Є–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –†–Р–Р–° –Є–Ј —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–є –Ї—А–Њ–≤–Є –Є —А–∞–Ј–ї–Є—З–љ—Л—Е —В–Ї–∞–љ–µ–є (—Б–µ—А–і—Ж–∞, –њ–Њ—З–µ–Ї, –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤, –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є –Є –і—А.) [12] –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞—В—М –Ї–Њ–љ—Ж–µ–њ—Ж–Є—О –Њ –љ–∞–ї–Є—З–Є–Є –і–≤—Г—Е –Ј–≤–µ–љ—М–µ–≤ —Б–Є—Б—В–µ–Љ—Л – —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–є –†–Р–Р–° –Є —В–Ї–∞–љ–µ–≤–Њ–є –†–Р–Р–°. –Ш–Љ–µ–љ–љ–Њ –≤ —А–∞–Љ–Ї–∞—Е —В–Ї–∞–љ–µ–≤–Њ–є –†–Р–Р–° (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –њ–Њ—З–µ–Ї –Є —Б–µ—А–і—Ж–∞) –≤—Л–і–µ–ї–µ–љ—Л –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л–µ –њ—Г—В–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Р–љ–≥ II –±–µ–Ј —Г—З–∞—Б—В–Є—П –Р–Я–§ –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ —Е–Є–Љ–∞–Ј, –Ї–∞—В–µ–њ—Б–Є–љ–∞ G –Є –Ї–∞–ї–ї–Є–Ї—А–µ–Є–љ––њ–Њ–і–Њ–±–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤.
–Т–Ј–≥–ї—П–і—Л –љ–∞ –Љ–µ—Б—В–Њ –†–Р–Р–° –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є —Д—Г–љ–Ї—Ж–Є–є —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Њ–≥–Њ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –≤ –љ–Њ—А–Љ–µ –Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –љ–µ–Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ –њ–µ—А–µ—Б–Љ–∞—В—А–Є–≤–∞–ї–Є—Б—М. –°–µ–≥–Њ–і–љ—П –Њ—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –†–Р–Р–° —П–≤–ї—П–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –≤–∞–ґ–љ–µ–є—И–µ–є —А–µ–≥—Г–ї—П—В–Њ—А–љ–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є, –љ–Њ —В–∞–Ї–ґ–µ –Є–≥—А–∞–µ—В —Ж–µ–љ—В—А–∞–ї—М–љ—Г—О —А–Њ–ї—М –≤ —И–Є—А–Њ–Ї–Њ–Љ —Б–њ–µ–Ї—В—А–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —В–Ї–∞–љ—П—Е –Є –Њ—А–≥–∞–љ–∞—Е —З–µ–ї–Њ–≤–µ–Ї–∞. –Т—Л—А–∞–ґ–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –†–Р–Р–° (–Ї–∞–Ї –∞–Ї—В–Є–≤–∞—Ж–Є—П, —В–∞–Ї –Є –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ) –≤—Л—П–≤–ї–µ–љ—Л –њ—А–Є –±–Њ–ї–µ–µ —З–µ–Љ 30 –љ–Њ–Ј–Њ–ї–Њ–≥–Є—П—Е –Є —Б–Є–љ–і—А–Њ–Љ–∞—Е [13].
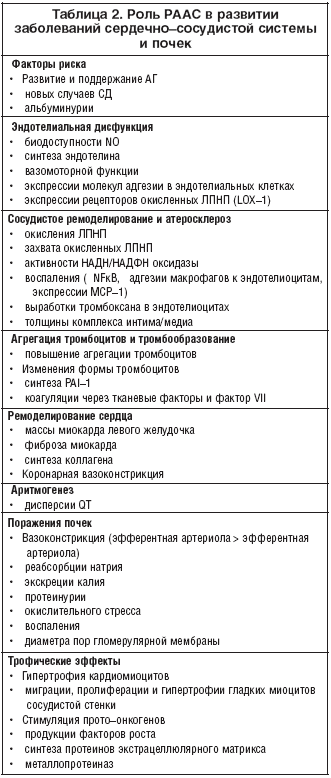
–Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞—Е in vitro, –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –Љ–Њ–і–µ–ї—П—Е in vivo –Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Г —З–µ–ї–Њ–≤–µ–Ї–∞ –і–Њ–Ї–∞–Ј–∞–љ–∞ —А–Њ–ї—М –†–Р–Р–° (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –∞–Ї—В–Є–≤–∞—Ж–Є–Є –µ–µ —В–Ї–∞–љ–µ–≤–Њ–≥–Њ –Ј–≤–µ–љ–∞) –≤ —А–∞–Ј–≤–Є—В–Є–Є —Н—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –Є –≤—В–Њ—А–Є—З–љ—Л—Е –Р–У, —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –∞—А—В–µ—А–Є–є –Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–У–Ы–Ц), –Є—И–µ–Љ–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞, —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П —Б–µ—А–і—Ж–∞ –њ–Њ—Б–ї–µ –Ш–Ь, –•–°–Э, –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –Є –љ–µ–і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—Д—А–Њ–њ–∞—В–Є–Є, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–•–Я–Э) (—В–∞–±–ї. 2).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —А–Њ–ї—М –†–Р–Р–° –њ—А–Њ—Б–ї–µ–ґ–Є–≤–∞–µ—В—Б—П –љ–∞ –≤—Б–µ—Е —Н—В–∞–њ–∞—Е —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –Є –њ–Њ—З–µ—З–љ–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ—Г—Г–Љ–Њ–≤.
–°–µ–≥–Њ–і–љ—П –≤ –∞—А—Б–µ–љ–∞–ї–µ –≤—А–∞—З–∞ –Є–Љ–µ—О—В—Б—П —В—А–Є –≥—А—Г–њ–њ—Л –ї–µ–Ї–∞—А—Б—В–≤, —Б–њ–Њ—Б–Њ–±–љ—Л—Е –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –†–Р–Р–° – –Є–Р–Я–§, –±–ї–Њ–Ї–∞—В–Њ—А—Л –Р–Ґ1–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ (–С–†–Р), –њ—А—П–Љ–Њ–є –Є–љ–≥–Є–±–Є—В–Њ—А —А–µ–љ–Є–љ–∞ (–∞–ї–µ—Б–Ї–Є—А–µ–љ).
–Я–µ—А–≤—Л–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–∞–Љ–Є, –±–ї–Њ–Ї–Є—А—Г—О—Й–Є–Љ–Є –†–Р–Р–°, —Б—В–∞–ї–Є –Є–Р–Я–§, —А–∞–Ј—А–∞–±–Њ—В–Ї–∞ –Ї–Њ—В–Њ—А—Л—Е –љ–∞—З–∞–ї–∞—Б—М –µ—Й–µ –≤ 60–—Е –≥–Њ–і–∞—Е XX –≤–µ–Ї–∞, –∞ –њ–µ—А–≤—Л–є –љ–µ–њ–µ–њ—В–Є–і–љ—Л–є –Є–Р–Я–§ –Ї–∞–њ—В–Њ–њ—А–Є–ї –±—Л–ї —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ –≤ 1975 –≥. –Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –Љ–Њ–Љ–µ–љ—В—Г –Є–Р–Я–§ —П–≤–ї—П—О—В—Б—П –≤–∞–ґ–љ–µ–є—И–Є–Љ –Ї–ї–∞—Б—Б–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ—А–Є–Љ–µ–љ—П—О—Й–Є—Е—Б—П –≤ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є–Є, –Є –≤—Е–Њ–і—П—В –≤ –≥—А—Г–њ–њ—Г —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤, —Б–њ–∞—Б–∞—О—Й–Є—Е –ґ–Є–Ј–љ—М (life–saving drugs) –≤ —Б–≤—П–Ј–Є —Б –і–Њ–Ї–∞–Ј–∞–љ–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —Г–ї—Г—З—И–∞—В—М –њ—А–Њ–≥–љ–Њ–Ј –њ—А–Є —Ж–µ–ї–Њ–Љ —А—П–і–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Є –њ–Њ—З–µ—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –Є–Р–Я–§ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –Ї–Њ–љ–Ї—Г—А–µ–љ—В–љ–Њ–Љ –њ–Њ–і–∞–≤–ї–µ–љ–Є–Є –Р–Я–§, —З—В–Њ, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Р–љ–≥ II – –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–Њ—А–∞ –†–Р–Р–°, –∞ —Б –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, —Г–Љ–µ–љ—М—И–∞–µ—В –і–µ–≥—А–∞–і–∞—Ж–Є—О –±—А–∞–і–Є–Ї–Є–љ–Є–љ–∞, –Ї–∞–ї–ї–Є–Ї—А–µ–Є–љ–∞, —Б—Г–±—Б—В–∞–љ—Ж–Є–Є –†. –≠—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –Є–Р–Я–§: —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П, —Г–ї—Г—З—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є—П, –∞–љ—В–Є–њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ, –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Є—Б—В–µ–Љ—Г —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є, —Г–ї—Г—З—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї.
–Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –Є –Њ—Б–љ–Њ–≤–љ—Л–µ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –µ–і–Є–љ—Л –і–ї—П –≤—Б–µ–≥–Њ –Ї–ї–∞—Б—Б–∞ –Є–Р–Я–§. –Ю–і–љ–∞–Ї–Њ –≤—Л–±–Њ—А –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ –Є–Ј –≥—А—Г–њ–њ—Л –Є–Р–Я–§ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –Љ–Њ–ґ–µ—В –Є–Љ–µ—В—М –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ. –Є–Р–Я–§ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є –≥–µ—В–µ—А–Њ–≥–µ–љ–љ—Г—О –≥—А—Г–њ–њ—Г –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Њ—В–ї–Є—З–∞—О—Й–Є—Е—Б—П –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є –Ї–∞–Ї –њ–Њ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ, –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є –Є —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, —В–∞–Ї –Є –њ–Њ –љ–∞–ї–Є—З–Є—О –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –±–∞–Ј—Л –і–ї—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ–Њ —А–∞–Ј–ї–Є—З–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ. –Т–∞–ґ–љ–Њ –њ–Њ–љ–Є–Љ–∞—В—М, —З—В–Њ —Е–Њ—В—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Є–Р–Я–§ —Б–љ–Є–ґ–∞—В—М –Р–Ф –Є –Ј–∞–Љ–µ–і–ї—П—В—М –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –•–°–Э —А–∞—Б—Ж–µ–љ–Є–≤–∞—О—В—Б—П –Ї–∞–Ї –Ї–ї–∞—Б—Б–—Н—Д—Д–µ–Ї—В—Л [14], –Љ–љ–Њ–≥–Є–µ –Њ—А–≥–∞–љ–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –Њ—В–і–µ–ї—М–љ—Л—Е –Є–Р–Я–§ –љ–µ –Љ–Њ–≥—Г—В –±—Л—В—М —Б –њ–Њ–Ј–Є—Ж–Є–є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –њ–µ—А–µ–љ–µ—Б–µ–љ—Л –љ–∞ –≤–µ—Б—М –Ї–ї–∞—Б—Б –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–Ш–љ–≥–Є–±–Є—В–Њ—А—Л –Р–Я–§ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ–Њ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ (–љ–∞–ї–Є—З–Є—О —Б—Г–ї—М—Д–≥–Є–і—А–Є–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л –Є –і—А.), –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ (–љ–∞–ї–Є—З–Є–µ —Н—Д—Д–µ–Ї—В–∞ –њ–µ—А–≤–Њ–≥–Њ –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є—П —З–µ—А–µ–Ј –њ–µ—З–µ–љ—М), –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ –≤—Л–≤–µ–і–µ–љ–Є—П –Є–Ј –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ (—В–Њ–ї—М–Ї–Њ –њ–Њ—З–Ї–∞–Љ–Є –Є–ї–Є –њ–Њ—З–Ї–∞–Љ–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б –њ–µ—З–µ–љ—М—О), —В–Ї–∞–љ–µ–≤–Њ–є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є (—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М —В–Ї–∞–љ–µ–≤—Л–µ –†–Р–Р–°) –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –і–µ–є—Б—В–≤–Є—П (—В–∞–±–ї. 3).
–Ю–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –Є–Ј—Г—З–µ–љ–љ—Л—Е –њ–Њ —И–Є—А–Њ–Ї–Њ–Љ—Г —Б–њ–µ–Ї—В—А—Г –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Є–Р–Я–§ —П–≤–ї—П–µ—В—Б—П —А–∞–Љ–Є–њ—А–Є–ї (–Ґ—А–Є—В–∞—Ж–µ®). –Я—А–µ–њ–∞—А–∞—В —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ–є –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М—О (–њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В —Н–љ–∞–ї–∞–њ—А–Є–ї –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤ 20 —А–∞–Ј), —В–Ї–∞–љ–µ–≤–Њ–є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О (–њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В —Н–љ–∞–ї–∞–њ—А–Є–ї –≤ 3–10 —А–∞–Ј –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В–Ї–∞–љ–Є), –і–ї–Є—В–µ–ї—М–љ—Л–Љ –њ—Г—В–µ–Љ –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Є–Љ–µ–љ—П—В—М –µ–≥–Њ –Њ–і–Є–љ —А–∞–Ј –≤ —Б—Г—В–Ї–Є. –Ю—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–∞—П –±–∞–Ј–∞ –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —А–∞–Љ–Є–њ—А–Є–ї–∞ –њ—А–Є –°–°–Ч, –Њ—Б–љ–Њ–≤–∞–љ–љ–∞—П –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –†–Ъ–Ш —Б –ґ–µ—Б—В–Ї–Є–Љ –Ї–Њ–љ–µ—З–љ—Л–Љ–Є —В–Њ—З–Ї–∞–Љ–Є, –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –љ–∞–Є–±–Њ–ї—М—И–∞—П —Б—А–µ–і–Є –≤—Б–µ—Е –Є–Р–Я–§.
–Р–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М —А–∞–Љ–Є–њ—А–Є–ї–∞ –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –≤ –Ї—А—Г–њ–љ–Њ–Љ –Њ—В–Ї—А—Л—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CARE, –њ—А–Њ–≤–Њ–і–Є–≤—И–µ–Љ—Б—П –≤ —Г—Б–ї–Њ–≤–Є—П—Е —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є. –Т –Є—Б–њ—Л—В–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 11100 –±–Њ–ї—М–љ—Л—Е –Р–У I–II —Б—В., —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Г 8261 –њ–∞—Ж–Є–µ–љ—В–∞. –†–∞–Љ–Є–њ—А–Є–ї –љ–∞–Ј–љ–∞—З–∞–ї–Є –≤ –≤–Є–і–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –≤ –і–Њ–Ј–µ –Њ—В 2,5 –і–Њ 10 –Љ–≥/—Б—Г—В. –І–µ—А–µ–Ј 8 –љ–µ–і–µ–ї—М –ї–µ—З–µ–љ–Є—П –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–∞–Ї –°–Р–Ф, —В–∞–Ї –Є –Ф–Р–Ф –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 13%, –њ—А–Є—З–µ–Љ –і–∞–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –Њ—В–Љ–µ—З–∞–ї—Б—П –Є –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –Р–У (–Ш–°–Р–У). –І–∞—Б—В–Њ—В–∞ –Њ—В–≤–µ—В–∞ –љ–∞ –ї–µ—З–µ–љ–Є–µ (–і–Њ—Б—В–Є–ґ–µ–љ–Є–µ —Ж–µ–ї–µ–≤–Њ–≥–Њ –Р–Ф –љ–Є–ґ–µ 140 –Є 90 –Љ–Љ —А—В.—Б—В. –Є–ї–Є —Б–љ–Є–ґ–µ–љ–Є–µ –Ф–Р–Ф>10 –Љ–Љ —А—В.—Б—В., –Є–ї–Є —Б–љ–Є–ґ–µ–љ–Є–µ –°–Р–Ф>20 –Љ–Љ —А—В.—Б—В. –њ—А–Є –Ш–°–Р–У) —Б–Њ—Б—В–∞–≤–Є–ї–∞ –≤ –≥—А—Г–њ–њ–µ —Б–Є—Б—В–Њ–ї–Њ––і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –Р–У –±–Њ–ї–µ–µ 85%, –∞ –≤ –≥—А—Г–њ–њ–µ –Ш–°–Р–У –±–Њ–ї–µ–µ 70%. –І–Є—Б–ї–Њ –њ–Њ–±–Њ—З–љ—Л—Е —П–≤–ї–µ–љ–Є–є –≤ —Е–Њ–і–µ —В–µ—А–∞–њ–Є–Є, –Њ—Ж–µ–љ–µ–љ–љ–Њ–µ —Г 11100 –±–Њ–ї—М–љ—Л—Е, –±—Л–ї–Њ –љ–µ–≤—Л—Б–Њ–Ї–Є–Љ, —З–∞—Б—В–Њ—В–∞ –Ї–∞—И–ї—П –љ–µ –њ—А–µ–≤—Л—Б–Є–ї–∞ 3% [15].
–Ь–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Є–Р–Я–§ —Б–њ–Њ—Б–Њ–±–љ—Л –≤—Л–Ј—Л–≤–∞—В—М —А–µ–≥—А–µ—Б—Б –У–Ы–Ц –Є —Н—В–Њ—В —Н—Д—Д–µ–Ї—В –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –љ–µ —В–Њ–ї—М–Ї–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Р–Ф, –љ–Њ –Є —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –±–ї–Њ–Ї–∞–і–Њ–є –†–Р–Р–°.
–Ь–µ—В–∞––∞–љ–∞–ї–Є–Ј—Л –†–Ъ–Ш, –≤ –Ї–Њ—В–Њ—А—Л—Е –Є–Ј—Г—З–∞–ї–Є—Б—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–ї–∞—Б—Б–Њ–≤ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤—Л–Ј—Л–≤–∞—В—М —А–µ–≥—А–µ—Б—Б –У–Ы–Ц, —В–∞–Ї–ґ–µ –≤—Л—П–≤–Є–ї–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –Є–Р–Я–§ –љ–∞–і –і—А—Г–≥–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є [16,17].
–°–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —А–∞–Љ–Є–њ—А–Є–ї–∞ —Г–Љ–µ–љ—М—И–∞—В—М –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –У–Ы–Ц –Є–Ј—Г—З–∞–ї–Є –≤ –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –†–Ъ–Ш HYCAR. –Т —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П 115 –±–Њ–ї—М–љ—Л–Љ –Р–У –љ–∞–Ј–љ–∞—З–∞–ї–Є –ї–Є–±–Њ —А–∞–Љ–Є–њ—А–Є–ї –≤ –і–Њ–Ј–∞—Е 1,25 –Љ–≥/—Б—Г—В. –Є 5 –Љ–≥/—Б—Г—В., –ї–Є–±–Њ –њ–ї–∞—Ж–µ–±–Њ. –І–µ—А–µ–Ј 6 –Љ–µ—Б—П—Ж–µ–≤ –Љ–∞—Б—Б–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–ї–∞—Б—М –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ –Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М –≤ –≥—А—Г–њ–њ–∞—Е —А–∞–Љ–Є–њ—А–Є–ї–∞. –С–Њ–ї—М—И–µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –±—Л–ї–Њ –≤ –≥—А—Г–њ–њ–µ —Б –і–Њ–Ј–Њ–є —А–∞–Љ–Є–њ—А–Є–ї–∞ 5 –Љ–≥/—Б—Г—В. [18]. –Т –Њ—В–Ї—А—Л—В–Њ–Љ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–Љ –†–Ъ–Ш —Б–Њ —Б–ї–µ–њ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є RACE —Г 193 –±–Њ–ї—М–љ—Л—Е –Р–У I–II —Б—В. —Б—А–∞–≤–љ–Є–≤–∞–ї–Є –≤–ї–Є—П–љ–Є–µ —А–∞–Љ–Є–њ—А–Є–ї–∞ –Є –∞—В–µ–љ–Њ–ї–Њ–ї–∞ –љ–∞ —Г—А–Њ–≤–љ–Є –Р–Ф –Є –Љ–∞—Б—Б—Г –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц, –Њ—Ж–µ–љ–µ–љ–љ—Г—О —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є. –†–∞–Љ–Є–њ—А–Є–ї –љ–∞–Ј–љ–∞—З–∞–ї–Є –≤ –і–Њ–Ј–µ 2,5 –Љ–≥/—Б—Г—В., –∞—В–µ–љ–Њ–ї–Њ–ї –≤ –і–Њ–Ј–µ 50 –Љ–≥/—Б—Г—В. —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О —Г–і–≤–Њ–µ–љ–Є—П –і–Њ–Ј—Л —З–µ—А–µ–Ј 2 –љ–µ–і–µ–ї–Є. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є—Б–њ—Л—В–∞–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ 6 –Љ–µ—Б. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ –Є —А–∞–Љ–Є–њ—А–Є–ї, –Є –∞—В–µ–љ–Њ–ї–Њ–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–Ј–Є–ї–Є –Ї–∞–Ї –°–Р–Ф, —В–∞–Ї –Є –Ф–Р–Ф, –њ—А–Є—З–µ–Љ –≤ —А–∞–≤–љ–Њ–є —Б—В–µ–њ–µ–љ–Є. –Ю–і–љ–∞–Ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Є–љ–і–µ–Ї—Б–∞ –Љ–∞—Б—Б—Л –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —В–Њ–ї—М–Ї–Њ –≤ –≥—А—Г–њ–њ–µ —А–∞–Љ–Є–њ—А–Є–ї–∞ [19].
–Т–∞–ґ–љ–Њ–є –≤–µ—Е–Њ–є –≤ –Є–Ј—Г—З–µ–љ–Є–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є –Є–Р–Я–§ –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ —Б—В–∞–ї–Њ –Ї—А—Г–њ–љ–Њ–µ –†–Ъ–Ш HOPE (Heart Outcome Prevention Evaluation) [20]. –¶–µ–ї—М—О –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–∞ –Њ—Ж–µ–љ–Ї–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Њ—В –°–°–Ч —Г –±–Њ–ї—М–љ—Л—Е –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –і–≤—Г—Е —Б—В—А–∞—В–µ–≥–Є–є –ї–µ—З–µ–љ–Є—П: –Є–Р–Я–§ —А–∞–Љ–Є–њ—А–Є–ї–Њ–Љ –Є –≤–Є—В–∞–Љ–Є–љ–Њ–Љ –Х. –Т —Н—В–Њ –і–≤–Њ–є–љ–Њ–µ —Б–ї–µ–њ–Њ–µ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б —Д–∞–Ї—В–Њ—А–Є–∞–ї—М–љ—Л–Љ –і–Є–Ј–∞–є–љ–Њ–Љ –±—Л–ї –≤–Ї–ї—О—З–µ–љ 9541 –њ–∞—Ж–Є–µ–љ—В —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤—Б–ї–µ–і—Б—В–≤–Є–µ –≤–Њ–Ј—А–∞—Б—В–∞ (>55 –ї–µ—В), –љ–∞–ї–Є—З–Є—П —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –ї–Є–±–Њ —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ —Б–Њ—Б—Г–і–Њ–≤ –Є–ї–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ (–Р–У, –Ї—Г—А–µ–љ–Є–µ, –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є—П). –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –±–Њ–ї—М–љ—Л—Е, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –±—Л–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц –Є –•–°–Э, –љ–µ–≤—Л—Б–Њ–Ї–Њ–µ —Б—А–µ–і–љ–µ–µ –Є—Б—Е–Њ–і–љ–Њ–µ –Р–Ф (139 –Є 79 –Љ–Љ —А—В.—Б—В.), —Е–Њ—В—П –њ–Њ—З—В–Є –њ–Њ–ї–Њ–≤–Є–љ–∞ –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є–Љ–µ–ї–Є –Р–У, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –і—А—Г–≥–Є—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥–ї–Є –њ–Њ–≤–ї–Є—П—В—М –љ–∞ –Є—Б—Е–Њ–і—Л –ї–µ—З–µ–љ–Є—П. –Ґ–∞–Ї, 76% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–ї—Г—З–∞–ї–Є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ (–≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤—Г—О –Ї–—В—Г (–Р–°–Ъ)), 45% – –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –Ї–∞–ї—М—Ж–Є—П, 40% – β––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, 30% – –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л, 15% – –і–Є—Г—А–µ—В–Є–Ї–Є. –Т —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —З–∞—Б—В–Њ—В–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤, β––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –Є –і–Є—Г—А–µ—В–Є–Ї–Њ–≤ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–∞—Б—М, –∞ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ –Ї–∞–ї—М—Ж–Є—П – —Б–љ–Є–Ј–Є–ї–∞—Б—М –љ–∞ 5%. –Ш—Б—Е–Њ–і–љ–Њ –љ–Є–Ј–Ї–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –Р–Ф –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Њ–±—К—П—Б–љ—П—О—В—Б—П –Є–Љ–µ–љ–љ–Њ —И–Є—А–Њ–Ї–Є–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –†–∞–Љ–Є–њ—А–Є–ї –љ–∞–Ј–љ–∞—З–∞–ї—Б—П, –љ–∞—З–Є–љ–∞—П —Б –і–Њ–Ј—Л 2,5 –Љ–≥/—Б—Г—В., —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —В–Є—В—А–∞—Ж–Є–µ–є –і–Њ 10 –Љ–≥/—Б—Г—В. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Г—О –і–Њ–Ј—Г –Ї –Ї–Њ–љ—Ж—Г –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–ї—Г—З–∞–ї–Є 82% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –∞ –Ї –Ї–Њ–љ—Ж—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (4,5 –≥–Њ–і–∞) – 65% –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я–µ—А–≤–Є—З–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–∞ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–Є, –љ–µ—Д–∞—В–∞–ї—М–љ–Њ–≥–Њ –Ш–Ь –Є –љ–µ—Д–∞—В–∞–ї—М–љ–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ HOPE –±—Л–ї–Њ –Њ—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –і–Њ—Б—А–Њ—З–љ–Њ (–љ–∞ –њ–Њ–ї–≥–Њ–і–∞ —А–∞–љ—М—И–µ) –≤ —Б–≤—П–Ј–Є —Б —П–≤–љ—Л–Љ–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞–Љ–Є —А–∞–Љ–Є–њ—А–Є–ї–∞ –њ–µ—А–µ–і –≤–Є—В–∞–Љ–Є–љ–Њ–Љ –Х. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–∞—Б—М –Њ—В –њ–ї–∞—Ж–µ–±–Њ. –І–∞—Б—В–Њ—В–∞ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –њ–µ—А–≤–Є—З–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Є –≤ –≥—А—Г–њ–њ–µ —А–∞–Љ–Є–њ—А–Є–ї–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 14% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б 17,8% –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Б–љ–Є–ґ–µ–љ–Є—О –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ –љ–∞ 22% (—А<0,001). –Ю—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Њ—В–і–µ–ї—М–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –њ–µ—А–≤–Є—З–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Є —В–∞–Ї–ґ–µ —Б–љ–Є–Ј–Є–ї—Б—П: –Є–љ—Б—Г–ї—М—В–∞ –љ–∞ 32%, –Ш–Ь –љ–∞ 20%, —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–Є –љ–∞ 26%. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —А–∞–Љ–Є–њ—А–Є–ї–∞ –Њ–±–µ—Б–њ–µ—З–Є–ї–Њ —В–∞–Ї–ґ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –•–°–Э (–љ–∞ 23%) –Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ—А–Њ—Ж–µ–і—Г—А —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є (–љ–∞ 15%). –Т–∞–ґ–љ–µ–є—И–Є–Љ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Э–Ю–†–Х —Б—В–∞–ї–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ —А–∞–Љ–Є–њ—А–Є–ї–∞ –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 16% (—А=0,005), –њ—А–Є—З–µ–Љ –Ї—А–Є–≤—Л–µ –Ъ–∞–њ–ї–∞–љ–∞––Ь–∞–є–µ—А–∞ —А–∞–Ј–Њ—И–ї–Є—Б—М —Г–ґ–µ –Ї –њ–µ—А–≤–Њ–Љ—Г –≥–Њ–і—Г –Є –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є —А–∞—Б—Е–Њ–і–Є—В—М—Б—П –і–Њ –Ї–Њ–љ—Ж–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–µ –Ј–∞–≤–Є—Б–µ–ї–Є –Њ—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –і—А—Г–≥–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –±—Л–ї–Є –Ј–љ–∞—З–Є–Љ—Л –і–ї—П —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–Њ–і–≥—А—Г–њ–њ (—Б –°–Ф, –Р–У, –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є–Љ–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П–Љ–Є —Б–Њ—Б—Г–і–Њ–≤, –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ).
–Э–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–∞–Љ–Є–њ—А–Є–ї–∞ —З–∞—Б—В–Њ—В–∞ —А–∞–Ј–≤–Є—В–Є—П –љ–Њ–≤—Л—Е —Б–ї—Г—З–∞–µ–≤ –°–Ф –±—Л–ї–∞ –љ–∞ 33% –љ–Є–ґ–µ, —З–µ–Љ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –њ–ї–∞—Ж–µ–±–Њ.
–Т–∞–ґ–љ—Л–Љ –≤—Л–≤–Њ–і–Њ–Љ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П HOPE —Б—В–∞–ї —В–Њ—В —Д–∞–Ї—В, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –Ї–Њ–љ–µ—З–љ—Л—Е —В–Њ—З–µ–Ї –±—Л–ї–Њ –≥–Њ—А–∞–Ј–і–Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ, —З–µ–Љ –Њ–ґ–Є–і–∞–µ–Љ–Њ–µ –Њ—В —Б–љ–Є–ґ–µ–љ–Є—П –Р–Ф. –Ґ–Њ –µ—Б—В—М –њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —А–∞–Љ–Є–њ—А–Є–ї–∞ —П–≤–љ–Њ –њ—А–Њ—Б—В–Є—А–∞–ї–Є—Б—М –і–∞–ї—М—И–µ –µ–≥–Њ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П. –≠—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—В—М, —З—В–Њ —А–∞–Љ–Є–њ—А–Є–ї –∞–Ї—В–Є–≤–љ–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Њ–≤–∞–ї –љ–∞ –њ—А–Њ—Ж–µ—Б—Б—Л —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П —Б–Њ—Б—Г–і–Њ–≤ –Є –∞—В–µ—А–Њ–≥–µ–љ–µ–Ј–∞.
–°–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Є–Р–Я–§ —В–Њ—А–Љ–Њ–Ј–Є—В—М —А–∞–Ј–≤–Є—В–Є–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –±—Л–ї–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е [21,22]. –Ю–і–љ–∞–Ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г —З–µ–ї–Њ–≤–µ–Ї–∞ –і–∞–ї–Є –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л. –°—А–µ–і–Є –≤—Б–µ—Е –Є–Р–Я–§, —В–µ—Б—В–Є—А–Њ–≤–∞–≤—И–Є—Е—Б—П –љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —В–Њ—А–Љ–Њ–ґ–µ–љ–Є—П –∞—В–µ—А–Њ–≥–µ–љ–µ–Ј–∞ in vivo, –љ–∞–Є–±–Њ–ї—М—И–∞—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–∞—П –±–∞–Ј–∞ –љ–∞–Ї–Њ–њ–ї–µ–љ–∞ –і–ї—П —А–∞–Љ–Є–њ—А–Є–ї–∞ –Є –њ–µ—А–Є–љ–і–Њ–њ—А–Є–ї–∞. –Т —А–∞–Љ–Ї–∞—Е –Є—Б–њ—Л—В–∞–љ–Є—П –Э–Ю–†–Х –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –њ–Њ–і–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ SECURE, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Г 753 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —А–∞–Љ–Є–њ—А–Є–ї–∞ –Ј–∞–Љ–µ–і–ї—П—В—М –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞. –Э–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤—Л—Б–Њ–Ї–Њ–є –і–Њ–Ј—Л —А–∞–Љ–Є–њ—А–Є–ї–∞ (10 –Љ–≥/—Б—Г—В.) –Њ—В–Љ–µ—З–µ–љ–Њ –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ –љ–∞ 37% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –≤ —Б–Њ–љ–љ–Њ–є –∞—А—В–µ—А–Є–Є, –Њ—Ж–µ–љ–Є–≤–∞–≤—И–µ–µ—Б—П –њ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є—О —В–Њ–ї—Й–Є–љ—Л –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –Є–љ—В–Є–Љ–∞/–Љ–µ–і–Є–∞ (–Ъ–Ш–Ь). –Т –≥—А—Г–њ–њ–µ –љ–Є–Ј–Ї–Њ–є –і–Њ–Ј—Л —А–∞–Љ–Є–њ—А–Є–ї–∞ (2,5 –Љ–≥/—Б—Г—В.) —В–Њ–ї—Й–Є–љ–∞ –Ъ–Ш–Ь —В–Њ–ґ–µ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –Љ–µ–љ—М—И–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ, –Њ–і–љ–∞–Ї–Њ —А–∞–Ј–ї–Є—З–Є—П –љ–µ –±—Л–ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ–Є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В —А–∞–Љ–Є–њ—А–Є–ї–∞ –Љ–Њ–ґ–љ–Њ —Б—З–Є—В–∞—В—М –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–Љ, –љ–Њ –µ–≥–Њ —Б–ї–µ–і—Г–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Ї–∞–Ї –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–є [23].
–Р–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ —А–∞–Љ–Є–њ—А–Є–ї–∞, –≤—Л—П–≤–ї–µ–љ–љ–Њ–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SECURE, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –Њ–±—К—П—Б–љ—П–µ—В –≤–Њ –Љ–љ–Њ–≥–Њ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –≤–Њ –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –°–°–Ч, —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Г—О –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є HOPE.
–Я—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Э–Ю–†–Х —Б—В–∞–ї –њ—А–Њ–µ–Ї—В –Э–Ю–†–Х––Ґ–Ю–Ю [24], –њ—А–Є–Ј–≤–∞–љ–љ—Л–є –Њ—Ж–µ–љ–Є—В—М, —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –ї–Є –≤–Њ –≤—А–µ–Љ–µ–љ–Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —А–∞–Љ–Є–њ—А–Є–ї–∞ —Г–Љ–µ–љ—М—И–∞—В—М —З–Є—Б–ї–Њ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є –Є –љ–Њ–≤—Л—Е —Б–ї—Г—З–∞–µ–≤ –°–Ф —Г –±–Њ–ї—М–љ—Л—Е –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–Є–ї–Є 4528 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Э–Ю–†–Х, –Ї–Њ—В–Њ—А—Л–µ –ї–Є–±–Њ –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є –њ—А–Є–љ–Є–Љ–∞—В—М —А–∞–Љ–Є–њ—А–Є–ї 10 –Љ–≥/—Б—Г—В. –≤ –Њ—В–Ї—А—Л—В–Њ–Љ —А–µ–ґ–Є–Љ–µ, –ї–Є–±–Њ –њ–µ—А–µ–≤–Њ–і–Є–ї–Є—Б—М –љ–∞ —А–∞–Љ–Є–њ—А–Є–ї –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –њ–ї–∞—Ж–µ–±–Њ. –Ъ –Ї–Њ–љ—Ж—Г –њ–µ—А–Є–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П (2,6 –ї–µ—В) –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –і–∞–ї—М–љ–µ–є—И–µ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ –њ–µ—А–≤–Є—З–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Є –љ–∞ 17%, –Ш–Ь –љ–∞ 19%, –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ—А–Њ—Ж–µ–і—Г—А —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –љ–∞ 16%, –∞ –љ–Њ–≤—Л—Е —Б–ї—Г—З–∞–µ–≤ –°–Ф –љ–∞ 34%. –°–љ–Є–ґ–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Б–Њ–±—Л—В–Є–є –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–Њ–і–≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤–Ї–ї—О—З–∞—П –њ–Њ–і–≥—А—Г–њ–њ—Л –љ–Є–Ј–Ї–Њ–≥–Њ, —Б—А–µ–і–љ–µ–≥–Њ –Є –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –±—Л–ї–Њ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —А–∞–Љ–Є–њ—А–Є–ї–∞ –љ–µ —В–Њ–ї—М–Ї–Њ —Б–Њ—Е—А–∞–љ—П—О—В—Б—П –≤–Њ –≤—А–µ–Љ–µ–љ–Є, –љ–Њ –Є—Е –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤—Л—И–µ, —З–µ–Љ —Н—В–Њ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Э–Ю–†–Х.
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —А–∞–Љ–Є–њ—А–Є–ї–∞ –њ—А–Є –Ш–Ь, –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, –Є–Ј—Г—З–∞–ї–Њ—Б—М –≤ –Ї—А—Г–њ–љ–Њ–Љ –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ –†–Ъ–Ш AIRE. –Т –Є—Б–њ—Л—В–∞–љ–Є–µ –≤–Ї–ї—О—З–Є–ї–Є 2006 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ—Л–Љ –Ш–Ь –Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є. –†–∞–Љ–Є–њ—А–Є–ї –љ–∞–Ј–љ–∞—З–∞–ї—Б—П –≤ –і–Њ–Ј–µ 5 –Љ–≥/—Б—Г—В., –љ–∞—З–Є–љ–∞—П —Б 3–10 –і–љ—П –±–Њ–ї–µ–Ј–љ–Є, —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —В–Є—В—А–∞—Ж–Є–µ–є –і–Њ 10 –Љ–≥/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 2 –і–љ–µ–є. –Я–µ—А–≤–Є—З–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –±—Л–ї–∞ –Њ–±—Й–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М, –≤—В–Њ—А–Є—З–љ—Л–Љ–Є – –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–µ —Б–Њ–±—Л—В–Є—П (—Б–Љ–µ—А—В—М, –њ–Њ–≤—В–Њ—А–љ—Л–є –Є–љ—Д–∞—А–Ї—В, –Є–љ—Б—Г–ї—М—В, –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є). –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ –≤ —Б—А–µ–і–љ–µ–Љ 15 –Љ–µ—Б. (–Љ–Є–љ–Є–Љ—Г–Љ 6 –Љ–µ—Б.). 59% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ —А–∞–Љ–Є–њ—А–Є–ї–∞ –±—Л–ї–Є –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б—Г, 77% –њ—А–Є–љ–Є–Љ–∞–ї–Є –Р–°–Ъ, 25% – β––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, 56% – –љ–Є—В—А–∞—В—Л. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —А–∞–Љ–Є–њ—А–Є–ї–∞ –Њ–±–µ—Б–њ–µ—З–Є–ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 27%, —Б—В–∞–≤—И–µ–µ –Њ—З–µ–≤–Є–і–љ—Л–Љ —Г–ґ–µ —З–µ—А–µ–Ј 30 –і–љ–µ–є –ї–µ—З–µ–љ–Є—П. –Ю—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –≤—В–Њ—А–Є—З–љ—Л—Е –Ї–Њ–љ–µ—З–љ—Л—Е —В–Њ—З–µ–Ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–Ј–Є–ї—Б—П –љ–∞ 19%. –Я—А–Є —Н—В–Њ–Љ –Ї—А–Є–≤—Л–µ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є —А–∞—Б—Е–Њ–і–Є—В—М—Б—П –љ–∞ –≤—Б–µ–Љ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (–і–Њ 30 –Љ–µ—Б.). –≠—Д—Д–µ–Ї—В —А–∞–Љ–Є–њ—А–Є–ї–∞ —Б–Њ—Е—А–∞–љ—П–ї—Б—П –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–Њ–і–≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (–Љ—Г–ґ—З–Є–љ—Л –Є –ґ–µ–љ—Й–Є–љ—Л, —Б –Р–У –Є –±–µ–Ј –љ–µ–µ, –Є –і—А.). –І–∞—Б—В–Њ—В–∞ –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–∞—Б—М –Њ—В —З–∞—Б—В–Њ—В—Л –Њ—В–Љ–µ–љ—Л –њ–ї–∞—Ж–µ–±–Њ [25].
–Я—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ–Љ AIRE —П–≤–Є–ї–Њ—Б—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ AIREX, —Ж–µ–ї—М—О –Ї–Њ—В–Њ—А–Њ–≥–Њ —Б—В–∞–ї–∞ –Њ—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і–Њ–ї–≥–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є (5 –ї–µ—В) —В–µ—А–∞–њ–Є–Є —А–∞–Љ–Є–њ—А–Є–ї–Њ–Љ –±–Њ–ї—М–љ—Л—Е –Ш–Ь —Б —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є. –Т –Є—Б–њ—Л—В–∞–љ–Є–µ –≤–Ї–ї—О—З–Є–ї–Є 603 –њ–∞—Ж–Є–µ–љ—В–∞ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П AIRE, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є –њ–Њ–ї—Г—З–∞—В—М –ї–Є–±–Њ —А–∞–Љ–Є–њ—А–Є–ї, –ї–Є–±–Њ –њ–ї–∞—Ж–µ–±–Њ. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ –≤ —Б—А–µ–і–љ–µ–Љ 59 –Љ–µ—Б. (–Љ–Є–љ–Є–Љ—Г–Љ 42 –Љ–µ—Б.). –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї 59––Љ—Г –Љ–µ—Б—П—Ж—Г –∞–±—Б–Њ–ї—О—В–љ–∞—П –≤–µ–ї–Є—З–Є–љ–∞ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –±—Л–ї–∞ –љ–∞ 11,4% –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ —А–∞–Љ–Є–њ—А–Є–ї–∞, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —Б–Љ–µ—А—В–Є –љ–∞ 36%. –°—А–µ–і–љ–µ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ґ–Є–Ј–љ–Є –≤ –≥—А—Г–њ–њ–µ —А–∞–Љ–Є–њ—А–Є–ї–∞ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 1,45 –≥. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –љ–µ —В–Њ–ї—М–Ї–Њ –±—Л–ї–∞ –≤–љ–Њ–≤—М –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ –≤—Л—Б–Њ–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —Н—В–Њ–є –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –µ–µ —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –≤–Њ –≤—А–µ–Љ–µ–љ–Є. –С—Л–ї —В–∞–Ї–ґ–µ —Б–і–µ–ї–∞–љ –≤—Л–≤–Њ–і –Њ —В–Њ–Љ, —З—В–Њ «–ї–µ—З–µ–љ–Є–µ —А–∞–Љ–Є–њ—А–Є–ї–Њ–Љ –≤ –і–Њ–Ј–µ 5 –Љ–≥ –і–≤–∞–ґ–і—Л –≤ —Б—Г—В–Ї–Є –њ–Њ—Б–ї–µ –Њ—Б—В—А–Њ–≥–Њ –Ш–Ь, –±—Г–і—Г—З–Є –Њ–і–љ–∞–ґ–і—Л –љ–∞—З–∞—В—Л–Љ, –і–Њ–ї–ґ–љ–Њ –њ—А–Њ–і–Њ–ї–ґ–∞—В—М—Б—П –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ –і–Њ–ї–≥–Њ» [26].
–С–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ —А–∞–Љ–Є–њ—А–Є–ї–∞ –љ–∞ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –њ–Њ–ґ–Є–ї—Л—Е –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь, –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤ –Ї–∞–љ–∞–і—Б–Ї–Њ–Љ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –≤ –Ї–Њ—В–Њ—А–Њ–µ –≤–Ї–ї—О—З–Є–ї–Є 7512 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б—В–∞—А—И–µ 65 –ї–µ—В, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ–Њ—Б–ї–µ –≤—Л–њ–Є—Б–Ї–Є –Є–Ј —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞ —А–∞–Ј–ї–Є—З–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –Р–Я–§ [27]. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ–Њ –≤–ї–Є—П–љ–Є—О –љ–∞ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ —А–∞–Љ–Є–њ—А–Є–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –њ—А–µ–≤–Ј–Њ—И–µ–ї —Н–љ–∞–ї–∞–њ—А–Є–ї, —Д–Њ–Ј–Є–љ–Њ–њ—А–Є–ї, –Ї–∞–њ—В–Њ–њ—А–Є–ї, –Ї–≤–Є–љ–∞–њ—А–Є–ї –Є –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї.
–Ш–љ—В–µ—А–µ—Б–љ—Л–µ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–ї—Г—З–µ–љ—Л –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ –Є—Б—Е–Њ–і–Њ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤–Ї–ї—О—З–∞–≤—И–Є—Е—Б—П –≤ —А–µ–≥–Є—Б—В—А MITRA PLUS. –°—А–µ–і–Є 14608 –±–Њ–ї—М–љ—Л—Е –Ш–Ь —Б –њ–Њ–і—К–µ–Љ–Њ–Љ —Б–µ–≥–Љ–µ–љ—В–∞ ST 4,7% –њ–Њ–ї—Г—З–∞–ї–Є —А–∞–Љ–Є–њ—А–Є–ї, 39,0% – –і—А—Г–≥–Є–µ –Є–Р–Я–§, 56,3% – –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є –Є–Р–Я–§. –Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ —В–µ—А–∞–њ–Є–Є –Є–Р–Я–§ –Є, —З—В–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –Є–Р–Я–§ –ї–µ—З–µ–љ–Є–µ —А–∞–Љ–Є–њ—А–Є–ї–Њ–Љ –Њ–±–µ—Б–њ–µ—З–Є–ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–є –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –Є —З–∞—Б—В–Њ—В—Л –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Є —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е —Б–Њ–±—Л—В–Є–є. –Ю–і–љ–∞–Ї–Њ –њ–Њ —З–∞—Б—В–Њ—В–µ —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –Є–Р–Я–§ –љ–µ –±—Л–ї–Њ [28].
–Ш–љ—В–µ—А–µ—Б–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–ї—Г—З–µ–љ—Л –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –і–≤–Њ–є–љ–Њ–≥–Њ —Б–ї–µ–њ–Њ–≥–Њ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П DIAB–HYCAR, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –≤–ї–Є—П–љ–Є–µ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј —А–∞–Љ–Є–њ—А–Є–ї–∞ (1,25 –Љ–≥/—Б—Г—В.) –љ–∞ —З–∞—Б—В–Њ—В—Г —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Є –њ–Њ—З–µ—З–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г 4912 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ф 2 —В–Є–њ–∞ –Є –љ–µ—Д—А–Њ–њ–∞—В–Є–µ–є, –њ—А–Њ—П–≤–ї—П–≤—И–µ–є—Б—П –Љ–Є–Ї—А–Њ–∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є–µ–є –Є–ї–Є –њ—А–Њ—В–µ–Є–љ—Г—А–Є–µ–є. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —Б—В–Њ–ї—М –љ–Є–Ј–Ї–Њ–є –і–Њ–Ј–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Њ –љ–µ–Ї–Њ—В–Њ—А–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –Р–Ф –Є —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Н–Ї—Б–Ї—А–µ—Ж–Є–Є –±–µ–ї–Ї–∞ —Б –Љ–Њ—З–Њ–є, –Њ–і–љ–∞–Ї–Њ –љ–µ –њ—А–Є–≤–µ–ї–Њ –Ї –Ј–љ–∞—З–Є–Љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –љ–Є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е, –љ–Є –њ–Њ—З–µ—З–љ—Л—Е –Ї–Њ–љ–µ—З–љ—Л—Е —В–Њ—З–µ–Ї [29]. –≠—В–Њ—В —А–µ–Ј—Г–ї—М—В–∞—В –µ—Й–µ —А–∞–Ј –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В, —З—В–Њ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —А–∞–Љ–Є–њ—А–Є–ї–∞ —А–µ–∞–ї–Є–Ј—Г—О—В—Б—П –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –і–Њ–Ј – 10 –Љ–≥/—Б—Г—В.
–Э–µ–і–∞–≤–љ–Њ –Ј–∞–≤–µ—А—И–Є–ї–Њ—Б—М –Ї—А—Г–њ–љ–µ–є—И–µ–µ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ –†–Ъ–Ш ONTARGET, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Б—А–∞–≤–љ–Є–≤–∞–ї–Є—Б—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е –°–°–Ч –Є–ї–Є –°–Ф –±–µ–Ј —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є —Б –њ–Њ–Љ–Њ—Й—М—О —В—А–µ—Е —А–µ–ґ–Є–Љ–Њ–≤ —В–µ—А–∞–њ–Є–Є: –Є–Р–Я–§, –С–†–Р –Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Є–Р–Я–§ + –С–†–Р. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–Є–ї–Є 25620 –±–Њ–ї—М–љ—Л—Е —Б –Ш–С–°, –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—Г–і–Њ–≤, —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Є–ї–Є –°–Ф. –Ш—Б—Е–Њ–і–љ–Њ —Г 89% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–ї–Є—Б—М –°–°–Ч, —Г 69% – –Р–У –Є —Г 38% – –°–Ф. –Я—А–Є –≤–Ї–ї—О—З–µ–љ–Є–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ 80,9% –±–Њ–ї—М–љ—Л—Е –њ—А–Є–љ–Є–Љ–∞–ї–Є –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В—Л, 61,6% – —Б—В–∞—В–Є–љ—Л, 56,9% – β––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, 28,0% – –і–Є—Г—А–µ—В–Є–Ї–Є. –Я–∞—Ж–Є–µ–љ—В–Њ–≤ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–ї–Є –≤ —В—А–Є –≥—А—Г–њ–њ—Л: –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е —А–∞–Љ–Є–њ—А–Є–ї –≤ –і–Њ–Ј–µ 10 –Љ–≥/—Б—Г—В. (n=8502), –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е —В–µ–ї–Љ–Є—Б–∞—А—В–∞–љ –≤ –і–Њ–Ј–µ 80 –Љ–≥/—Б—Г—В. (n=8542) –Є –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О —А–∞–Љ–Є–њ—А–Є–ї–∞ —Б —В–µ–ї–Љ–Є—Б–∞—А—В–∞–љ–Њ–Љ (n=8502). –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 56 –Љ–µ—Б.
–Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ–µ—А–≤–Є—З–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Є, –≤–Ї–ї—О—З–∞–≤—И–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В—М –Њ—В –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –°–°–Ч, –Ш–Ь, –Є–љ—Б—Г–ї—М—В –Є–ї–Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є—О –њ–Њ –њ–Њ–≤–Њ–і—Г —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, –і–Њ—Б—В–Є–≥–ї–Є 16,5% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ —А–∞–Љ–Є–њ—А–Є–ї–∞, 16,7% –≤ –≥—А—Г–њ–њ–µ —В–µ–ї–Љ–Є—Б–∞—А—В–∞–љ–∞ –Є 16,3% –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –Ґ–Њ –µ—Б—В—М –љ–µ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є —А–∞–Љ–Є–њ—А–Є–ї–Њ–Љ, –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є —В–µ–ї–Љ–Є—Б–∞—А—В–∞–љ–Њ–Љ –Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є –Њ–±–Њ–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –І–∞—Б—В–Њ—В–∞ —А–∞–Ј–≤–Є—В–Є—П –Њ—В–і–µ–ї—М–љ—Л—Е –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М, –Є –Њ–±—Й–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М —В–∞–Ї–ґ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Г—Е—Г–і—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї —З–∞—Й–µ –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є: –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –•–Я–Э —Б–Њ—Б—В–∞–≤–Є–ї 1,33 (—А<0,001) [30].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Н—В–Њ –Ї—А—Г–њ–љ–µ–є—И–µ–µ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ –≤—Л—П–≤–Є–ї–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –С–†–Р –љ–∞–і —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є –Є–Р–Я–§ —Г –±–Њ–ї—М–љ—Л—Е –°–°–Ч –Є –°–Ф, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–µ–љ—М—И–µ–є —З–∞—Б—В–Њ—В—Л –∞–љ–≥–Є–Њ–љ–µ–≤—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–µ–Ї–∞. –§–∞–Ї—В–Є—З–µ—Б–Ї–Є —В–µ–ї–Љ–Є—Б–∞—А—В–∞–љ –≤ –і–Њ–Ј–µ 80 –Љ–≥/—Б—Г—В. –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–ї 94% —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–∞–Љ–Є–њ—А–Є–ї–∞ –≤ –і–Њ–Ј–µ 10 –Љ–≥/—Б—Г—В., —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Э–Ю–†–Х. –≠—В–Є –і–∞–љ–љ—Л–µ —Б–Њ–≥–ї–∞—Б—Г—О—В—Б—П —Б —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –†–Ъ–Ш VALIANT, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Н—Д—Д–µ–Ї—В –≤–∞–ї—Б–∞—А—В–∞–љ–∞ —В–∞–Ї–ґ–µ –љ–µ –њ—А–µ–≤–Ј–Њ—И–µ–ї —Н—Д—Д–µ–Ї—В –Ї–∞–њ—В–Њ–њ—А–Є–ї–∞ [31].
–Т—Б–µ —Н—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ J.McMurray –≤ —А–µ–і–∞–Ї—Ж–Є–Њ–љ–љ–Њ–є —Б—В–∞—В—М–µ New England Journal of Medicine –≤—Л—Б–Ї–∞–Ј–∞—В—М –Љ–љ–µ–љ–Є–µ, —З—В–Њ –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –С–†–Р –љ–µ –њ—А–µ–≤–Њ—Б—Е–Њ–і—П—В —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ –Є–Р–Я–§ –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є, –љ–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –і–Њ—А–Њ–ґ–µ, —В–Њ –Њ–±–ї–∞—Б—В—М –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ —Б–≤–Њ–і–Є—В—Б—П –Ї —Б–ї—Г—З–∞—П–Љ –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Є–Р–Я–§ –Є–Ј––Ј–∞ –Ї–∞—И–ї—П [32].
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П ONTARGET –Є–Љ–µ—О—В –±–Њ–ї—М—И–Њ–µ –љ–∞—Г—З–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–Љ –њ–ї–∞–љ–µ. –Ю–љ–Є –µ—Й–µ —А–∞–Ј –Ј–∞—Б—В–∞–≤–ї—П—О—В –Њ–±—А–∞—В–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ—Г—О —А–Њ–ї—М –±—А–∞–і–Є–Ї–Є–љ–Є–љ–∞ –≤ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –±–ї–Њ–Ї–Є—А—Г—О—Й–Є—Е –†–Р–Р–°. –Ш —Е–Њ—В—П –Є–Р–Я–§ –њ–Њ–ї–љ–Њ—Б—В—М—О –љ–µ –±–ї–Њ–Ї–Є—А—Г—О—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Р–љ–≥ II, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –С–†–Р –Њ–љ–Є —Г–Љ–µ–љ—М—И–∞—О—В –і–µ–≥—А–∞–і–∞—Ж–Є—О –±—А–∞–і–Є–Ї–Є–љ–Є–љ–∞ –і–Њ –љ–µ–∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є–Љ–µ—О—Й–Є–µ—Б—П —А–µ–Ј—Г–ї—М—В–∞—В—Л –†–Ъ–Ш —Б —Г—З–∞—Б—В–Є–µ–Љ —А–∞–Љ–Є–њ—А–Є–ї–∞ –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –њ—А–µ–њ–∞—А–∞—В –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–Њ–љ–µ—З–љ—Л–µ —В–Њ—З–Ї–Є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Њ–±—Й—Г—О —Б–Љ–µ—А—В–љ–Њ—Б—В—М, –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –°–°–Ч. –Я–Њ —Б—Г—В–Є –і–µ–ї–∞, —Н—В–Њ –і–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—В—М –Њ—А–≥–∞–љ–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—О –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е —Н—В–∞–њ–∞—Е —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ (–≤–Ї–ї—О—З–∞—П –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Є–є –Ї–∞—Б–Ї–∞–і) –Ї–Њ–љ—В–Є–љ—Г—Г–Љ–∞, –љ–∞—З–Є–љ–∞—П –Њ—В –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –Р–У –Є –°–Ф) –Є –Ј–∞–Ї–∞–љ—З–Є–≤–∞—П —В–µ—А–Љ–Є–љ–∞–ї—М–љ—Л–Љ–Є –Њ—А–≥–∞–љ–љ—Л–Љ–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П–Љ–Є (–•–°–Э). –Я—А–Є —Н—В–Њ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М –≤–∞–ґ–љ–Њ—Б—В—М –њ—А–∞–≤–Є–ї—М–љ–Њ–≥–Њ –≤—Л–±–Њ—А–∞ –і–Њ–Ј–Є—А–Њ–≤–Ї–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ, –Ј–∞—З–∞—Б—В—Г—О –њ–Њ–ґ–Є–Ј–љ–µ–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Ezzati M, Hoorn SV, Rodgers A, et al. 2003. Estimates of global and regional potential health gains from reducing multiple major risk factors. Lancet, 362:271–80.
2. Dzau V, Braunwald E. Resolved and unresolved issues in the prevention and treatment of coronary artery disease: a workshop consensus statement. Am Heart J. 1991 Apr;121(4 Pt 1):1244–63.
3. Victor J. Dzau, Elliott M. Antman, Henry R. Black et al. The cardiovascular disease continuum validated: clinical evidence of improved patient outcomes: part I: Pathophysiology and clinical trial evidence (risk factors through stable coronary artery disease). Circulation. 2006 Dec 19;114(25):2850–70.
4. –Т.–Ш.–Я–Њ–і–Ј–Њ–ї–Ї–Њ–≤, –Т.–Р.–С—Г–ї–∞—В–Њ–≤. –Ь–Є–Њ–Ї–∞—А–і. –Э–µ—Д—А–Њ–љ. –Т–Ј–≥–ї—П–і —З–µ—А–µ–Ј –њ—А–Є–Ј–Љ—Г —Н–≤–Њ–ї—О—Ж–Є–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є. –†–Ь–Ц 2008, 16(11): 1517–1523.
5. Morgan L, Broughton PF, Kalsheker N. Angiotensinogen: molecular biology, biochemistry and physiology. Int J Biochem Cell Biol. 1996;28:1211–22.
6. Carey RM, Siragy HM. Newly recognized components of the renin–angiotensin system: potential roles in cardiovascular and renal regulation. Endocr Rev. 2003;24:261–71.
7. Reudelhuber TL. The renin–angiotensin system: peptides and enzymes beyond angiotensin II. Curr Opin Nephrol Hypertens. 2005;14:155–59.
8. Donoghue M, Hsieh F, Baronas E, et al. A novel angiotensin–converting enzyme–related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1–9. Circ Res. 2000 Sep 1;87(5):E1–9.
9. Tallant EA, Ferrario CM, Gallagher PE. Angiotensin–(1–7) inhibits growth of cardiac myocytes through activation of the mas receptor. Am J Physiol Heart Circ Physiol 2005;289: H1560–H1566.
10. Stanton A. Therapeutic potential of renin inhibitors in the management of cardiovascular disorders. Am J Cardiovasc Drugs. 2003;3:389–94.
11. Ichihara A, Hayashi M, Kaneshiro Y, et al. Inhibition of diabetic nephropathy by a decoy peptide corresponding to the “handle” region for nonproteolytic activation of prorenin. J Clin Invest. 2004;114:1128–35.
12. Phillips MI. Tissue renin–angiotensin systems. In: Izzo JL, Black HR, ed. Hypertension Primer: The Essentials of High Blood Pressure. 2nd ed. Baltimore, MD: Lippincott William & Wilkins; 1999:23–24.
13. Paul M, Poyan Mehr A, Kreutz R. Physiology of local renin–angiotensin systems. Physiol Rev. 2006;86:747–803.
14. Lopez–Sendon J, Swedberg K, McMurray J, et al. Expert consensus document on angiotensin converting enzyme inhibitors in cardiovascular disease. The Task Force on ACE–inhibitors of the European Society of Cardiology. Eur Heart J. 2004 Aug;25(16):1454–70.
15. Kaplan NM. The CARE Study: a postmarketing evaluation of ramipril in 11,100 patients. The Clinical Altace Real–World Efficacy (CARE) Investigators. Clin Ther. 1996 Jul–Aug;18(4):658–70.
16. Dahlof B, Pennert K, Hansson L. Reversal of left ventricular hypertrophy in hypertensive patients. A metaanalysis of 109 treatment studies. Am J Hypertens. 1992 Feb;5(2):95–110.
17. Schmieder RE, Martus P, Klingbeil A. Reversal of left ventricular hypertrophy in essential hypertension. A meta–analysis of randomized double–blind studies. JAMA. 1996 May 15;275(19):1507–13.
18. Lievre M, Gueret P, Gayet C, et al. Remission of left ventricular hypertrophy with ramipril independently of blood pressure changes: the HYCAR study (cardiac hypertrophy and ramipril)] Arch Mal Coeur Vaiss. 1995 Feb;88 Spec No 2:35–42.
19. Agabiti–Rosei E, Ambrosioni E, Dal Palu C, Muiesan ML, Zanchetti A. ACE inhibitor ramipril is more effective than the beta–blocker atenolol in reducing left ventricular mass in hypertension. Results of the RACE (ramipril cardioprotective evaluation) study on behalf of the RACE study group. J Hypertens. 1995 Nov;13(11):1325–34.
20. The Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin–converting–enzyme inhibitor, ramipril, on death from cardiovascular causes,myocardial infarction and stroke in high–risk patients.New Engl J Med 2000;342: 145–153.
21. Pitt B. Potential role of angiotensin–converting enzyme inhibitors in the treatment of atherosclerosis. Eur Heart J 1995;16:49–54.
22. Schoelkens BA, Landgraf W. ACE inhibition and atherosclerosis. Can J Physiol Pharmacol 2002;80:354–9.
23. Lonn E, Yusuf S, Dzavik V, et al. Effects of ramipril and vitamin E on atherosclerosis: the study to evaluate carotid ultrasound changes in patients treated with ramipril and vitamin E (SECURE). Circulation. 2001 Feb 20;103(7):919–25.
24. Bosch J, Lonn E, Pogue J, Arnold JM, Dagenais GR, Yusuf S; HOPE/HOPE–TOO Study Investigators. Long–term effects of ramipril on cardiovascular events and on diabetes: results of the HOPE study extension. Circulation. 2005 Aug 30;112(9):1339–46.
25. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. Lancet. 1993 Oct 2;342(8875):821–8.
26. Hall AS, Murray GD, Ball SG. Follow–up study of patients randomly allocated ramipril or placebo for heart failure after acute myocardial infarction: AIRE Extension (AIREX) Study. Acute Infarction Ramipril Efficacy. Lancet. 1997 May 24;349(9064):1493–7.
27. Pilote L, Abrahamowicz M, Rodrigues E, Eisenberg MJ, Rahme E. Mortality rates in elderly patients who take different angiotensin–converting enzyme inhibitors after acute myocardial infarction: a class effect? Ann Intern Med. 2004 Jul 20;141(2):102–12.
28. Wienbergen H, Schiele R, Gitt AK, et al. Impact of ramipril versus other angiotensin–converting enzyme inhibitors on outcome of unselected patients with ST–elevation acute myocardial infarction. Am J Cardiol. 2002 Nov 15;90(10):1045–9.
29. Michel Marre, Michel Lievre, Gilles Chatellier, et al. on behalf of the DIABHYCAR Study Investigators. Effects of low dose ramipril on cardiovascular and renal outcomes in patients with type 2 diabetes and raised excretion of urinary albumin: randomised, double blind, placebo controlled trial (the DIAB–HYCAR study). BMJ 2004;328;495.
30. The ONTARGET Investigators. Telmisartan, ramipril or both in patients at a high risk for vascular events. N Eng J Med 2008;358:1547–1559
31. Pfeffer M, McMurray J, Velazquez E, et al. Valsartan, captopril or both in myocardial infarction complicated by heart failure, left ventricle dysfunction. N Eng J Med 2003;349:1893–1906
32. McMurray J. ACE–inhibitors in cardiovascular disease – unbeatable? N Eng J Med 2008;358:1615–1616








.gif)



