В патогенезе развития ОКС ведущую роль играет активация тромбоцитов. Назначение двойной антитромбоцитарной терапии, включающей в себя ацетилсалициловую кислоту (АСК) и ингибитор P2Y12 –рецепторов (как правило, клопидогрел), признано обязательным у больных с ОКС как в случаях проведения чрескожного коронарного вмешательства (ЧКВ), так и при консервативной тактике лечения. Вместе с тем у значительного числа больных, несмотря на регулярный прием данной комбинации антитромбоцитарных препаратов, отмечается отсутствие ожидаемого эффекта по предотвращению риска развития тромботических осложнений. Изучение новых антитромбоцитарных препаратов, способных усилить традиционную терапию больных с ОКС и при этом являющихся достаточно безопасными в плане риска возможных кровотечений, остается приоритетным направлением современной кардиологии.
Как известно, процесс активации тромбоцитов и их последующей агрегации осуществляется под действием различных медиаторов, наиболее важными из которых являются тромбоксан А2 и АДФ. АСК блокирует активацию тромбоцитов за счет ингибирования циклооксигеназы и образования тромбоксана А2. Реализация эффектов АДФ происходит через P2Y12 –рецепторы, антагонисты которых являются в настоящее время второй по частоте применения группой антитромбоцитарных препаратов. К необратимым ингибиторам P2Y12 –рецепторов относятся тиенопириды (тиклопидин, клопидогрел и прасугрел), а к обратимым – тикагрелор и кангрелор.
Клопидогрел – наиболее известный на сегодняшний день представитель группы тиенопиридинов [3]. Он, как тиклопидин и прасугрел, относится к пролекарствам. Препарат имеет сложный метаболизм. Абсорбция клопидогрела в кишечнике контролируется особым белком (Р–гликопротеином), кодируемым геном АВСВ1. Только около 15% из абсорбируемого клопидогрела в печени превращается в активный метаболит. Процесс является двухступенчатым (окисление и гидролиз), зависящим от нескольких изоферментов системы цитохрома 450, наиболее важными из которых являются СУР2С19 и СУР3А4. Антитромботический эффект клопидогрела отличается значительной вариабельностью, что может быть обусловлено рядом фармакокинетических факторов, в том числе недостаточной ударной и поддерживающей дозой препарата, нарушением его всасывания, образования активного метаболита из пролекарства (вследствие полиморфизма генов, кодирующих изоферменты системы цитохрома 450), лекарственным взаимодействием.
Доказательства эффективности и безопасности применения клопидогрела у больных с ОКС были получены в крупномасштабных исследованиях CURE, СOMMIT, CLARITY–TIMI 28 и др. [4–6]. При ОКС клопидогрел назначается в нагрузочной дозе 300 мг и 600 мг – в случае процедуры ЧКВ [7–10]. Прием клопидогрела вместе с АСК рекомендовано осуществлять как можно раньше, желательно на догоспитальном этапе, причем в нагрузочной дозе. Поддерживающая доза клопидогрела (которая принимается до 1 года) составляет 75 мг/сут., независимо от того, какая тактика лечения (инвазивная или консервативная) была проведена в остром периоде заболевания. При аортокоронарном шунтировании (АКШ) или других крупных хирургических вмешательствах клопидогрел следует отменять за 5–7 дней до операции, кроме случаев, когда опасность отказа от срочного вмешательства превосходит риск повышенной кровопотери. Клопидогрел может применяться и в качестве монотерапии при невозможности назначения АСК.
Прасугрел характеризуется более быстрым в сравнении с клопидогрелом началом терапевтического действия [3]. Образование активного метаболита в печени также происходит под действием изоферментов системы цитохрома 450 и требует нескольких этапов. Индивидуальная вариабельность эффекта препарата не исключается. В исследовании TRITON–TIMI 38 у больных с ОКС с подъемом и без подъема сегмента ST на ЭКГ и запланированным ЧКВ терапия прасугрелом в сравнении с клопидогрелом ассоциировалась с достоверно меньшим числом сердечно–сосудистых событий, но с большим риском возникновения больших кровотечений, включая фатальные [11]. В настоящее время назначение прасугрела при ОКС ограничено случаями запланированного ЧКВ у лиц, не имеющих высокого риска развития геморрагических осложнений. Назначение прасугрела противопоказано пациентам с инсультом/транзиторной ишемической атакой (ТИА) в анамнезе, не рекомендовано в возрастной группе старше 75 лет (за исключением лиц с сахарным диабетом и повторным инфарктом миокарда), а также при весе менее 60 кг [10]. Не следует назначать прасугрел при предполагаемом экстренном АКШ. Действие препарата не изучено у больных с ОКС, получавших тромболитическую терапию. Нагрузочная доза прасугрела составляет 60 мг, поддерживающая – 10 мг, она может быть назначена в комбинации с АСК на срок не менее 12 мес. у больных, перенесших ОКС.
Тикагрелор является нетиенопиридиновым пероральным обратимым антагонистом P2Y12 –рецепторов прямого действия [3]. Препарат представляет собой активное вещество, которое метаболизируется посредством изофермента СУР3А4 с образованием активного метаболита. Степень ингибирования P2Y12–рецепторов определяется прежде всего содержанием тикагрелора в плазме и, в меньшей степени, – его активного метаболита. Период полувыведения составляет около 12 ч, в связи с чем препарат назначается дважды в сутки. Как и прасугрел, тикагрелор характеризуется более быстрым началом терапевтического действия и обеспечивает более выраженное и стойкое ингибирование активации тромбоцитов по сравнению с клопидогрелом. В то же время восстановление функции тромбоцитов после отмены тикагрелора происходит быстрее по сравнению с клопидогрелом. Наличие более привлекательных фармакологических свойств, а также существующие проблемы, связанные с приемом клопидогрела, послужили основными причинами организации крупномасштабного исследования РLATO (Platelet inhibition and patient outcomes), в котором сравнивалась эффективность и безопасность применения тикагрелора в сравнении с клопидогрелом у больных с ОКС.
В исследование были включены 18 624 больных с ОКС с подъемом и без подъема сегмента ST на ЭКГ и началом симптомов заболевания давностью не более 24 ч [12]. Исследование было двойным слепым рандомизированным проспективным, проводилось на базе 862 центров в 43 странах. Больные с ОКС без подъема сегмента ST на ЭКГ могли участвовать в исследовании при наличии не менее двух из трех следующих критериев: изменения сегмента ST ишемического характера; повышение уровня биомаркеров, свидетельствующих о некрозе миокарда; наличие хотя бы одного дополнительного фактора риска неблагоприятного исхода (возраст 60 лет и старше, инфаркт миокарда, АКШ, ишемический инсульт/ТИА в анамнезе, атеросклероз не менее двух коронарных артерий со стенозом 50% и более, стеноз сонных артерий не менее 50% или реваскуляризация церебральных сосудов в анамнезе, сахарный диабет, заболевание периферических артерий, хроническая почечная недостаточность).
Пациенты с ОКС и подъемом сегмента ST на ЭКГ включались в исследование при наличии: стойкого подъема сегмента ST не менее чем на 0,1 мВ хотя бы в двух смежных отведениях либо впервые возникшей блокады левой ножки пучка Гиса и при планируемом первичном ЧКВ. К основным критериям исключения относились: противопоказания к применению клопидогрела, тромболитическая терапия в течение 24 ч до момента рандомизации, необходимость приема непрямых антикоагулянтов, индексное событие (острое осложнение ЧКВ) или ЧКВ, выполненное до приема первой дозы исследуемого препарата, повышенный риск развития брадикардии, сопутствующее назначение сильных индукторов или ингибиторов изофермента СУР3А4. Пациенты были рандомизированы к приему тикагрелора в нагрузочной дозе 180 мг с последующим переходом на поддерживающую (по 90 мг 2 р./сут.) терапию или прием клопидогрела (300–600 мг – нагрузочная доза и 75 мг/сут. – поддерживающая). Все больные получали АСК в дозе 75–100 мг, за исключением лиц с известной непереносимостью препарата. Пациентам, ранее не получавшим АСК, был рекомендован прием нагрузочной дозы 325 мг (допускался прием доз от 160 до 500 мг). Доза АСК в 325 мг также была разрешена для ежедневного приема в течение 6 мес. после имплантации стента. В случаях необходимости проведения АКШ исследуемый препарат отменялся: клопидогрел за 5 дней, а тикагрелор – за 24–72 ч до операции. Продолжительность наблюдения составила 6–12 мес.
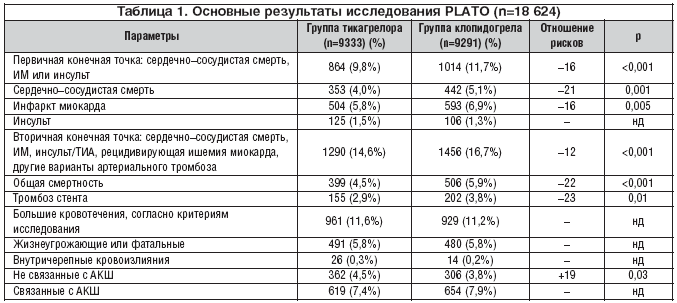
На фоне терапии тикагрелором по сравнению с клопидогрелом наблюдалось достоверное уменьшение общего количества первичных конечных точек (сердечно–сосудистая смерть, инфаркт миокарда или инсульт) на 16% (табл. 1). У получавших тикагрелор по сравнению с лечившимися клопидогрелом отмечалось значимое снижение частоты развития инфаркта миокарда: с 6,9 до 5,8%, сердечно–сосудистой смерти – с 5,1 до 4%. В то же время общее число перенесенных инсультов было практически одинаковым в обеих подгруппах: 1,5 и 1,3%. Геморрагический инсульт встречался несколько чаще на фоне приема тикагрелора, чем клопидогрела – 23 (0,2%) и 13 (0,1%) случаев соответственно. Однако общее их количество было незначительным, и разница недостоверной. Частота комбинированной вторичной конечной точки (смерть от сосудистых причин, инфаркт миокарда, инсульт, рецидивирующая ишемия миокарда, ТИА или другие варианты артериального тромбоза), а также смерти от всех причин была достоверно ниже в группе тикагрелора по сравнению с клопидогрелом (табл. 1). Положительный эффект тикагрелора был более выраженным у больных с исходно положительным уровнем тропонина по сравнению с тропониннегативными пациентами, а также у лиц с окончательным диагнозом инфаркта миокарда по сравнению с теми, у которых при выписке был диагноз нестабильной стенокардии. Большая эффективность тикагрелора по сравнению с клопидогрелом отмечалась в различных подгруппах больных, однако была ниже у пациентов с пониженной массой тела, у лиц, не принимавших гиполипидемические препараты, а также у жителей Северной Америки.
Не было выявлено значимых различий между группами в частоте больших, а также фатальных и угрожающих жизни кровотечений. Интересно отметить, что риск больших кровотечений, включая фатальные внутричерепные, не связанных с процедурой АКШ, был несколько выше в группе тикагрелора по сравнению с клопидогрелом. В то же время количество связанных с АКШ кровотечений было меньше среди лиц, получавших тикагрелор.
Отдельно были проанализированы результаты 13 408 (72%) больных с запланированной на этапе рандомизации инвазивной стратегией лечения [13]. У 49,1% пациентов был диагностирован ОКС с подъемом сегмента ST на ЭКГ и у 50,9% – ОКС без подъема сегмента ST на ЭКГ. Во время первой госпитализации ЧКВ было проведено у 10 298 (72%) больных, а АКШ – у 782 (5,8%) пациентов. Среднее время до проведения ЧКВ составило 2,4 (0,8–20,1) ч после рандомизации у больных с ОКС без подъема сегмента ST на ЭКГ и 0,5 (0,2–1) ч при ОКС с подъемом сегмента ST на ЭКГ. Среднее время до проведения АКШ составило 6 (3–10) дней. Общее количество инфарктов миокарда, инсультов и случаев сердечно–сосудистой смерти на фоне терапии тикагрелором достоверно уменьшилось на 16% (табл. 2).
Важно подчеркнуть, что преимущества тикагрелора в отношении первичной конечной точки отмечались в различных подгруппах и не зависели от нагрузочной дозы клопидогрела. Большие кровотечения одинаково часто встречались как у принимавших тикагрелор, так и у лечившихся клопидогрелом. Число случаев тромбоза стента было достоверно ниже в группе тикагрелора, причем как при использовании стентов с лекарственным покрытием, так и без него. Частота случаев определенных тромбозов стента у больных, получавших тикагрелор, была достоверно ниже как через 30 дней, так и через 360 дней наблюдения в сравнении с лечившимися клопидогрелом, включая и тех пациентов, кто принимал нагрузочную дозу препарата 600 мг и более.
При анализе фрагмента исследования, включившего 1261 пациента, подвергнутого процедуре АКШ, в течение 7 дней после последнего приема исследуемого препарата не было выявлено достоверной разницы в снижении количества первичных конечных точек (10,6% в группе тикагрелора и 13,1% – клопидогрела). При этом среди принимавших тикагрелор наблюдалось достоверное уменьшение общей смертности на 51%, а сердечно–сосудистой – на 48%, как в ранние, так и в поздние сроки после операции [14].
Среди больных, включенных в исследование РLATO, у 5216 (28%) изначально на этапе рандомизации предполагалась консервативная стратегия лечения [15]. В этой группе абсолютное большинство составляли пациенты с ОКС без подъема сегмента ST на ЭКГ (91,3%), т.к., согласно условиям данного клинического исследования, при наличии ОКС с подъемом сегмента ST исходно планировалось первичное ЧКВ. По сравнению с больными с запланированной инвазивной стратегией лечения среди лечившихся консервативно преобладали лица более старшего возраста, было больше женщин, чаще отмечались сердечно–сосудистые факторы риска, такие как сахарный диабет, перенесенные инфаркт миокарда и инсульт в анамнезе, заболевания периферических артерий, хроническая сердечная и почечная недостаточность. При этом среди лечившихся консервативно повышенный уровень тропонина выявлялся в 75%, депрессия сегмента ST на ЭКГ в – 63%, значения индекса риска TIMI – в 89% случаев; для сравнения: в группе инвазивного лечения эти значения составляли 87, 46 и 69% соответственно. Таким образом, очевидно, что больные, у которых первоначально предполагалось консервативное лечение по профилю риска сердечно–сосудистых осложнений, не только не уступали, но и по ряду показателей превосходили тех, для кого исходно планировалось инвазивное вмешательство. Эти данные, по–видимому, соответствуют ситуации лечения больных с ОКС без подъема сегмента ST высокого риска в реальной клинической практике, с одной стороны, а с другой, отражают вклад стран, участвующих в исследовании РLATO, где инвазивное лечение малодоступно. Тем не менее, даже в данной группе коронароангиография была выполнена в 42%, а за весь период исследования – в 55% случаев. По ее итогам ЧКВ во время первой госпитализации было проведено у 20%, а АКШ – у 4% пациентов, а за весь период исследования – у 29 и 11% больных соответственно.
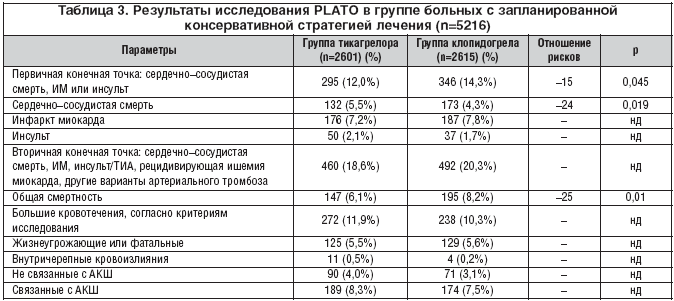
В группе лечившихся консервативно на фоне терапии тикагрелором по сравнению с клопидогрелом также наблюдалось достоверное уменьшение общего количества первичных конечных точек, сосудистой и общей смертности (табл. 3). Достоверных различий по частоте инфаркта миокарда, других артериальных тромботических событий, больших кровотечений между группами отмечено не было, что, очевидно, связано с меньшим числом наблюдений и соответствующей потерей статистической значимости. Следует отметить, что в группе лечившихся консервативно по сравнению с получившими инвазивное лечение частота первичных конечных точек была значительно выше, что отмечалось начиная с первого месяца наблюдения. Особенно отчетливо это заметно на подгруппе из 3948 больных, в которой в независимости от первоначальных намерений во время всего периода наблюдения инвазивное лечение не проводилось. У них применение тикагрелора также сопровождалось достоверным снижением первичных конечных точек на 19%, что составило 12,2 и 15,2% у получавших тикагрелор и клопидогрел соответственно.
Таким образом, РLATO явилось первым крупномасштабным исследованием, в котором была продемонстрирована клиническая эффективность тикагрелора в отношении снижения частоты развития основных сосудистых событий у больных с ОКС без существенного повышения риска кровотечений. Преимущества тикагрелора перед клопидогрелом наблюдались относительно снижения риска развития инфаркта миокарда, общей и сердечно–сосудистой смертности, но не в отношении инсульта. Большая эффективность тикагрелора по сравнению с клопидогрелом отмечалась как в ранние (в первые 30 дней), так и в более поздние (с 31 по 360–й день) сроки лечения. Положительный эффект был очевиден в независимости от планируемой стратегии лечения (инвазивной или консервативной) у больных с ОКС, а также от приема более высоких нагрузочных доз клопидогрела. Следует, однако, отметить, что, несмотря на положительное влияние тикагрелора, тактика консервативной терапии у пациентов высокого и умеренного риска не всегда оправданна, это показал анализ подгруппы больных, которым во время всего периода наблюдения инвазивное лечение не проводилось. Эти данные согласуются с результатами предыдущих наблюдений и особенно актуальны для Российской Федерации, т.к. у нас превалирует консервативная терапия, особенно у больных с ОКС без подъема сегмента ST на ЭКГ.
Более значимое снижение риска развития тромботических эпизодов на терапии тикагрелором, по всей видимости, обусловлено более быстрым и интенсивным ингибированием P2Y12–рецепторов тромбоцитов. При назначении нагрузочной дозы клопидогрела в 600 мг требуется 2–4 ч для достижения 50% ингибирования агрегации тромбоцитов, и тот же эффект достигается через 30 мин. при приеме 180 мг тикагрелора или 60 мг прасугрела. Кроме того, существует достаточно большая группа больных с наличием дефективных вариантов аллелей системы цитохрома 450, что ассоциируется с замедлением образования активного метаболита клопидогрела, недостаточным подавлением функции тромбоцитов при его приеме, а также с более высоким риском сердечно–сосудистых осложнений после ОКС и ЧКВ.
К преимуществам тикагрелора также относится обратимый характер ингибирования P2Y12–рецепторов тромбоцитов, что означает более быстрое прекращение антиагрегантного эффекта после отмены препарата. Это обстоятельство представляется важным при инвазивных вмешательствах, а также перед предстоящей процедурой АКШ. Хотя частота больших кровотечений на фоне приема тикагрелора была не ниже, чем при назначении клопидогрела, следует учесть, что более интенсивное ингибирование функции тромбоцитов не сопровождалось увеличением частоты больших кровотечений. Это выгодно отличает тикагрелор от прасугрела, чей более выраженный антиагрегантный эффект сопровождается значимым увеличением риска больших кровотечений.
Тикагрелор несколько чаще, чем клопидогрел отменялся в связи с развитием нежелательных явлений: у 7,4 и 6% пациентов соответственно (р<0,001). Одышка чаще регистрировалась в группе тикагрелора, чем клопидогрела (13,8 vs 7,8%, р<0,001). Появление одышки, как правило, носило преходящей характер и не было связано с ухудшением функции сердечно–сосудистой системы и легких. Одышка стала причиной отмены препарата лишь у 0,9% больных, принимавших тикагрелор. При мониторировании ЭКГ у принимавших тикагрелор в первую неделю достоверно чаще, чем у лечившихся клопидогрелом, отмечались паузы. Паузы, как правило, наблюдались у лиц, уже имевших нарушения проводящей системы сердца. К 30–му дню лечения количество пауз значительно уменьшилось в обеих группах, и разница нивелировалась. С возможной причиной возникновения одышки и пауз связывают нарушение обратного захвата аденозина эритроцитами под действием тикагрелора.
Как уже было отмечено, у 1814 пациентов из США и Канады положительный эффект тикагрелора не был подтвержден. Количество первичных конечных точек у принимавших тикагрелор в сравнении с клопидогрелом было 11,9% vs 9,6%, р–нд. Разница в результатах, полученных у пациентов из Северной Америки и других регионов, возможно, объясняется как фактом случайности, так и особенностями популяции и неодинаковыми подходами в клинической практике, в частности приемом более высоких доз АСК.
Европейское общество кардиологов рекомендовало прием тикагрелора (в нагрузочной дозе 180 мг и 90 мг 2 р./сут. – в поддерживающей) всем больным с ОКС, в независимости от планируемой стратегии лечения (инвазивной или консервативной). Если пациенты в самом начале заболевания получали клопидогрел, его следует заменить на тикагрелор. Прием клопидогрела у больных с ОКС возможен в случаях отсутствия тикагрелора или прасугрела. Продолжительность терапии ингибиторами P2Y12– рецепторов у больных, перенесших ОКС, составляет не менее 12 мес. У пациентов, находящихся на терапии ингибиторами P2Y12–рецепторов, в случаях планового оперативного вмешательства (включая АКШ) тикагрелор и клопидогрел отменяются за 5 сут., а прасугрел – за 7 сут. Это не касается лиц с высоким риском ишемических сосудистых событий. В отдельных случаях у получающих терапию клопидогрелом возможны проведение генотипирования и изучение функции тромбоцитов [1].
Более сдержанны рекомендации Американской коллегии кардиологов/Американской ассоциации сердца/специалистов интервенционной ардиологии [10]. У больных с ОКС, подвергшихся ЧКВ, в равной степени допустимо применение тикагрелора, прасугрела и клопидогрела вначале в нагрузочной, а затем – в поддерживающей дозе. Применение тикагрелора не изучено у лиц, получивших тромболитическую терапию. Больным без ОКС, подвергшимся процедуре ЧКВ, рекомендовано назначение клопидогрела. Не рекомендовано рутинное генотипирование и изучение функции тромбоцитов у всех больных, получающих клопидогрел, хотя в отдельных случаях у пациентов высокого риска и с предполагаемым неадекватным антиагрегантным эффектом клопидогрела такой поход возможен. В данной ситуации в качестве альтернативы клопидогрелу могут назначаться тикагрелор и прасугрел. Доза АСК при ее комбинации с тикагрелором не должна превышать 75–100 мг/сут.

Литература
1. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST segment elevation. The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST segment elevation of the European Society of Cardiology // Eur. Heart J. 2011. Vol. 32. P. 2999–3054.
2. Thom T., Haase N., Rosamond W. et. al. American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics – 2006 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee // Circulation. 2006. Vol. 113. P. 85–151.
3. Kei A.A., Florentin M. et. al. Antiplatelet Drugs: What comes next ? Clinical and Applied Thrombosis // Hemostasis. 2011. Vol. 17(1). P. 9–26.
4. Effect of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST elevation. The CURE trial investigators // N. Engl. J. Med. 2001. Vol. 345. P. 494–502.
5. COMMIT collaborative group. Addition of clopidogrel to aspirin in 45852 patients with acute myocardial infarction: randomised placebo–controlled trial // Lancet. 2005. Vol. 366. P. 1607–21.
6. Sabatine M.S., Cannon C.P., Gibson C.M. et. al. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST–segment elevation // N. Engl. J. Med. 2005. Vol. 352.
7. Guidelines for the diagnosis and treatment of non ST segment elevation acute coronary syndromes. The Task Force for the diagnosis and treatment of non ST segment elevation acute coronary syndromes of the European Society of Cardiology // Eur. Heart J. Advance Access published. 2007. 63 p.
8. Bcepoccийское научное общество кардиологов. Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST электрокардиограммы // Российские рекомендации. – М., 2007.
9. O,Connor R.E, Bossaert L., Arntz HR et. al. Acute coronary syndromes: 2010 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science With Treatment Recommendations // Circulation. 2010. Vol. 122 (suppl 2). P. S422–S465.
10. Levine G.N. et al. 2011 ACCF/AHA/SCAI Guideline for percutaneous coronary intervention. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions // J. Amer. Coll. Cardiol. 2011. Vol 58, № 24. P. e44–122.
11. Wiviotti S.D. Braunwald E. et. al. For the TRITON–TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes // N. Engl. J. Med. 2007. Vol. 357. P. 2001–2015.
12. Wallentin L., Becker R.C., Budaj A. et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes // N. Engl. J. Med. 2009. Vol. 361 (11). P. 1045–1057.
13. Cannon C.P., Harrington R.A., James S. et al. Comparison of ticagrelor with clopidogrel in patients with a planned invasive strategy for acute coronary syndromes (PLATO): a randomised double–blind study // Lancet. 2010. Vol. 375 (9711). P. 283–293.
14. Held C., Asenblad N., Bassand J.P. et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes undergoing coronary artery bypass surgery, results from the PLATO // J. Amer. Coll. Cardiol. 2011.Vol 57. P. 672–684.
15. James S.K., Roe M.T., Cannon C.P. et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes intended for non–invasive management: substudy from prospective randomized PLATelet inhibition and patient Outcomes (PLATO) Trial // Br. Med. J. 2011. Vol. 342. P. 3527.












