–Ю–і–љ–Є–Љ –Є–Ј —Б–Є–љ–і—А–Њ–Љ–Њ–≤ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є, —Б –Ї–Њ—В–Њ—А—Л–Љ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤—А–∞—З-–љ–µ–≤—А–Њ–ї–Њ–≥ –≤ —Б–≤–Њ–µ–є –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є —А–∞–±–Њ—В–µ, —П–≤–ї—П–µ—В—Б—П —Б–Є–љ–і—А–Њ–Љ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –њ–Њ—Б—В–Є–љ—Б—Г–ї—М—В–љ–Њ–є (—В–∞–ї–∞–Љ–Є—З–µ—Б–Ї–Њ–є) –±–Њ–ї–Є [2]. –Т 1906 –≥. —Д—А–∞–љ—Ж—Г–Ј—Б–Ї–Є–µ –≤—А–∞—З–Є – –љ–µ–≤—А–Њ–њ–∞—В–Њ–ї–Њ–≥ J. Dejerine (1849–1917) –Є –њ–∞—В–Њ–ї–Њ–≥ G. Roussy (1874–1948) – —Б–Њ–Њ–±—Й–Є–ї–Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–Љ—Г —Б–Њ–Њ–±—Й–µ—Б—В–≤—Г –Њ –љ–Њ–≤–Њ–Љ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Є–љ—Б—Г–ї—М—В, –Ї–Њ—В–Њ—А—Л–є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є: –Ї–Њ–љ—В—А–∞–ї–∞—В–µ—А–∞–ї—М–љ—Л–Љ–Є –≥–µ–Љ–Є–∞–ї–≥–Є—П–Љ–Є (–±–Њ–ї–Є –љ–µ—Б—В–µ—А–њ–Є–Љ–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞ —Б –Њ—Й—Г—Й–µ–љ–Є—П–Љ–Є –ї–Њ–Љ–Њ—В—Л, –ґ–ґ–µ–љ–Є—П, –≤—Л–Ї—А—Г—З–Є–≤–∞–љ–Є—П –Є –і—А.), —З–∞—Б—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–Љ–Є—Б—П –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –≥–Є–њ–µ—А–њ–∞—В–Є–µ–є (–∞–ї–ї–Њ–і–Є–љ–Є–µ–є), –њ—А–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–є –Є –≥–ї—Г–±–Њ–Ї–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–є –њ–Њ–ї–Њ–≤–Є–љ—Л —В–µ–ї–∞; –Ї–Њ–љ—В—А–∞–ї–∞—В–µ—А–∞–ї—М–љ–Њ–є —Б–µ–љ—Б–Є—В–Є–≤–љ–Њ–є –≥–µ–Љ–Є–∞—В–∞–Ї—Б–Є–µ–є –Є –Ї–Њ–љ—В—А–∞–ї–∞—В–µ—А–∞–ї—М–љ–Њ–є –≥–Њ–Љ–Њ–љ–Є–Љ–љ–Њ–є –≥–µ–Љ–Є–∞–љ–Њ–њ—Б–Є–µ–є. –Ґ–∞–Ї–ґ–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–Њ–ґ–љ–Њ –љ–∞–±–ї—О–і–∞—В—М –њ—А–Є—Б—В—Г–њ—Л –љ–∞—Б–Є–ї—М—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Б–Љ–µ—Е–∞ –Є–ї–Є –њ–ї–∞—З–∞ –Є –Ї–Њ–љ—В—А–∞–ї–∞—В–µ—А–∞–ї—М–љ—Л–µ –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ-—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –≤ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є —Г—Б—В–∞–љ–Њ–≤–Ї–Є —А—Г–Ї–Є —Б —Е–Њ—А–µ–Њ–∞—В–µ—В–Њ–Є–і–љ—Л–Љ–Є –і–≤–Є–ґ–µ–љ–Є—П–Љ–Є –≤ –њ–∞–ї—М—Ж–∞—Е.
–Я–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П–Љ [2, 4, 7, 9], —Б–Є–љ–і—А–Њ–Љ –Ф–µ–ґ–µ—А–Є–љ–∞––†—Г—Б—Б–Є —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Њ–±–ї–∞—Б—В–Є –њ–µ—А—Д–Њ—А–Є—А—Г—О—Й–Є—Е –∞—А—В–µ—А–Є–є —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Є–љ—Д–∞—А–Ї—В–∞ –≤ –Њ–±–ї–∞—Б—В–Є –≤–µ–љ—В—А–Њ–њ–Њ—Б—В–µ—А–Є–Њ–Љ–µ–і–Є–∞–ї—М–љ—Л—Е –Є –≤–µ–љ—В—А–Њ–њ–Њ—Б—В–µ—А–Є–Њ–ї–∞—В–µ—А–∞–ї—М–љ—Л—Е —П–і–µ—А —В–∞–ї–∞–Љ—Г—Б–∞. –Т –Ї–ї–Є–љ–Є–Ї–µ –љ–µ—А–≤–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Б–Є–љ–і—А–Њ–Љ–∞ –Ф–µ–ґ–µ—А–Є–љ–∞––†—Г—Б—Б–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ 1-–≥–Њ –≥–Њ–і–∞ –њ—А–Є–Љ–µ—А–љ–Њ —Г 8% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Њ—Б—В—А–Њ–µ –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П. –С–Њ–ї–Є –Љ–Њ–≥—Г—В –≤–Њ–Ј–љ–Є–Ї–љ—Г—В—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–Њ—Б–ї–µ –Є–љ—Б—Г–ї—М—В–∞, —Г 50% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±–Њ–ї—М –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ —В–µ—З–µ–љ–Є–µ 1-–≥–Њ –Љ–µ—Б. –њ–Њ—Б–ї–µ –Є–љ—Б—Г–ї—М—В–∞, —Г 37% – –≤ –њ–µ—А–Є–Њ–і –Њ—В 1 –Љ–µ—Б. –і–Њ 2 –ї–µ—В, —Г 11% – –њ–Њ—Б–ї–µ 2 –ї–µ—В [2, 4, 10]. –С–Њ–ї–Є –Њ—Й—Г—Й–∞—О—В—Б—П –≤ –±–Њ–ї—М—И–µ–є —З–∞—Б—В–Є —В–µ–ї–∞, –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е –±–Њ–ї–µ–≤—Л–µ –Њ—Й—Г—Й–µ–љ–Є—П –Љ–Њ–≥—Г—В –±—Л—В—М –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ—Л —В–Њ–ї—М–Ї–Њ –≤ –Њ–і–љ–Њ–є —А—Г–Ї–µ, –љ–Њ–≥–µ –Є–ї–Є –ї–Є—Ж–µ. –Ґ–∞–Ї–Є–µ –њ–∞—Ж–Є–µ–љ—В—Л —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В –±–Њ–ї–µ–≤—Л–µ –Њ—Й—Г—Й–µ–љ–Є—П –Ї–∞–Ї «–ґ–≥—Г—З–Є–µ», «–љ–Њ—О—Й–Є–µ», «–≤—Л–Ї—А—Г—З–Є–≤–∞—О—Й–Є–µ», «–≤—Л—А—Л–≤–∞—О—Й–Є–µ», «–Є–Ј–Љ–∞—В—Л–≤–∞—О—Й–Є–µ», –Њ—В –Ї–Њ—В–Њ—А—Л—Е –љ–µ—В –љ–Є–Ї–∞–Ї–Њ–≥–Њ —Б–њ–∞—Б–µ–љ–Є—П. –С–Њ–ї—М –Љ–Њ–≥—Г—В —Г—Б–Є–ї–Є–≤–∞—В—М —А–∞–Ј–ї–Є—З–љ—Л–µ –≤–љ–µ—И–љ–Є–µ —Д–∞–Ї—В–Њ—А—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –і–≤–Є–ґ–µ–љ–Є—П, —Е–Њ–ї–Њ–і, —В–µ–њ–ї–Њ, —Н–Љ–Њ—Ж–Є–Є [2, 5]. –Э–Њ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е —Н—В–Є –ґ–µ —Д–∞–Ї—В–Њ—А—Л –Љ–Њ–≥—Г—В –њ—А–Є–≤–Њ–і–Є—В—М –Є –Ї –Њ–±—А–∞—В–љ–Њ–Љ—Г —Н—Д—Д–µ–Ї—В—Г –≤ –≤–Є–і–µ –Њ—Б–ї–∞–±–ї–µ–љ–Є—П –±–Њ–ї–Є. –Я—А–Є–Љ–µ—А–љ–Њ —Г 71% –±–Њ–ї—М–љ—Л—Е –љ–∞–±–ї—О–і–∞—О—В—Б—П –њ–∞—А–µ—Б—В–µ–Ј–Є–Є –Є –∞–ї–ї–Њ–і–Є–љ–Є—П. –°—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –њ–Њ–ї–Њ–Љ –Є –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ –љ–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П [3].
–Ґ–∞–Ї–Њ–µ –Љ–љ–Њ–≥–Њ–Њ–±—А–∞–Ј–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є —Б–Є–љ–і—А–Њ–Љ–∞ –Ф–µ–ґ–µ—А–Є–љ–∞––†—Г—Б—Б–Є —З–∞—Б—В–Њ –≤—Л–Ј—Л–≤–∞–µ—В —Б–ї–Њ–ґ–љ–Њ—Б—В–Є –Ї–∞–Ї –љ–∞ —Н—В–∞–њ–µ –µ–≥–Њ –њ–µ—А–≤–Є—З–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, —В–∞–Ї –Є –ї–µ—З–µ–љ–Є—П. –Т–Њ-–њ–µ—А–≤—Л—Е, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –±–Њ–ї–µ–≤—Л—Е –Є –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –љ–∞ —Д–Њ–љ–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–≥–Њ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –≤ —А–∞–љ–љ–µ–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ —З–∞—Б—В–Њ –Љ–∞—Б–Ї–Є—А—Г–µ—В—Б—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Њ—З–∞–≥–Њ–≤–Њ–є –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є –Є –љ–µ–і–Њ–Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П –њ–∞—Ж–Є–µ–љ—В–Њ–Љ. –Я–Њ—А–Њ–є —В–Њ–ї—М–Ї–Њ –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, —В—А—Г–і–љ–Њ –њ–Њ–і–і–∞—О—Й–µ–≥–Њ—Б—П –ї–µ—З–µ–љ–Є—О, –Ј–∞—Б—В–∞–≤–ї—П–µ—В –њ—А–Є–љ–Є–Љ–∞—В—М –Љ–µ—А—Л –њ–Њ –њ–Њ–Є—Б–Ї—Г –љ–Њ–≤–Њ–є —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П —В–∞–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–є –Є–Љ–µ–љ–љ–Њ –љ–∞ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –±–Њ–ї–Є.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–ї—П –ї–µ—З–µ–љ–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –±–Њ–ї–Є –њ—А–Є —Б–Є–љ–і—А–Њ–Љ–µ –Ф–µ–ґ–µ—А–Є–љ–∞––†—Г—Б—Б–Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–µ –Љ–µ—В–Њ–і—Л, –≤–Ї–ї—О—З–∞—П –Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–µ [9], –љ–Њ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–Љ –≤ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –≤—Б–µ –ґ–µ –Њ—Б—В–∞–µ—В—Б—П —В–µ—А–∞–њ–Є—П —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–Љ–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –±–Њ–ї–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є [7–10]. –Ю–±—Л—З–љ–Њ –≤ —Б—Е–µ–Љ—Г –ї–µ—З–µ–љ–Є—П –≤–Ї–ї—О—З–∞—О—В—Б—П –њ—А–µ–њ–∞—А–∞—В—Л —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –≥—А—Г–њ–њ [10], –Њ–±–ї–∞–і–∞—О—Й–Є–µ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –І–∞—Й–µ –≤—Б–µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Э–Я–Т–Я), –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–Њ–≤, –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В–Њ–≤, –∞–љ–µ—Б—В–µ—В–Є–Ї–Њ–≤ –Є –і—А. [7].
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –¶–µ–ї—М—О –љ–∞—И–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–∞ —А–∞–Ј—А–∞–±–Њ—В–Ї–∞ –і–Њ—Б—В—Г–њ–љ–Њ–є –Є —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П —Б–Є–љ–і—А–Њ–Љ–∞ –Ф–µ–ґ–µ—А–Є–љ–∞––†—Г—Б—Б–Є, –Ї–Њ—В–Њ—А–∞—П –Љ–Њ–≥–ї–∞ –±—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П —Б —А–∞–≤–љ—Л–Љ —Г—Б–њ–µ—Е–Њ–Љ –≤—А–∞—З–∞–Љ–Є –Ї–∞–Ї —Б—В–∞—Ж–Є–Њ–љ–∞—А–љ—Л—Е, —В–∞–Ї –Є –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ-–њ–Њ–ї–Є–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Њ—В–і–µ–ї–µ–љ–Є–є.
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л
–Т –њ–µ—А–Є–Њ–і —Б 2009 –њ–Њ 2013 –≥. –љ–∞–Љ–Є –±—Л–ї–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Њ 43 –њ–∞—Ж–Є–µ–љ—В–∞ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 56–74 –ї–µ—В, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В –Є –Є–Љ–µ—О—Й–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –њ–Њ—Б—В–Є–љ—Б—Г–ї—М—В–љ–Њ–є –±–Њ–ї–Є –≤ —А–∞–Љ–Ї–∞—Е —Б–Є–љ–і—А–Њ–Љ–∞ –Ф–µ–ґ–µ—А–Є–љ–∞––†—Г—Б—Б–Є. –Т —Б—А–µ–і–љ–µ–Љ —Б—А–Њ–Ї –љ–∞–±–ї—О–і–µ–љ–Є—П –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ —Б–Њ—Б—В–∞–≤–Є–ї 1 –≥–Њ–і —Б –Љ–Њ–Љ–µ–љ—В–∞ –Њ–±—А–∞—Й–µ–љ–Є—П –Ј–∞ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й—М—О –њ–Њ –њ–Њ–≤–Њ–і—Г –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞.
–Ф–Є–Ј–∞–є–љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–С—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –ї–µ—З–µ–љ–Є–µ –њ–Њ –њ–Њ–≤–Њ–і—Г —В–∞–ї–∞–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –≤ —А–∞–Љ–Ї–∞—Е —Б–Є–љ–і—А–Њ–Љ–∞ –Ф–µ–ґ–µ—А–Є–љ–∞––†—Г—Б—Б–Є, —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Д–Њ—А–Љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –і–љ–µ–≤–љ–Є–Ї–Њ–≤ –±–Њ–ї–Є, —Б —А–∞—Б—З–µ—В–Њ–Љ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –њ–Њ —И–Ї–∞–ї–∞–Љ (–≤–Є–Ј—Г–∞–ї—М–љ–Њ-–∞–љ–∞–ї–Њ–≥–Њ–≤–∞—П —И–Ї–∞–ї–∞ –±–Њ–ї–Є (–Т–Р–®) (Visual Analogue Scale, VAS) [Huskisson E.–°., 1974] –Є –≤–µ—А–±–∞–ї—М–љ–Њ-–Њ–њ–Є—Б–∞—В–µ–ї—М–љ–∞—П —И–Ї–∞–ї–∞ –±–Њ–ї–Є (–Т–Ю–®) (Verbal Descriptor Scale) (Gaston-Johansson F., Albert –Ь., Fagan E. et al., 1990), —Ж–Є—В. –њ–Њ [5, 6]) –≤ —Б—А–Њ–Ї–Є 1 –љ–µ–і., 1 –Љ–µ—Б., 3 –Љ–µ—Б., 6 –Љ–µ—Б. –Є 1 –≥–Њ–і –Њ—В –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П. –£—З–Є—В—Л–≤–∞—П —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –±–Њ–ї–µ–≤–Њ–µ –Њ—Й—Г—Й–µ–љ–Є–µ —Б—Г–±—К–µ–Ї—В–Є–≤–љ–Њ, –њ–∞—Ж–Є–µ–љ—В–∞–Љ —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–∞—Б—М —Г—Б—А–µ–і–љ–µ–љ–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–Є –і–ї—П –њ–∞—Ж–Є–µ–љ—В–∞ –Є –≤ –≥—А—Г–њ–њ–µ. –°—А–µ–і–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е 20 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–∞–Љ–Є (–Ї–∞—А–±–∞–Љ–∞–Ј–µ–њ–Є–љ –Ї–Њ—А–Њ—В–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П – 12 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є —А–µ—В–∞—А–і–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П – 8 –њ–∞—Ж–Є–µ–љ—В–Њ–≤) –≤ –і–Њ–Ј–µ 3–5 –Љ–≥/–Ї–≥ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –≤ 2–3 –њ—А–Є–µ–Љ–∞ –≤ —Б—Г—В–Ї–Є (1 –Є 2 –≥—А—Г–њ–њ–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). 4 –њ–∞—Ж–Є–µ–љ—В–∞ –њ–Њ–ї—Г—З–∞–ї–Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Э–Я–Т–Я (–Ї–µ—В–Њ—А–Њ–ї–∞–Ї–∞ —В—А–Њ–Љ–µ—В–∞–Љ–Њ–ї 60 –Љ–≥/—Б—Г—В. –≤ 2 –њ—А–Є–µ–Љ–∞ –њ–Њ—Б–ї–µ –µ–і—Л – 3 –≥—А—Г–њ–њ–∞). 19 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–ї—Г—З–∞–ї–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –Э–Я–Т–Я –Є –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–Њ–≤ (—А–µ—В–∞—А–і–Є—А–Њ–≤–∞–љ–љ–∞—П —Д–Њ—А–Љ–∞ –Ї–∞—А–±–∞–Љ–∞–Ј–µ–њ–Є–љ–∞) – 4 –≥—А—Г–њ–њ–∞.
–†–µ–Ј—Г–ї—М—В–∞—В—Л
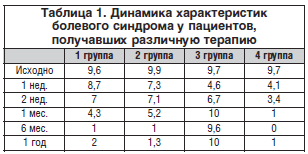
–Т —В–∞–±–ї–Є—Ж–µ 1 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –і–Є–љ–∞–Љ–Є–Ї–∞ –Њ—Ж–µ–љ–Ї–Є —Г—Б—А–µ–і–љ–µ–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –±–Њ–ї–Є –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —А–∞–Ј–ї–Є—З–љ—Л–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л–µ —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–∞–Љ–Є, –≤—Л—П–≤–Є–ї–Њ, —З—В–Њ —Н—Д—Д–µ–Ї—В –Њ—В –ї–µ—З–µ–љ–Є—П –љ–∞—Б—В—Г–њ–∞–ї –љ–µ —А–∞–љ–µ–µ 3-–є –љ–µ–і. –Є –і–Њ—Б—В–Є–≥–∞–ї –Љ–∞–Ї—Б–Є–Љ—Г–Љ–∞ –Ї –Ї–Њ–љ—Ж—Г 2-–≥–Њ –Љ–µ—Б., –њ—А–Є—З–µ–Љ –љ–∞–Є–±–Њ–ї–µ–µ —Б—В–Њ–є–Ї–Є–є —Н—Д—Д–µ–Ї—В –Њ—В–Љ–µ—З–∞–ї–Є –њ–∞—Ж–Є–µ–љ—В—Л, –њ–Њ–ї—Г—З–∞–≤—И–Є–µ —А–µ—В–∞—А–і–Є—А–Њ–≤–∞–љ–љ—Л–є –≤–∞—А–Є–∞–љ—В –њ—А–µ–њ–∞—А–∞—В–∞. –Т –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О –Э–Я–Т–Я, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Њ—В–Љ–µ—З–∞–ї—Б—П —В–Њ–ї—М–Ї–Њ –љ–∞ 1-–є –љ–µ–і. –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞, –≤ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ –њ–∞—Ж–Є–µ–љ—В—Л –Њ—В–Љ–µ—З–∞–ї–Є –±—Л—Б—В—А–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–∞ –Њ—В –њ—А–Є–µ–Љ–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –њ–Њ–ї–љ–Њ–µ –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї–µ–љ–Є–µ –±–Њ–ї–µ–є –Ї –Є—Б—Е–Њ–і—Г 1-–є –љ–µ–і. –њ—А–Є–µ–Љ–∞. –Т –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ, –Ї –Ї–Њ–љ—Ж—Г –Љ–µ—Б—П—Ж–∞, –њ–∞—Ж–Є–µ–љ—В—Л –Њ—В–Љ–µ—З–∞–ї–Є –љ–∞—А–∞—Б—В–∞–љ–Є–µ –і–Є—Б–њ–µ–њ—В–Є—З–µ—Б–Ї–Є—Е —П–≤–ї–µ–љ–Є–є, —З—В–Њ –≤—Л–љ—Г–ґ–і–∞–ї–Њ –Є—Е –њ—А–µ–Ї—А–∞—Й–∞—В—М –ї–µ—З–µ–љ–Є–µ.
–Э–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Њ—В –ї–µ—З–µ–љ–Є—П –љ–∞–±–ї—О–і–∞–ї—Б—П –≤ –≥—А—Г–њ–њ–µ, –њ–Њ–ї—Г—З–∞–≤—И–µ–є —Б–Њ—З–µ—В–∞–љ–љ—Г—О —В–µ—А–∞–њ–Є—О –Э–Я–Т–Я –Є —А–µ—В–∞—А–і–Є—А–Њ–≤–∞–љ–љ—Л–Љ –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–Њ–Љ, –њ–∞—Ж–Є–µ–љ—В—Л –Њ—В–Љ–µ—З–∞–ї–Є –±—Л—Б—В—А–Њ–µ –њ–Њ—П–≤–ї–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–∞ –Њ—В –ї–µ—З–µ–љ–Є—П –Є –µ–≥–Њ —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –≥–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ –Є –≤—Л–≤–Њ–і—Л
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ —Е–Њ–і–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–Є–Ј–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –≤ –ї–µ—З–µ–љ–Є–Є —Б–Є–љ–і—А–Њ–Љ–∞ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –њ–Њ—Б—В–Є–љ—Б—Г–ї—М—В–љ–Њ–є –±–Њ–ї–Є, —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –Є –і—А—Г–≥–Є–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є, –Є–Ј—Г—З–∞–≤—И–Є–Љ–Є —Д–µ–љ–Њ–Љ–µ–љ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –њ–Њ—Б—В–Є–љ—Б—Г–ї—М—В–љ–Њ–є –±–Њ–ї–Є [7, 8, 10]. –Ш–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Э–Я–Т–Я –≤—Л–Ј—Л–≤–∞–µ—В —В–Њ–ї—М–Ї–Њ –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –љ–∞ 1-–є –љ–µ–і. –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П, –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –Э–Я–Т–Я –±—Л—Б—В—А–Њ —В–µ—А—П–µ—В —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М [10]. –Ш–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–Њ–≤, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Є—Е –Њ–±—Й—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –њ–Њ—Б—В–Є–љ—Б—Г–ї—М—В–љ–Њ–є –±–Њ–ї–Є, –Њ—В–ї–Є—З–∞–µ—В—Б—П –Љ–µ–і–ї–µ–љ–љ—Л–Љ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ–Љ —Н—Д—Д–µ–Ї—В–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є –Є, –њ–Њ—А–Њ–є, –Ї –љ–µ–Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–є –Њ—В–Љ–µ–љ–µ –ї–µ—З–µ–љ–Є—П. –Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–Њ–≤ –Ї–Њ—А–Њ—В–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —Е—Г–ґ–µ –≤–Њ—Б–њ—А–Є–љ–Є–Љ–∞–ї–Њ—Б—М –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Є –љ–∞—А—Г—И–µ–љ–Є–Є —А–µ–ґ–Є–Љ–∞ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –Њ–љ–Є –Њ—В–Љ–µ—З–∞–ї–Є –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї–µ–љ–Є–µ –±–Њ–ї–µ–є, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —А–µ—В–∞—А–і–Є—А–Њ–≤–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л –њ–Њ–Ј–≤–Њ–ї—П–ї–Њ –Љ–µ–љ–µ–µ —Б—В—А–Њ–≥–Њ —Б–ї–µ–і–Є—В—М –Ј–∞ —А–µ–ґ–Є–Љ–Њ–Љ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–ї—П –≤—Л–±–Њ—А–∞ —В–∞–Ї—В–Є–Ї–Є –ї–µ—З–µ–љ–Є—П —Б–Є–љ–і—А–Њ–Љ–∞ –Ф–µ–ґ–µ—А–Є–љ–∞––†—Г—Б—Б–Є –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –њ–Њ–і—Е–Њ–і, —Б–Њ—З–µ—В–∞—О—Й–Є–є –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Э–Я–Т–Я –љ–µ–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ—Л–Љ –Ї—Г—А—Б–Њ–Љ (1–2 –љ–µ–і.) —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —А–µ—В–∞—А–і–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–∞, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ–±–Є—В—М—Б—П –±—Л—Б—В—А–Њ–≥–Њ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Ї–∞–Ї –љ–∞ —А–∞–љ–љ–Є—Е —Н—В–∞–њ–∞—Е –ї–µ—З–µ–љ–Є—П, —В–∞–Ї –Є –≤ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Т–µ–є–љ –Р.–Ь., –Ъ–Њ–ї–Њ—Б–Њ–≤–∞ –Ю. –Р. –У–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М. (–Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П, –Ї–ї–Є–љ–Є–Ї–∞, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –ї–µ—З–µ–љ–Є–µ). –Ь., 1994. 280 —Б.
2. –Т–µ–є–љ –Р.–Ь. –С–Њ–ї–µ–≤—Л–µ —Б–Є–љ–і—А–Њ–Љ—Л –≤ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –Ь.: MEDpress-inform, 2001. 187 —Б.
3. –Т–µ–є–љ –Р.–Ь., –Ф–∞–љ–Є–ї–Њ–≤ –Р–ї. –С. –У–µ–љ–і–µ—А–љ–∞—П –њ—А–Њ–±–ї–µ–Љ–∞ –≤ –љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є // –Ц—Г—А–љ–∞–ї –љ–µ–≤—А–Њ–ї. –Є –њ—Б–Є—Е–Є–∞—В—А–Є–Є. 2003. вДЦ 10. –°. 5–15.
4. –У—Г—Б–µ–≤ –Х.–Ш., –Ъ–Њ–љ–Њ–≤–∞–ї–Њ–≤ –Р.–Э., –°–Ї–≤–Њ—А—Ж–Њ–≤–∞ –Т.–Ш., –У–µ—Е—В –Р.–С. –Э–µ–≤—А–Њ–ї–Њ–≥–Є—П, –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ. –Ь.: –У–≠–Ю–Ґ–Р–†- –Ь–µ–і–Є–∞, 2009. 1064 —Б.
5. –Ы–Є–Љ–∞–љ—Б–Ї–Є–є –Ѓ.–Я., –Ы–Є–Љ–∞–љ—Б–Ї–∞—П –Ы.–Ш. –Я—А–Њ–±–ї–µ–Љ–∞ –±–Њ–ї–Є –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ // –Ц—Г—А–љ. –њ—А–∞–Ї—В. –ї—Ц–Ї–∞—А—П. 2001. вДЦ 2. –°. 37–39.
6. –Ы–Є–Љ–∞–љ—Б–Ї–Є–є –Ѓ.–Я. –§–Є–Ј–Є–Њ–ї–Њ–≥–Є—П –±–Њ–ї–Є. –Ъ–Є–µ–≤: –Ч–і–Њ—А–Њ–≤'—П, 1986. 96 —Б.
7. Kim J.S., Bashford G., T. Murphy K. et al. Safety and efficacy of pregabalin in patients with central post-stroke pain // PAIN. 2011. Vol. 152, Issue 5. P. 1018–1023.
8. Kumar G., Soni C.R., Central post-stroke pain: Current evidence // J. Neurolog. Sciences. 2009. Vol. 284, Issues 1–2. P. 10–17.
9. Pickering A.E., Thornton S.R., Love-Jones S.J. et al. Analgesia in conjunction with normalisation of thermal sensation following deep brain stimulation for central post-stroke pain // PAIN. 2009. Vol. 147, Issues 1–3. 15. P. 299–304.
10. Siniscalchi –Р., Gallelli L., De Sarro G. et al. Antiepileptic drugs for central post-stroke pain management // Pharmacol. Research. 2012. Vol. 65, Issue 2. P. 171–177.








.gif)



