Деменция – приобретенное снижение интеллекта, возникающее в результате органических поражений головного мозга и нарушающее социальную адаптацию больного, то есть делающее его неспособным к профессиональной деятельности и/или ограничивающее возможности его самообслуживания и нарушающее его бытовую независимость [1,7,30,37]. Деменция выявляется у 5–8% пожилых лиц, причем с увеличением возраста на каждые 10 лет распространенность деменции удваивается. В связи с увеличением доли пожилых в обществе проблема деменции приобретает все более актуальное звучание, становясь одной из основных проблем текущего столетия – «болезнью века» или даже «эпидемией века», так как сопровождается резким усилением бремени для лиц, ухаживающих за пациентом, и общества в целом [30,37]. В России проблема деменции стоит особенно остро. Хотя за последнее десятилетие отмечено значительное снижение средней продолжительности жизни, доля пожилых лиц, тем не менее, неуклонно растет [6]. Соответственно, соотношение больных деменцией и работающих лиц в России может складываться более неблагоприятно, чем в других странах. С ростом численности пациентов с деменцией неуклонно растут расходы, которые несут семьи пациентов и общество в связи с необходимостью многолетнего ухода за ними. В то же время современные методы лечения деменции (при условии их адекватного применения) способны не только облегчить жизнь пациентам и их родственникам, но и снизить социально–экономическое бремя для общества в целом [20,29,37].
Важность раннего распознавания деменции
Развитие деменции – длительный процесс, начинающийся за многие месяцы до того, как она становится очевидной для близких и знакомых больного. Поэтому заболевание обычно диагностируется с большим или меньшим опозданием. До тех пор пока лечение деменции оставалось чисто симптоматическим, своевременная диагностика не имела практического значения. Появление современных антидементных средств изменило ситуацию. В ряде контролируемых исследований показано, что отсроченное назначение ингибиторов холинэстеразы пациентам с болезнью Альцгеймера (БА) или иной формой деменции не позволяет добиться того же эффекта, как при использовании активного препарата с самого начала [11,22]. Таким образом, позднее назначение антидементного средства лишает пациента возможности поддерживать более высокий уровень когнитивных функций и функциональных возможностей. Связано ли это с нейропротекторным действием или более ранней нейрохимической компенсацией, остается неясным. Но, учитывая уже полученные результаты, польза ранней диагностики деменции представляется несомненной. В связи с этим важное значение приобретает широкое внедрение простейших вариантов нейропсихологического скрининга, прежде всего у пожилых лиц.
Базисная терапия деменции
До недавнего времени лекарственная терапия деменции сводилась на ранней стадии к назначению повторных курсов ноотропных и вазоактивных средств с весьма сомнительной эффективностью, а на поздней стадии – к применению психотропных средств, прежде всего нейролептиков, которые ослабляли остроту поведенческих нарушений, но не оказывали положительного влияния на долгосрочный прогноз. Появление современных возможностей диагностики и терапии деменции позволяет сформулировать понятие базисной терапии деменции [3,5]. Под базисной терапией следует понимать методы лечения, направленные на предупреждение дальнейшего повреждения мозга и обеспечивающие длительную стабилизацию или по меньшей мере замедление снижения психических функций в условиях прогрессирующего патологического процесса. В конечном итоге это позволяет более длительно поддерживать бытовую независимость больного и отсрочить момент наступления его беспомощности, развитие поздних поведенческих нарушений, госпитализации в психиатрические учреждения, а также снизить нагрузку на родственников и социальные службы по уходу за больным.
Возможности базисной терапии более значительны при потенциально обратимых деменциях. Удаление опухоли или гематомы, шунтирующая операция при гидроцефалии, восполнение дефицита витамина В12 и фолиевой кислоты, заместительная терапия при гипотиреозе, иммунотропная терапия при аутоиммуных заболеваниях и антибактериальная терапия при инфекциях могут со временем приводить к значительному или полному регрессу когнитивных нарушений. При алкогольной деменции решающее значение имеют отказ от алкоголя, восполнение дефицита витамина В1 и других витаминов, полноценное питание, лечение соматических осложнений.
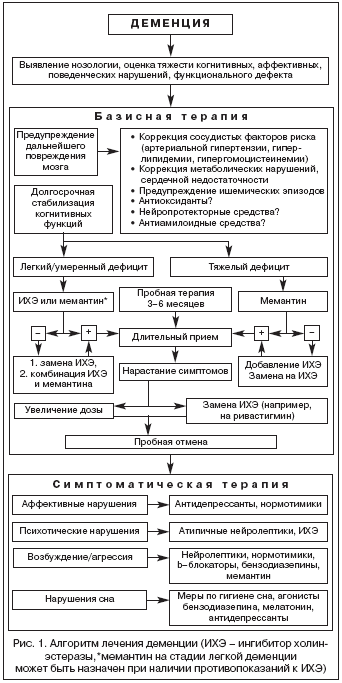
При сосудистой деменции или смешанной деменции с сосудистым компонентом базисная терапия включает как можно более раннюю адекватную коррекцию сосудистых факторов риска, в том числе гипотензивную терапию (прежде всего с помощью торможения ренин–ангиотензиновой системы), лечение гиперлипидемии (с помощью статинов), коррекцию гипергомоцистеинемии и сахарного диабета, отказ от курения и т.д., предупреждение повторных ишемических эпизодов с помощью длительного приема антиагрегантов (прежде всего малых доз ацетилсалициловой кислоты). Кроме того, при сосудистой деменции, а также при болезни Альцгеймера и деменции с тельцами Леви к базисной терапии несомненно следует отнести длительное применение антидементных средств: ингибиторов холинэстеразы и мемантина (табл. 1) [8,11,13,26,27]. Алгоритм терапии деменции представлен на рисунке 1.
Ингибиторы холинэстеразы
Основой применения ингибиторов холинэстеразы является «холинергическая гипотеза», согласно которой когнитивные, поведенческие и функциональные расстройства при болезни Альцгеймера (БА) и некоторых других формах деменции объясняются (по крайней мере частично) гибелью холинергических нейронов, сконцентрированных в базальном ядре Мейнерта, и снижением активности холинергических систем в мозге. Холинергическая гипотеза в настоящее время подтверждается целым рядом патоморфологических, гистохимических, нейровизуализационных, экспериментальных данных [21].
Теоретически для повышения холинергической активности в пораженных зонах мозга могут применяться несколько групп препаратов: 1) предшественники ацетилхолина (такие как холин, лецитин, холина альфосцерат и др.); 2) препараты, способствующие высвобождению ацетилхолина в синапсе, прежде всего блокаторы калиевых каналов (линопирдин, безипирдин, ипидакрин и др.); 3) агонисты М– и Н–холинорецепторов, способные имитировать действие ацетилхолина на постсинаптические рецепторы; 4) ингибиторы холинэстеразы (ИХЭ), блокирующие распад ацетилхолина; 5) трофические факторы, повышающие жизнеспособность холинергических нейронов.
Среди этих групп препаратов именно ИХЭ на сегодняшний день оказались единственной группой средств, удовлетворяющих потребности клинической практики, то есть способными оказывать клинически значимый лечебный эффект при приемлемом уровне побочного действия [22,24,27]. В настоящее время в нашей стране, как и во всех развитых странах, применяется три препарата из группы ИХЭ: галантамин, донепезил и ривастигмин (Экселон). Из этих трех препаратов только донепезил является «чистым» ингибитором ацетилхолинэстеразы, двум другим препаратам свойственны дополнительные эффекты, которые могут играть важную роль в их клиническом действии: галантамин модулирует Н–холинорецепторы, а ривастигмин, наряду с ацетилхолинэстеразой, блокирует и бутирилхолинэстеразу. Последняя играет важную роль в деградации ацетилхолина в физиологических условиях и патогенезе дементирующих процессов [10,17].
К настоящему времени в большом числе контролируемых исследований доказана способность всех трех ИХЭ улучшать и стабилизировать когнитивные функции пациентов и общее состояние пациентов с БА (прежде всего на стадии легкой и умеренной деменции, когда оценка по Краткой шкале психического статуса превышает 10 баллов) [18]. В контролируемых исследованиях показана эффективность ИХЭ при сосудистой и смешанной деменции. На основании масштабного контролируемого исследования, продемонстрировавшего эффективность ривастигмина при деменции у больных болезнью Паркинсона, получено разрешение на его применение по данному показанию. Кроме того, в ряде открытых исследований показана эффективность ИХЭ при посттравматической и алкогольной деменции, корсаковском амнестическом синдроме, когнитивных нарушениях у больных рассеянным склерозом [2,3,30]. Согласно недавно опубликованным рекомендациям комиссии экспертов EFNS по диагностике и лечению деменции, именно ИХЭ отнесены к препаратам первого ряда при БА, сосудистой деменции, деменции при болезни Паркинсона и деменции с тельцами Леви (на стадии легкой или умеренной деменции) [37]. В последние годы накапливается все более широкий опыт применения ИХЭ и у пациентов с тяжелой деменцией [12].
В клинических испытаниях показано, что ИХЭ прежде всего улучшают внимание и регуляторные когнитивные процессы, связанные с функцией лобных долей. Вторично при этом могут улучшаться память, зрительно–пространственные и речевые функции. Помимо влияния на собственно когнитивные функции, препараты повышают активность и степень бытовой независимости больных, снижают потребность в постороннем уходе, позволяют более длительно сохранять пациента в семье, уменьшают выраженность психотических нарушений, агрессивности, возбуждения, снижают потребность в назначении нейролептиков [4]. После улучшения, которое в среднем наблюдается 3–4 месяца, и стабилизации функций, которая в среднем сохраняется около 12 месяцев (у отдельных пациентов – до нескольких лет), у большинства больных, несмотря на продолжение лечения ИХЭ, закономерно наблюдается снижение когнитивных функций, которое, тем не менее, происходит более медленно и плавно, чем в отсутствие приема препарата (табл. 2).
Следует подчеркнуть вариабельность эффекта ИХЭ у больных БА и другими формами деменции. Любой положительный эффект (улучшение, временная стабилизация или снижение скорости прогрессирования) в целом отмечается примерно у 80% пациентов, однако лишь у 35–50% пациентов после начала приема ИХЭ отмечается клинически значимое улучшение (оценка по Mini–Mental State Examination – MMSE увеличивается на 1–2 пункта), и лишь у 12–20% пациентов отмечается значительное («драматическое») улучшение с увеличением оценки по MMSE на 3 пункта и более [30].
Эффективность ИХЭ в пределах терапевтического диапазона дозозависима, поэтому для получения максимально возможного эффекта данного препарата следует стремиться к его наивысшей рекомендуемой дозе. Однако превышение этой дозы, как показывают исследования, обычно не приносит значительного приращения лечебного эффекта, тогда как вероятность побочного действия существенно возрастает. Эффективность ИХЭ доказана не только в относительно кратковременных исследованиях, продолжавшихся 6 месяцев, но и в более долговременной открытой фазе исследований, продолжавшейся до 5 лет. Более того, именно при длительном применении польза препаратов ИХЭ особенно ощутима [22,35].
Наиболее изучена в долгосрочной перспективе эффективность ривастигмина. По данным G.W. Small et al. (2006), которые провели 5–летнее наблюдение за пациентами, принимавшими ривастигмин, последний существенно замедлял нарастание когнитивного дефекта. Если у нелеченных больных за 3 года показатель MMSE должен был снизиться в среднем на 9 баллов, то у пациентов, принимавших ривастигмин, даже по завершении 5–летнего периода средняя оценка по MMSE снизилась примерно на 8 баллов, оказавшись выше критической черты в 10–12 баллов, ниже которой развиваются тяжелые поведенческие нарушения, резко затрудняющие уход за пациентами [35].
В эксперименте показано, что ИХЭ способны замедлять трансформацию бета–амилоидного пептида в токсичную агрегированную форму, тормозить образование амилоида в мозге и защищать культуры клеток от токсического действия амилоида и свободных радикалов, ослаблять воспалительные процессы, имеющие важное значение при сосудистой и дегенеративной патологии, усиливать перфузию мозга, оказывая вазодилатирующий эффект на сосуды коры головного мозга и гиппокампа [33]. По данным нескольких исследований, ИХЭ замедляют нарастание атрофии медиальных отделов височных долей [30]. По мере прогрессирования дегенеративных деменций (прежде всего БА) в пораженных зонах мозга происходит увеличение активности бутирилхолинэстеразы, поэтому ее торможение ривастигмином может оказывать дополнительный нейропротекторный эффект, продлевая жизнедеятельность нейронов [10].
Побочные эффекты ИХЭ, как правило, связаны с их основным действием – усилением активности холинергических систем, как в ЦНС, так и на периферии. В фазе титрования дозы ИХЭ чаще всего отмечаются тошнота (реже рвота), диарея, анорексия, слабость, головокружение. Эти эффекты могут проявиться как в начале лечения, так и после очередного повышения дозы. В большинстве случаев они бывают легкими или умеренными и носят преходящий характер. В фазе длительной поддерживающей терапии в качестве побочных эффектов чаще возникают симптомы дисфункции ЦНС (возбуждение, спутанность сознания, нарушение сна), сердечно–сосудистой системы (брадикардия, нарушение проводимости сердца, обмороки), мышечные спазмы [1, 20].
Чтобы предупредить побочные эффекты ИХЭ, необходимо придерживаться медленной схемы титрования дозы (табл. 1), принимать препарат во время или сразу после еды. Как правило, препараты противопоказаны при тяжелых заболеваниях печени и почек, синдроме слабости синусового узла с эпизодами выраженной брадикардии, нарушении проводимости сердца, свежей язве желудка, тяжелой обструктивной болезни легких. Перед назначением препарата целесообразно провести ЭКГ, чтобы исключить нарушения проводимости миокарда. Больным с синдромом слабости синусового узла, которым показаны ИХЭ, возможно их назначение после имплантации кардиостимулятора.
Перед назначением препарата важно учесть возможность лекарственного взаимодействия ИХЭ с препаратами, которые были назначены пациенту ранее. Необходима осторожность при комбинации с НПВП, препаратами, вызывающими брадикардию (b–блокаторы, сердечные гликозиды). У пожилых велик риск побочных эффектов, связанных с лекарственным взаимодействием. Донепезил и галантамин метаболизируются печеночными ферментами P450 и в силу этого могут вступать в лекарственное взаимодействие с другими препаратами, метаболизирующимися этими ферментами. С этой точки зрения ривастигмин имеет преимущества, так как подвергается гидролизу эстеразами мозга и не вступает в лекарственные взаимодействия [16].
При появлении побочного эффекта возможны пропуск 1–2 приемов препарата, снижение его дозы до прежнего уровня или назначение корректоров, в качестве которых могут выступать, например, домперидон (при тошноте) или атипичный нейролептик (при возбуждении или инсомнии). После развития толерантности к нежелательным эффектам препарата (обычно в течение нескольких недель) корректоры могут быть отменены.
Долгосрочность эффекта различных ИХЭ может быть неодинаковой. Так, благодаря торможению G1–изоформы ацетилхолинэстеразы и бутирилхолинэстеразы, активность которых по мере развития деменции возрастает, ривастигмин может обладать растянутым во времени «терапевтическим окном». Благодаря этому он оказывает более долгосрочный эффект при дегенеративных деменциях, чем препараты, неселективно тормозящие ацетилхолинэстеразу, общая активность которой в мозге со временем снижается. В ряде исследований показано, что ривастигмин оказывает терапевтический эффект у пациентов, уже утративших клиническую реакцию на донепезил, блокирующий активность лишь ацетилхолинэстеразы [9,14,29,34].
Мемантин
Мемантин – селективный блокатор NMDA–глутаматных рецепторов. Механизм действия связан с модулированием глутаматергической передачи, которая опосредует кортико–кортикальные и кортико–субкортикальные взаимосвязи в головном мозге. В серии контролируемых исследований доказана способность мемантина улучшать и стабилизировать когнитивные функции, повседневную активность, уменьшать поведенческие нарушения у пациентов с БА (как на ранней стадии, так и особенно на стадии умеренной и тяжелой деменции). Положительное влияние мемантина на когнитивные функции отмечено и при сосудистой деменции. В открытых исследованиях показана эффективность мемантина при смешанной деменции, деменции с тельцами Леви, алкогольной деменции и корсаковском амнестическом синдроме, лобно–височной деменции. Мемантин – препарат первого выбора при умеренной и тяжелой деменции, но может использоваться и на стадии легкой деменции в качестве монотерапии или в комбинации с ИХЭ. Долгосрочная эффективность мемантина изучена в меньшей степени.
Для мемантина характерна хорошая переносимость, тем не менее в фазе титрования могут наблюдаться головокружение или спутанность сознания, которые, как правило, носят преходящий характер. Реже отмечаются сонливость, падения, головная боль. В эксперименте показано, что мемантин способен защищать клетки от токсического эффекта возбуждающих аминокислот и тормозить образование нейрофибриллярных клубочков, влияя на метаболизм t–протеина, что является одним из ключевых звеньев патогенеза БА [1,3,32].
Альтернативные средства
Для улучшения когнитивных функций у больных деменцией применяется широкий спектр ноотропных и вазоактивных препаратов, средств с антиоксидантным, нейрометаболическим и предполагаемым нейротрофическим действием и т.д., однако их долговременная эффективность не изучена. В связи с этим их применение возможно лишь в комбинации с базисными антидементными средствами (см. далее) либо в тех случаях, когда последние оказываются неэффективными или плохо переносятся [20]. Согласно рекомендациям комиссии экспертов EFNS, у больных с БА и сосудистой деменцией нет достаточных оснований для назначения препаратов ginkgo biloba, ноотропов, противовоспалительных средств, антагонистов кальция, пентоксифиллина и т.д. [37]
Как оценить эффективность
антидементных средств?
Ключевая проблема в практике применения базисных антидементных средств заключается в адекватной оценке их эффективности у конкретного больного. Это особенно актуально в связи с тем, что базисные антидементные средства оказываются эффективными не у всех пациентов с данной нозологической формой. Между тем пациент должен принимать только те препараты, которые действительно оказывают лечебный эффект, а не те, которые лишь потенциально полезны для него. Особенно трудно ценить эффективность препарата в условиях прогрессирования заболевания. Положительный эффект, ради которого стоит принимать его, может заключаться не только в улучшении состояния пациента, но также в стабилизации или хотя бы замедлении ухудшения состояния пациента.
При оценке эффекта антидементных средств следует учитывать возможность их действия на различные мишени: когнитивные функции, функциональный статус, аффективные и поведенческие нарушения. Необходимо по возможности количественно оценить исходный уровень когнитивных и поведенческих нарушений, функциональный статус, чтобы получить точку отсчета для последующей оценки эффективности препарата. Препараты могут вариабельно действовать на различные сферы, одни функции могут улучшаться, другие – продолжать ухудшаться. В связи с этим следует предостеречь от оценки эффективности только на основании одного теста или исследования одной психической сферы. Для оценки когнитивных функций в процессе лечения могут применяться простейшие нейропсихологические тесты (например, MMSE, тест «Рисование часов», тест на речевую активность). Для оценки функционального статуса может применяться опросник Pfeffer [31], а для оценки поведенческих нарушений – краткий вариант Нейропсихиатрической шкалы [25].
Важно подчеркнуть, что в целом чувствительность формальной оценки довольно низкая и не может заменить тщательного расспроса близких пациента об изменениях в его поведении [20]. На этом основан так называемый «целевой подход» к оценке эффективности препарата. Предварительно вместе с пациентом и ухаживающим лицом врач выявляет наиболее беспокоящие симптомы (снижение критики, негативизм, дезориентация, галлюциноз и т.д.). Если симптомы улучшаются или по крайней мере не ухудшаются столь быстро, как ранее, можно говорить об эффективности лечения.
Поскольку надежные предикторы эффективности антидементных средств до настоящего времени выявить не удалось, первоначальная оценка их эффективности у всех пациентов, которым они показаны, должна проводиться в процессе пробной терапии в течение 3–6 месяцев. В тех случаях, когда зарегистрирован положительный эффект препарата хотя бы на одну сферу (когнитивную, функциональную, поведенческую), необходим длительный, часто многолетний, прием данного средства (при условии его удовлетворительной переносимости). Контроль эффективности долгосрочной базисной терапии должен проводиться каждые 6 месяцев.
Предикторы эффективности
антидементных средств
Надежных предикторов эффективности ИХЭ и мемантина, как уже упоминалось, пока найти не удалось. Тем не менее в клинических испытаниях ИХЭ отмечены некоторые закономерности, позволяющие в некоторой степени предсказывать эффективность препарата. Так, в некоторых (но не во всех) исследованиях обнаружено, что при наличии психотических нарушений (особенно зрительного галлюциноза) и умеренных нейродинамических нарушений (прежде всего внимания) эффективность ИХЭ может быть несколько выше. Показано, что эффективность ИХЭ может быть выше у тех больных БА, у которых отмечаются диффузные изменения белого вещества (по данным МРТ) и артериальная гипертензия [22,30]. В клинических испытаниях ривастигмина показано, что при быстром прогрессировании деменции эффект ривастигмина был выше, чем у пациентов с более медленным прогрессированием когнитивного дефекта [19]. С другой стороны, найдены и некоторые негативные предикторы эффективности, предвещающие более низкий эффект препаратов. К ним относятся грубая атрофия гиппокампа, очаговые изменения в проекции корковых холинергических путей (по данным МРТ), а также более значительная длительность заболевания. Вопреки обыденным представлениям, обычно не влияют на эффективность лечения возраст пациентов и выраженность общей церебральной атрофии (по данным КТ и МРТ) [22].
Резистентность
к антидементным средствам
Уже упоминалось, что эффективность антидементных средств весьма вариабельна, и у определенной части пациентов они не оказывают клинически значимого эффекта. Резистентность к антидементным средствам может быть «кажущаяся» (псевдорезистентность), связанная с трудностью оценки лечебного эффекта препарата, и истинная. Последняя может быть первичной, когда антидементное средство с самого начало оказывается неэффективным, и вторичной, когда первоначальный эффект истощается при продолжении терапии. Первичная резистентность может быть вызвана как нозогенными факторами (отсутствием холинергического дефицита, например, при лобно–височных деменциях), так и индивидуальными особенностями фармакокинетики препаратов или низкой комплаентностью. Низкая комплаентность – частая проблема у пациентов с деменцией, которые просто забывают вовремя принимать препарат. В значительной степени эту проблему может решить появление новых лекарственных форм, прежде всего для трансдермального введения, – пластырей с ривастигмином (Экселоном). Для преодоления резистентности применяют различные приемы (повышение дозы препаратов до максимально переносимой, замена препарата на средство с иным механизмом действия, переход на комбинированную терапию и т.д.).
Замена препарата
При неэффективности первоначально назначенного препарата, появлении непереносимых побочных эффектов, а также при утрате первоначального эффекта возможно переключение с одного препарата на другой. Например, если пациент принимал ИХЭ, его можно перевести на другой ИХЭ или мемантин. Три применяющихся ИХЭ имеют целый ряд фармакологических особенностей (табл. 3), что делает целесообразным их замену при непереносимости или неэффективности одного из средств [23,28].
Чаще всего замену одного ИХЭ на другой проводят, когда у пациента отмечались стойкие непереносимые побочные эффекты (например, тошнота), не устранимые временным снижением дозы или назначением корректоров и препятствующие достижению эффективной дозы. При проведении замены ИХЭ в этом случае требуется отмывочный период, величина которого примерно равна 5 периодам полуэлиминации первого препарата). У больных, принимавших донепезил, величина отмывочного периода должна достигать 7–14 дней. При замене галантамина на ривастигмин достаточно 1–2–дневной паузы [20,28]. После этого рекомендуется более медленное наращивание дозы второго препарата, чем обычно рекомендуется (например, начальная доза ривастигмина может равняться 1,5 мг в сутки, а затем суточную дозу каждые 4 недели увеличивают на 1,5 мг, а не на 3 мг). В момент замены препарата больной особенно уязвим, поэтому необходим тщательный контроль за его состоянием.
Второе основание для замены ИХЭ – отсутствие эффекта максимальной дозы первого ИХЭ в течение 3–6 месяцев (в отсутствие сомнений в комплаентности пациента). Опыт показывает, что пациент, неплохо переносивший первый ИХЭ, как правило, будет переносить и второй препарат. Поэтому переключение осуществляется более быстро (день в день), в соответствии с принципом эквивалентности доз. Эмпирически 10 мг донепезила примерно эквивалентны 24 мг галантамина и 6 мг ривастигмина. В некоторых случаях прибегают к небольшому отмывочному периоду и первоначальному назначению более низкой дозы второго препарата.
Утрата эффекта (вторичная резистентность) – наиболее спорное показание для замены ИХЭ. Переключение с одного ИХЭ на другой может быть необходимо при явном прогрессировании заболевания, когда пациент утрачивает наиболее важные повседневные навыки, контакт с другими членами семьи, резко снижается качество жизни ухаживающих лиц. При отмене ранее эффективного средства существует опасность нарастания когнитивных и поведенческих расстройств, которые не всегда удается нивелировать повторным назначением того же препарата. Замена ИХЭ в такой ситуации обычно производится немедленно (день в день) на эквивалентную дозу другого ИХЭ. В отдельных случаях возможна обратная замена препаратов (ротация ИХЭ), после чего эффективность первого средства проявляется более четко.
В ряде исследований показано, что примерно у половины пациентов, не отреагировавших на первый назначенный ИХЭ, утративших со временем на него реакцию или плохо переносящих его, переключение на другой препарат этой группы приводит к улучшению. В принципе любой ИХЭ может быть заменен любым другим из двух оставшихся препаратов. На практике наибольший опыт накоплен при переключении на ривастигмин (Экселон). Показано, что в отсутствие реакции на донепезил и галантамин, введение ривастигмина привело к стабилизации и улучшению у 46–67% пациентов [15,28].
Комбинированная базисная терапия
Если ИХЭ противопоказаны, плохо переносятся или неэффективны, вместо них может применяться мемантин в качестве монотерапии. Но если ИХЭ продемонстрировал некоторую эффективность (хотя бы на ранней стадии лечения), то целесообразнее его оставлять, добавляя к нему мемантин и переходя таким образом на комбинированную базисную терапию. При комбинации ИХЭ с мемантином достигается не только повышение эффективности терапии, особенно в долгосрочном плане (оно может заключаться в улучшении когнитивного статуса, повседневной активности, поведения), но и улучшение переносимости лечения. T. Dantoine и соавт. (2006), обследовав серию пациентов с БА, резистентных к донепезилу и галантамину, отметили улучшение почти у половины этих больных при переходе на монотерапию ривастигмином и почти у 80% – при назначении комбинации ривастигмина и мемантина [15].
С другой стороны, переход к комбинированной базисной терапии возможен при недостаточной эффективности монотерапии мемантином путем добавления к нему ИХЭ. Нерационально сразу же назначать комбинацию несколько средств: первоначально следует испробовать один препарат и, лишь убедившись, что в максимально переносимых данным пациентом дозах он оказывает лишь частичный эффект, к нему следует присоединить следующее средство, которое, как правило, обладает иным механизмом действия. При БА и сосудистой деменции для повышения эффективности лечения к ИХЭ и/или мемантину могут быть добавлены препараты нейротрофического действия (например, церебролизин), холина альфосцерат или цитидиндифосфохолин.
Когда препараты базисной терапии целесообразно отменять?
Если, несмотря на оптимальную терапию, на поздней стадии деменции возникает тотальная зависимость пациента по всем видам базисной повседневной активности и, по мнению членов семьи, пациента и врача, осмысленное взаимодействие с ним становится невозможным, продолжение базисной терапии может не иметь смысла. В этой ситуации ИХЭ и мемантин могут быть отменены [20]. Если, тем не менее, это приводит к существенному нарастанию когнитивных, функциональных и поведенческих нарушений, то необходимо возобновить лечение ранее применявшимся или другим агентом. К пробной отмене препарата иногда целесообразно прибегать при быстром ухудшении состояния пациента и кажущейся неэффективности лечения (при этом за больным должен быть установлен тщательный контроль). В любом случае пациента важно предостеречь от резкой отмены препарата, особенно если он принимал его в высокой дозе – это может повлечь резкое ухудшение когнитивных функций и спутанность сознания [28].
Для чего необходимо знать
нозологический диагноз деменции?
В последнее время довольно широкое распространение получает точка зрения, согласно которой точный нозологический диагноз прогрессирующей деменции практически невозможен из–за высокой частоты смешанной деменции и, более того, не очень–то и важен, поскольку принципы лечения разных форм деменции (БА, сосудистой деменции, деменции с тельцами Леви) весьма схожи и предусматривают применение одних и тех же препаратов. Несмотря на внешнюю прагматическую привлекательность такого взгляда, с ним все же нельзя согласиться. С одной стороны, в большинстве случаев деменции нозологический диагноз, по крайней мере вероятностный, все же может быть установлен. Любопытно, что на ранней стадии процесса ввиду его топической ограниченности диагноз иногда более прост, чем на поздней стадии, когда при разных нозологических формах деменции возникает клиника более или менее тотального поражения мозга. А во–вторых, точный нозологический диагноз позволяет лучше прогнозировать течение болезни, планировать ее лечение, оценивать ее эффективность.
Нет необходимости напоминать, как важно в процессе поиска нозологического диагноза деменции исключить курабельное заболевание (опухоль, гидроцефалию, метаболическую или аутоиммунную энцефалопатию и т.д.). Но даже дифференциация между БА, сосудистой деменцией и деменцией с тельцами Леви может оказывать существенное влияние на выбор препарата для базисной терапии и целей лечения. Так, при БА об эффективности базисной терапии может свидетельствовать не только увеличение, но и даже снижение оценки по шкале MMSE, но не более чем на 1 балл (за полгода). Тогда как при сосудистой деменции, как показывают результаты контролируемых исследований, ожидаемый результат должен заключаться в улучшении когнитивного статуса по сравнению с исходным уровнем. Сравнение эффективности 2–летней терапии ривастигмином и донепезилом у больных БА показало, что ривастигмин оказывал более значительный эффект и лучше переносился при наличии клинических признаков болезни с тельцами Леви у лиц моложе 75 лет [36].
Поскольку нозологическая диагностика деменции требует комплексного обследования нейропсихологического и функционального статуса пациентов, проведения лабораторного и нейровизуализационного исследования, желательно назначать препарат в специализированном клиническом центре. Последующее наблюдение может проводиться врачом общей практики.



Литература
1. Гаврилова С.И. Фармакотерапия болезни Альцгеймера. М., 2003. – 319 С.
2. Дамулин И.В. Сосудистая деменция и болезнь Альцгеймера. М., 2002. – 85 С.
3. Левин О.С. Алгоритмы диагностики и лечения деменции. М., 2005. –C.4–12.
4. Левин О.С. Деменция с тельцами Леви. М., 2006. – 125 С.
5. Левин О.С. Современные подходы к диагностике и лечению деменции.//Справочник поликлинического врача. 2007. – № 1.
6. Случевская С.Ф. Анализ демографических процессов, происходящих в Санкт– Петербурге в период с 1999 по 2005 год с расчетом прогнозного значения на 2006– 2008 годы. С–Петербург, 2007.
7. Яхно Н.Н. Актуальные вопросы нейрогериатрии//В кн.: Достижения в нейрогериатрии. М., 1995.– С.9–27.
8. Geldmacher D.S. Long–term cholinesterase inhibitor therapy for Alzheimer’s disease: practical considerations for the primary care physician.//Prim. Care Companion J. Clin. Psychiatry, 2003. – V.5.– P. 251–259.
9. Auriacombe S., Pere J.–J., Loria–Kanza Y., Vellas B. Efficacy and safety of rivastigmine in patients with Alzheimer’s disease who failed to benefit from treatment with donepezil.//Curr. Med. Res. Opin., 2002. –V.18. – P.129–138.
10. Ballard C.G. Advances in the treatment of Alzheimer’s disease: benefits of dual cholinesterase inhibition.//Eur. Neurol., 2002. –V.47. – P.64–70.
11. Bullok R. Cholinesterase inhibitors: long–term studies. //C.W.Ritchie et al. Therapeutic strategies in dementia.Oxford. Clinical Publishing, 2007. –P.13–22.
12. Burns A., Spiegel R., Quarg P. Efficacy of rivastigmine in subjects with moderately severe Alzheimer’s disease.//Int. J. Geriatr. Psychiatry, 2004. –V.19. – P. 243–249.
13. Cummings J.L., Frank J.C., Cherry D., et al. Guidelines for managing Alzheimer’s disease.//Am. Fam. Physician, 2002. –V.65. –P.2525–2534.
14. Cummings J.L., Koumaras B., Chen M., Mirski D. Effects of rivastigmine treatment on the neuropsychiatric and behavioral disturbances of nursing home residents with moderate to severe probable Alzheimer’s disease: a 26–week, multicenter, open–label study.//Am. J. Geriatr. Pharmacother., 2005. –V.3. – P. 137–148.
15. Dantoine T., Auricombe S., Sarazin M. Et al. Rivastigmin monotherapy and combination therapy with memantine in patients with moderately severe Alzheimer’s disease who failed to benefit from previous cholinesterase inhibitor treatment.//Int J. Clin. Practice, 2006. –V.60.– P.110–118.
16. Defilippi J.L., Crismon M.L. Drug interactions with cholinesterase inhibitors.//Drugs and Aging, 2003. –V.20. – P. 437–444.
17. Desai A.K., Grossberg G.T. Rivastigmine for Alzheimer’s disease.// Expert Rev. Neurotherapeutics., 2005. –V.5. – P.563–580.
18. Doody R.S., Stevens J.C., Beck R.N., et al. Practice parameter: management of dementia (an evidence–based review).//Neurology, 2001. – V.56. – P.1154–1166.
19. Farlow M.R., Hake A., Messina J. et al. Response of patients with Alzheimer disease to rivastigmine treatment is predicted by rate of disease progression.//Arch. Neurol., 2001. –V.58. –P.417–422.
20. Farlow M.R., Cummings J.L. Effective Pharmacologic Management of Alzheimer’s disease.//Am.J.Med., 2007. –V.120. – P.388–397.
21. Francis P.T., Palmer A.M., Snape M., Wilcock G.K. The cholinergic hypothesis of Alzheimer’s disease: a review of progress.//J. Neurol. Neurosurg. Psychiatry, 1999. –V.66. – P.137–147.
22. Gauthier S. (ed). Clinical diagnosis and management of Alzheimer’s disease. London, –Informa healthcare, 2007. –393 P.
23. Gauthier S., Emre M., Farlow M.R., Bullock R., Grossberg G.T., Potkin S.G.: Strategies for continued successful treatment of Alzheimer’s disease: switching cholinesterase inhibitors.//Curr. Med. Res. Opin., 2003. –V.19. –P.707–714.
24. Kaduszkiewicz H., Zimmermann T., Beck–Bornholdt H.P., van den Bussche H. Cholinesterase inhibitors for patients with Alzheimer’s disease: systematic review of randomised clinical trials.// BMJ, 2005. –V.331. – P.321–327.
25. Kaufer D.I., Cummings J.L., Ketchel P., et al.Validation of the NPI–Q, a brief clinical form of the Neuropsychiatric Inventory.//J. Neuropsychiatry Clin. Neurosci., 2000. –V.12. –P. 233–239.
26. Lopez O.L., Becker S., Wisniewski S., et al. Cholinesterase inhibitor treatment alters the natural history of Alzheimer’s disease.//J. Neurol. Neurosurg. Psychiatry, 2002. –V.72. – P.310–314.
27. Lyketos C.G., Colenda C.C., Beck C. et al. Position statement of AAGP regarding principles of care for patients with dementia resulting from Alzheimer ;s disease.//Am.J.Geriatr. Psychiatry, 2006. – V.14. – P. 561–573.
28. MacKnight C. Switching Cholinesterase inhibitors.//Geriatrics and aging., 2007. –V.10. –P.158–161.
29. Marin D., Amaya K., Casciano R. et al. Impact of rivastigmine on costs and on time spent in caregiving for families of patients with Alzheimer’s disease.//Int. Psychogeriatr., 2003. –V.15. –P. 385–398.
30. Mendez M.F., Cummings J. Dementia. Philadelphia, Butterworth Heinemann, 2003. – 654 C.
31. Pfeffer R.I., Kurosaki T.T., Harrah C.H., et al. Measurement of functional activities in older adults in the community.//J. Gerontol, 1982. –V.37. – P.323–329.
32. Reisberg B., Doody R., Stoffler A., Schmitt F., et. al. Memantine in moderate–to–severe Alzheimer’s disease.//N. Engl. J. Med., 2003. –V. 348. – P. 1333–1341.
33. Roman G.C. Rivastigmine for subcortical vascular dementia.//Expert Rev. Neurotherapeutics., 2005. –V.5. –P.309–313.
34. Rosler M., Anand R., Cicin–Sain A. et al. Efficacy and safety of rivastigmine in patients with Alzheimer’s disease: international randomised controlled trial.//BMJ, 1999. –V.318. – P. 633–638.
35. Small G.W., Kaufer D., Mendiondo et al. Cognitive performance in Alzheimer;s patients receiving rivasrigmine for up to 5 years.//Int.J.Clin. Pract., 2005.–V.59.–C.473–477.
36. Touchon J., Bergman H., Bullock R. et al. Response to rivastigmine or donepezil in Alzheimer’s disease with symptoms suggestive of concomitant Lewy body pathology.//Curr. Med. Res. Op., 2006. –V.22.–P.49–59.
37. Waldemar G., Dubois B., Emre M. et al. Alzheimer’s disease and other disorders associated with dementia.//R.Hughes et al. European handbook of neurological management. Oxford. Blackwell Publishing, 2006. –P.266–298.








.gif)



