–Ъ–ї—О—З–µ–≤—Л–µ —Б–ї–Њ–≤–∞: –±–µ–љ–Ј–∞–ї–Ї–Њ–љ–Є—П —Е–ї–Њ—А–Є–і, —О–љ–Є—В-–і–Њ–Ј—Л, –∞–љ–∞–ї–Њ–≥–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞, —В–∞—Д–ї—Г–њ—А–Њ—Б—В.
Abstract
Tafluprost – the first preservative-free prostaglandin analogue
Petrov S.Yu., Safonova D.M.
Scientific Research Institute of Eye Diseases of the Russian Academy of Medical SciencesMoscow
Pharmacodynamics of tafluprost, the first commercially available preservative-free unit-dose prostaglandin analogue, is analyzed in the article. Characteristic of the experimental preclinical studies, as well as the first three phases of tafluprost clinical trials are presented. A strong hypotensive effect of once a day local administration of tafluprost is described. The review also analyzes postmarketing studies of the comparative efficacy and tolerability of tafluprost and assesses the prospects of the new drug usage.
Keywords: benzalkonium chloride, single-dose, unit-dose, prostaglandin analogues, tafluprost.
–Я–Њ—Б–ї–µ –Њ—В–Ї—А—Л—В–Є—П –≤ 1981 –≥. –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ [11] —А—П–і –Є—Е –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е –±—Л–ї–Є –≤—Л–њ—Г—Й–µ–љ—Л –љ–∞ —А—Л–љ–Њ–Ї –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤: —Г–љ–Њ–њ—А–Њ—Б—В–Њ–љ [49], –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В [11, 45], –±–Є–Љ–∞—В–Њ–њ—А–Њ—Б—В [58], —В—А–∞–≤–Њ–њ—А–Њ—Б—В [16, 43] (—А–Є—Б. 1). –Т –њ—А–Њ—Ж–µ—Б—Б–µ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А—П–і–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞–Љ–Є, —З–µ–Љ —И–Є—А–Њ–Ї–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –≤ —В–Њ –≤—А–µ–Љ—П –±–µ—В–∞-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–Љ —В–Є–Љ–Њ–ї–Њ–ї–Њ–Љ [7, 34, 55]. –°–њ—Г—Б—В—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –ї–µ—В –≤—Л—Б–Њ–Ї–∞—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Б–Є—Б—В–µ–Љ–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–і–µ–ї–∞–ї–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –њ–µ—А–≤–Њ–≥–Њ –≤—Л–±–Њ—А–∞ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б—В—А–∞–љ –Љ–Є—А–∞. –Т –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В—Б—П –Љ–µ—Б—В–љ—Л–Љ–Є –њ–Њ–±–Њ—З–љ—Л–Љ–Є —А–µ–∞–Ї—Ж–Є—П–Љ–Є: –њ–Є–≥–Љ–µ–љ—В–∞—Ж–Є–µ–є —А–∞–і—Г–ґ–Ї–Є [44, 57, 59], –Ї–Њ–ґ–Є –≤–µ–Ї [54] –Є —А–Њ—Б—В–Њ–Љ —А–µ—Б–љ–Є—Ж [22]. –Т—Л—Б–Њ–Ї–Є–є, –љ–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В, –∞ —В–∞–Ї–ґ–µ –Љ–µ—Б—В–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞–ї–Є —Г—З–µ–љ—Л—Е –љ–∞ –њ–Њ–Є—Б–Ї–Є –љ–Њ–≤—Л—Е, –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤–Њ–≥–Њ —А—П–і–∞.
–Ш—Б—Б–ї–µ–і—Г—П —Б–≤–Њ–є—Б—В–≤–∞ —А—П–і–∞ –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е 15,15-–і–Є—Д–ї—О–Њ—А–Њ–њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ F2α –љ–∞ –±–∞–Ј–µ –Њ—В–і–µ–ї–∞ –≥–ї–∞—Г–Ї–Њ–Љ—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Њ–≥–Њ —Ж–µ–љ—В—А–∞ –Ї–Њ–Љ–њ–∞–љ–Є–Є Santen Pharmaceutical (–ѓ–њ–Њ–љ–Є—П), T. Nakajima [36] –≤ 2003 –≥. —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–ї –Љ–Њ–ї–µ–Ї—Г–ї—Г, –Њ–±–ї–∞–і–∞—О—Й—Г—О –±ó–ї—М—И–Є–Љ —Б—А–Њ–і—Б—В–≤–Њ–Љ –Ї FP-—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, —З–µ–Љ –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В. –Т–µ—Й–µ—Б—В–≤–Њ –њ–Њ–ї—Г—З–Є–ї–Њ –Ї–Њ–і AFP-168 –Є, –њ–Њ–Ј–ґ–µ, –љ–∞–Ј–≤–∞–љ–Є–µ —В–∞—Д–ї—Г–њ—А–Њ—Б—В. –Т 2008 –≥. –њ—А–µ–њ–∞—А–∞—В –±—Л–ї –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ –≤ —Б—В—А–∞–љ–∞—Е –Х–≤—А–Њ—Б–Њ—О–Ј–∞, –∞ –≤ 2012 –≥. – –њ–Њ–ї—Г—З–Є–ї –Њ–і–Њ–±—А–µ–љ–Є–µ FDA –°–®–Р, —Б—В–∞–≤ –≤ —Н—В–Њ–є —Б—В—А–∞–љ–µ –њ–µ—А–≤—Л–Љ –∞–љ–∞–ї–Њ–≥–Њ–Љ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ –±–µ–Ј –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–∞.
–§–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞
–Ґ–∞—Д–ї—Г–њ—А–Њ—Б—В (AFP-168, 1-–Љ–µ—В–Є–ї—Н—В–Є–ї (5Z)-7-((1R,2R, 3R,5S)-2-((1E)-3,3-–і–Є—Д–ї—О–Њ—А–Њ-4-—Д–µ–љ–Њ–Ї—Б–Є-1-–±—Г—В–µ–љ–Є–ї-3,5-–і–Є–≥–Є–і—А–Њ–Ї—Б–Є—Ж–Є–Ї–ї–Њ–њ–µ–љ—В–Є–ї)-5-–≥–µ–њ—В–µ–љ–Њ–∞—В) – —Д—В–Њ—А–Є—А–Њ–≤–∞–љ–љ—Л–є –∞–љ–∞–ї–Њ–≥ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ F2a. –ѓ–≤–ї—П–µ—В—Б—П —Н—Д–Є—А–Њ–Љ —В–∞—Д–ї—Г–њ—А–Њ—Б—В–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, —В. –µ. –њ—А–Њ–ї–µ–Ї–∞—А—Б—В–≤–Њ–Љ, –≥–Є–і—А–Њ–ї–Є–Ј–Є—А—Г—О—Й–Є–Љ—Б—П –і–Њ —Б–∞–Љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Д–µ—А–Љ–µ–љ—В–Њ–Љ —Н—Б—В–µ—А–∞–Ј–Њ–є –≤ —В–Ї–∞–љ—П—Е —Б–Ї–ї–µ—А—Л –Є —А–Њ–≥–Њ–≤–Є—Ж—Л –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –≤–Њ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ—Г—О –ґ–Є–і–Ї–Њ—Б—В—М [41], –Ї–∞–Ї –Є –Њ—Б—В–∞–ї—М–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–Є –≥—А—Г–њ–њ—Л –∞–љ–∞–ї–Њ–≥–Њ–≤ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ [48].
–Ґ–∞—Д–ї—Г–њ—А–Њ—Б—В–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ (AFP-172) – –Љ–Њ—Й–љ—Л–є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є –∞–≥–Њ–љ–Є—Б—В FP-—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —З–µ–ї–Њ–≤–µ–Ї–∞. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –љ–∞–ї–Є—З–Є–µ 2-—Е –∞—В–Њ–Љ–Њ–≤ —Д—В–Њ—А–∞ –љ–∞ 15-–Љ –∞—В–Њ–Љ–µ —Г–≥–ї–µ—А–Њ–і–∞ β-—Ж–µ–њ–Є –Љ–Њ–ї–µ–Ї—Г–ї—Л —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –љ–∞–і–µ–ї—П–µ—В —В–∞—Д–ї—Г–њ—А–Њ—Б—В–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г –≤ 12 —А–∞–Ј –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ —Б—А–Њ–і—Б—В–≤–Њ–Љ –Ї FP-—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, —З–µ–Љ –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В [48].
–§–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Љ–µ—Б—В–љ—Л—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞–њ—А—П–Љ—Г—О –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б –Є—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –њ—А–Њ—Е–Њ–і–Є—В—М —З–µ—А–µ–Ј —А–Њ–≥–Њ–≤–Є—Ж—Г –Є —Б–Ї–ї–µ—А—Г, –і–Њ—Б—В–Є–≥–∞—П —В–Ї–∞–љ–µ–є —А–∞–і—Г–ґ–Ї–Є –Є —Ж–Є–ї–Є–∞—А–љ–Њ–≥–Њ —В–µ–ї–∞. –Т —Б–ї—Г—З–∞–µ —Б –∞–љ–∞–ї–Њ–≥–∞–Љ–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ F2a –Є–Љ–µ–љ–љ–Њ —Н—Б—В–µ—А–Є—Д–Є–Ї–∞—Ж–Є—П –Ї–∞—А–±–Њ–Ї—Б–Є–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л α-—Ж–µ–њ–Є –њ–Њ–≤—Л—И–∞–µ—В –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М –Є—Е –Љ–Њ–ї–µ–Ї—Г–ї, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–ї—Г—З—И–∞—П —В—А–∞–љ—Б–њ–Њ—А—В —З–µ—А–µ–Ј —В–Ї–∞–љ–Є, –≤ –Ї–Њ—В–Њ—А—Л—Е –Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Њ–±—А–∞—В–љ—Л–є –≥–Є–і—А–Њ–ї–Є–Ј –і–Њ –Ї–Є—Б–ї–Њ—В—Л [31].
–Ф–Њ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Ф–Њ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–Ї–ї—О—З–∞—О—В –≤ —Б–µ–±—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П in vitro (–ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П) –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П in vivo (–љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е), –≤ —Е–Њ–і–µ –Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і—Г—О—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–µ –і–Њ–Ј—Л —В–µ—Б—В–Є—А—Г–µ–Љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л—Е –і–∞–љ–љ—Л—Е –Њ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤–∞—Е, —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є, —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–µ –Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –Є–Ј—Г—З–∞–µ–Љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞.
–У–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –љ–∞ –Њ–±–µ–Ј—М—П–љ–∞—Е —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ –Т–У–Ф –Є —Б –ї–∞–Ј–µ—А-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –Њ—Д—В–∞–ї—М–Љ–Њ–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є [48]. –Т –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –Њ–і–љ–Њ–Ї—А–∞—В–љ—Л–µ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е (–Њ—В 0,00002 –і–Њ 0,0025%) –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –і–Њ–Ј–Њ–љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Г—О –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М. –°–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ 0,0025% –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ, —З–µ–Љ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞ –≤ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є 0,005%, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Н—Д—Д–µ–Ї—В —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ 0,0005% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї —Н—Д—Д–µ–Ї—В—Г –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞ 0,005%. –Т –≥—А—Г–њ–њ–µ —Б –љ–Њ—А–Љ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–Љ–Є –ґ–Є–≤–Њ—В–љ—Л–Љ–Є —В–∞—Д–ї—Г–њ—А–Њ—Б—В 0,0015, 0,0025 –Є 0,005% –Є–љ—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–ї–Є –≤ —В–µ—З–µ–љ–Є–µ 5 –і–љ–µ–є, –Њ—В–Љ–µ—З–∞—П —Б–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф —Б –њ–µ—А–≤—Л—Е —Б—Г—В–Њ–Ї, —Б–Њ—Е—А–∞–љ—П—О—Й–µ–µ—Б—П –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ —Б—А–Њ–Ї–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞.
–Т—Л—Б–Њ–Ї–Њ–µ —Б—А–Њ–і—Б—В–≤–Њ –Ї F2α-—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ –њ–Њ–±—Г–і–Є–ї–Њ H. Kurashima [27] –≤ 2011 –≥. –Є—Б—Б–ї–µ–і–Њ–≤–∞—В—М –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –≤ –≥—А—Г–њ–њ–µ –Є–Ј 10 –Њ–±–µ–Ј—М—П–љ, —Г –Ї–Њ—В–Њ—А—Л—Е –љ–µ –±—Л–ї–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –љ–∞ —В–µ—А–∞–њ–Є—О –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–Њ–Љ. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ —Б—А–µ–і–љ–µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ 0,0015% (–љ–∞ 2,4 –Љ–Љ) —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ—А–µ–≤—Л—И–∞–ї–Њ —Н—Д—Д–µ–Ї—В –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞ 0,005% (–љ–∞ 0,4 –Љ–Љ —А—В. —Б—В.) —Г –≤—Б–µ—Е –ґ–Є–≤–Њ—В–љ—Л—Е (—А<0,01).
–Ф–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–є —Н—Д—Д–µ–Ї—В —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –±—Л–ї –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ –љ–∞ –Љ—Л—И–∞—Е —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ –њ—А–Њ—Б—В–∞–љ–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ [39]. –У–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М —Б—А–∞–≤–љ–Є–Љ–∞ —Б —В–∞–Ї–Њ–≤–Њ–є —Г —В—А–∞–≤–Њ–њ—А–Њ—Б—В–∞, –љ–Њ —Б–Є–ї—М–љ–µ–µ –Є —Г—Б—В–Њ–є—З–Є–≤–µ–µ, —З–µ–Љ —Г –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞. T. Ota [38] –≤—Л—Б–Ї–∞–Ј–∞–ї –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—К—П—Б–љ–µ–љ–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ —В–∞–Ї–ґ–µ –Є –љ–∞ –њ—А–Њ—Б—В–∞–љ–Њ–Є–і–љ—Л–µ E3-—А–µ—Ж–µ–њ—В–Њ—А—Л. –Я–Њ—Е–Њ–ґ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —В–∞–Ї–ґ–µ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л T. Akaishi –≤ 2009 –≥.
–°–Њ–≥–ї–∞—Б–љ–Њ —А—П–і—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є, —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Њ–±–ї–∞—Б—В–Є –і–Є—Б–Ї–∞ –Ј—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –љ–µ—А–≤–∞ (–Ф–Ч–Э) –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б —В–µ—З–µ–љ–Є–µ–Љ –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є. –Ш–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є –љ–Є–ґ–µ, —З–µ–Љ –њ—А–Є –Њ—Д—В–∞–ї—М–Љ–Њ–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є –Є –≤ –љ–Њ—А–Љ–µ. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Њ–±–ї–∞—Б—В–Є –Ф–Ч–Э —Б–≤—П–Ј–∞–љ–Њ —Б –њ—А–Њ–≥—А–µ—Б—Б–Є–µ–є –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ Izumi –њ–Њ–Ї–∞–Ј–∞–ї–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —А–µ—В–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –ї–∞–Ј–µ—А–љ–Њ–є –і–Њ–њ–њ–ї–µ—А–Њ–≤—Б–Ї–Њ–є –≤–µ–ї–Њ—Б–Є–Љ–µ—В—А–Є–Є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ 0,0015% [25].
–Я–Њ—Е–Њ–ґ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ—Л T. Akaishi [6] –љ–∞ –Ї—А–Њ–ї–Є–Ї–∞—Е, —Г –Ї–Њ—В–Њ—А—Л—Е –Ї—А–Њ–≤–Њ—В–Њ–Ї —Г –Ф–Ч–Э –≤–Њ–Ј—А–∞—Б—В–∞–ї —Б–њ—Г—Б—В—П 28 –і–љ–µ–є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ (+11,9%), –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞ (+7,2%) –Є —В—А–∞–≤–Њ–њ—А–Њ—Б—В–∞ (+6,7%). Y. Dong [12] –≤—Л—П–≤–Є–ї —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –≤—Л–Ј—Л–≤–∞—В—М –Ј–∞–≤–Є—Б–Є–Љ–Њ–µ –Њ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —А–∞—Б—И–Є—А–µ–љ–Є–µ —Б–њ–∞–Ј–Љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л—Е —Ж–Є–ї–Є–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–Њ–ї –Ї—А–Њ–ї–Є–Ї–Њ–≤, –≤–µ—А–Њ—П—В–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –Ї–Њ—В–Њ—А–Њ–≥–Њ –Љ–Њ–ґ–µ—В —П–≤–ї—П—В—М—Б—П –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –≤ –Ї–ї–µ—В–Ї–Є –Є–Њ–љ–Њ–≤ –°–∞2+. –£–ї—Г—З—И–µ–љ–Є–µ —А–µ—В–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –∞–љ–∞–ї–Њ–≥–Њ–≤ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ F2α —Г –Ї—А–Њ–ї–Є–Ї–Њ–≤ —В–∞–Ї–ґ–µ –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –њ—А–Є –µ–≥–Њ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Є–љ—В—А–∞–≤–Є—В—А–µ–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П —Н–љ–і–Њ—В–µ–ї–Є–љ–∞-1. –Ґ–∞—Д–ї—Г–њ—А–Њ—Б—В –њ–Њ–Ї–∞–Ј–∞–ї –±–Њ–ї–µ–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–µ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–∞ —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –∞–љ–∞–ї–Њ–≥–∞–Љ–Є [28]. C. Mayama [33] –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї —Г—Б–Є–ї–µ–љ–Є–µ —В–∞—Д–ї—Г–њ—А–Њ—Б—В–Њ–Љ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Ф–Ч–Э –≤ –≥—А—Г–њ–њ–∞—Е –Њ–±–µ–Ј—М—П–љ —Б –љ–Њ—А–Љ–Њ—В–µ–љ–Ј–Є–µ–є –Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є. –Я–Њ–Ј–ґ–µ —Н—В–Є –і–∞–љ–љ—Л–µ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є—Б—М —Г–ґ–µ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е (S. Tsuda, 2013).
–Я—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Њ—В–ї–Є—З–Є–µ –≤ –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є —В–∞–Ї–ґ–µ –Њ–±—К—П—Б–љ—П—О—В –љ–∞–ї–Є—З–Є–µ–Љ –Њ–њ–Є—Б–∞–љ–љ–Њ–є –≤—Л—И–µ –≥—А—Г–њ–њ—Л –Є–Ј 2-—Е –∞—В–Њ–Љ–Њ–≤ —Д—В–Њ—А–∞. –Ф–∞–љ–љ—Л–є —Д—А–∞–≥–Љ–µ–љ—В –њ—А–Є–і–∞–µ—В —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –Ї –Њ–Ї–Є—Б–ї–µ–љ–Є—О 15-–≥–Є–і—А–Њ–Ї—Б–Є–ї-–њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ-–і–µ–≥–Є–і—А–Њ–≥–µ–љ–∞–Ј—Л, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–µ–є –≤ –Ї—А–Њ–≤–Є –Є —Б–Њ—Б—Г–і–∞—Е –Ф–Ч–Э, —Г—Б–Є–ї–Є–≤–∞—П –Є –њ—А–Њ–ї–Њ–љ–≥–Є—А—Г—П —Н—Д—Д–µ–Ї—В.
–Т –ї–Є—В–µ—А–∞—В—Г—А–µ –≤—Б—В—А–µ—З–∞—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ –љ–∞–ї–Є—З–Є–Є —Г —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –њ—А—П–Љ–Њ–≥–Њ –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П. A. Kanamori [23] –њ–Њ–Ї–∞–Ј–∞–ї –µ–≥–Њ –њ—А—П–Љ–Њ–є –∞–љ—В–Є–∞–њ–Њ–њ—В–Њ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –љ–∞ –Ї—Г–ї—М—В—Г—А—Г –≥–∞–љ–≥–ї–Є–Њ–љ–∞—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б–µ—В—З–∞—В–Ї–Є —Б –≥–ї—Г—В–∞–Љ–∞—В-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ –∞–њ–Њ–њ—В–Њ–Ј–Њ–Љ. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ –њ–Њ–і–∞–≤–ї—П–ї–Њ –∞–њ–Њ–њ—В–Њ–Ј –њ—Г—В–µ–Љ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ї–∞—Б–њ–∞–Ј—Л-3 –њ–Њ–Ј–Є—В–Є–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ Ca2+. –Т —Н—В–Њ–є –ґ–µ —А–∞–±–Њ—В–µ –≤ –≥—А—Г–њ–њ–µ in vivo –љ–∞ –Ї—А—Л—Б–∞—Е —Б —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–є –љ–µ–є—А–Њ–Њ–њ—В–Є–Ї–Њ–њ–∞—В–Є–µ–є —В–∞—Д–ї—Г–њ—А–Њ—Б—В –њ–Њ–≤—Л—Б–Є–ї —Б—В–µ–њ–µ–љ—М –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б–њ—Г—Б—В—П 14 –і–љ–µ–є —В–µ—А–∞–њ–Є–Є. –Ф—А—Г–≥–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ N. Bull [9] –≤–ї–Є—П–љ–Є—П –њ—А—П–Љ—Л—Е –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є –Ї–Њ–Љ–Љ–µ—А—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ—Л —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –±–µ–Ј –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–∞ –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –Ї—Г–ї—М—В—Г—А—Л –Ї–ї–µ—В–Њ–Ї —Б–µ—В—З–∞—В–Ї–Є –Ї—А—Л—Б –њ–Њ–Ї–∞–Ј–∞–ї–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ–Њ—В–µ—А–Є –Ї–ї–µ—В–Њ–Ї —Б–њ—Г—Б—В—П 4 –і–љ—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –Ї–Њ–љ—В—А–Њ–ї—П –±–µ–Ј —В–µ—А–∞–њ–Є–Є. –Я–Њ—Е–Њ–ґ–Є–µ –і–∞–љ–љ—Л–µ –њ–Њ–ї—Г—З–µ–љ—Л –≤ —А—П–і–µ –і—А—Г–≥–Є—Е —А–∞–±–Њ—В [5, 35].
–Ю–і–Є–љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –Є–Ј–≤–µ—Б—В–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ–∞–ї–Њ–≥–Њ–≤ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ – –≥–Є–њ–µ—А–њ–Є–≥–Љ–µ–љ—В–∞—Ж–Є—П —А–∞–і—Г–ґ–Ї–Є –Є –Ї–Њ–ґ–Є –≤–µ–Ї. Y. Takagi [48] –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–є –Љ–µ–ї–∞–љ–Њ–≥–µ–љ–µ–Ј —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ in vitro. –Т –Ї–ї–µ—В–Ї–∞—Е –Љ–µ–ї–∞–љ–Њ–Љ—Л, –Є–љ–Ї—Г–±–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤ —Б—А–µ–і–µ —Б –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –≤ —В–µ—З–µ–љ–Є–µ 4 –і–љ–µ–є, —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Љ–µ–ї–∞–љ–Є–љ–∞ –љ–µ –њ—А–µ–≤—Л—И–∞–ї–Њ —В–∞–Ї–Њ–≤–Њ–µ –≤ –≥—А—Г–њ–њ–µ —Б —В–Њ–є –ґ–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞. –Я–Њ–Љ–Є–Љ–Њ –і–Њ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤–∞ —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞, –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–≤—И–Є—Е –≤—Л—Б–Њ–Ї–Њ–µ —Б—А–Њ–і—Б—В–≤–Њ —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є [20], –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –µ–≥–Њ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї—Г–ї—М—В—Г—А—Л –Љ–µ–ї–∞–љ–Њ—Ж–Є—В–Њ–≤ [24].
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В –±–µ–љ–Ј–∞–ї–Ї–Њ–љ–Є—П —Е–ї–Њ—А–Є–і –њ–Њ–≤—Л—И–∞–µ—В –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В—М —А–Њ–≥–Њ–≤–Є—Ж—Л –і–ї—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б –љ–Є–Ј–Ї–Њ–є –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М—О [10]. –Ш —В–Њ—В —Д–∞–Ї—В, —З—В–Њ —В–∞—Д–ї—Г–њ—А–Њ—Б—В —П–≤–ї—П–µ—В—Б—П –њ–µ—А–≤–Њ–є –Ї–Њ–Љ–Љ–µ—А—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ–Њ–є –∞–љ–∞–ї–Њ–≥–∞ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ –±–µ–Ј –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–∞, —Б–≤—П–Ј—Л–≤–∞–ї–Є —Б –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –љ–Є–Ј–Ї–Њ–є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —В–Ї–∞–љ–Є –≥–ї–∞–Ј–∞. –Ю–і–љ–∞–Ї–Њ —Г–і–∞–ї–µ–љ–Є–µ –±–µ–љ–Ј–∞–ї–Ї–Њ–љ–Є—П –љ–µ –њ–Њ–≤–ї–Є—П–ї–Њ –љ–∞ –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В—М —А–Њ–≥–Њ–≤–Є—Ж—Л –і–ї—П —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –љ–∞ –Ї—А–Њ–ї–Є–Ї–∞—Е. –°–њ—Г—Б—В—П 45 –Љ–Є–љ –њ–Њ—Б–ї–µ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ї–Є—Б–ї–Њ—В—Л —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –≤ –ґ–Є–і–Ї–Њ—Б—В–Є –њ–µ—А–µ–і–љ–µ–є –Ї–∞–Љ–µ—А—Л —Б–Њ—Б—В–∞–≤–Є–ї–∞ 4,50 –љ–≥/–Љ–ї –і–ї—П –±–µ—Б–Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–љ–Њ–є —Д–Њ—А–Љ—Л –Є 3,99 –љ–≥/–Љ–ї –і–ї—П —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ —Б –±–µ–љ–Ј–∞–ї–Ї–Њ–љ–Є–µ–Љ, —З—В–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ–є –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М—О —Н—Д–Є—А–∞ –Ї–Є—Б–ї–Њ—В—Л —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ [40].
–Ю–і–љ–Њ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –±–µ—Б–Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–љ–Њ–є —Д–Њ—А–Љ—Л – —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–µ—Б—В–љ–Њ–є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –Ј–∞ —Б—З–µ—В —Г—Б—В—А–∞–љ–µ–љ–Є—П –±–µ–љ–Ј–∞–ї–Ї–Њ–љ–Є—П —Е–ї–Њ—А–Є–і–∞, —З—В–Њ —В–∞–Ї–ґ–µ –±—Л–ї–Њ –і–Њ–Ї–∞–Ј–∞–љ–Њ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є. –Т —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –і–µ–є—Б—В–≤–Є–µ–Љ –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞, —В—А–∞–≤–Њ–њ—А–Њ—Б—В–∞ –Є –±–Є–Љ–∞—В–Њ–њ—А–Њ—Б—В–∞ —Б –С–• –љ–∞ –Ї—Г–ї—М—В—Г—А—Г –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —В–∞—Д–ї—Г–њ—А–Њ—Б—В –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Б–Њ—Е—А–∞–љ–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ—А–Њ–∞–њ–Њ–њ—В–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ [8]. H. Liang [29, 30] –Њ—Ж–µ–љ–Є–≤–∞–ї –≤–ї–Є—П–љ–Є–µ in vivo –љ–∞ –Ї—А–Њ–ї–Є–Ї–∞—Е –±–µ—Б–Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–љ–Њ–≥–Њ —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞, –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞ —Б –С–• –Є 0,02% —А–∞—Б—В–≤–Њ—А–∞ —Б–∞–Љ–Њ–≥–Њ –±–µ–љ–Ј–∞–ї–Ї–Њ–љ–Є—П —Е–ї–Њ—А–Є–і–∞. –Ф–≤–µ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥—А—Г–њ–њ—Л –≤—Л–Ј–≤–∞–ї–Є –≤—Л—А–∞–ґ–µ–љ–љ—Г—О —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –Є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б —В–∞—Д–ї—Г–њ—А–Њ—Б—В–Њ–Љ.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є
–Я—А–Њ—Ж–µ—Б—Б —А–∞–Ј—А–∞–±–Њ—В–Ї–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ –њ—А–Њ—Е–Њ–і–Є—В 3–4 —Д–∞–Ј—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е I —Д–∞–Ј—Л –Њ–±—Л—З–љ–Њ —Г—З–∞—Б—В–≤—Г—О—В –і–Њ 100 –Ј–і–Њ—А–Њ–≤—Л—Е –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–µ–≤. –§–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є–Ї–∞, –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –±—Л–ї–Є –Њ—Ж–µ–љ–µ–љ—Л –≤ —А–∞–Љ–Ї–∞—Е 3-—Е –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П I —Д–∞–Ј—Л [44, 47, 52].
–Т –њ–µ—А–≤–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ј–і–Њ—А–Њ–≤—Л–Љ –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–∞–Љ –Є–љ—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–ї–Є —В–∞—Д–ї—Г–њ—А–Њ—Б—В 0,0025 –Є 0,005%, –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В 0,005% –Є –њ–ї–∞—Ж–µ–±–Њ –≤ —В–µ—З–µ–љ–Є–µ 7 –і–љ–µ–є. –°–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–Њ 4,3 –Љ–Љ —А—В. —Б—В. (—В–∞—Д–ї—Г–њ—А–Њ—Б—В 0,0025%), 6,8 –Љ–Љ —А—В. —Б—В. (—В–∞—Д–ї—Г–њ—А–Њ—Б—В 0,005%), 5,3 –Љ–Љ —А—В. —Б—В. (–ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В) –Є 3,1 –Љ–Љ —А—В. —Б—В. (–њ–ї–∞—Ж–µ–±–Њ).
–Т–Њ –≤—В–Њ—А–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ј–і–Њ—А–Њ–≤—Л–Љ –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–∞–Љ –±—Л–ї–Є –љ–∞–Ј–љ–∞—З–µ–љ—Л –≤–Њ–Ј—А–∞—Б—В–∞—О—Й–Є–µ –і–Њ–Ј–Є—А–Њ–≤–Ї–Є —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞: 0,0001, 0,0005, 0,0025 –Є 0,005%. –Ф–ї—П –≤—Б–µ—Е –і–Њ–Ј —Б–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф –Ј–љ–∞—З–Є–Љ–Њ –њ—А–µ–≤—Л—И–∞–ї–Њ —В–∞–Ї–Њ–≤–Њ–µ –і–ї—П –њ–ї–∞—Ж–µ–±–Њ. –С—Л–ї –Њ—В–Љ–µ—З–µ–љ –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–є —Н—Д—Д–µ–Ї—В, –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –і–ї—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є 0,0005, 0,0025 –Є 0,005%. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –і–Њ—Б—В–Є–≥–∞–ї—Б—П —Б–њ—Г—Б—В—П 12 —З –њ–Њ—Б–ї–µ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є –Є –њ—А–Њ–і–Њ–ї–ґ–∞–ї—Б—П –і–Њ 2-—Е —Б—Г—В. –°–Є—Б—В–µ–Љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –±—Л–ї–Њ –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–Љ –і–ї—П —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞, –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞ –Є –њ–ї–∞—Ж–µ–±–Њ: –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –Ј–љ–∞—З–Є–Љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –∞–љ–∞–ї–Є–Ј–Њ–≤, —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Є –≠–Ъ–У —Г –≤—Б–µ—Е 49 –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–µ–≤ –—Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ I —Д–∞–Ј—Л. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ –Љ–µ—Б—В–љ—Л–Љ –њ–Њ–±–Њ—З–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –±—Л–ї–∞ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А–µ–Љ–Є—П, –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —З–∞—Й–µ –≤—Б—В—А–µ—З–∞—О—Й–∞—П—Б—П –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ 0,0025 –Є 0,005%, —З–µ–Љ –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞ 0,005%. –Т–њ—А–Њ—З–µ–Љ, –≥–Є–њ–µ—А–µ–Љ–Є—П –≤–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е –±—Л–ї–∞ —Б–ї–∞–±–Њ–є –Є —Г–Љ–µ—А–µ–љ–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є, —З—В–Њ –љ–µ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [44].
–°—А–∞–≤–љ–Є—В–µ–ї—М–љ—Г—О –Њ—Ж–µ–љ–Ї—Г —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –±–µ—Б–Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–љ–Њ–є —Д–Њ—А–Љ—Л —Б —В–∞—Д–ї—Г–њ—А–Њ—Б—В–Њ–Љ —Б –С–• –њ—А–Њ–≤–Њ–і–Є–ї–Є –≤ —А–∞–Љ–Ї–∞—Е 3-–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П I —Д–∞–Ј—Л, –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ H. Uusitalo [52] –љ–µ —Г–і–∞–ї–Њ—Б—М –≤—Л—П–≤–Є—В—М –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є. –С—Л–ї–∞ –Њ—В–Љ–µ—З–µ–љ–∞ –і–∞–ґ–µ –∞–љ–∞–ї–Њ–≥–Є—З–љ–∞—П —З–∞—Б—В–Њ—В–∞ —Б–ї—Г—З–∞–µ–≤ –Љ–µ—Б—В–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–Є, –Њ–і–љ–∞–Ї–Њ –µ—Б–ї–Є –≤ –≥—А—Г–њ–њ–µ —Б –±–µ–љ–Ј–∞–ї–Ї–Њ–љ–Є–µ–Љ –і–Њ–Љ–Є–љ–Є—А–Њ–≤–∞–ї–∞ —Г–Љ–µ—А–µ–љ–љ–∞—П —Б—В–µ–њ–µ–љ—М –≥–Є–њ–µ—А–µ–Љ–Є–Є, —В–Њ –і–ї—П –±–µ—Б–Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–љ–Њ–є —Д–Њ—А–Љ—Л –±—Л–ї–∞ —Е–∞—А–∞–Ї—В–µ—А–љ–∞ —Б–ї–∞–±–∞—П –≥–Є–њ–µ—А–µ–Љ–Є—П.
II —Д–∞–Ј–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –њ—А–Њ—Е–Њ–і–Є–ї–∞ –≤ –≤–Є–і–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ, –і–≤–Њ–є–љ–Њ–≥–Њ —Б–ї–µ–њ–Њ–≥–Њ, –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–≥–Њ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–≥–Њ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞ 38 –њ–∞—Ж–Є–µ–љ—В–∞—Е —Б –њ–µ—А–≤–Є—З–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є (–Я–Ю–£–У), –њ—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є –Є –Њ—Д—В–∞–ї—М–Љ–Њ–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є –≤ –Ї–ї–Є–љ–Є–Ї–∞—Е –Ш—В–∞–ї–Є–Є –Є –§–Є–љ–ї—П–љ–і–Є–Є –њ–Њ–і —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ–Љ C. Traverso [50]. –Ю—Ж–µ–љ–Є–≤–∞–ї–Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ 0,0015% –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б —В–∞–Ї–Њ–≤—Л–Љ–Є –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞ 0,005% –≤ —В–µ—З–µ–љ–Є–µ 42 –і–љ–µ–є. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –±—Л–ї–Њ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ –љ–∞ 7-–µ —Б—Г—В –Є –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Њ—Б—М –і–Њ –Ї–Њ–љ—Ж–∞ –њ–µ—А–Є–Њ–і–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ґ–∞—Д–ї—Г–њ—А–Њ—Б—В 0,0015% —Б–љ–Є–Ј–Є–ї –Т–У–Ф –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 9,7±3,3 –Љ–Љ —А—В. —Б—В. –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ, –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В 0,005% – –љ–∞ 8,8±4,3 –Љ–Љ —А—В. —Б—В.
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ 0,0015% –Є –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞ 0,005% (–Њ–±–∞ –њ—А–µ–њ–∞—А–∞—В–∞ —Б –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–Њ–Љ) –±—Л–ї–Є –Њ—Ж–µ–љ–µ–љ—Л –≤ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ, –њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ–Љ, –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤ —А–∞–Љ–Ї–∞—Е III —Д–∞–Ј—Л, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –≤ 49 –Ї–ї–Є–љ–Є–Ї–∞—Е 8 —Б—В—А–∞–љ –Х–≤—А–Њ–њ—Л –љ–∞ 533 –њ–∞—Ж–Є–µ–љ—В–∞—Е —Б –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є (–≤–Ї–ї—О—З–∞—П –њ–Є–≥–Љ–µ–љ—В–љ—Г—О, –њ—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ—Г—О) –Є –Њ—Д—В–∞–ї—М–Љ–Њ–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є. –°–њ—Г—Б—В—П 24 –Љ–µ—Б. –љ–∞–±–ї—О–і–µ–љ–Є—П —Б—А–µ–і–љ–µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 7,1 –Љ–Љ —А—В. —Б—В. (29,1%) –≤ –≥—А—Г–њ–њ–µ —Б —В–∞—Д–ї—Г–њ—А–Њ—Б—В–Њ–Љ –Є 7,7 –Љ–Љ —А—В. —Б—В. (32,2%) —Б –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–Њ–Љ (—А–∞–Ј–љ–Є—Ж–∞ –±—Л–ї–∞ –Њ—Ж–µ–љ–µ–љ–∞ –Ї–∞–Ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Љ–∞–ї–Њ–Ј–љ–∞—З–Є–Љ–∞—П) [53].
–Ю—В–Љ–µ—З–µ–љ–∞ —Е–Њ—А–Њ—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е: –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —П–≤–ї–µ–љ–Є—П –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –≤ –њ—А–µ–і–µ–ї–∞—Е —Б–ї–∞–±–Њ–є –Є —Г–Љ–µ—А–µ–љ–љ–Њ–є —Б—В–µ–њ–µ–љ–µ–є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є. –°–Є—Б—В–µ–Љ–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л, —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –њ—А–Є–µ–Љ–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –±—Л–ї–Є –Њ—В–Љ–µ—З–µ–љ—Л –≤ 11 —Б–ї—Г—З–∞—П—Е –≤ 1-–є (—В–∞—Д–ї—Г–њ—А–Њ—Б—В) –Є –≤ 9-—В–Є – –≤–Њ 2-–є (–ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В) –≥—А—Г–њ–њ–∞—Е. –Ь–µ—Б—В–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л (–њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А–µ–Љ–Є—П) –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ—Л –≤ 1-–є –≥—А—Г–њ–њ–µ –≤ 48,1 –Є –≤ 44,3% – –≤–Њ 2-–є. –Я–Њ–≤—Л—И–µ–љ–љ—Л–є —А–Њ—Б—В —А–µ—Б–љ–Є—Ж —Б–њ—Г—Б—В—П 24 –Љ–µ—Б. –Њ—В–Љ–µ—В–Є–ї–Є 90% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ. –Я–Є–≥–Љ–µ–љ—В–∞—Ж–Є—П —А–∞–і—Г–ґ–Ї–Є —Г—Б–Є–ї–Є–ї–∞—Б—М –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –њ—А–Є —В–µ—А–∞–њ–Є–Є –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–Њ–Љ (28%), —З–µ–Љ —В–∞—Д–ї—Г–њ—А–Њ—Б—В–Њ–Љ (26,1%) [13, 53].
–Т —А–∞–Љ–Ї–∞—Е III —Д–∞–Ј—Л —В–∞–Ї–ґ–µ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ —Б –С–• –Є –µ–≥–Њ –±–µ—Б–Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–љ–Њ–є —Д–Њ—А–Љ—Л –љ–∞ 43 –њ–∞—Ж–Є–µ–љ—В–∞—Е —Б –Ю–£–У. –Ю–±–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ —Б—А–Њ–Ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П (4 –љ–µ–і.) [15]. –Т –†–Њ—Б—Б–Є–Є –Є —Б—В—А–∞–љ–∞—Е –°–Э–У —А—П–і –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є —В–∞–Ї–ґ–µ –њ—А–Њ–≤–µ–ї–Є –Њ—А–Є–≥–Є–љ–∞–ї—М–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ —В. —З. –≤ —А–∞–Љ–Ї–∞—Е —Д–∞–Ј—Л III [13,1–4].
–Я–Њ–Љ–Є–Љ–Њ –≤—Л—Б–Њ–Ї–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –љ–Є–Ј–Ї–Њ–≥–Њ —Г—А–Њ–≤–љ—П –њ–Њ–±–Њ—З–љ—Л—Е —П–≤–ї–µ–љ–Є–є –Њ–і–љ–Є–Љ –Є–Ј –≤–∞–ґ–љ–µ–є—И–Є—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –∞–љ–∞–ї–Њ–≥–Њ–≤ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ —П–≤–ї—П–µ—В—Б—П –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П —Б—Г—В–Њ—З–љ—Л—Е –Ї–Њ–ї–µ–±–∞–љ–Є–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н—В–Є—Е —Б–≤–Њ–є—Б—В–≤ –≤ 2013 –≥. –≤—Л–њ–Њ–ї–љ–Є–ї A. Konstas [25], –њ—А–Њ–≤–µ–і—П —Б—Г—В–Њ—З–љ—Г—О —В–Њ–љ–Њ–Љ–µ—В—А–Є—О –њ–Њ –У–Њ–ї—М–і–Љ–∞–љ—Г 38 –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є –≤ 10:00, 14:00, 18:00 –Є 22:00. –†–µ–Ј—Г–ї—М—В–∞—В—Л —В–Њ–љ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Є–≤–Њ–є –Њ–Ї–∞–Ј–∞–ї–Є—Б—М —Б—Е–Њ–ґ–Є–Љ–Є —Б –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞.
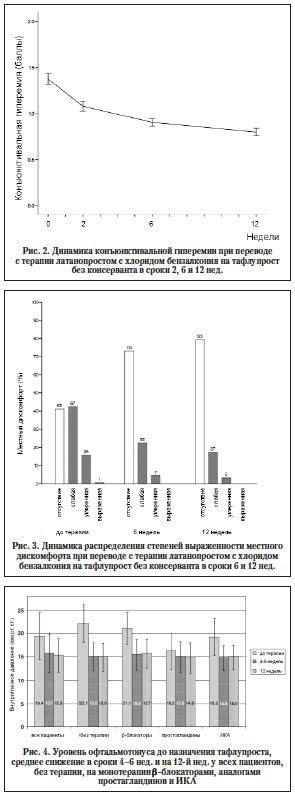
–Я–Њ—П–≤–ї–µ–љ–Є–µ –∞–љ–∞–ї–Њ–≥–∞ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ –±–µ–Ј –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–∞ –і–Њ–ї–ґ–љ–Њ —Б—В–∞—В—М —Е–Њ—А–Њ—И–Є–Љ –њ–Њ–і—Б–њ–Њ—А—М–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є —А–∞–Ј–і—А–∞–ґ–µ–љ–Є—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –≥–ї–∞–Ј–∞ –Є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є. –Т –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ —Н—В–Њ–Љ—Г –≤ 2010 –≥. –њ—А–Њ—Д–µ—Б—Б–Њ—А H. Uusitalo [51] –њ—А–Њ–≤–µ–ї –Њ—Ж–µ–љ–Ї—Г —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –±–µ–Ј –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–∞ –љ–∞ 158 –њ–∞—Ж–Є–µ–љ—В–∞—Е —Б –Ю–£–У –Є –Њ—Д—В–∞–ї—М–Љ–Њ–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є, –њ–µ—А–µ–≤–µ–і—П –Є—Е –љ–∞ —В–∞—Д–ї—Г–њ—А–Њ—Б—В —Б –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞ –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –њ–ї–Њ—Е–Њ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ. –Т —В–µ—З–µ–љ–Є–µ 12 –љ–µ–і. –њ–Њ—Б–ї–µ —Б–Љ–µ–љ—Л —В–µ—А–∞–њ–Є–Є —А–∞–Ј–љ–Є—Ж—Л –≤ –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–µ –Њ—В–Љ–µ—З–µ–љ–Њ –љ–µ –±—Л–ї–Њ. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –≥–ї–∞–Ј–∞ (–Ј—Г–і, —Б–ї–µ–Ј–Њ—В–µ—З–µ–љ–Є–µ, —А–∞–Ј–і—А–∞–ґ–µ–љ–Є–µ, –ґ–ґ–µ–љ–Є–µ, –њ–Њ–Ї–∞–ї—Л–≤–∞–љ–Є–µ –Є –Њ—Й—Г—Й–µ–љ–Є–µ –Є–љ–Њ—А–Њ–і–љ–Њ–≥–Њ —В–µ–ї–∞), –∞ —В–∞–Ї–ґ–µ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–µ–є –Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Д–ї—О–Њ—А–µ—Б—Ж–µ–Є–љ–Њ–≤–Њ–≥–Њ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –Є —А–Њ–≥–Њ–≤–Є—Ж—Л –њ–Њ—Б–ї–µ –њ–µ—А–µ–Ї–ї—О—З–µ–љ–Є—П –љ–∞ —В–∞—Д–ї—Г–њ—А–Њ—Б—В –±–µ–Ј –С–• —Б–Њ—Б—В–∞–≤–Є–ї–Њ 50% (—А–Є—Б. 2 –Є 3). –°–њ—Г—Б—В—П 12 –љ–µ–і. —В–µ—А–∞–њ–Є–Є —А–∞–Ј—А—Л–≤ —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є —Б–Њ—Б—В–∞–≤–Є–ї 7,8±4,9 —Б –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Є—Б—Е–Њ–і–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ –≤ 4,5±2,5 —Б (—А<0,001). –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є–Љ–њ—А–µ—Б—Б–Є–Њ–љ–љ–Њ–є —Ж–Є—В–Њ–ї–Њ–≥–Є–Є –≤—Л—П–≤–Є–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –∞–љ–Њ–Љ–∞–ї—М–љ—Л—Е –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –њ–Њ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –∞–љ—В–Є–≥–µ–љ–Њ–≤ – –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л (HLA-DR –Є Mucin-5AC). –Т—Л—И–µ–њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –≤—Л—Б–Њ–Ї–Њ–Љ –њ—А–Њ—Д–Є–ї–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –±–µ—Б–Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–љ–Њ–є —Д–Њ—А–Љ—Л —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є A. Hommer [17, 18] 544 –њ–∞—Ж–Є–µ–љ—В–∞ —Б –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є –±—Л–ї–Є –њ–µ—А–µ–≤–µ–і–µ–љ—Л –љ–∞ —В–µ—А–∞–њ–Є—О —В–∞—Д–ї—Г–њ—А–Њ—Б—В–Њ–Љ –±–µ–Ј –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–∞ —Б —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (β––±–ї–Њ–Ї–∞—В–Њ—А—Л, –Є–љ–≥–Є–±–Є—В–Њ—А—Л –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л (–Ш–Ъ–Р), –∞–љ–∞–ї–Њ–≥–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤). –Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –±—Л–ї–Є –Њ—В–Љ–µ—З–µ–љ—Л —Б–љ–Є–ґ–µ–љ–Є–µ –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ (—А–Є—Б. 4) –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Љ–µ—Б—В–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є.
–Я–Њ—Е–Њ–ґ–µ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ –њ–µ—А–µ–≤–Њ–і—Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є –Є –Њ—Д—В–∞–ї—М–Љ–Њ–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є —Б —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б —Г—Б–ї–Њ–≤–љ–Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –љ–∞ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О —В–∞—Д–ї—Г–њ—А–Њ—Б—В–Њ–Љ 0,0015% –±–µ–Ј –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–∞ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤ –У–µ—А–Љ–∞–љ–Є–Є. –Ъ –Ї–Њ–љ—Ж—Г —Б—А–Њ–Ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П (6–12 –љ–µ–і.) –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф —Б 19,5±4,4 –і–Њ 16,4±2,9 –Љ–Љ —А—В. —Б—В. –љ–∞ —В–∞—Д–ї—Г–њ—А–Њ—Б—В–µ (—А<0,001). –Э–∞ –њ—А–µ–і—И–µ—Б—В–≤–Њ–≤–∞–≤—И–µ–є —В–µ—А–∞–њ–Є–Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є –Ї–∞–Ї «–Њ—З–µ–љ—М —Е–Њ—А–Њ—И–∞—П» –Є «—Е–Њ—А–Њ—И–∞—П» –≤ 28,3% —Б–ї—Г—З–∞–µ–≤, «–Љ–µ–љ–µ–µ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–∞—П» – –≤ 38,4% –Є «–љ–µ–њ—А–Є–µ–Љ–ї–µ–Љ–∞—П» – –≤ 18%. –Я–Њ—Б–ї–µ –њ–µ—А–µ–≤–Њ–і–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ —В–∞—Д–ї—Г–њ—А–Њ—Б—В –±–µ–Ј –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–∞ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Є–Ј–Љ–µ–љ–Є–ї–Њ—Б—М –≤ –ї—Г—З—И—Г—О —Б—В–Њ—А–Њ–љ—Г: 85,7% –±–Њ–ї—М–љ—Л—Е –Њ—В–Љ–µ—В–Є–ї–Є —Б–≤–Њ–Є –Њ—Й—Г—Й–µ–љ–Є—П –Ї–∞–Ї «–Њ—З–µ–љ—М —Е–Њ—А–Њ—И–Є–µ» –Є «—Е–Њ—А–Њ—И–Є–µ» [14].
–Ю—Ж–µ–љ–Ї—Г –≤–ї–Є—П–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М —А–Њ–≥–Њ–≤–Є—Ж—Л –њ—А–Њ–≤–µ–ї –≤ 2014 –≥. T. Kumagami [26], –њ–µ—А–µ–≤–µ–і—П 28 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞ –Є —В—А–∞–≤–Њ–њ—А–Њ—Б—В–∞ –љ–∞ –±–µ—Б–Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–љ—Г—О —Д–Њ—А–Љ—Г —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞, –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–≤ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–Є–њ–µ—А–µ–Љ–Є–Є –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –≤—А–µ–Љ–µ–љ–Є —А–∞–Ј—А—Л–≤–∞ —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є –≤–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е. –Я–Њ—Е–Њ–ґ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –Є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [21, 37, 56].
–Т–ї–Є—П–љ–Є–µ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Н–љ–і–Њ—В–µ–ї–Є—П, –Ї–µ—А–∞—В–Њ—Ж–Є—В–Њ–≤ –Є —Б—Г–±–±–∞–Ј–∞–ї—М–љ—Л—Е –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ —А–Њ–≥–Њ–≤–Є—Ж—Л –њ–Њ –і–∞–љ–љ—Л–Љ –Ї–Њ–љ—Д–Њ–Ї–∞–ї—М–љ–Њ–є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ —В–∞—Д–ї—Г–њ—А–Њ—Б—В–∞ –±–µ–Ј –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–∞ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б–Њ –Ј–і–Њ—А–Њ–≤—Л–Љ–Є –≥–ї–∞–Ј–∞–Љ–Є –Є –њ–Њ—Б–ї–µ 1 –≥–Њ–і–∞ –ї–µ—З–µ–љ–Є—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —Б –±–µ–љ–Ј–∞–ї–Ї–Њ–љ–Є–µ–Љ —Е–ї–Њ—А–Є–і–Њ–Љ –њ—А–Њ–≤–µ–ї –≤ 2013 –≥. –Ї–Њ–ї–ї–µ–Ї—В–Є–≤ –Є—В–∞–ї—М—П–љ—Б–Ї–Є—Е –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Њ–≤. –С—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤ —Н–њ–Є—В–µ–ї–Є–Є –Є —Б—В—А–Њ–Љ–µ —А–Њ–≥–Њ–≤–Є—Ж—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–∞, –Є —Б–Њ—Е—А–∞–љ–љ–Њ—Б—В—М –Ї–Њ—А–љ–µ–∞–ї—М–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А –њ—А–Є –±–µ—Б–Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є [42]. –° –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ–љ—Д–Њ–Ї–∞–ї—М–љ–Њ–є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є –Є –Є–Љ–њ—А–µ—Б—Б–Є–Њ–љ–љ–Њ–є —Ж–Є—В–Њ–ї–Њ–≥–Є–Є L. Mastropasqua [32] –њ–Њ–і—В–≤–µ—А–і–Є–ї —Б–Њ—Е—А–∞–љ–љ–Њ—Б—В—М –±–Њ–Ї–∞–ї–Њ–≤–Є–і–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е –Љ—Г—Ж–Є–љ, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є–љ—Б—В–Є–ї–ї–Є—А—Г—О—Й–Є—Е —В–∞—Д–ї—Г–њ—А–Њ—Б—В –±–µ–Ј –С–•.
–Т–∞–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –љ–∞–±–ї—О–і–∞–µ–Љ–Њ–µ –≤ —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–љ–Є–ґ–µ–љ–Є–µ –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –њ–Њ—Б–ї–µ –њ–µ—А–µ–≤–Њ–і–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ –±–µ—Б–Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–љ—Г—О —Д–Њ—А–Љ—Г –њ—А–µ–њ–∞—А–∞—В–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–ї–µ–і—Б—В–≤–Є–µ–Љ –њ–Њ–≤—Л—И–µ–љ–Є—П –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є –±–Њ–ї—М–љ—Л—Е –њ—А–Є —Г–ї—Г—З—И–µ–љ–Є–Є —Б—В–µ–њ–µ–љ–Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Т —Н—В–Њ–Љ –≥–Њ–і—Г –≤ –†–Њ—Б—Б–Є–Є –њ–Њ—П–≤–Є–ї—Б—П –њ–µ—А–≤—Л–є –Ї–Њ–Љ–Љ–µ—А—З–µ—Б–Ї–Є –і–Њ—Б—В—Г–њ–љ—Л–є –∞–љ–∞–ї–Њ–≥ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –±–µ–Ј –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–∞ –≤ —Д–Њ—А–Љ–µ —О–љ–Є—В-–і–Њ–Ј—Л – –Ґ–∞—Д–ї–Њ—В–∞–љ. –Я—А–Њ–є–і—П –≤—Б–µ —Д–∞–Ј—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Њ–љ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї –≤—Л—Б–Њ–Ї—Г—О, —Б—А–∞–≤–љ–Є–Љ—Г—О —Б –і–Њ—Б—В—Г–њ–љ—Л–Љ–Є –Њ—А–Є–≥–Є–љ–∞–ї—М–љ—Л–Љ–Є –∞–љ–∞–ї–Њ–≥–∞–Љ–Є —Б—В–∞–±–Є–ї—М–љ—Г—О –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М. –Я–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –љ–Њ–≤–Њ–є –±–µ—Б–Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–љ–Њ–є —Д–Њ—А–Љ—Л –њ–Њ–ї—Г—З–Є–ї–∞ –≤—Л—Б–Њ–Ї—Г—О –Њ—Ж–µ–љ–Ї—Г –Ї–∞–Ї –Ї–ї–Є–љ–Є—Ж–Є—Б—В–∞–Љ–Є, —В–∞–Ї –Є —Б–∞–Љ–Є–Љ–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, —З—В–Њ, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ–Њ–Љ–Њ–ґ–µ—В –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ —В–Ї–∞–љ–µ–є –њ–µ—А–µ–і–љ–µ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –≥–ї–∞–Ј–∞, —Б –і—А—Г–≥–Њ–є – –њ–Њ–≤—Л—Б–Є—В—М –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Р–ї–µ–Ї—Б–µ–µ–≤ –Т.–Э., –Ы–µ–≤–Ї–Њ –Ь.–Р., –Р–ї—М-–У–Є—Д–∞—А–Є –Ь—Г—Б–∞ –Р.–Ь. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –≤ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–µ—А–≤–Є—З–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л // –У–ї–∞—Г–Ї–Њ–Љ–∞. 2009. –Ґ. 8. вДЦ 1. –°. 29–31.
2. –Х—А–Є—З–µ–≤ –Т.–Я., –Р–Љ–±–∞—А—Ж—Г–Љ—П–љ –Ъ.–У. –Ъ–Њ–љ—Б–µ—А–≤–∞–љ—В—Л –Є –≤—В–Њ—А–Є—З–љ—Л–є —Б–Є–љ–і—А–Њ–Љ «—Б—Г—Е–Њ–≥–Њ –≥–ї–∞–Ј–∞» –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—Б—В–љ–Њ–є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–µ—А–≤–Є—З–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л // –У–ї–∞—Г–Ї–Њ–Љ–∞. –Ц—Г—А–љ–∞–ї –Э–Ш–Ш –≥–ї–∞–Ј–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є –†–Р–Ь–Э. 2011. –Ґ. 10. вДЦ 2. –°. 59–66.
3. –Х—А–Є—З–µ–≤ –Т.–Я., –§–Є–ї–Є–њ–њ–Њ–≤–∞ O.M., –Ы–Њ–≤–њ–∞—З–µ –Ф–ґ.–Э., –Т–∞—Б–Є–ї–µ–љ–Ї–Њ–≤–∞ –Ы.–Т. –°–Є–љ–і—А–Њ–Љ «—Б—Г—Е–Њ–≥–Њ –≥–ї–∞–Ј–∞» –Є –Љ–µ—Б—В–љ–∞—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л // –Ю—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—П –≤ –С–µ–ї–∞—А—Г—Б–Є. 2009. вДЦ 1. –°. 123–126.
4. –Ь–∞—А—З–µ–љ–Ї–Њ –Ы.–Э., –Ф–ґ—Г–Љ–Њ–≤–∞ –Ь.–§., –С–Є—А–Є—З –Ґ.–Р. –Є –і—А. –Ґ–∞—Д–ї—Г–њ—А–Њ—Б—В –≤ –ї–µ—З–µ–љ–Є–Є –њ–µ—А–≤–Є—З–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л // –Ю—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—П. –Т–Њ—Б—В–Њ—З–љ–∞—П –Х–≤—А–Њ–њ–∞. 2011. –Ґ. 4. вДЦ 11. –°. 111–116.
5. Abe S., Watabe H., Takaseki S., Aihara M., Yoshitomi T. The effects of prostaglandin analogues on intracellular Ca2+ in ciliary arteries of wild-type and prostanoid receptor-deficient mice // J. Ocul. Pharmacol. Ther. 2013. Vol. 29. вДЦ 1. P. 55–60.
6. Akaishi T., Kutrashima H., Odani-Kaeabata N., et al. Effects of repeated administration of tafluprost, latanoprost, and travoprost on optic nerve blood flow in conscious normal rabbits // J. Ocul. Pharmacol. Ther. 2010. Vol. 26. вДЦ 2. P. 181–186.
7. Alm A. Comparative phase III clinical trial of latanoprost and timolol in patients with elevated intraocular pressure // Adv. Prostaglandin Thromboxane Leukot. Res. 1995. Vol. 23. P. 527–532.
8. Brasnu E., Brignole-Baudouin F., Riancho L. et al. In vitro effects of preservative-free tafluprost and preserved latanoprost, travoprost, and bimatoprost in a conjunctival epithelial cell line // Curr Eye Res. 2008. Vol. 33. вДЦ 4. P. 303–312.
9. Bull N.D., Johnson T.V., Welsapar G. et al. Use of an adult retinal explant model for screening of potential retinal ganglion cell neuroprotective therapies // Invest. Ophthalmol. Vis. Sci. 2011. Vol. 52. вДЦ 6. P. 3309–3320.
10. Burstein N.L. Preservative alteration of corneal permeability in humans and rabbits // Invest. Ophthalmol. Vis. Sci. 1984. Vol. 25. вДЦ 12. P. 1453–1457.
11. Camras C.B., Bito L.Z. Reduction of intraocular pressure in normal and glaucomatous primate (Aotus trivirgatus) eyes by topically applied prostaglandin F2a // Curr. Eye Res. 1981. вДЦ 1. P. 205–209.
12. Dong Y., Watabe H., Su G. et al. Relaxing effect and mechanism of tafluprost on isolated rabbit ciliary arteries // Exp. Eye Res. 2008. Vol. 87. вДЦ 3. P. 251–256.
13. Egorov E., Ropo A; Investigators. Adjunctive use of tafluprost with timolol provides additive effects for reduction of intraocular pressure in patients with glaucoma // Eur. J. Ophthalmol. 2009. Vol. 19. вДЦ 2. P. 214–222.
14. Erb C., Lanzl I., Seidova S.F., Kimmich F. Preservative-free tafluprost 0.0015% in the treatment of patients with glaucoma and ocular hypertension // Avd. Ther. 2011. Vol. 28. вДЦ 7. P. 575–585.
15. Hamacher T., Airaksinen J., Saarela V. et al. Efficacy and safety levels of preserved and preservative-free tafluprost are equivalent in patients with glaucoma or ocular hypertension: results from a pharmacodynamics analysis // Acta. Ophthalmol. Suppl. (Oxf). 2008. Vol. 242. P. 14–19.
16. Hellberg M.R., Sallee V.L., McLaughlin M.A. et. al. Preclinical efficacy of travoprost, a potent and selective FP prostaglandin receptor agonist // J. Ocular. Pharmacol. Ther. 2001. Vol. 17. P. 421–432.
17. Hommer A., Kimmich F. Switching patients from preserved prostaglandin-analog monotherapy to preservative-free tafluprost // Clin Ophthalmol. 2011. вДЦ 5. P. 623–631.
18. Hommer A., Mohammed R.O., Burchert M., Kimmich F. IOP-lowering efficacy and tolerability of preservative-free tafluprost 0.0015% among patients with ocular hypertension or glaucoma // Curr Med Res Opin. 2010. Vol. 26. вДЦ 8. P. 1905–1913.
19. Izumi N., Nagaoka T., Sato E. et al. Short-term effects of topical tafluprost on retinal blood flow in cats // J. Ocul. Pharmacol. Ther. 2008. Vol. 24. вДЦ 5. P. 521–526.
20. Ishida N., Odani-Kawabata N., Shimazaki A., Hara H. Prostanoids in the therapy of glaucoma // Cardiovasc. Drug. Rev. 2006. Vol. 24. вДЦ 1. P. 1–10.
21. Janulevičienė I., Derkač I., Grybauskiene L., Paulauskaitė R. et al. Effects of preservative-free tafluprost on tear film osmolarity, tolerability, and intraocular pressure in previously treated patients with open-angle glaucoma // Clin. Ophthalmol. 2012. вДЦ 6. P. 103–109.
22. Johnstone M.A. Hypertrichosis and increased pigmentation of eyelashes and adjacent hair in the region of the ipsilateral eyelids of patients treated with unilateral topical latanoprost // Am. J. Ophthalmol. 1997. Vol. 124. P. 544–547.
23. Kanamori A., Naka M., Fukuda M. et al. Tafluprost protects rat retinal ganglion cells from apoptosis in vitro and in vivo // Graefes Arch. Clin. Exp. Ophthalmol. 2009. Vol. 247. вДЦ 10. P. 1353–1360.
24. Kashiwagi K., Tsukamoto K., Suzuki M., Tsukahara S.J. Effects of isopropyl unoprostone and latanoprost on melanogenesis in mouse epidermal melanocytes // Glaucoma. 2002. Vol. 11. вДЦ 1. P. 57–64.
25. Konstas A.G., Quaranta L., Katsanos A., Riva I. et al. Twenty-four hour efficacy with preservative free tafluprost compared with latanoprost in patients with primary open angle glaucoma or ocular hypertension // Br. J. Ophthalmol. 2013. Vol. 97. вДЦ 12. P. 1510–1515.
26. Kumagami T., Wakiyama H., Kusano M., Kajiyama A. et al. Comparison of corneal safety and intraocular pressure-lowering effect of tafluprost ophthalmic solution with other prostaglandin ophthalmic solutions // J Ocul. Pharmacol. Ther. 2014. Vol. 30. вДЦ 4. P. 340–345.
27. Kurashima H., Asai Y., Aihara M., Ishida N., Nakamura M., Araie M. Ocular hypotensive effect of tafluprost in latanoprost low-responder cynomolgus monkeys // J. Glaucoma. 2012. Vol. 21. вДЦ 2. P. 123–128.
28. Kurashima H., Watabe H., Sato N., Abe S., Ishida N., Yoshitomi T. Effects of prostaglandin PGF2α analogues on endothelin-1-induced impairment of rabbit ocular blood flow: comparison among tafluprost, travoprost, and latanoprost // Exp. Eye Res. 2010. Vol. 91. вДЦ 6. P. 853–859.
29. Liang H., Baudouin C., Labbe A., Riancho L., Brignole-Baudouin F. Conjunctiva-associated lymphoid tissue (CALT) reactions to antiglaucoma prostaglandins with or without BAK-preservative in rabbit acute toxicity study // PLoS One. 2012. Vol. 7. вДЦ 3. –†. 33913.
30. Liang H., Baudouin C., Pauly A. et al. Conjunctival and corneal reactions in rabbits following short and repeated exposure to preservative-free tafluprost, commercially available latanoprost and 0.02% benzalkonium chloride // Br. J. Ophthalmol. 2008. Vol. 92. вДЦ 9. P. 1275–1282.
31. Madhu C., Rix P., Nguyen T. et al. Penetration of natural prostaglandins and their ester prodrugs and analogs // J. Ocul. Pharmacol. Ther. 1998. Vol. 14. вДЦ 5. P. 389–399.
32. Mastropasqua L., Agnifili L., Fasanella V., Curcio C. et al. Conjunctival goblet cells density and preservative-free tafluprost therapy for glaucoma: an in vivo confocal microscopy and impression cytology study // Acta Ophthalmol. 2013. Vol. 91. вДЦ 5. P. 397–405.
33. Mayama C., Ishii K., Saeki T. et al. Effects of topical phenylephrine and tafluprost on optic nerve head circulation in monkeys with unilateral experimental glaucoma // Invest. Ophthamol. Vis. Sci. 2010. Vol. 51. вДЦ 8. P. 4117–4124.
34. Mishima H.K., Masuda K., Kitazawa Y., Azuma I., Araie M. A comparison of latanoprost and timolol in primary open-angle glaucoma and ocular hypertension: A 12-week study // Arch. Ophthalmol. 1996. Vol. 114. P. 929–932.
35. Nagata A., Omachi K., Higashide T., Shirae S., Shimazaki A. et al. OCT evaluation of neuroprotective effects of tafluprost on retinal injury after intravitreal injection of endothelin-1 in the rat eye // Invest. Ophthalmol. Vis. Sci. 2014. Vol. 55. вДЦ 2. P. 1040–1047.
36. Nakajima T., Matsugi T., Goto W. et al. New fluoroprostaglandin F2α derivatives with prostanoid FP-receptor agonistic activity as potent ocular-hypotensive agents // Biol. Pharm. Bull. 2003. Vol. 26. вДЦ 12. P. 1691–1695.
37. Niwano Y., Iwasawa A., Ayaki M. Ocular surface cytotoxicity and safety evaluation of tafluprost, a recently developed anti-glaucoma prostaglandin analog // Ophthalmol. Eye. Dis. 2014. вДЦ 6. P. 5–12.
38. Ota T., Aihara M., Saeki T. et al. The IOP-lowering effects and mechanism of action of tafluprost in prostanoid receptor-deficient mice // Br. J. Ophthalmol. 2007. Vol. 91. P. 673–676.
39. Ota T., Murata H., Sugimoto E. et al. Prostaglandin analogues and mouse intraocular pressure: Effects of tafluprost, latanoprost, travoprost, and unoprostone, considering 24 hour variation // Invest. Ophthalmol. Vis. Sci. 2005. Vol. 46. вДЦ 6. P. 2006–2011.
40. Pellinen P., Lokkila J. Corneal penetration into rabbit aqueous humor is comparable between preserved and preservative-free tafluprost // Ophthalmic. Res. 2009. Vol. 41. вДЦ 2. P. 118–122.
41. Redell M.A., Yang D.C., Lee V.H. The role of esterase activity in the ocular disposition of dipivalyl epinephrine in rabbits // Int. J. Pharm. 1983. Vol. 17. P. 299–312.
42. Rossi G.C., Blini M., Scudeller L., Ricciardelli G. et al. Effect of preservative-free tafluprost on keratocytes, sub-Basal nerves, and endothelium: a single-blind one-year confocal study on naïve or treated glaucoma and hypertensive patients versus a control group // J. Ocul. Pharmacol. Ther. 2013. 2013. Vol. 29. вДЦ 9. P. 821–825.
43. Sharif N.A., Davis T.L., Williams G.W. [3H]AL-5848 ([3H]9b-(þ)-Fluprostenol). Carboxylic acid of travoprost (AL-6221), a novel FP prostaglandin to study the pharmacology and autoradiographic localization of the FP receptor // J. Pharmac. Pharmacol. 1999. Vol. 51. P. 685–694.
44. Sherwood M., Brandt J. Six-month comparison of bimatoprost once-daily and twice-daily with timolol twice-daily in patients with elevated intraocular pressure // Surv. Ophthalmol. 2001. Vol. 45. P. 361–368.
45. Stjernschantz J., Selen G., Sjoquist B., Resul B. Preclinical pharmacology of latanoprost, a phenyl-substituted PGF2a analogue // Adv. Prostaglandin Thromboxane Leuket. Res. 1995. Vol. 23. P. 513–518.
46. Sutton A., Gilvarry A., Ropo A. A comparative placebo-controlled study of prostanoid fluoroprostaglandin receptor agonist tafluprost and latanoprost in healthy males // J. Ocul. Pharmacol. Ther. 2007. Vol. 23. вДЦ 4. P. 359–365.
47. Sutton A., Gouws P., Ropo A. Tafluprost a new potent prostanoid receptor agonist: a dose-response study on pharmacodynamics and tolerability in healthy volunteers // Int. J. Clin. Pharmacol. Ther. 2008. Vol. 46. вДЦ 8. P. 400–406.
48. Takagi Y., Nakajima T., Shimazaki A. et al. Pharmacological characteristics of AFP-168 (tafluprost), a new prostanoid FP receptor agonist, a san ocular hypotensive drug // Exp. Eye Res. 2004. Vol. 74. вДЦ 4. P. 767–776.
49. Taniguchi T., Haque M.S., Sugiyama K., Hori N., Kitazawa Y. Ocular hypotensive mechanism of topical isopropyl unoprostone, a novel prostaglandin metabolite-related drug, in rabbits // J. Ocul. Pharmacol. Ther. 1996. Vol. 12. P. 489–498.
50. Traverso C.E., Ropo A., Papadia M. et al. A Phase II study on the duration and stability of the intraocular pressure-lowering effect and tolerability of tafluprost compared with latanoprost // J. Ocul. Pharmacol. Ther. 2010. Vol. 26. вДЦ 1. P. 97–104.
51. Uusitalo H., Chen E., Pfeiffer N. et al. Switching from a preserved to a preservative-free prostaglandin preparation in topical glaucoma medication // Acta. Ophthalmol. 2010. Vol. 88. вДЦ 3. P. 329–336.
52. Uusitalo H., Kaarniranta K., Ropo A. Pharmacokinetics, efficacy and safety of preserved and preservative-free tafluprost in healthy volunteers // Acta Ophthalmol. Suppl. (Oxf). 2008. Vol. 242. P. 7–13.
53. Uusitalo H., Pillunat L.E., Ropo A. Efficacy and safety of tafluprost 0.0015% versus latanoprost 0.005% eye drops in open-angle glaucoma and ocular hypertension: 24-month results of a randomized, double-masked Phase III study // Acta Ophthalmol. 2010. Vol. 88. вДЦ 1. P. 12–19.
54. Wand M., Ritch R., Isbey E.K.J., Zimmerman T.J. Latanoprost and periocular skin color changes // Arch. Ophthalmol. 2001. Vol. 119. P. 614–615.
55. Watson P., Stjernschantz J., Beck L. et al. A six-month, randomized, double-masked study comparing latanoprost with timolol in open-angle glaucoma and ocular hypertension // Ophthalmology. 1996. Vol. 103. P. 126–137.
56. Whitson J.T., Petroll W.M. Corneal epithelial cell viability following exposure to ophthalmic solutions containing preservatives and/or antihypertensive agents // Adv. Ther. 2012. Vol. 29. вДЦ 10. P. 874–888.
57. Wistrand P.J., Stjernschantz J., Olsson K. The incidence and time-course of latanoprost-induced iridial pigmentation as a function of eye color // Surv. Ophthalmol. 1997. Vol. 41. P. 129–138.
58. Woodward D.F., Krauss A.H., Chen J. et. al. The pharmacology of bimatoprost (Lumigan) // Surv. Ophthalmol. 2001. Vol. 47. P. 337–345.
59. Yamamoto T., Kitazawa Y. Iris-color change developed after topical isopropyl unoprostone treatment. J // Glaucoma. 1997. вДЦ 6. P. 430–432.












