–í–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ
–ü—Ä–ĺ—Ü–Ķ—Ā—Ā –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —Ā—ā–į—Ä–Ķ–Ĺ–ł—Ź –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ —Ü–Ķ–Ľ–ĺ–ľ—É —Ä—Ź–ī—É –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ—č—Ö –ł –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ—č—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ. –í –ĺ—Ā–Ĺ–ĺ–≤–Ķ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į —Ā—ā–į—Ä–Ķ–Ĺ–ł—Ź –Ľ–Ķ–∂–į—ā –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –ľ–Ķ—ā–ł–Ľ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –Ē–Ě–ö –ł, –ļ–į–ļ —Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ, –Ķ–Ķ –Ņ–ĺ–≤—Ä–Ķ–∂–ī–Ķ–Ĺ–ł—Ź [1, 2]. –£–≥–Ĺ–Ķ—ā–Ķ–Ĺ–ł–Ķ —ć–Ĺ–ī–ĺ–≥–Ķ–Ĺ–Ĺ—č—Ö –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ–ĺ–≤ —Ä–Ķ–Ņ–į—Ä–į—Ü–ł–ł –Ē–Ě–ö —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É–Ķ—ā –Ĺ–į–ļ–ĺ–Ņ–Ľ–Ķ–Ĺ–ł—é —Ā–ĺ–ľ–į—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ľ—É—ā–į—Ü–ł–Ļ, —Ź–≤–Ľ—Ź—é—Č–ł—Ö—Ā—Ź –ī–≤–ł–∂—É—Č–ł–ľ–ł —Ā–ł–Ľ–į–ľ–ł –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ–ĺ–≤ –ļ–į–Ĺ—Ü–Ķ—Ä–ĺ–≥–Ķ–Ĺ–Ķ–∑–į —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ —Ā —ć–Ņ–ł–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź–ľ–ł –≤ –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–ľ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–Ķ —Ā—ā–į—Ä–Ķ–Ĺ–ł—Ź [2]. –Ě–į—Ä—É—ą–Ķ–Ĺ–ł—Ź —Ä–į–Ī–ĺ—ā—č –ł —Ā—ā—Ä—É–ļ—ā—É—Ä—č –≥–Ķ–Ĺ–ĺ–≤ —Ä–į–∑–Ľ–ł—á–Ĺ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ĺ–į–Ņ—Ä–į–≤–Ľ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –≤–ĺ–∑–Ĺ–ł–ļ–į—é—ā –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –Ē–Ě–ö. –ė–∑—É—á–Ķ–Ĺ–ĺ –Ī–ĺ–Ľ—Ć—ą–ĺ–Ķ –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–ĺ –≥–Ķ–Ĺ–ĺ–≤, –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –ļ–ĺ—ā–ĺ—Ä—č—Ö –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—é —Ā–ĺ–ī–Ķ—Ä–∂–į–Ĺ–ł—Ź –ļ–ĺ–ī–ł—Ä—É–Ķ–ľ—č—Ö –ł–ľ–ł –≤–Ķ—Č–Ķ—Ā—ā–≤, —á—ā–ĺ —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É–Ķ—ā —Ä–į–∑–≤–ł—ā–ł—é –ĺ–Ĺ–ļ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ.
–ė–Ĺ—Ā—É–Ľ–ł–Ĺ–ĺ–Ņ–ĺ–ī–ĺ–Ī–Ĺ—č–Ļ —Ą–į–ļ—ā–ĺ—Ä —Ä–ĺ—Ā—ā–į 1 (IGF1) –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź–Ķ—ā —Ā–ĺ–Ī–ĺ–Ļ –Ņ–Ķ–Ņ—ā–ł–ī–Ĺ—č–Ļ —Ą–į–ļ—ā–ĺ—Ä —Ä–ĺ—Ā—ā–į, –ļ–ĺ—ā–ĺ—Ä—č–Ļ —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É–Ķ—ā –Ņ—Ä–ĺ–Ľ–ł—Ą–Ķ—Ä–į—Ü–ł–ł –ļ–Ľ–Ķ—ā–ĺ–ļ –ł –ł–Ĺ–≥–ł–Ī–ł—Ä—É–Ķ—ā –į–Ņ–ĺ–Ņ—ā–ĺ–∑. –Ě–į –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–ľ —É—Ä–ĺ–≤–Ĺ–Ķ IGF1 —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į–Ķ—ā—Ā—Ź –ļ–į–ļ –ļ–Ľ—é—á–Ķ–≤–ĺ–Ļ —Ą–į–ļ—ā–ĺ—Ä –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł–ł, –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ—č–Ļ –ī–Ľ—Ź –Ņ—Ä–ĺ—Ö–ĺ–∂–ī–Ķ–Ĺ–ł—Ź –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–≥–ĺ —Ü–ł–ļ–Ľ–į. –ö–į–ļ –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ—č–Ķ, —ā–į–ļ –ł —Ä–į–ļ–ĺ–≤—č–Ķ –ļ–Ľ–Ķ—ā–ļ–ł –ļ–ĺ–Ľ–ĺ—Ä–Ķ–ļ—ā–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ —ć–Ņ–ł—ā–Ķ–Ľ–ł—Ź —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—Ä—É—é—ā —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä—č IGF1 (IGF1R) [3]. –ü—Ä–ł –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–Ĺ–ĺ–ľ —É—Ä–ĺ–≤–Ĺ–Ķ IGF1 —É—Ā–ł–Ľ–ł–≤–į–Ķ—ā—Ā—Ź —Ä–ĺ—Ā—ā —Ä–į–ļ–ĺ–≤—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ.
–ė–Ĺ—ā–Ķ—Ä—Ą–Ķ—Ä–ĺ–Ĺ ő≥ (IFN-ő≥) ‚ÄĒ –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –≤–į–∂–Ĺ—č–Ļ —Ü–ł—ā–ĺ–ļ–ł–Ĺ, —É—á–į—Ā—ā–≤—É—é—Č–ł–Ļ –≤ –Ņ—Ä–ĺ—ā–ł–≤–ĺ–ĺ–Ņ—É—Ö–ĺ–Ľ–Ķ–≤–ĺ–ľ –ł–ľ–ľ—É–Ĺ–ł—ā–Ķ—ā–Ķ. –ě–Ī–Ľ–į–ī–į—Ź —Ü–ł—ā–ĺ—Ā—ā–į—ā–ł—á–Ķ—Ā–ļ–ł–ľ, –Ņ—Ä–ĺ–į–Ņ–ĺ–Ņ—ā–ĺ—ā–ł—á–Ķ—Ā–ļ–ł–ľ –ł –ł–ľ–ľ—É–Ĺ–ĺ—Ā—ā–ł–ľ—É–Ľ–ł—Ä—É—é—Č–ł–ľ –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ, IFN-ő≥ –ł–≥—Ä–į–Ķ—ā —Ü–Ķ–Ĺ—ā—Ä–į–Ľ—Ć–Ĺ—É—é —Ä–ĺ–Ľ—Ć –≤ —Ä–į—Ā–Ņ–ĺ–∑–Ĺ–į–≤–į–Ĺ–ł–ł –ł —ć–Ľ–ł–ľ–ł–Ĺ–į—Ü–ł–ł —ā—Ä–į–Ĺ—Ā—Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ. –í —Ö–ĺ–ī–Ķ —ć–Ņ–ł–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –ī–į–Ĺ–Ĺ–į—Ź —Ą—É–Ĺ–ļ—Ü–ł—Ź IFN-ő≥ –ľ–ĺ–∂–Ķ—ā –Ĺ–į—Ä—É—ą–į—ā—Ć—Ā—Ź, –Ņ—Ä–ł–≤–ĺ–ī—Ź –ļ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—é –ī–Ķ—ā–Ķ–ļ—Ü–ł–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–Ĺ—č—Ö –Ķ–ī–ł–Ĺ–ł—Ü [4].
–ß–Ľ–Ķ–Ĺ—č —Ā–Ķ–ľ–Ķ–Ļ—Ā—ā–≤–į –ī–ł–ľ–Ķ—Ä–Ĺ—č—Ö –Ņ–ĺ–Ľ–ł–Ņ–Ķ–Ņ—ā–ł–ī–ĺ–≤ ‚ÄĒ TGF-ő≤ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ–ł—Ä—É—é—ā –ľ–Ĺ–ĺ–≥–ĺ—á–ł—Ā–Ľ–Ķ–Ĺ–Ĺ—č–Ķ –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ—č–Ķ —Ą—É–Ĺ–ļ—Ü–ł–ł, –≤–ļ–Ľ—é—á–į—Ź –Ņ—Ä–ĺ–Ľ–ł—Ą–Ķ—Ä–į—Ü–ł—é, –į–Ņ–ĺ–Ņ—ā–ĺ–∑, –ī–ł—Ą—Ą–Ķ—Ä–Ķ–Ĺ—Ü–ł—Ä–ĺ–≤–ļ—É, —ć–Ņ–ł—ā–Ķ–Ľ–ł–į–Ľ—Ć–Ĺ–ĺ-–ľ–Ķ–∑–Ķ–Ĺ—Ö–ł–ľ–į–Ľ—Ć–Ĺ—č–Ļ –Ņ–Ķ—Ä–Ķ—Ö–ĺ–ī –ł –ľ–ł–≥—Ä–į—Ü–ł—é. –Ē–ł—Ā—Ä–Ķ–≥—É–Ľ—Ź—Ü–ł—Ź TGF-ő≤ –≤–ĺ–≤–Ľ–Ķ—á–Ķ–Ĺ–į –≤ –ļ–į–Ĺ—Ü–Ķ—Ä–ĺ–≥–Ķ–Ĺ–Ķ–∑. –Ě–į —Ä–į–Ĺ–Ĺ–ł—Ö —Ā—ā–į–ī–ł—Ź—Ö —Ä–į–ļ–į TGF-ő≤ –ł–Ĺ–≥–ł–Ī–ł—Ä—É–Ķ—ā –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–≥–ĺ —Ü–ł–ļ–Ľ–į –ł —Ā—ā–ł–ľ—É–Ľ–ł—Ä—É–Ķ—ā –į–Ņ–ĺ–Ņ—ā–ĺ–∑. –ě–ī–Ĺ–į–ļ–ĺ –Ĺ–į –Ņ–ĺ–∑–ī–Ĺ–ł—Ö —Ā—ā–į–ī–ł—Ź—Ö TGF-ő≤ –ľ–ĺ–∂–Ķ—ā –ĺ–ļ–į–∑—č–≤–į—ā—Ć —Ā—ā–ł–ľ—É–Ľ–ł—Ä—É—é—Č–Ķ–Ķ –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ –Ĺ–į –ĺ–Ņ—É—Ö–ĺ–Ľ—Ć, —É–≤–Ķ–Ľ–ł—á–ł–≤–į—Ź –Ķ–Ķ –ł–Ĺ–≤–į–∑–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ł —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā—Ć –ļ –ľ–Ķ—ā–į—Ā—ā–į–∑–ł—Ä–ĺ–≤–į–Ĺ–ł—é [5].
–Ď–Ķ–Ľ–ĺ–ļ CD69 –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź–Ķ—ā —Ā–ĺ–Ī–ĺ–Ļ —ā—Ä–į–Ĺ—Ā–ľ–Ķ–ľ–Ī—Ä–į–Ĺ–Ĺ—č–Ļ –≥–Ľ–ł–ļ–ĺ–Ņ—Ä–ĺ—ā–Ķ–ł–Ĺ —Ā –Ľ–Ķ–ļ—ā–ł–Ĺ–ĺ–≤—č–ľ –ī–ĺ–ľ–Ķ–Ĺ–ĺ–ľ –°-—ā–ł–Ņ–į (CTLD). –ü–ĺ—Ā–Ľ–Ķ –Ņ–Ķ—Ä–Ķ–ļ—Ä–Ķ—Ā—ā–Ĺ–ĺ–≥–ĺ —Ā–≤—Ź–∑—č–≤–į–Ĺ–ł—Ź –≤–Ĺ–Ķ–ļ–Ľ–Ķ—ā–ĺ—á–Ĺ—č—Ö –ī–ĺ–ľ–Ķ–Ĺ–ĺ–≤ CTLD —Ü–ł—ā–ĺ–Ņ–Ľ–į–∑–ľ–į—ā–ł—á–Ķ—Ā–ļ–ł–Ļ —Ö–≤–ĺ—Ā—ā CD69 –≥–Ķ–Ĺ–Ķ—Ä–ł—Ä—É–Ķ—ā –≤–Ĺ—É—ā—Ä–ł–ļ–Ľ–Ķ—ā–ĺ—á–Ĺ—č–Ļ –Ņ—É—ā—Ć –Ņ–Ķ—Ä–Ķ–ī–į—á–ł —Ā–ł–≥–Ĺ–į–Ľ–į. –¶–ł—ā–ĺ–Ņ–Ľ–į–∑–ľ–į—ā–ł—á–Ķ—Ā–ļ–ł–Ļ –ī–ĺ–ľ–Ķ–Ĺ —ć—ā–ĺ–Ļ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—č —Ā–≤—Ź–∑–į–Ĺ —Ā –ļ–ł–Ĺ–į–∑–ĺ–Ļ —Ā–Ķ–ľ–Ķ–Ļ—Ā—ā–≤–į Janus(Jak)3, –ļ–ĺ—ā–ĺ—Ä–į—Ź –į–ļ—ā–ł–≤–ł—Ä—É–Ķ—ā —ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—Ü–ł–ĺ–Ĺ–Ĺ—č–Ļ —Ą–į–ļ—ā–ĺ—Ä STAT. Jak/STAT —Ā–ł–≥–Ĺ–į–Ľ—Ć–Ĺ—č–Ļ –Ņ—É—ā—Ć —ć–≤–ĺ–Ľ—é—Ü–ł–ĺ–Ĺ–Ĺ–ĺ –ļ–ĺ–Ĺ—Ā–Ķ—Ä–≤–į—ā–ł–≤–Ķ–Ĺ –ł —Ä–Ķ–≥—É–Ľ–ł—Ä—É–Ķ—ā —Ü–Ķ–Ĺ—ā—Ä–į–Ľ—Ć–Ĺ—č–Ķ –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ—č–Ķ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā—č, —ā–į–ļ–ł–Ķ –ļ–į–ļ —Ä–į–∑–≤–ł—ā–ł–Ķ –ł —Ä–ĺ—Ā—ā. –ē–≥–ĺ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ –ľ–ĺ–∂–Ķ—ā –Ņ—Ä–ł–≤–Ķ—Ā—ā–ł –ļ —Ä–į–∑–≤–ł—ā–ł—é —Ä–į–ļ–į –ł/–ł–Ľ–ł –ł–ľ–ľ—É–Ĺ–ĺ–ī–Ķ—Ą–ł—Ü–ł—ā–Ĺ—č–ľ —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź–ľ [6].
–ö —Ā–Ķ–ľ–Ķ–Ļ—Ā—ā–≤—É —ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—Ü–ł–ĺ–Ĺ–Ĺ—č—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ –Ņ—Ä–ł–Ĺ–į–ī–Ľ–Ķ–∂–ł—ā GATA-—Ā–≤—Ź–∑—č–≤–į—é—Č–ł–Ļ –Ī–Ķ–Ľ–ĺ–ļ 3 (GATA3), –ļ–ĺ—ā–ĺ—Ä—č–Ļ –ł–≥—Ä–į–Ķ—ā –≤–į–∂–Ĺ—É—é —Ä–ĺ–Ľ—Ć –≤ –ī–ł—Ą—Ą–Ķ—Ä–Ķ–Ĺ—Ü–ł—Ä–ĺ–≤–ļ–Ķ –ł –Ņ—Ä–ĺ–Ľ–ł—Ą–Ķ—Ä–į—ā–ł–≤–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ę-–ļ–Ľ–Ķ—ā–ĺ–ļ, —Ź–≤–Ľ—Ź—Ź—Ā—Ć –ĺ–Ņ—É—Ö–ĺ–Ľ–Ķ–≤—č–ľ —Ā—É–Ņ—Ä–Ķ—Ā—Ā–ĺ—Ä–ĺ–ľ [7].
–ö –≥—Ä—É–Ņ–Ņ–Ķ —ā–ĺ–Ľ–Ľ-–Ņ–ĺ–ī–ĺ–Ī–Ĺ—č—Ö —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–ĺ–≤ –ĺ—ā–Ĺ–ĺ—Ā–ł—ā—Ā—Ź –ľ–Ķ–ľ–Ī—Ä–į–Ĺ–Ĺ—č–Ļ –Ī–Ķ–Ľ–ĺ–ļ TLR4, –ļ–ĺ—ā–ĺ—Ä—č–Ļ —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—Ä—É–Ķ—ā—Ā—Ź –Ĺ–į –ļ–Ľ–Ķ—ā–ļ–į—Ö –ļ–į—Ä—Ü–ł–Ĺ–ĺ–ľ—č —ā–ĺ–Ľ—Ā—ā–ĺ–Ļ –ļ–ł—ą–ļ–ł —á–Ķ–Ľ–ĺ–≤–Ķ–ļ–į. TLR4 –ľ–ĺ–∂–Ķ—ā —Ā–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ĺ–≤–į—ā—Ć –ł–ľ–ľ—É–Ĺ–Ĺ–ĺ–ľ—É ¬ę—É—Ā–ļ–ĺ–Ľ—Ć–∑–į–Ĺ–ł—鬼 –ļ–Ľ–Ķ—ā–ĺ–ļ –ĺ–Ņ—É—Ö–ĺ–Ľ–ł, –ł–Ĺ–ī—É—Ü–ł—Ä—É—Ź –ł–ľ–ľ—É–Ĺ–ĺ—Ā—É–Ņ—Ä–Ķ—Ā—Ā–ł–≤–Ĺ—č–Ķ —Ą–į–ļ—ā–ĺ—Ä—č –ł –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–ł–≤–į—Ź —É—Ā—ā–ĺ–Ļ—á–ł–≤–ĺ—Ā—ā—Ć –ļ –į–Ņ–ĺ–Ņ—ā–ĺ–∑—É [8].
–Ď–Ķ–Ľ–ļ–ĺ–≤—č–Ļ –Ņ—Ä–ĺ–ī—É–ļ—ā —Ā—á–ł—ā—č–≤–į–Ĺ–ł—Ź –Ľ–ĺ–ļ—É—Ā–į CDKN2A ‚ÄĒ p14ARF, –ļ–ĺ—ā–ĺ—Ä—č–Ļ –ĺ–Ī—Ä–į–∑—É–Ķ—ā —Ā—ā–į–Ī–ł–Ľ—Ć–Ĺ—č–Ķ –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā—č —Ā NPM –ł–Ľ–ł Mdm, –ī–Ķ–Ļ—Ā—ā–≤—É–Ķ—ā –ļ–į–ļ —Ā—É–Ņ—Ä–Ķ—Ā—Ā–ĺ—Ä –ĺ–Ņ—É—Ö–ĺ–Ľ–ł, –ł–Ĺ–≥–ł–Ī–ł—Ä—É—Ź –Ī–ł–ĺ–≥–Ķ–Ĺ–Ķ–∑ —Ä–ł–Ī–ĺ—Ā–ĺ–ľ –ł–Ľ–ł –ł–Ĺ–ł—Ü–ł–ł—Ä—É—Ź p53-–∑–į–≤–ł—Ā–ł–ľ—É—é –ĺ—Ā—ā–į–Ĺ–ĺ–≤–ļ—É –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–≥–ĺ —Ü–ł–ļ–Ľ–į –ł –į–Ņ–ĺ–Ņ—ā–ĺ–∑ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ. –í—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ —ć–Ņ–ł–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ–Ķ—Ä–Ķ—Ā—ā—Ä–ĺ–Ķ–ļ —Ą—É–Ĺ–ļ—Ü–ł–ł —Ā—É–Ņ—Ä–Ķ—Ā—Ā–ł–ł –ĺ–Ņ—É—Ö–ĺ–Ľ–Ķ–Ļ –ľ–ĺ–≥—É—ā –Ĺ–į—Ä—É—ą–į—ā—Ć—Ā—Ź, —á—ā–ĺ –ľ–ĺ–∂–Ķ—ā –Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä–ĺ–≤–į—ā—Ć —Ä–į–∑–≤–ł—ā–ł–Ķ –ļ–ĺ–Ľ–ĺ—Ä–Ķ–ļ—ā–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ —Ä–į–ļ–į (–ö–†–†) [9].
–ü–ĺ–ľ–ł–ľ–ĺ –≤—č—ą–Ķ–Ņ–Ķ—Ä–Ķ—á–ł—Ā–Ľ–Ķ–Ĺ–Ĺ—č—Ö –Ņ—Ä–ĺ–ī—É–ļ—ā–ĺ–≤ –≥–Ķ–Ĺ–ĺ–≤-—É—á–į—Ā—ā–Ĺ–ł–ļ–ĺ–≤ –ł–∑–≤–Ķ—Ā—ā–Ĺ—č –ł –ī—Ä—É–≥–ł–Ķ –≥–Ķ–Ĺ—č, —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—Ź –ļ–ĺ—ā–ĺ—Ä—č—Ö –≤–Ľ–Ķ—á–Ķ—ā –∑–į —Ā–ĺ–Ī–ĺ–Ļ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ —Ä–ł—Ā–ļ–į —Ä–į–∑–≤–ł—ā–ł—Ź –ö–†–†.
–° —ā–Ķ—á–Ķ–Ĺ–ł–Ķ–ľ –≤—Ä–Ķ–ľ–Ķ–Ĺ–ł —Ą–ł–∑–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –ł –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź, –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–ī—Ź—Č–ł–Ķ –≤ —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–Ķ —ā–ĺ–Ľ—Ā—ā–ĺ–Ļ –ļ–ł—ą–ļ–ł, –≤–Ľ–ł—Ź—é—ā –Ĺ–į –Ņ—Ä–ĺ–Ľ–ł—Ą–Ķ—Ä–į—Ü–ł—é —ć–Ņ–ł—ā–Ķ–Ľ–ł—Ź, –Ķ–≥–ĺ —Ä–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—Ü–ł—é –ł –ł–Ĺ—ā–Ķ–Ĺ—Ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–ī—Ź—Č–ł—Ö –≤ –Ĺ–Ķ–ľ –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–ĺ–≤, –Ņ—Ä–ł–≤–ĺ–ī—Ź –ļ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–ľ—É –Ņ–ĺ–≤—Ä–Ķ–∂–ī–Ķ–Ĺ–ł—é –ł —Ä–į–∑–≤–ł—ā–ł—é —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö –Ĺ–Ķ–ĺ–Ņ–Ľ–į–∑–ł–Ļ [10, 11]. –ė–∑—É—á–Ķ–Ĺ–ł–Ķ –≤–Ľ–ł—Ź–Ĺ–ł—Ź —ć–Ņ–ł–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ –Ĺ–į —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—é –≥–Ķ–Ĺ–ĺ–≤ –≤ —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–Ķ —ā–ĺ–Ľ—Ā—ā–ĺ–Ļ –ļ–ł—ą–ļ–ł, –į —ā–į–ļ–∂–Ķ –Ņ–ĺ–Ĺ–ł–ľ–į–Ĺ–ł–Ķ –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ–ĺ–≤ –Ķ–Ķ —ā–ļ–į–Ĺ–Ķ–≤–ĺ–≥–ĺ —Ā—ā–į—Ä–Ķ–Ĺ–ł—Ź –ľ–ĺ–≥—É—ā –ł–ľ–Ķ—ā—Ć –Ī–ĺ–Ľ—Ć—ą–ĺ–Ķ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –≤ –ĺ—ā–Ĺ–ĺ—ą–Ķ–Ĺ–ł–ł –Ņ–Ķ—Ä–≤–ł—á–Ĺ–ĺ–Ļ –ł –≤—ā–ĺ—Ä–ł—á–Ĺ–ĺ–Ļ –Ņ—Ä–ĺ—Ą–ł–Ľ–į–ļ—ā–ł–ļ–ł –ö–†–†.
–¶–Ķ–Ľ—Ć –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź: –ĺ—Ü–Ķ–Ĺ–ł—ā—Ć –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ—č–Ķ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –ľ–†–Ě–ö –≤ –ĺ–Ī—Ä–į–∑—Ü–į—Ö –Ĺ–Ķ–ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ļ —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–ł —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö —ć–ľ–Ī—Ä–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ-–į–Ĺ–į—ā–ĺ–ľ–ł—á–Ķ—Ā–ļ–ł—Ö –ĺ—ā–ī–Ķ–Ľ–ĺ–≤ —ā–ĺ–Ľ—Ā—ā–ĺ–Ļ –ļ–ł—ą–ļ–ł.
–ú–į—ā–Ķ—Ä–ł–į–Ľ –ł –ľ–Ķ—ā–ĺ–ī—č
–Ē–Ľ—Ź –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź —Ü–Ķ–Ľ–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ņ—Ä–ĺ–į–Ĺ–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ –Ņ—Ä–ĺ—Ą–ł–Ľ—Ć —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –ľ–†–Ě–ö 63 –≥–Ķ–Ĺ–ĺ–≤-–ļ–į–Ĺ–ī–ł–ī–į—ā–ĺ–≤, –Ņ–ĺ—ā–Ķ–Ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č—Ö —Ā —Ä–į–∑–≤–ł—ā–ł–Ķ–ľ –Ĺ–Ķ–ĺ–Ņ–Ľ–į–∑–ł–Ļ —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–ł –ļ–ł—ą–Ķ—á–Ĺ–ł–ļ–į.
–í –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –≤–ļ–Ľ—é—á–Ķ–Ĺ–ĺ 95 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ĺ—ā 21 –≥–ĺ–ī–į –ī–ĺ 79 –Ľ–Ķ—ā (—Ā—Ä–Ķ–ī–Ĺ–ł–Ļ –≤–ĺ–∑—Ä–į—Ā—ā 55,25¬Ī17,37 –≥–ĺ–ī–į, 43 –ľ—É–∂—á–ł–Ĺ—č).
–ö—Ä–ł—ā–Ķ—Ä–ł–ł –≤–ļ–Ľ—é—á–Ķ–Ĺ–ł—Ź –≤ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ: –≤–ĺ–∑—Ä–į—Ā—ā 21‚Äď79 –Ľ–Ķ—ā, –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł —ā–ĺ–Ľ—Ā—ā–ĺ–Ļ –ļ–ł—ą–ļ–ł –ł –ĺ–Ĺ–ļ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –Ľ—é–Ī–ĺ–Ļ –Ľ–ĺ–ļ–į–Ľ–ł–∑–į—Ü–ł–ł –Ĺ–į –ľ–ĺ–ľ–Ķ–Ĺ—ā –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –ł –≤ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ. –í—Ā–Ķ –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č –Ņ–ĺ–ī–Ņ–ł—Ā–į–Ľ–ł –Ņ–ł—Ā—Ć–ľ–Ķ–Ĺ–Ĺ–ĺ–Ķ —Ā–ĺ–≥–Ľ–į—Ā–ł–Ķ –Ĺ–į —É—á–į—Ā—ā–ł–Ķ –≤ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł.
–ö—Ä–ł—ā–Ķ—Ä–ł–ł –Ĺ–Ķ–≤–ļ–Ľ—é—á–Ķ–Ĺ–ł—Ź –≤ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ: –≤–ĺ–∑—Ä–į—Ā—ā –ľ–Ľ–į–ī—ą–Ķ 21 –≥–ĺ–ī–į –ł —Ā—ā–į—Ä—ą–Ķ 79 –Ľ–Ķ—ā, –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—Ź —ā–ĺ–Ľ—Ā—ā–ĺ–Ļ –ļ–ł—ą–ļ–ł –ł –ĺ–Ĺ–ļ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ľ—é–Ī–ĺ–Ļ –Ľ–ĺ–ļ–į–Ľ–ł–∑–į—Ü–ł–ł –Ĺ–į –ľ–ĺ–ľ–Ķ–Ĺ—ā –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –ł –≤ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ, –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –Ņ–ĺ–ī–Ņ–ł—Ā–į–Ĺ–Ĺ–ĺ–≥–ĺ —Ā–ĺ–≥–Ľ–į—Ā–ł—Ź –Ĺ–į —É—á–į—Ā—ā–ł–Ķ –≤ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł, –ĺ–Ī—Č–ł–Ķ –Ņ—Ä–ĺ—ā–ł–≤–ĺ–Ņ–ĺ–ļ–į–∑–į–Ĺ–ł—Ź –ļ –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł—é –≤–ł–ī–Ķ–ĺ–ļ–ĺ–Ľ–ĺ–Ĺ–ĺ—Ā–ļ–ĺ–Ņ–ł–ł –ł/–ł–Ľ–ł –Ī–ł–ĺ–Ņ—Ā–ł–ł.
–í—Ā–Ķ –ĺ–Ī—Ä–į–∑—Ü—č —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–ł –ļ–ł—ą–Ķ—á–Ĺ–ł–ļ–į –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ—č –Ņ—É—ā–Ķ–ľ —Č–ł–Ņ—Ü–ĺ–≤–ĺ–Ļ –Ī–ł–ĺ–Ņ—Ā–ł–ł –≤ —Ö–ĺ–ī–Ķ –Ņ—Ä–ĺ—Ą–ł–Ľ–į–ļ—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ł/–ł–Ľ–ł –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –≤–ł–ī–Ķ–ĺ–ļ–ĺ–Ľ–ĺ–Ĺ–ĺ—Ā–ļ–ĺ–Ņ–ł–ł. –ě–Ī—Ä–į–∑—Ü—č –ĺ—ā–Ī–ł—Ä–į–Ľ–ł—Ā—Ć –ł–∑ –≤—Ā–Ķ—Ö —ć–ľ–Ī—Ä–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ-–į–Ĺ–į—ā–ĺ–ľ–ł—á–Ķ—Ā–ļ–ł—Ö –ĺ—ā–ī–Ķ–Ľ–ĺ–≤ —ā–ĺ–Ľ—Ā—ā–ĺ–Ļ –ļ–ł—ą–ļ–ł: –Ņ—Ä–į–≤–ĺ–Ļ –ĺ–Ī–ĺ–ī–ĺ—á–Ĺ–ĺ–Ļ (n=91), –Ľ–Ķ–≤–ĺ–Ļ –ĺ–Ī–ĺ–ī–ĺ—á–Ĺ–ĺ–Ļ (n=95) –ł –Ņ—Ä—Ź–ľ–ĺ–Ļ (n=87). –í—Ā–Ķ–≥–ĺ –Ī—č–Ľ–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ĺ 273 –ĺ–Ī—Ä–į–∑—Ü–į. –≠–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—é –ľ–†–Ě–ö –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ľ–ł –ľ–Ķ—ā–ĺ–ī–ĺ–ľ –Ņ–ĺ–Ľ–ł–ľ–Ķ—Ä–į–∑–Ĺ–ĺ–Ļ —Ü–Ķ–Ņ–Ĺ–ĺ–Ļ —Ä–Ķ–į–ļ—Ü–ł–ł —Ā –ĺ–Ī—Ä–į—ā–Ĺ–ĺ–Ļ —ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—Ü–ł–Ķ–Ļ (–ě–Ę-–ü–¶–†).
–ě–Ī—Ä–į–∑—Ü—č –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–≥–ĺ –ľ–į—ā–Ķ—Ä–ł–į–Ľ–į –Ņ–ĺ–ľ–Ķ—Č–į–Ľ–ł –≤ —Ä–į—Ā—ā–≤–ĺ—Ä Ever Fresh RNA (¬ę–ö–Ľ–ĺ–Ĺ–ĺ–≥–Ķ–ŬĽ, –†–ĺ—Ā—Ā–ł—Ź) —Ā—ā–į–Ī–ł–Ľ–ł–∑–ł—Ä—É—é—Č–ł–Ļ –†–Ě–ö. –°—É–ľ–ľ–į—Ä–Ĺ—É—é –†–Ě–ö –≤—č–ī–Ķ–Ľ—Ź–Ľ–ł —Ā –Ņ–ĺ–ľ–ĺ—Č—Ć—é –Ĺ–į–Ī–ĺ—Ä–į RNeasy Mini Kit (QIAGEN, –ď–Ķ—Ä–ľ–į–Ĺ–ł—Ź) —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –Ņ—Ä–ĺ—ā–ĺ–ļ–ĺ–Ľ—É –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī–ł—ā–Ķ–Ľ—Ź. –†–Ě–ö —ć–Ľ—é–ł—Ä–ĺ–≤–į–Ľ–ł –≤ 100 –ľ–ļ–Ľ DEPC-–ĺ–Ī—Ä–į–Ī–ĺ—ā–į–Ĺ–Ĺ–ĺ–Ļ –≤–ĺ–ī—č. –ö–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł—Ź –†–Ě–ö –≤ –ļ–ĺ–Ĺ–Ķ—á–Ĺ–ĺ–ľ —Ä–į—Ā—ā–≤–ĺ—Ä–Ķ —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ľ–į 35‚Äď40 –ľ–ļ–≥/–ľ–Ľ. –ė–∑ –Ņ—Ä–ĺ—ā–ĺ–ļ–ĺ–Ľ–į –Ī—č–Ľ –ł—Ā–ļ–Ľ—é—á–Ķ–Ĺ —ć—ā–į–Ņ –ĺ–Ī—Ä–į–Ī–ĺ—ā–ļ–ł –Ē–Ě–ö–į–∑–ĺ–Ļ I, –Ņ–ĺ—Ā–ļ–ĺ–Ľ—Ć–ļ—É –≤ –ļ–į—á–Ķ—Ā—ā–≤–Ķ –∑–į—ā—Ä–į–≤–ĺ–ļ –ī–Ľ—Ź –Ņ–ĺ—Ā–Ľ–Ķ–ī—É—é—Č–Ķ–Ļ –ĺ–Ī—Ä–į—ā–Ĺ–ĺ–Ļ —ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—Ü–ł–ł (–ě–Ę) –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ–ł –Ņ—Ä–į–Ļ–ľ–Ķ—Ä—č, —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ķ—Ā–ļ–ł–Ķ –ī–Ľ—Ź —Ā–Ņ–Ľ–į–Ļ—Ā–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ļ –ľ–†–Ě–ö –ł—Ā—Ā–Ľ–Ķ–ī—É–Ķ–ľ—č—Ö –≥–Ķ–Ĺ–ĺ–≤, —Ä–į–∑—Ä–į–Ī–ĺ—ā–į–Ĺ–Ĺ—č–Ķ –ļ–ĺ–ľ–Ņ–į–Ĺ–ł–Ķ–Ļ ¬ę–Ě–ü–§ –Ē–Ě–ö-–Ę–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł—Ź¬Ľ (–†–ĺ—Ā—Ā–ł—Ź). –†–Ķ–į–ļ—Ü–ł—é –ě–Ę –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ł, –ł—Ā–Ņ–ĺ–Ľ—Ć–∑—É—Ź –≥–Ķ–Ĺ-—Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ĺ—č–Ķ –Ņ—Ä–į–Ļ–ľ–Ķ—Ä—č, –Ĺ–į–Ī–ĺ—Ä—č —Ä–Ķ–į–≥–Ķ–Ĺ—ā–ĺ–≤, –Ņ—Ä–ĺ—ā–ĺ–ļ–ĺ–Ľ—č –ł –ĺ–Ī–ĺ—Ä—É–ī–ĺ–≤–į–Ĺ–ł–Ķ ¬ę–Ě–ü–§ –Ē–Ě–ö-–Ę–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł—Ź¬Ľ. –†–Ķ–į–ļ—Ü–ł—Ź –Ņ—Ä–ĺ—ā–Ķ–ļ–į–Ľ–į –Ņ—Ä–ł —ā–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–Ķ 40 ¬įC –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 30 –ľ–ł–Ĺ, —Ā –Ņ–ĺ—Ā–Ľ–Ķ–ī—É—é—Č–Ķ–Ļ –ł–Ĺ–į–ļ—ā–ł–≤–į—Ü–ł–Ķ–Ļ –ĺ–Ī—Ä–į—ā–Ĺ–ĺ–Ļ —ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—ā–į–∑—č –Ņ—Ä–ł 95 ¬įC –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 5 –ľ–ł–Ĺ. –Ē–Ľ—Ź –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –≥–Ķ–Ĺ–ĺ–≤ –ľ–Ķ—ā–ĺ–ī–ĺ–ľ –ü–¶–† –≤ —Ä–Ķ–į–Ľ—Ć–Ĺ–ĺ–ľ –≤—Ä–Ķ–ľ–Ķ–Ĺ–ł –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ–ł –Ĺ–į–Ī–ĺ—Ä –ł–∑ 63 –≥–Ķ–Ĺ-—Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ĺ—č—Ö –∑–ĺ–Ĺ–ī–ĺ–≤ –ł –Ņ–į—Ä –Ņ—Ä–į–Ļ–ľ–Ķ—Ä–ĺ–≤, —Ä–į–∑—Ä–į–Ī–ĺ—ā–į–Ĺ–Ĺ—č–Ļ –ļ–ĺ–ľ–Ņ–į–Ĺ–ł–Ķ–Ļ ¬ę–Ě–ü–§ –Ē–Ě–ö-–Ę–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł—Ź¬Ľ. –†–Ķ–į–ļ—Ü–ł–ĺ–Ĺ–Ĺ—É—é —Ā–ľ–Ķ—Ā—Ć –≥–ĺ—ā–ĺ–≤–ł–Ľ–ł —Ā –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł–Ķ–ľ –į–≤—ā–ĺ–ľ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ī–ĺ–∑–ł—Ä—É—é—Č–Ķ–≥–ĺ —É—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤–į D–Ęstream9 (¬ę–Ě–ü–§ –Ē–Ě–ö-–Ę–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł—Ź¬Ľ). –†–Ķ–į–ļ—Ü–ł—é –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ł —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ł–Ĺ—Ā—ā—Ä—É–ļ—Ü–ł–ł –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī–ł—ā–Ķ–Ľ—Ź –≤ 384-–Ľ—É–Ĺ–ĺ—á–Ĺ–ĺ–ľ —Ą–ĺ—Ä–ľ–į—ā–Ķ –≤ –ī–≤—É—Ö –Ņ–ĺ–≤—ā–ĺ—Ä–į—Ö –Ĺ–į –į–ľ–Ņ–Ľ–ł—Ą–ł–ļ–į—ā–ĺ—Ä–Ķ DT-Prime 5 (¬ę–Ě–ü–§ –Ē–Ě–ö-–Ę–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł—Ź¬Ľ). –≠–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—é –ľ–†–Ě–ö –ł–∑–ľ–Ķ—Ä—Ź–Ľ–ł –≤ –ĺ—ā–Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –Ķ–ī–ł–Ĺ–ł—Ü–į—Ö, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ–ľ—č—Ö –ľ–Ķ—ā–ĺ–ī–ĺ–ľ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź –ł–Ĺ–ī–ł–ļ–į—ā–ĺ—Ä–Ĺ—č—Ö —Ü–ł–ļ–Ľ–ĺ–≤ (Cp). –£—Ä–ĺ–≤–Ķ–Ĺ—Ć —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –≥–Ķ–Ĺ–į –Ī–Ķ–∑ —É—á–Ķ—ā–į –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–į –ľ–į—ā–Ķ—Ä–ł–į–Ľ–į, [Ci], –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ľ–ł –ļ–į–ļ [Ci] = 2Cpi - Cpi min, –≥–ī–Ķ –°pi ‚ÄĒ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –ł–Ĺ–ī–ł–ļ–į—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ —Ü–ł–ļ–Ľ–į –≤ –ł—Ā—Ā–Ľ–Ķ–ī—É–Ķ–ľ–ĺ–ľ –ĺ–Ī—Ä–į–∑—Ü–Ķ, –į –°pi min ‚ÄĒ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –ł–Ĺ–ī–ł–ļ–į—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ —Ü–ł–ļ–Ľ–į –≤ –ĺ–Ī—Ä–į–∑—Ü–Ķ —Ā –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ—č–ľ —É—Ä–ĺ–≤–Ĺ–Ķ–ľ —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –ī–į–Ĺ–Ĺ–ĺ–≥–ĺ –≥–Ķ–Ĺ–į, –ł—Ā–Ņ–ĺ–Ľ—Ć–∑—É—Ź –Ņ–į–Ĺ–Ķ–Ľ—Ć –Ĺ–ĺ—Ä–ľ–ł—Ä–ĺ–≤–ĺ—á–Ĺ—č—Ö –≥–Ķ–Ĺ–ĺ–≤. –í —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ –į–Ĺ–į–Ľ–ł–∑–į –≤ –ļ–į–∂–ī–ĺ–ľ –ĺ–Ī—Ä–į–∑—Ü–Ķ –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–≥–ĺ –ľ–į—ā–Ķ—Ä–ł–į–Ľ–į –Ī—č–Ľ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ –ĺ—ā–Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ —É—Ä–ĺ–≤–Ķ–Ĺ—Ć —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –ľ–†–Ě–ö 63 –≥–Ķ–Ĺ–ĺ–≤, –ĺ—ā–Ĺ–ĺ—Ā—Ź—Č–ł—Ö—Ā—Ź –ļ —Ä–į–∑–Ĺ—č–ľ —Ą—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ—č–ľ –ļ–Ľ–į—Ā—ā–Ķ—Ä–į–ľ. –Ď–ĺ–Ľ–Ķ–Ķ –Ņ–ĺ–ī—Ä–ĺ–Ī–Ĺ–ĺ –ľ–Ķ—ā–ĺ–ī–ł–ļ–į –ě–Ę-–†–Ě–ö –Ī—č–Ľ–ĺ –ĺ–Ņ–ł—Ā–į–Ĺ–į –Ĺ–į–ľ–ł —Ä–į–Ĺ–Ķ–Ķ [12].
–°—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–į—Ź –ĺ–Ī—Ä–į–Ī–ĺ—ā–ļ–į —Ā–ĺ–Ī—Ä–į–Ĺ–Ĺ–ĺ–Ļ –Ī–į–∑—č –ī–į–Ĺ–Ĺ—č—Ö –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–į —Ā –Ņ–ĺ–ľ–ĺ—Č—Ć—é –ĺ—ā–ļ—Ä—č—ā–ĺ–≥–ĺ –Ņ—Ä–ĺ–≥—Ä–į–ľ–ľ–Ĺ–ĺ–≥–ĺ —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ–į–ļ–Ķ—ā–į Jamovi (–°–®–ź). –°–ĺ–∑–ī–į–≤–į–Ķ–ľ—č–Ķ –Ľ–ł–Ĺ–Ķ–Ļ–Ĺ—č–Ķ –ł –Ľ–ĺ–≥–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł–Ķ —Ä–Ķ–≥—Ä–Ķ—Ā—Ā–ł–ĺ–Ĺ–Ĺ—č–Ķ –ľ–ĺ–ī–Ķ–Ľ–ł –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ľ–ł—Ā—Ć –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ź–ľ–ł R2 –ł —ā–Ķ—Ā—ā–ĺ–ľ –Ĺ–į –į–≤—ā–ĺ–ļ–ĺ—Ä—Ä–Ķ–Ľ—Ź—Ü–ł—é –Ē—É—Ä–Ī–ł–Ĺ–į ‚ÄĒ –£–ĺ—ā—Ā–ĺ–Ĺ–į (DW). –ö–į—á–Ķ—Ā—ā–≤–ĺ –ľ–ĺ–ī–Ķ–Ľ–ł —Ā—á–ł—ā–į–Ľ–ł –Ņ—Ä–ł–Ķ–ľ–Ľ–Ķ–ľ—č–ľ –Ņ—Ä–ł –∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź—Ö R2>0,3 –ł DW>1,5. –í–ł–∑—É–į–Ľ—Ć–Ĺ–į—Ź –ĺ—Ü–Ķ–Ĺ–ļ–į –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ—č—Ö –ī–į–Ĺ–Ĺ—č—Ö –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–į –≤ –ī–ł–į–≥—Ä–į–ľ–ľ–į—Ö —Ä–į—Ā—Ā–Ķ—Ź–Ĺ–ł—Ź. –°—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ—č–ľ–ł —Ā—á–ł—ā–į–Ľ–ł —Ä–į–∑–Ľ–ł—á–ł—Ź –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –Ņ—Ä–ł –∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź—Ö p<0,001.
–†–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź
–Ě–į –Ņ–Ķ—Ä–≤–ĺ–ľ —ć—ā–į–Ņ–Ķ –Ī—č–Ľ–į —Ā—Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–į –Ľ–ł–Ĺ–Ķ–Ļ–Ĺ–į—Ź —Ä–Ķ–≥—Ä–Ķ—Ā—Ā–ł–ĺ–Ĺ–Ĺ–į—Ź –ľ–ĺ–ī–Ķ–Ľ—Ć –∑–į–≤–ł—Ā–ł–ľ–ĺ—Ā—ā–ł —Ą–į–ļ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į (–Ņ–ĺ–Ľ–Ĺ—č—Ö –Ľ–Ķ—ā) –≤ –ļ–į—á–Ķ—Ā—ā–≤–Ķ –∑–į–≤–ł—Ā–ł–ľ–ĺ–Ļ –Ņ–Ķ—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ –ĺ—ā –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –ľ–†–Ě–ö —Ä—Ź–ī–į –≥–Ķ–Ĺ–ĺ–≤ –≤ –ĺ–Ī—Ä–į–∑—Ü–į—Ö —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–ł —ā–ĺ–Ľ—Ā—ā–ĺ–Ļ –ļ–ł—ą–ļ–ł –ł–∑ —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö —ć–ľ–Ī—Ä–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ-–į–Ĺ–į—ā–ĺ–ľ–ł—á–Ķ—Ā–ļ–ł—Ö –ĺ—ā–ī–Ķ–Ľ–ĺ–≤, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ—č –ļ–į–ļ –ĺ–Ī—ä—Ź—Ā–Ĺ—Ź—é—Č–ł–Ķ –Ņ–Ķ—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č–Ķ. R2 –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ–ĺ–Ļ –ľ–ĺ–ī–Ķ–Ľ–ł 0,43, —ā–Ķ—Ā—ā DW –Ĺ–į –į–≤—ā–ĺ–ļ–ĺ—Ä—Ä–Ķ–Ľ—Ź—Ü–ł—é 1,54, —á—ā–ĺ –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ–ĺ —Ā—á–ł—ā–į—ā—Ć –ľ–ĺ–ī–Ķ–Ľ—Ć —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ–ĺ –Ĺ–į–ī–Ķ–∂–Ĺ–ĺ–Ļ. –ú–ĺ–ī–Ķ–Ľ—Ć —Ā—Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ľ–ł 10 –≥–Ķ–Ĺ–ĺ–≤-—É—á–į—Ā—ā–Ĺ–ł–ļ–ĺ–≤: TERT, IGF1, IFNg, TGFb, CD69, GATA3, IL7, LGALS1, TLR4, P14ARF (P19ARF) (—ā–į–Ī–Ľ. 1).

–Ě–į –≤—ā–ĺ—Ä–ĺ–ľ —ć—ā–į–Ņ–Ķ —Ä–į–Ī–ĺ—ā—č –ľ—č –ł–∑—É—á–ł–Ľ–ł –ĺ—ą–ł–Ī–ļ–ł –ļ–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł–ł –Ľ–ł–Ĺ–Ķ–Ļ–Ĺ–ĺ–Ļ –ľ–ĺ–ī–Ķ–Ľ–ł –∑–į–≤–ł—Ā–ł–ľ–ĺ—Ā—ā–ł —Ą–į–ļ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į –ĺ—ā –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –ľ–†–Ě–ö —Ä—Ź–ī–į –≥–Ķ–Ĺ–ĺ–≤ –≤ —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–Ķ –ł –ł—Ö —Ā–≤—Ź–∑—Ć —Ā —ć–ľ–Ī—Ä–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ-–į–Ĺ–į—ā–ĺ–ľ–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ĺ—ā–ī–Ķ–Ľ–į–ľ–ł —ā–ĺ–Ľ—Ā—ā–ĺ–Ļ –ļ–ł—ą–ļ–ł.
–í—č—Ź–≤–Ľ–Ķ–Ĺ–ĺ, —á—ā–ĺ –ľ–ł–Ĺ–ł–ľ–į–Ľ—Ć–Ĺ–ĺ–Ķ —á–ł—Ā–Ľ–ĺ –ĺ—ą–ł–Ī–ĺ–ļ –≤–ĺ–∑–Ĺ–ł–ļ–į–Ķ—ā –Ņ—Ä–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –ĺ–Ī—Ä–į–∑—Ü–ĺ–≤ –ł–∑ –Ņ—Ä—Ź–ľ–ĺ–Ļ –ļ–ł—ą–ļ–ł, –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ–ĺ–Ķ ‚ÄĒ –ł–∑ –Ņ—Ä–į–≤–ĺ–Ļ –ĺ–Ī–ĺ–ī–ĺ—á–Ĺ–ĺ–Ļ (—Ä–ł—Ā. 1).
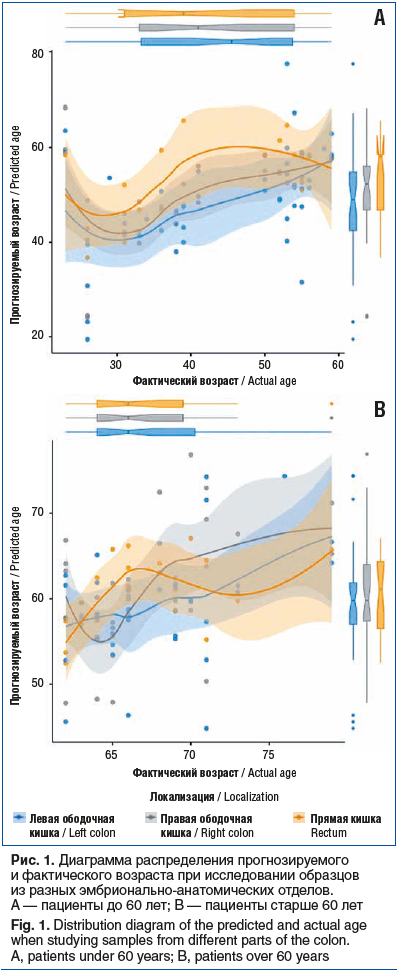
–ě—Ä–ł–Ķ–Ĺ—ā–ł—Ä—É—Ź—Ā—Ć –Ĺ–į —ć–Ņ–ł–ī–Ķ–ľ–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –ī–į–Ĺ–Ĺ—č–Ķ –ĺ –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–ľ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–ł —Ä–ł—Ā–ļ–į —Ä–į–∑–≤–ł—ā–ł—Ź –ö–†–† –Ņ–ĺ—Ā–Ľ–Ķ 60 –Ľ–Ķ—ā, –Ĺ–į —ā—Ä–Ķ—ā—Ć–Ķ–ľ —ć—ā–į–Ņ–Ķ —Ä–į–Ī–ĺ—ā—č –ľ—č —Ä–Ķ—ą–ł–Ľ–ł –≤—č—Ź—Ā–Ĺ–ł—ā—Ć, –ļ–į–ļ —Ä–į–∑–Ľ–ł—á–į—é—ā—Ā—Ź —É—Ä–ĺ–≤–Ĺ–ł —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –ł–∑—É—á–Ķ–Ĺ–Ĺ—č—Ö –≥–Ķ–Ĺ–ĺ–≤ –ī–ĺ –ł –Ņ–ĺ—Ā–Ľ–Ķ –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź —ć—ā–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į –ł –ļ–į–ļ–ł–Ķ –ł–∑ –Ĺ–ł—Ö –ľ–ĺ–≥—É—ā —Ā—Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į—ā—Ć ¬ę–ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ėŗɗ鬼 –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ—É—é —ą–ļ–į–Ľ—É.
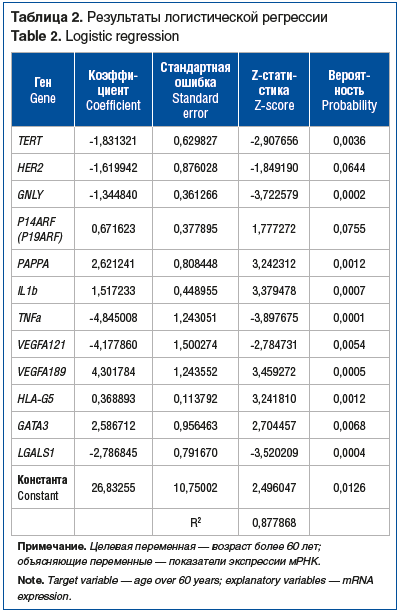
–° —ć—ā–ĺ–Ļ —Ü–Ķ–Ľ—Ć—é –Ī—č–Ľ–į —Ā—Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–į —Ä–Ķ–≥—Ä–Ķ—Ā—Ā–ł–ĺ–Ĺ–Ĺ–į—Ź –ľ–ĺ–ī–Ķ–Ľ—Ć –Ī–ł–Ĺ–į—Ä–Ĺ–ĺ–≥–ĺ –≤—č–Ī–ĺ—Ä–į, –≥–ī–Ķ —Ü–Ķ–Ľ–Ķ–≤–ĺ–Ļ –Ņ–Ķ—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ —Ā–Ľ—É–∂–ł–Ľ –ļ—Ä–ł—ā–ł—á–Ķ—Ā–ļ–ł–Ļ –≤–ĺ–∑—Ä–į—Ā—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–Ĺ—č–Ļ –Ĺ–į–ľ–ł –≤ 60 –Ņ–ĺ–Ľ–Ĺ—č—Ö –Ľ–Ķ—ā. –†–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ–ĺ–Ļ –Ľ–ĺ–≥–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ä–Ķ–≥—Ä–Ķ—Ā—Ā–ł–ł –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ—č –≤ —ā–į–Ī–Ľ–ł—Ü–Ķ 2. –ú–ĺ–ī–Ķ–Ľ—Ć —Ā—Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ľ–ł –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł 12 –≥–Ķ–Ĺ–ĺ–≤-—É—á–į—Ā—ā–Ĺ–ł–ļ–ĺ–≤: TERT, HER2, GNLY, P14ARF (P19ARF), PAPPA, IL1b, TNFa, VEGFA121, VEGFA189, HLA-G5, GATA3, LGALS1. R2 –ī–į–Ĺ–Ĺ–ĺ–Ļ –ľ–ĺ–ī–Ķ–Ľ–ł 0,87, —ā–Ķ—Ā—ā DW –Ĺ–į –į–≤—ā–ĺ–ļ–ĺ—Ä—Ä–Ķ–Ľ—Ź—Ü–ł—é 1,84. –ü–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –ľ–ĺ–ī–Ķ–Ľ–ł –ľ—č —Ā–ĺ—á–Ľ–ł —É–ī–ĺ–≤–Ľ–Ķ—ā–≤–ĺ—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ—č–ľ–ł.
–Ē–Ľ—Ź —Ä–Ķ—ą–Ķ–Ĺ–ł—Ź –∑–į–ī–į—á–ł —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ĺ–į –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ—č–Ķ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ—č –ľ–ĺ–Ľ–ĺ–∂–Ķ –ł —Ā—ā–į—Ä—ą–Ķ 60 –Ľ–Ķ—ā –ł –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –ļ—Ä–ł—ā–ł—á–Ķ—Ā–ļ–ł—Ö –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ļ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ—č—Ö –≥–Ķ–Ĺ–ĺ–≤ –ľ—č –Ņ–ĺ—Ā—ā—Ä–ĺ–ł–Ľ–ł –ī–Ķ—Ä–Ķ–≤–ĺ –Ī–ł–Ĺ–į—Ä–Ĺ–ĺ–Ļ –ļ–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł–ł (—Ä–ł—Ā. 2).
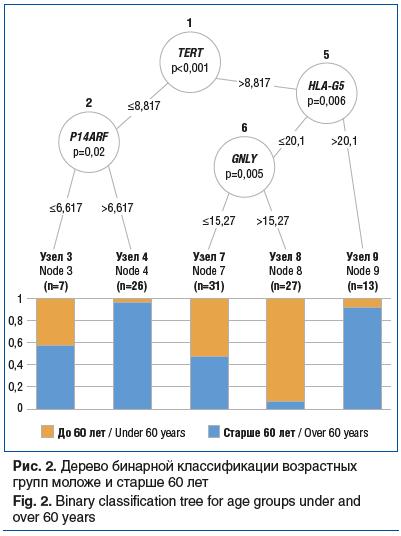
–í—č—Ź–≤–Ľ–Ķ–Ĺ–ĺ, —á—ā–ĺ –Ņ–Ķ—Ä–≤–ł—á–Ĺ—č–Ļ —É–∑–Ķ–Ľ –ļ–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ–ĺ –≤–ĺ–∑—Ä–į—Ā—ā—É —Ā—ā–į—Ä—ą–Ķ –ł–Ľ–ł –ľ–ĺ–Ľ–ĺ–∂–Ķ 60 –Ľ–Ķ—ā –ĺ–Ī—Ä–į–∑—É–Ķ—ā —É—Ä–ĺ–≤–Ķ–Ĺ—Ć —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –≥–Ķ–Ĺ–į TERT. –Ę–Ķ–Ľ–ĺ–ľ–Ķ—Ä–į–∑–Ĺ–į—Ź –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –≤ —Ā–ĺ—á–Ķ—ā–į–Ĺ–ł–ł —Ā –≥–ł–Ņ–Ķ—Ä—ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–Ķ–Ļ –≥–Ķ–Ĺ–į HLA-G5 —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ–į –ī–Ľ—Ź —Ā—ā–į—Ä—ą–Ķ–Ļ –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ—č. –ď–ł–Ņ–ĺ—ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—Ź –∂–Ķ —á–Ķ–Ľ–ĺ–≤–Ķ—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ľ–Ķ–Ļ–ļ–ĺ—Ü–ł—ā–į—Ä–Ĺ–ĺ–≥–ĺ –į–Ĺ—ā–ł–≥–Ķ–Ĺ–į G (HLA-G5) —Ā –ĺ–ī–Ĺ–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ –≥–ł–Ņ–Ķ—Ä—ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–Ķ–Ļ –≥—Ä–į–Ĺ—É–Ľ–ł–∑–ł–Ĺ–į (GNLY) —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ–į –ī–Ľ—Ź –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ—č –ľ–ĺ–Ľ–ĺ–∂–Ķ 60 –Ľ–Ķ—ā. –ú–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ—č–Ļ –ļ–į—Ā–ļ–į–ī, –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ—č–Ļ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ–ľ —ā–Ķ–Ľ–ĺ–ľ–Ķ—Ä–į–∑–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –≥–ł–Ņ–ĺ—ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł TERT —Ā –ĺ–ī–Ĺ–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ –≥–ł–Ņ–Ķ—Ä—ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–Ķ–Ļ —Ä–Ķ–≥—É–Ľ—Ź—ā–ĺ—Ä–į –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–≥–ĺ —Ü–ł–ļ–Ľ–į –ł –≥–Ķ–Ĺ–į-–ĺ–Ĺ–ļ–ĺ—Ā—É–Ņ—Ä–Ķ—Ā—Ā–ĺ—Ä–į P14ARF, —ā–į–ļ–∂–Ķ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ķ–Ĺ –ī–Ľ—Ź –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–ł —ā–ĺ–Ľ—Ā—ā–ĺ–Ļ –ļ–ł—ą–ļ–ł —É –Ľ—é–ī–Ķ–Ļ —Ā—ā–į—Ä—ą–Ķ 60 –Ľ–Ķ—ā.
–ě–Ī—Ā—É–∂–ī–Ķ–Ĺ–ł–Ķ
–í –ľ–ł—Ä–ĺ–≤–ĺ–Ļ –ł –ĺ—ā–Ķ—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ –Ľ–ł—ā–Ķ—Ä–į—ā—É—Ä–Ķ —ā–Ķ–ľ–į –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ—č—Ö –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–Ķ–Ļ —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –≥–Ķ–Ĺ–ĺ–≤ –≤ —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö —ā–ļ–į–Ĺ—Ź—Ö –ł –≤–Ľ–ł—Ź–Ĺ–ł–Ķ —ć—ā–ĺ–≥–ĺ —Ą–į–ļ—ā–ĺ—Ä–į –Ĺ–į –ļ–į–Ĺ—Ü–Ķ—Ä–ĺ–≥–Ķ–Ĺ–Ķ–∑ –ľ–į–Ľ–ĺ –ĺ–Ī—Ā—É–∂–ī–į—é—ā—Ā—Ź. –Ě–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –Ī–ĺ–Ľ–Ķ–Ķ –ī–Ķ—ā–į–Ľ—Ć–Ĺ–ĺ–Ķ –ł–∑—É—á–Ķ–Ĺ–ł–Ķ —ć–Ņ–ł–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ, –≤–Ľ–Ķ–ļ—É—Č–ł—Ö –∑–į —Ā–ĺ–Ī–ĺ–Ļ —Ä–ł—Ā–ļ–ł —Ä–į–∑–≤–ł—ā–ł—Ź –ĺ–Ĺ–ļ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ. –í —Ö–ĺ–ī–Ķ –į–Ĺ–į–Ľ–ł–∑–į —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł 63 –≥–Ķ–Ĺ–ĺ–≤-—É—á–į—Ā—ā–Ĺ–ł–ļ–ĺ–≤ –Ĺ–į–ľ–ł –Ī—č–Ľ–ł –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ—č –≥—Ä—É–Ņ–Ņ—č –≥–Ķ–Ĺ–ĺ–≤, —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—Ź –ļ–ĺ—ā–ĺ—Ä—č—Ö, –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ, –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –∑–Ĺ–į—á–ł–ľ–į –ī–Ľ—Ź —Ä–į–∑–≤–ł—ā–ł—Ź –ö–†–†.
–ú—č –ĺ–Ī—Ä–į—ā–ł–Ľ–ł –≤–Ĺ–ł–ľ–į–Ĺ–ł–Ķ –Ĺ–į —ā–ĺ, —á—ā–ĺ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –≥–Ķ–Ĺ–ĺ–≤ ‚ÄĒ —É—á–į—Ā—ā–Ĺ–ł–ļ–ĺ–≤ –Ĺ–į—ą–ł—Ö –Ņ—Ä–ĺ–≥–Ĺ–ĺ—Ā—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ľ–ĺ–ī–Ķ–Ľ–Ķ–Ļ –ł–ľ–Ķ—é—ā –≤–į–∂–Ĺ–ĺ–Ķ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ņ—Ä–ł –ö–†–†. –Ę–į–ļ, –≤ –Ľ–ł—ā–Ķ—Ä–į—ā—É—Ä–Ķ –ł–ľ–Ķ—é—ā—Ā—Ź —Ā–≤–Ķ–ī–Ķ–Ĺ–ł—Ź, —á—ā–ĺ –≤—č—Ā–ĺ–ļ–ł–Ķ —É—Ä–ĺ–≤–Ĺ–ł –ļ–ĺ—ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł IGF2 –ł TGFő≤ –Ņ—Ä–Ķ–ī—Ā–ļ–į–∑—č–≤–į—é—ā –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –ö–†–† —Ā –Ī–ĺ–Ľ—Ć—ą–Ķ–Ļ —ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć—é, —á–Ķ–ľ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–Ĺ–į—Ź —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—Ź –ĺ—ā–ī–Ķ–Ľ—Ć–Ĺ—č—Ö –≥–Ķ–Ĺ–ĺ–≤. –ď–Ķ–Ĺ IGF2 —ā–į–ļ–∂–Ķ –Ņ—Ä–Ķ–ī–Ľ–į–≥–į–Ķ—ā—Ā—Ź –≤ –ļ–į—á–Ķ—Ā—ā–≤–Ķ –Ņ–ĺ—ā–Ķ–Ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –ľ–ł—ą–Ķ–Ĺ–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź [13]. A.J. Cagnoni et al. [14] –Ņ–ĺ–ļ–į–∑–į–Ľ–ł, —á—ā–ĺ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–Ĺ–į—Ź —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—Ź –≥–į–Ľ–Ķ–Ņ—ā–ł–Ĺ–į (LGALS1) —É–ļ–į–∑—č–≤–į–Ķ—ā –Ĺ–į –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č–Ļ –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑ –Ņ—Ä–ł –ö–†–†.
–ü–ĺ–ľ–ł–ľ–ĺ –≥–Ķ—ā–Ķ—Ä–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ—č—Ö –ł –Ī–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –≤–į—Ä–ł–į–Ĺ—ā–ĺ–≤ –ö–†–† –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ–ĺ, —á—ā–ĺ –ĺ–Ņ—É—Ö–ĺ–Ľ–Ķ–≤—č–Ķ –ļ–Ľ–Ķ—ā–ļ–ł –ľ–ĺ–≥—É—ā —ā–į–ļ–∂–Ķ –ĺ–Ī—Ö–ĺ–ī–ł—ā—Ć —Ä–Ķ–Ņ–Ľ–ł–ļ–į—ā–ł–≤–Ĺ–ĺ–Ķ —Ā—ā–į—Ä–Ķ–Ĺ–ł–Ķ –ł –Ņ—Ä–ł–ĺ–Ī—Ä–Ķ—ā–į—ā—Ć —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā—Ć –Ņ–ĺ–ī–ī–Ķ—Ä–∂–ł–≤–į—ā—Ć –Ĺ–Ķ–ĺ–≥—Ä–į–Ĺ–ł—á–Ķ–Ĺ–Ĺ—É—é –Ņ—Ä–ĺ–Ľ–ł—Ą–Ķ—Ä–į—Ü–ł—é. –Ę–Ķ–Ľ–ĺ–ľ–Ķ—Ä–į–∑–Ĺ–į—Ź –ĺ–Ī—Ä–į—ā–Ĺ–į—Ź —ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—ā–į–∑–į (TERT) ‚ÄĒ –ļ–į—ā–į–Ľ–ł—ā–ł—á–Ķ—Ā–ļ–į—Ź —Ā—É–Ī—ä–Ķ–ī–ł–Ĺ–ł—Ü–į —ā–Ķ–Ľ–ĺ–ľ–Ķ—Ä–į–∑—č. –í–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ —ā–Ķ–Ľ–ĺ–ľ–Ķ—Ä/—ā–Ķ–Ľ–ĺ–ľ–Ķ—Ä–į–∑–į —Ā–Ľ—É–∂–ł—ā –≤–į–∂–Ĺ—č–ľ –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ–ĺ–ľ, —É—á–į—Ā—ā–≤—É—é—Č–ł–ľ –ļ–į–ļ –≤ —Ā—ā–į–Ī–ł–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł –≥–Ķ–Ĺ–ĺ–ľ–į, —ā–į–ļ –ł –≤ –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–ľ —Ä–Ķ–Ņ–Ľ–ł–ļ–į—ā–ł–≤–Ĺ–ĺ–ľ –Ņ–ĺ—ā–Ķ–Ĺ—Ü–ł–į–Ľ–Ķ, –ł –Ķ–≥–ĺ –ī–ł—Ā—Ą—É–Ĺ–ļ—Ü–ł—Ź –ł–≥—Ä–į–Ķ—ā –ļ–Ľ—é—á–Ķ–≤—É—é —Ä–ĺ–Ľ—Ć –≤ –ĺ–Ĺ–ļ–ĺ–≥–Ķ–Ĺ–Ķ–∑–Ķ. –°–ĺ–ļ—Ä–į—Č–Ķ–Ĺ–ł–Ķ —ā–Ķ–Ľ–ĺ–ľ–Ķ—Ä –ł–∑-–∑–į –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–Ļ –Ņ—Ä–ĺ–Ľ–ł—Ą–Ķ—Ä–į—Ü–ł–ł –ľ–ĺ–∂–Ķ—ā –Ī—č—ā—Ć —É—Ā–ļ–ĺ—Ä–Ķ–Ĺ–ĺ —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź–ľ–ł –≤ –≥–Ķ–Ĺ–į—Ö, –≤–ĺ–≤–Ľ–Ķ—á–Ķ–Ĺ–Ĺ—č—Ö –≤ –ļ–į–Ĺ—Ü–Ķ—Ä–ĺ–≥–Ķ–Ĺ–Ķ–∑ –ö–†–†, —ā–į–ļ–ł—Ö –ļ–į–ļ APC –ł MSH2. –ź–ļ—ā–ł–≤–į—Ü–ł—Ź TERT –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –ĺ–Ņ—É—Ö–ĺ–Ľ–Ķ–≤—č–ľ –ļ–Ľ–Ķ—ā–ļ–į–ľ –Ĺ–Ķ–ĺ–≥—Ä–į–Ĺ–ł—á–Ķ–Ĺ–Ĺ–ĺ —Ä–į—Ā—ā–ł –∑–į —Ā—á–Ķ—ā —Ā–ĺ—Ö—Ä–į–Ĺ–Ķ–Ĺ–ł—Ź –ī–Ľ–ł–Ĺ—č —ā–Ķ–Ľ–ĺ–ľ–Ķ—Ä, —á—ā–ĺ —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É–Ķ—ā –ĺ–Ī—Ä–į–∑–ĺ–≤–į–Ĺ–ł—é/–Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł—é –ĺ–Ņ—É—Ö–ĺ–Ľ–ł [15, 16]. –í –Ĺ–į—ą–Ķ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –Ī—č–Ľ–ĺ –Ņ–ĺ–ļ–į–∑–į–Ĺ–ĺ, —á—ā–ĺ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł TERT —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ–ĺ –ī–Ľ—Ź –Ľ–ł—Ü —Ā—ā–į—Ä—ą–Ķ 60 –Ľ–Ķ—ā.
–ď–Ķ–Ĺ TNFa –ļ–ĺ–ī–ł—Ä—É–Ķ—ā –Ņ—Ä–ĺ–≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ —Ü–ł—ā–ĺ–ļ–ł–Ĺ —Ā–Ķ–ľ–Ķ–Ļ—Ā—ā–≤–į —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ –Ĺ–Ķ–ļ—Ä–ĺ–∑–į –ĺ–Ņ—É—Ö–ĺ–Ľ–Ķ–Ļ (TNF). –¶–ł—ā–ĺ–ļ–ł–Ĺ —É—á–į—Ā—ā–≤—É–Ķ—ā –≤ –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ—č—Ö –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į—Ö, –≤–ļ–Ľ—é—á–į—Ź –Ņ—Ä–ĺ–Ľ–ł—Ą–Ķ—Ä–į—Ü–ł—é, –ī–ł—Ą—Ą–Ķ—Ä–Ķ–Ĺ—Ü–ł—Ä–ĺ–≤–ļ—É, –į–Ņ–ĺ–Ņ—ā–ĺ–∑, –į —ā–į–ļ–∂–Ķ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ –Ľ–ł–Ņ–ł–ī–ĺ–≤ –ł –ļ–ĺ–į–≥—É–Ľ—Ź—Ü–ł—é. –ú–ĺ–Ľ–Ķ–ļ—É–Ľ—č –≥–ł—Ā—ā–ĺ—Ā–ĺ–≤–ľ–Ķ—Ā—ā–ł–ľ–ĺ—Ā—ā–ł HLA-G –ļ–Ľ–į—Ā—Ā–į I –Ņ–ĺ–ī–į–≤–Ľ—Ź—é—ā —Ą—É–Ĺ–ļ—Ü–ł–ł –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ-–ļ–ł–Ľ–Ľ–Ķ—Ä–ĺ–≤. –†—Ź–ī–ĺ–ľ –į–≤—ā–ĺ—Ä–ĺ–≤ —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ, —á—ā–ĺ –≥–ł–Ņ–Ķ—Ä—ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—Ź HLA-G –≤ –∑–Ľ–ĺ–ļ–į—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ļ–į—Ö –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –ł–∑–Ī–Ķ–≥–į—ā—Ć –ł–ľ–ľ—É–Ĺ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ—É—é –ī–Ķ—ā–Ķ–ļ—Ü–ł—é [17, 18]. –í –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ–ĺ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ–ĺ, —á—ā–ĺ —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—Ź HLA-G —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ķ—ā—Ā—Ź –≤ —Ā—ā–į—Ä—ą–Ķ–Ļ –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ.
–ě–Ī—Ä–į—Č–į–Ķ—ā –Ĺ–į —Ā–Ķ–Ī—Ź –≤–Ĺ–ł–ľ–į–Ĺ–ł–Ķ –≥–ł–Ņ–Ķ—Ä—ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—Ź GNLY –≤ –≥—Ä—É–Ņ–Ņ–Ķ –∑–ī–ĺ—Ä–ĺ–≤—č—Ö –Ľ—é–ī–Ķ–Ļ –ľ–ĺ–Ľ–ĺ–∂–Ķ 60 –Ľ–Ķ—ā. –ö–ĺ–ī–ł—Ä—É–Ķ–ľ—č–Ļ –ł–ľ –≥—Ä–į–Ĺ—É–Ľ–ł–∑–ł–Ĺ, —á–Ľ–Ķ–Ĺ —Ā–Ķ–ľ–Ķ–Ļ—Ā—ā–≤–į —Ā–į–Ņ–ĺ–∑–ł–Ĺ–ĺ–Ņ–ĺ–ī–ĺ–Ī–Ĺ—č—Ö –Ī–Ķ–Ľ–ļ–ĺ–≤, –Ĺ–į—Ö–ĺ–ī–ł—ā—Ā—Ź –≤ —Ü–ł—ā–ĺ—ā–ĺ–ļ—Ā–ł—á–Ķ—Ā–ļ–ł—Ö –≥—Ä–į–Ĺ—É–Ľ–į—Ö –Ę-–ļ–Ľ–Ķ—ā–ĺ–ļ, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –≤—č—Ā–≤–ĺ–Ī–ĺ–∂–ī–į—é—ā—Ā—Ź –Ņ—Ä–ł —Ā—ā–ł–ľ—É–Ľ—Ź—Ü–ł–ł –į–Ĺ—ā–ł–≥–Ķ–Ĺ–ĺ–ľ. –Ē–į–Ĺ–Ĺ—č–Ļ –Ī–Ķ–Ľ–ĺ–ļ –Ņ—Ä–ł—Ā—É—ā—Ā—ā–≤—É–Ķ—ā –≤ —Ü–ł—ā–ĺ—ā–ĺ–ļ—Ā–ł—á–Ķ—Ā–ļ–ł—Ö –≥—Ä–į–Ĺ—É–Ľ–į—Ö –Ę-–Ľ–ł–ľ—Ą–ĺ—Ü–ł—ā–ĺ–≤ –ł –Ĺ–į—ā—É—Ä–į–Ľ—Ć–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ-–ļ–ł–Ľ–Ľ–Ķ—Ä–ĺ–≤, –ĺ–Ī–Ľ–į–ī–į—Ź –Ņ—Ä–ĺ—ā–ł–≤–ĺ–ľ–ł–ļ—Ä–ĺ–Ī–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć—é, —á—ā–ĺ –ľ–ĺ–∂–Ķ—ā –ĺ–Ī—ä—Ź—Ā–Ĺ–ł—ā—Ć –Ī–ĺ–Ľ–Ķ–Ķ —á–į—Ā—ā—č–Ķ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź –ľ–ł–ļ—Ä–ĺ–Ī–ł–ĺ—ā—č –≤ —Ā—ā–į—Ä—ą–Ķ–Ļ –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ. –£—á–į—Ā—ā–ł–Ķ –≤ —ć—ā–ĺ–ľ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ–ľ –ļ–į—Ā–ļ–į–ī–Ķ –≥–Ķ–Ĺ–į-–ĺ–Ĺ–ļ–ĺ—Ā—É–Ņ—Ä–Ķ—Ā—Ā–ĺ—Ä–į P14ARF –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–ĺ–∂–ł—ā—Ć –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–Ĺ—É—é –ľ–ł—ā–ĺ–≥–Ķ–Ĺ–Ĺ—É—é —Ā—ā–ł–ľ—É–Ľ—Ź—Ü–ł—é –≤ —ć—ā–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ –ł –ł–Ĺ–ł—Ü–ł–į—Ü–ł—é –į–Ņ–ĺ–Ņ—ā–ĺ–∑–į p53-–∑–į–≤–ł—Ā–ł–ľ–ĺ–≥–ĺ –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–≥–ĺ —Ü–ł–ļ–Ľ–į [19].
–ó–Ĺ–į—á–ł–ľ–ĺ—Ā—ā—Ć –≥–Ķ–Ĺ–ĺ–≤, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–Ĺ–į—Ź —Ā –Ņ–ĺ–ľ–ĺ—Č—Ć—é –Ľ–ł–Ĺ–Ķ–Ļ–Ĺ–ĺ–Ļ —Ä–Ķ–≥—Ä–Ķ—Ā—Ā–ł–ĺ–Ĺ–Ĺ–ĺ–Ļ –ľ–ĺ–ī–Ķ–Ľ–ł –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –Ņ–į—Ā–Ņ–ĺ—Ä—ā–Ĺ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į, –ļ–ĺ—ā–ĺ—Ä–į—Ź –≤–ļ–Ľ—é—á–į–Ķ—ā –≤ —Ā–Ķ–Ī—Ź –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –ł—Ö —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł, –ł–ľ–Ķ–Ķ—ā —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ—č–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –Ĺ–į–ī–Ķ–∂–Ĺ–ĺ—Ā—ā–ł: R2 –ľ–ĺ–ī–Ķ–Ľ–ł 0,45, —ā–Ķ—Ā—ā DW 1,54. –ě—ą–ł–Ī–ļ–ł –ĺ—Ü–Ķ–Ĺ–ļ–ł –≤–ĺ–∑—Ä–į—Ā—ā–į –≤ –ľ–ĺ–ī–Ķ–Ľ–ł –≤–ĺ–∑–Ĺ–ł–ļ–į—é—ā –Ņ—Ä–ĺ–Ņ–ĺ—Ä—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ —Ā –Ķ–≥–ĺ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ–ľ, —á—ā–ĺ —Ā–≤—Ź–∑–į–Ĺ–ĺ —Ā –ļ—É–ľ—É–Ľ—Ź—Ü–ł–Ķ–Ļ —ć–Ņ–ł–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ.
–ó–į–ļ–Ľ—é—á–Ķ–Ĺ–ł–Ķ
–Ě–į–ľ–ł —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ, —á—ā–ĺ —Ā —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ–ľ –≤–ĺ–∑—Ä–į—Ā—ā–į –≤ —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–Ķ —ā–ĺ–Ľ—Ā—ā–ĺ–Ļ –ļ–ł—ą–ļ–ł —É –∑–ī–ĺ—Ä–ĺ–≤—č—Ö –Ľ—é–ī–Ķ–Ļ –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–ī—Ź—ā –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź —É—Ä–ĺ–≤–Ĺ–Ķ–Ļ —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł —Ä—Ź–ī–į –≥–Ķ–Ĺ–ĺ–≤. –Ě–Ķ—Ā–ľ–ĺ—ā—Ä—Ź –Ĺ–į —ā–ĺ, —á—ā–ĺ —ć—ā–ĺ –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ķ –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ—č–Ķ (—ć–Ņ–ł–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł–Ķ) –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź, –ĺ–Ĺ–ł –≤ —ā–ĺ –∂–Ķ –≤—Ä–Ķ–ľ—Ź —É–≤–Ķ–Ľ–ł—á–ł–≤–į—é—ā —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –ö–†–†. –Ę–ĺ—á–Ĺ–ĺ—Ā—ā—Ć –į—Ā—Ā–ĺ—Ü–ł–į—Ü–ł–ł —Ą–į–ļ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į –ł —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –≥–Ķ–Ĺ–ĺ–≤ ‚ÄĒ —É—á–į—Ā—ā–Ĺ–ł–ļ–ĺ–≤ –ļ–į–Ĺ—Ü–Ķ—Ä–ĺ–≥–Ķ–Ĺ–Ķ–∑–į –∑–į–≤–ł—Ā–ł—ā –ĺ—ā —ć–ľ–Ī—Ä–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ-–į–Ĺ–į—ā–ĺ–ľ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ĺ—ā–ī–Ķ–Ľ–į, –ł–∑ –ļ–ĺ—ā–ĺ—Ä–ĺ–≥–ĺ –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ –ĺ–Ī—Ä–į–∑–Ķ—Ü.
–ü–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –ľ–†–Ě–ö 12 –≥–Ķ–Ĺ–ĺ–≤ (TERT, HER2, GNLY, P14ARF, PAPPA, IL1b, TNFa, VEGFA121, VEGFA189, HLA-G5, GATA3, LGALS) –≤ –ĺ–Ī—Ä–į–∑—Ü–į—Ö –Ĺ–Ķ–ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ļ —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–ł –Ņ—Ä—Ź–ľ–ĺ–Ļ –ļ–ł—ą–ļ–ł –ł–ľ–Ķ—é—ā —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ķ—Ā–ļ–ł–Ļ –Ņ—Ä–ĺ—Ą–ł–Ľ—Ć, —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ—č–Ļ –ī–Ľ—Ź –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ—č —Ā—ā–į—Ä—ą–Ķ 60 –Ľ–Ķ—ā. –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ —ć—ā–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ą–ł–Ľ—Ź –ľ–ĺ–∂–Ĺ–ĺ —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į—ā—Ć –ļ–į–ļ –ł–Ĺ—Ā—ā—Ä—É–ľ–Ķ–Ĺ—ā –ĺ—Ü–Ķ–Ĺ–ļ–ł —Ä–ł—Ā–ļ–į —Ä–į–∑–≤–ł—ā–ł—Ź –ö–†–†. –ü–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ—č–Ķ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –ļ–ĺ—Ā–≤–Ķ–Ĺ–Ĺ–ĺ –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–į—é—ā –Ņ—Ä–ł—á–ł–Ĺ–Ĺ–ĺ-—Ā–Ľ–Ķ–ī—Ā—ā–≤–Ķ–Ĺ–Ĺ—É—é —Ā–≤—Ź–∑—Ć –ľ–Ķ–∂–ī—É –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź–ľ–ł —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł –≥–Ķ–Ĺ–ĺ–≤ ‚ÄĒ —É—á–į—Ā—ā–Ĺ–ł–ļ–ĺ–≤ –Ľ–ĺ–≥–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ľ–ĺ–ī–Ķ–Ľ–ł, –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ–Ĺ–ĺ–Ļ –Ĺ–į–ľ–ł –≤ —Ā—ā–į—Ä—ą–Ķ–Ļ –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ, –ł —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ–ľ —Ä–ł—Ā–ļ–į —Ä–į–∑–≤–ł—ā–ł—Ź –ö–ö–†, —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č–ľ —Ā –≤–ĺ–∑—Ä–į—Ā—ā–ĺ–ľ.
–°–≤–Ķ–ī–Ķ–Ĺ–ł—Ź –ĺ–Ī –į–≤—ā–ĺ—Ä–į—Ö:
–ď–ĺ–Ĺ—á–į—Ä–ĺ–≤ –°–Ķ—Ä–≥–Ķ–Ļ –í–Ľ–į–ī–ł–ľ–ł—Ä–ĺ–≤–ł—á ‚ÄĒ –ļ.–ľ.–Ĺ., –∑–į–≤–Ķ–ī—É—é—Č–ł–Ļ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ–ľ —Ö–ł—Ä—É—Ä–≥–ł—á–Ķ—Ā–ļ–ł—Ö –ľ–Ķ—ā–ĺ–ī–ĺ–≤ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –ł –Ņ—Ä–ĺ—ā–ł–≤–ĺ–ĺ–Ņ—É—Ö–ĺ–Ľ–Ķ–≤–ĺ–Ļ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ –ĺ–Ĺ–ļ–ĺ–Ľ–ĺ–≥–ł–ł —Ā –ļ–ĺ–Ļ–ļ–į–ľ–ł –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ —Ö–ł—Ä—É—Ä–≥–ł–ł –§–ď–Ď–£ ¬ę–†–Ě–¶–†–†¬Ľ –ú–ł–Ĺ–∑–ī—Ä–į–≤–į –†–ĺ—Ā—Ā–ł–ł; 117997, –†–ĺ—Ā—Ā–ł—Ź, –≥. –ú–ĺ—Ā–ļ–≤–į, —É–Ľ. –ü—Ä–ĺ—Ą—Ā–ĺ—é–∑–Ĺ–į—Ź, –ī. 86; ORCID iD 0000-0001-7914-1882.
–Ď–ĺ–∂–Ķ–Ĺ–ļ–ĺ –í–Ľ–į–ī–ł–ľ–ł—Ä –ö–ĺ–Ĺ—Ā—ā–į–Ĺ—ā–ł–Ĺ–ĺ–≤–ł—á ‚ÄĒ –ī.–ľ.–Ĺ., –Ņ—Ä–ĺ—Ą–Ķ—Ā—Ā–ĺ—Ä, –∑–į–≤–Ķ–ī—É—é—Č–ł–Ļ –ĺ—ā–ī–Ķ–Ľ–ĺ–ľ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ–Ļ –Ī–ł–ĺ–Ľ–ĺ–≥–ł–ł –ł —ć–ļ—Ā–Ņ–Ķ—Ä–ł–ľ–Ķ–Ĺ—ā–į–Ľ—Ć–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –ĺ–Ņ—É—Ö–ĺ–Ľ–Ķ–Ļ –§–ď–Ď–£ ¬ę–†–Ě–¶–†–†¬Ľ –ú–ł–Ĺ–∑–ī—Ä–į–≤–į –†–ĺ—Ā—Ā–ł–ł; 117997, –†–ĺ—Ā—Ā–ł—Ź, –≥. –ú–ĺ—Ā–ļ–≤–į, —É–Ľ. –ü—Ä–ĺ—Ą—Ā–ĺ—é–∑–Ĺ–į—Ź, –ī. 86; ORCID iD 0000-0001-8351-8152.
–ó–į—Ö–į—Ä–Ķ–Ĺ–ļ–ĺ –ú–į—Ä–≥–į—Ä–ł—ā–į –í–Ľ–į–ī–ł–ľ–ł—Ä–ĺ–≤–Ĺ–į ‚ÄĒ –ļ.–Ī.–Ĺ., –ľ–Ľ–į–ī—ą–ł–Ļ –Ĺ–į—É—á–Ĺ—č–Ļ —Ā–ĺ—ā—Ä—É–ī–Ĺ–ł–ļ –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–ł–ł –ł–ľ–ľ—É–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł –ł –ĺ–Ĺ–ļ–ĺ—Ü–ł—ā–ĺ–Ľ–ĺ–≥–ł–ł –§–ď–Ď–£ ¬ę–†–Ě–¶–†–†¬Ľ –ú–ł–Ĺ–∑–ī—Ä–į–≤–į –†–ĺ—Ā—Ā–ł–ł; 117997, –†–ĺ—Ā—Ā–ł—Ź, –≥. –ú–ĺ—Ā–ļ–≤–į, —É–Ľ. –ü—Ä–ĺ—Ą—Ā–ĺ—é–∑–Ĺ–į—Ź, –ī. 86; ORCID iD 0000-0003-2480-4145.
–ß–į–Ņ—ā—č–ļ–ĺ–≤ –ź–Ĺ–ī—Ä–Ķ–Ļ –ź–Ľ–Ķ–ļ—Ā–į–Ĺ–ī—Ä–ĺ–≤–ł—á ‚ÄĒ –≤—Ä–į—á-—Ö–ł—Ä—É—Ä–≥ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź —Ö–ł—Ä—É—Ä–≥–ł—á–Ķ—Ā–ļ–ł—Ö –ľ–Ķ—ā–ĺ–ī–ĺ–≤ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –ł –Ņ—Ä–ĺ—ā–ł–≤–ĺ–ĺ–Ņ—É—Ö–ĺ–Ľ–Ķ–≤–ĺ–Ļ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ –ĺ–Ĺ–ļ–ĺ–Ľ–ĺ–≥–ł–ł —Ā –ļ–ĺ–Ļ–ļ–į–ľ–ł –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ —Ö–ł—Ä—É—Ä–≥–ł–ł –§–ď–Ď–£ ¬ę–†–Ě–¶–†–†¬Ľ –ú–ł–Ĺ–∑–ī—Ä–į–≤–į –†–ĺ—Ā—Ā–ł–ł; 117997, –†–ĺ—Ā—Ā–ł—Ź, –≥. –ú–ĺ—Ā–ļ–≤–į, —É–Ľ. –ü—Ä–ĺ—Ą—Ā–ĺ—é–∑–Ĺ–į—Ź, –ī. 86; ORCID iD 0000-0002-2120-6783.
–ö—É–Ľ–ł–Ĺ–ł—á –Ę–į—ā—Ć—Ź–Ĺ–į –ú–ł—Ö–į–Ļ–Ľ–ĺ–≤–Ĺ–į ‚ÄĒ –ļ.–ľ.–Ĺ., –∑–į–≤–Ķ–ī—É—é—Č–į—Ź –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–ł–Ķ–Ļ –ł–ľ–ľ—É–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł –ł –ĺ–Ĺ–ļ–ĺ—Ü–ł—ā–ĺ–Ľ–ĺ–≥–ł–ł –§–ď–Ď–£ ¬ę–†–Ě–¶–†–†¬Ľ –ú–ł–Ĺ–∑–ī—Ä–į–≤–į –†–ĺ—Ā—Ā–ł–ł; 117997, –†–ĺ—Ā—Ā–ł—Ź, –≥. –ú–ĺ—Ā–ļ–≤–į, —É–Ľ. –ü—Ä–ĺ—Ą—Ā–ĺ—é–∑–Ĺ–į—Ź, –ī. 86; ORCID iD 0000-0003-2331-5753.
–°–ĺ–Ľ–ĺ–ī–ļ–ł–Ļ –í–Ľ–į–ī–ł–ľ–ł—Ä –ź–Ľ–Ķ–ļ—Ā–Ķ–Ķ–≤–ł—á ‚ÄĒ –ī.–ľ.–Ĺ., –Ņ—Ä–ĺ—Ą–Ķ—Ā—Ā–ĺ—Ä, –į–ļ–į–ī–Ķ–ľ–ł–ļ –†–ź–Ě, –ī–ł—Ä–Ķ–ļ—ā–ĺ—Ä –§–ď–Ď–£ ¬ę–†–Ě–¶–†–†¬Ľ –ú–ł–Ĺ–∑–ī—Ä–į–≤–į –†–ĺ—Ā—Ā–ł–ł; 117997, –†–ĺ—Ā—Ā–ł—Ź, –≥. –ú–ĺ—Ā–ļ–≤–į, —É–Ľ. –ü—Ä–ĺ—Ą—Ā–ĺ—é–∑–Ĺ–į—Ź, –ī. 86; ORCID iD 0000-0002-1641-6452.
–ö–ĺ–Ĺ—ā–į–ļ—ā–Ĺ–į—Ź –ł–Ĺ—Ą–ĺ—Ä–ľ–į—Ü–ł—Ź: –ď–ĺ–Ĺ—á–į—Ä–ĺ–≤ –°–Ķ—Ä–≥–Ķ–Ļ –í–Ľ–į–ī–ł–ľ–ł—Ä–ĺ–≤–ł—á, e-mail: 9015@mail.ru.
–ü—Ä–ĺ–∑—Ä–į—á–Ĺ–ĺ—Ā—ā—Ć —Ą–ł–Ĺ–į–Ĺ—Ā–ĺ–≤–ĺ–Ļ –ī–Ķ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł: –Ĺ–ł–ļ—ā–ĺ –ł–∑ –į–≤—ā–ĺ—Ä–ĺ–≤ –Ĺ–Ķ –ł–ľ–Ķ–Ķ—ā —Ą–ł–Ĺ–į–Ĺ—Ā–ĺ–≤–ĺ–Ļ –∑–į–ł–Ĺ—ā–Ķ—Ä–Ķ—Ā–ĺ–≤–į–Ĺ–Ĺ–ĺ—Ā—ā–ł –≤ –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ—č—Ö –ľ–į—ā–Ķ—Ä–ł–į–Ľ–į—Ö –ł–Ľ–ł –ľ–Ķ—ā–ĺ–ī–į—Ö.
–ö–ĺ–Ĺ—Ą–Ľ–ł–ļ—ā –ł–Ĺ—ā–Ķ—Ä–Ķ—Ā–ĺ–≤ –ĺ—ā—Ā—É—ā—Ā—ā–≤—É–Ķ—ā.
–°—ā–į—ā—Ć—Ź –Ņ–ĺ—Ā—ā—É–Ņ–ł–Ľ–į 05.07.2023.
–ü–ĺ—Ā—ā—É–Ņ–ł–Ľ–į –Ņ–ĺ—Ā–Ľ–Ķ —Ä–Ķ—Ü–Ķ–Ĺ–∑–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź 28.07.2023.
–ü—Ä–ł–Ĺ—Ź—ā–į –≤ –Ņ–Ķ—á–į—ā—Ć 22.08.2023.
About the authors:
Sergey V. Goncharov ‚ÄĒ C. Sc. (Med.), Head of the Department of Surgical Treatment and Anticancer Drug Therapy for Abdominal Oncology with Abdominal Surgery Beds, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-7914-1882.
Vladimir K. Bozhenko ‚ÄĒ Dr. Sc. (Med.), Professor, Head of the Division of Tumor Molecular Biology and Experimental Therapy, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-8351-8152.
Margarita V. Zakharenko ‚ÄĒ C. Sc. (Biol.), junior researcher of the Laboratory of Immunology and Oncocytology, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-2480-4145.
Andrey A. Chaptykov ‚ÄĒ surgeon of the Department of Surgical Treatment and Anticancer Drug Therapy for Abdominal Oncology with Abdominal Surgery Beds, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-2120-6783.
Tat'yana M. Kulinich ‚ÄĒ C. Sc. (Med.), Head of the Laboratory of Immunology and Oncocytology, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-2331-5753.
Vladimir A. Solodkiy ‚ÄĒ Academician of the RAS, Professor, Director of the Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-1641-6452. Contact information: Sergey V. Goncharov, e-mail: 9015@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 05.07.2023.
Revised 28.07.2023.
Accepted 22.08.2023.












