Введение
Аксиальные спондилоартриты (аксСпА) — это хронические иммуноопосредованные воспалительные заболевания, при которых генетические изменения приводят к изменению функционирования иммунной системы с активацией Т-клеток, вызывающей секрецию провоспалительных цитокинов, включая фактор некроза опухоли α (ФНО-α), интерлейкины ИЛ-17, ИЛ-22 и интерферон γ (ИНФγ) [1].
ИЛ-17 играет особо важную роль в развитии и прогрессии заболевания. Центральная роль ИЛ-17 в патогенезе аксСпА привела к появлению новых генно-инженерных биологических препаратов [2]. В России зарегистрировано три препарата, влияющих на различные фракции и рецепторы ИЛ-17: секукинумаб (Козэнтикс®), нетакимаб (Эфлейра®) и иксекизумаб (ТАЛС®) [3]. Вместе с тем неизвестно, насколько блокада ИЛ-17 влияет на сердечно-сосудистый риск (ССР) у пациентов с аксСпА, для которых показано увеличение сердечно-сосудистой заболеваемости и смертности. Изучение этого вопроса представляется особенно актуальным в связи с наличием данных об отсутствии снижения ССР при применении ингибиторов ФНО-α и ранее повышенной концентрации ИЛ-17 на фоне лечения ингибиторами ФНО-α [4].
Цель исследования — изучить взаимосвязи ССР, оцененных посредством расчета шкал кардиоваскулярного риска, таких как индекс систематической оценки коронарного риска (Systematic COronary Risk Evaluation — SCORE), модифицированный алгоритм оценки ССР (QRESEARCH Cardiovascular Risk Algorithm — QRISK3) и шкала оценки ССР Рейнольдса (Reynolds Risk Score — RRS), у пациентов с аксСпА и полиморфизмами генов, ответственных за синтез ИЛ-17.
Материал и методы
В исследование были включены 48 пациентов с достоверным диагнозом аксСпА, соответствующего критериям Международного общества по изучению спондилоартритов (the Assessment Spondyloarthritis International Society — ASAS) (2009) [5], не менее 1 года получающих ингибиторы ФНО-α: голимумаб, адалимумаб и этанерцепт.
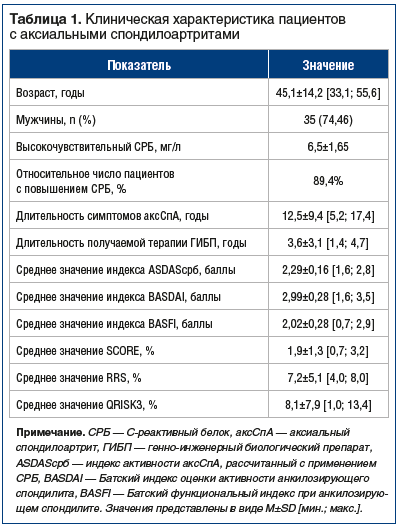
Степень активности аксСпА для всех обследованных оценивали при помощи расчета индексов активности ASDASсрб (Ankylosing Spondylitis Disease Activity Score — индекс активности анкилозирующего спондилита, рассчитанный с применением концентрации С-реактивного белка) и BASDAI (Bath Ankylosing Spondylitis Disease Activity Index — Батский индекс оценки активности анкилозирующего спондилита) [6, 7]. У всех пациентов был определен уровень высокочувствительного С-реактивного белка (СРБ) (уровень считался нормальным, если не превышал 1,0 мг/л).
У всех пациентов было проведено генетическое типирование по аллелям ИЛ17A-197, ИЛ17F7 His/Arg, ИЛ17F-11139 CG с последующим выявлением их взаимосвязей с острофазовыми показателями и ССР, который оценили с применением шкал SCORE, RRS и QRISK3.
Этические аспекты. Пациенты, включенные в исследование, подписывали форму информированного согласия на участие в нем. Все данные анализировали после присвоения пациенту рандомизационного номера, не позволяющего идентифицировать пациента как личность. Исследование одобрено локальным этическим комитетом ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России.
Статистическая обработка данных проводилась при помощи пакета прикладных статистических программ R версии 3.4.1 (R Core Team (2017). R: A language and environment for statistical computing. R Founation for statistical Computing, Вена, Австрия) с графическим интерфейсом пользователя jamovi и пакетов jmv (Ravi Selker, Jonathon Love and Damian Dropmann (2018). Jmv: The ‘jamovi’ Analyses. Версия 0.9.5.0).
Применяли традиционные методы описательной статистики с указанием средних значений признака и стандартного отклонения, минимальных и максимальных его значений M±SD [мин.; макс.]. Для сравнения качественных переменных использовали точный тест Фишера. Для количественных использовался t-тест или тест Уилкоксона — Манна — Уитни, в зависимости от нормальности распределения (проверка проводилась при помощи теста Шапиро — Уилка). Для выявления корреляции между полученными результатами использовался многофакторный анализ с ротацией ‘varimax’ с расчетом коэффициента мощности (R).
Результаты исследования
Характеристика пациентов, включенных в исследование, включая средние значения шкал оценки ССР, представлена в таблице 1. Результаты генетического типирования пациентов представлены в таблице 2.
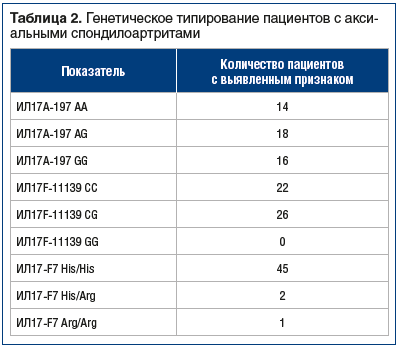
При проведении факторного анализа были выявлены корреляционные взаимосвязи между рисками возникновения значимых сердечно-сосудистых событий, уровнем СРБ и носительством различных аллелей ИЛ-17A и ИЛ-17F. Наибольшая мощность и прямая взаимосвязь c повышением риска возникновений фатальных кардиоваскулярных заболеваний достигались у лиц, гомозиготных по аллели АА ИЛ-17А и гетерозиготных по CG ИЛ-17F. Обратная взаимосвязь была выявлена при наличии гомозиготных по аллелям GG ИЛ-17А и CС ИЛ-17F.
В ходе работы получены данные о наличии прямой взаимосвязи между увеличением ССР и уровнем СРБ (табл. 3).

Обсуждение
Данные клинических исследований in vitro демонстрируют, что ИЛ-17A является критическим эффекторным цитокином, отвечающим за изменения в пораженных при аксСпА тканях [8]. Помимо ИЛ-17A семейство ИЛ-17 включает в себя еще четыре фракции: ИЛ-17B, ИЛ-17С, ИЛ-17D, ИЛ-17F [9]. Известно, что ИЛ-17A, ИЛ-17C и ИЛ-17F участвуют в патогенезе псориаза и псориатического артрита — их экспрессия увеличивается до восьмикратной при псориатических поражениях [10]. Хотя в псориатических очагах присутствует больше ИЛ-17C и ИЛ-17F, ИЛ-17A является наиболее биологически активным (в 30 раз активнее, чем ИЛ-17F) [8]. При аксСпА ключевую роль играют ИЛ-17A и ИЛ-17F. Вместе с тем лечение, направленное на блокаду ИЛ-17A, изменяет экспрессию генов других цитокинов и хемокинов, задействованных в патогенезе аксСпА, и эффективно снижает воспаление в суставах и позвоночнике [11].
В течение нескольких лет предполагалось, что основным источником ИЛ-17A при СпА были клетки T-хелперы-17 (Th17), которые продуцируют широкий спектр цитокинов, включая ИЛ-17F, ИЛ-21, ИЛ-22, ИЛ-26 и ФНО-α [11]. Вместе с тем накапливается все больше данных о дополнительных клеточных источниках ИЛ-17A, которыми могут быть тучные клетки, γδ T-клетки, αβ T-клетки и врожденные лимфоидные клетки и нейтрофилы [12–14]. У пациентов с аксСпА высокие уровни ИЛ-17A и рецептора к ИЛ-17А присутствуют в синовиальных мембранах, энтезисах, внутрисуставной жидкости, которые впоследствии способствуют воспалению и ремоделированию воспаленной ткани [15].
Следует отметить, что исследования патогенеза хронических воспалительных заболеваний, включавших ревматоидный артрит, псориатический артрит, аксСпА, воспалительные заболевания кишечника, привели к выделению ФНО-α как ключевого цитокина, участвующего в патогенезе данной группы заболеваний [16]. Ингибирование ФНО-α при СпА может не ассоциироваться с торможением ремоделирования тканей и снижением ССР из-за наличия адаптивного влияния оси ИЛ-17A на указанные процессы [16]. Препараты группы ингибиторов ИЛ-17 показывают достаточный уровень эффективности у пациентов с недостаточным эффектом или неэффективностью ингибиторов ФНО-α. Результаты исследований свидетельствуют о том, что ИЛ-17A и ФНО-α действуют через различные механизмы регуляции экспрессии нижестоящих генов, причем ось ИЛ-17A лежит в основе аксСпА, а ФНО-α стимулирует воспаление за счет синергизма с ИЛ-17A [16]. Эта гипотеза подтверждается данными о том, что только ингибирование ИЛ-17A является высокоэффективным при лечении СпА в отсутствие ингибирования ФНО-α [17].
ИЛ-17-опосредованная эндотелиальная дисфункция может способствовать развитию сопутствующих сердечно-сосудистых заболеваний при СпА [18], приводя к развитию сосудистого воспаления, усугублению течения эндотелиальной дисфункции, тромбозов и артериальной гипертензии — состояний, которые, согласно исследованию ASAS-COMOSPA (n=3923), встречаются при аксСпА много чаще, чем в популяции [19]. Повышение концентрации сывороточного ИЛ-17 наблюдается у пациентов с сердечно-сосудистой патологией (острый инфаркт миокарда и др.). Показано, что моноклональные антитела, нейтрализующие ИЛ-17, могут улучшать исходы у пациентов с псориатическим артритом и сопутствующими сердечно-сосудистыми заболеваниями [20]. Эта гипотеза дополнительно подтверждается моделью атеросклероза, воспроизведенной на животных, в которой ингибирование ИЛ-17A приводило к предотвращению прогрессирования сердечно-сосудистого поражения и стабилизации атеросклеротических бляшек [21]. В другой модели при подавлении сверхэкспрессии генов, ответственных за синтез ИЛ-17A, было достигнуто улучшение состояния сосудистой стенки [22]. Анти-ИЛ-17A моноклональные антитела предотвращали сосудистые заболевания на мышиной модели псориаза [23]. Регистр пациентов с острым инфарктом миокарда продемонстрировал, что при уровне сывороточного ИЛ-17A выше 6,26 пг/мл увеличивался риск смерти и вероятность повторного инфаркта миокарда [24].
При обследовании пациентов со СпА выявлено, что значение уровня сердечно-сосудистой смертности превышает популяционное. Особенности течения сердечно-сосудистых заболеваний у пациентов с аксСпА могут быть обусловлены не только воспалительной активностью [25], но и вкладом ИЛ-17 в атеросклеротический процесс. Появляется все больше исследований, посвященных независимой роли ИЛ-17 в патогенезе сердечно-сосудистой патологии у пациентов с ревматическими заболеваниями. Подтверждением вовлеченности ИЛ-17 в развитие сердечно-сосудистых заболеваний служат экспериментальные модели атеросклероза, в которых ингибирование ИЛ-17 приводило к предотвращению возникновения и прогрессирования сердечно-сосудистого поражения [21]. Многочисленные исследования с применением секукинумаба показали возможность стабилизации течения сердечно-сосудистых заболеваний на фоне лечения, в т. ч. возможность влияния на факторы риска их развития (снижение массы тела, гиперурикемия, инсулинорезистентность) [20].
Нами установлены достоверные взаимосвязи между носительством отдельных аллелей генов ИЛ-17 и ССР, в т. ч. не зависимые от острофазового ответа. Предположение о взаимосвязи повышения рисков развития значимых сердечно-сосудистых событий и генетически детерминированного повышения уровня ИЛ-17, обусловленных наличием различных аллелей ИЛ-17А и ИЛ-17F, может частично объяснять тот факт, что на фоне лечения ингибиторами ФНО-α не уменьшается риск фатальных сердечно-сосудистых событий. На основании полученных нами результатов можно предположить, что, несмотря на снижение концентрации ФНО-α, генетически детерминированная экспрессия ИЛ-17 может оставаться высокой у лиц с аксСпА, определяя как невозможность достижения безлекарственной ремиссии, так и сохраняющийся высоким ССР.
Заключение
Увеличение рисков возникновения сердечно-сосудистой патологии у пациентов с аксСпА прямо взаимосвязано с гомозиготным носительством аллеля АА ИЛ-17А и гетерозиготным носительством аллеля CG ИЛ-17F и обратно взаимосвязано с гомозиготным носительством аллелей
GG ИЛ-17А и CС ИЛ-17F.
Таким образом, повышение ССР при аксСпА может быть взаимосвязано с генетически детерминированными изменениями секреции разных субтипов ИЛ-17, что в перспективе определит обоснованность применения блокады ИЛ-17 у лиц с аксСпА, имеющих высокий риск сердечно-сосудистых событий.












