–Э–µ–Њ–±—А–∞—В–Є–Љ–Њ—Б—В—М —В–µ—З–µ–љ–Є—П —Б–Є–ї–Є–Ї–Њ–Ј–∞ –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П –і–µ–ї–∞—О—В –Њ—Б–Њ–±–µ–љ–љ–Њ –∞–Ї—В—Г–∞–ї—М–љ–Њ–є –Ј–∞–і–∞—З—Г –њ–Њ–Є—Б–Ї–∞ –љ–Њ–≤—Л—Е –Љ–µ—В–Њ–і–Њ–≤ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є [1вАУ3].
–Э–∞—И–µ –≤–љ–Є–Љ–∞–љ–Є–µ –Ї –Њ—Ж–µ–љ–Ї–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –≥–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–Є–ї–Є–Ї–Њ–Ј–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –Њ–±—Й–µ–Є–Ј–≤–µ—Б—В–љ—Л–Љ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ–Љ, —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї–Њ—В–Њ—А–Њ–Љ—Г –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б–Є–љ–і—А–Њ–Љ—Л –Є —Б–Є–Љ–њ—В–Њ–Љ—Л, –љ–∞–±–ї—О–і–∞–µ–Љ—Л–µ –≤ –Ї–ї–Є–љ–Є–Ї–µ –њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є, —Б–ї—Г–ґ–∞—В –њ–Њ–≤–Њ–і–Њ–Љ –і–ї—П —А–∞–Ј—А–∞–±–Њ—В–Ї–Є –≥–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤.
–Т–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ —Б–Є–ї–Є–Ї–Њ–Ј–∞, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В –њ—А–∞–≤–Њ–Љ–µ—А–љ–Њ—Б—В—М –≥–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—Б—В—Г–ї–∞—В–∞, —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї–Њ—В–Њ—А–Њ–Љ—Г –Є–љ–µ—А—В–љ–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ –њ—А–Є —А–∞—Б—В–Є—А–∞–љ–Є–Є, –Є–Ј–Љ–µ–ї—М—З–µ–љ–Є–Є –Љ–Њ–ґ–µ—В —Б—В–∞—В—М –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–Љ, —Б –і—А—Г–≥–Њ–є вАУ —В–µ—Е–љ–Њ–ї–Њ–≥–Є—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –≥–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—Г—В–µ–Љ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ–≥–Њ –Є—Е –њ–Њ—В–µ–љ—Ж–Є—А–Њ–≤–∞–љ–Є—П –Є–ї–Є –і–Є–љ–∞–Љ–Є–Ј–∞—Ж–Є–Є –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –Љ–µ—А–µ –Є–Љ–µ–µ—В —Б—Е–Њ–і—Б—В–≤–Њ —Б –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Ї–≤–∞—А—Ж–µ–≤–Њ–є –њ—Л–ї–Є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ. –С–µ–Ј –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ–є —Б–Љ–µ–љ—Л –њ—А–Њ—Ж–µ—Б—Б–∞ —Д–∞–≥–Њ—Ж–Є—В–Њ–Ј–∞, –≥–Є–±–µ–ї–Є –Є —А–∞—Б–њ–∞–і–∞ –Ї–Њ–љ–Є–Њ—Д–∞–≥–Њ–≤ –њ—Л–ї—М, –і–∞–ґ–µ –Ї–≤–∞—А—Ж–µ–≤–∞—П, –љ–µ –Њ–±–ї–∞–і–∞–µ—В –њ—А—П–Љ—Л–Љ —Д–Є–±—А–Њ–≥–µ–љ–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ [4].
–Ґ–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–і–њ–Њ—Б—Л–ї–Ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ы–Є–Љ—Д–Њ–Љ–Є–Њ–Ј–Њ—В, –Ь—Г–Ї–Њ–Ј–∞ –Ї–Њ–Љ–њ–Њ–Ј–Є—В—Г–Љ –Є –Ґ—А–∞—Г–Љ–µ–ї—М –° –і–ї—П –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–Є–ї–Є–Ї–Њ–Ј–∞
–Ю—З–Є—Й–µ–љ–Є–µ –ї–µ–≥–Ї–Є—Е –Њ—В –њ—Л–ї–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –±—А–Њ–љ—Е–Њ–≥–µ–љ–љ—Л–Љ –њ—Г—В–µ–Љ, –Љ–µ–љ—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ—Л–ї–µ–≤—Л—Е —З–∞—Б—В–Є—Ж –≤—Л–≤–Њ–і–Є—В—Б—П —З–µ—А–µ–Ј –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ –њ—Г—В–Є –≤ —В—А–∞—Е–µ–Њ–±—А–Њ–љ—Е–Є–∞–ї—М–љ—Л–µ —Г–Ј–ї—Л [1].
–Ю–і–љ–∞–Ї–Њ —З—А–µ–Ј–Љ–µ—А–љ–∞—П –њ—Л–ї–µ–≤–∞—П –љ–∞–≥—А—Г–Ј–Ї–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї –∞–Ї—В–Є–≤–∞—Ж–Є–Є –ї–Є–Љ—Д–Њ–≥–µ–љ–љ–Њ–≥–Њ –њ—Г—В–Є –≤—Л–≤–µ–і–µ–љ–Є—П –њ—Л–ї–Є, –њ–µ—А–µ–≥—А—Г–Ј–Ї–∞ –ї–Є–Љ—Д–Њ–≥–µ–љ–љ–Њ–≥–Њ –њ—Г—В–Є вАУ –Ї –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є –Ї–Њ–љ–Є–Њ—Д–∞–≥–∞–Љ–Є (–Љ–∞–Ї—А–Њ—Д–∞–≥–∞–Љ–Є, –њ–Њ–≥–ї–Њ—В–Є–≤—И–Є–Љ–Є –њ—Л–ї—М) –Ј–Њ–љ—Л –Ї–Њ—А–љ–µ–є –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—Г–і–Њ–≤, –Ј–∞—В–µ–Љ –Є –±–Њ–ї–µ–µ –Ї—А—Г–њ–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤. –†–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Ї–Њ–љ–Є–Њ—В–Є—З–µ—Б–Ї–Є–є –ї–Є–Љ—Д–∞–љ–≥–Є—В, –Ї–Њ—В–Њ—А—Л–є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –Ї–Њ–љ–Є–Њ—В–Є—З–µ—Б–Ї–Є—Е –≥—А–∞–љ—Г–ї–µ–Љ [4, 5].
–Т–љ–µ–і—А–µ–љ–Є–µ –Є —И–Є—А–Њ–Ї–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –±—А–Њ–љ—Е–Њ—Д–Є–±—А–Њ—Б–Ї–Њ–њ–Є–Є —Б –±–Є–Њ–њ—Б–Є–µ–є –Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є–Ј—Г—З–µ–љ–Є–µ–Љ –±–Є–Њ–њ—В–∞—В–Њ–≤, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—А–Њ–љ—Е–Њ–∞–ї—М–≤–µ–Њ–ї—П—А–љ–Њ–≥–Њ —Б–µ–Ї—А–µ—В–∞, –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ, —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ, —Ж–Є—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –Є –і—А—Г–≥–Є–µ –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –њ–Њ–ї—Г—З–Є—В—М –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ —Б—Г—Й–љ–Њ—Б—В–Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ –Њ—А–≥–∞–љ–∞—Е –і—Л—Е–∞–љ–Є—П, –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞—Е —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Є —В–µ—З–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є—Е –Њ—В –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ—Л—Е –∞—Н—А–Њ–Ј–Њ–ї–µ–є —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ [5вАУ7].
–Я–Њ–і –њ–љ–µ–≤–Љ–Њ–Ї–Њ–љ–Є–Њ–Ј–Њ–Љ —Б–ї–µ–і—Г–µ—В –њ–Њ–љ–Є–Љ–∞—В—М –њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –ї–µ–≥–Ї–Є—Е –Њ—В –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ–Њ–є –њ—Л–ї–Є, –њ—А–Њ—П–≤–ї—П—О—Й–Є–µ—Б—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –і–Є—Д—Д—Г–Ј–љ—Л–Љ –њ–љ–µ–≤–Љ–Њ–љ–Є—В–Њ–Љ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Д–Є–±—А–Њ–Ј–∞ –ї–µ–≥–Ї–Є—Е.
–Я–љ–µ–≤–Љ–Њ–Ї–Њ–љ–Є–Њ–Ј, –Ї–∞–Ї –і–Є—Д—Д—Г–Ј–љ—Л–є –њ–љ–µ–≤–Љ–Њ–љ–Є—В, –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –њ—А–Њ—П–≤–ї—П–µ—В —Б–µ–±—П –≤ 2-—Е –≥–ї–∞–≤–љ—Л—Е —Д–Њ—А–Љ–∞—Е: –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ–є –Є –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ-–≥—А–∞–љ—Г–ї–µ–Љ–∞—В–Њ–Ј–љ–Њ–є. –Я—А–Є –Њ–±–µ–Є—Е —Д–Њ—А–Љ–∞—Е —В–Ї–∞–љ–µ–≤—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –≤ –ї–µ–≥–Ї–Є—Е —Б–Ї–ї–∞–і—Л–≤–∞—О—В—Б—П –і–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ –Љ–Њ–Љ–µ–љ—В–∞ –Є–Ј –Њ–і–љ–Њ—В–Є–њ–љ—Л—Е –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, —Е–Њ—В—П –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є —Б—В–µ–њ–µ–љ—М –Є—Е –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Љ–Њ–≥—Г—В –≤–∞—А—М–Є—А–Њ–≤–∞—В—М –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Е–∞—А–∞–Ї—В–µ—А–∞ –Є –≤–Є–і–∞ –њ—Л–ї–Є.
–Ф–ї–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ –њ—Л–ї–Є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –≤–Њ–≤–ї–µ—З–µ–љ–Є—О –≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –≤—Б–µ –љ–Њ–≤—Л—Е –Є –љ–Њ–≤—Л—Е —Г—З–∞—Б—В–Ї–Њ–≤ –ї–µ–≥–Ї–Є—Е, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ —Г –Њ–і–љ–Њ–≥–Њ –Є —В–Њ–≥–Њ –ґ–µ –±–Њ–ї—М–љ–Њ–≥–Њ –Ї–Њ–љ–Є–Њ—В–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –љ–∞—Е–Њ–і–Є—В—Б—П –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–µ–≥–Љ–µ–љ—В–∞—Е –ї–µ–≥–Ї–Њ–≥–Њ –љ–∞ —А–∞–Ј–љ—Л—Е —Б—В–∞–і–Є—П—Е –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П.
–Я–∞—В–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –≤ —А–∞–Ј–≤–Є—В–Є–Є –ї—О–±–Њ–є —Д–Њ—А–Љ—Л –Є –≤–Є–і–∞ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–љ–Є–Њ–Ј–∞ –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ –≤—Л–і–µ–ї–Є—В—М 2 –њ–µ—А–Є–Њ–і–∞: 1-–є вАУ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ-–і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є; 2-–є вАУ –њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ-—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є.
–Я–µ—А–≤—Л–є –њ–µ—А–Є–Њ–і –і–ї–Є—В—Б—П –і–Њ —В–µ—Е –њ–Њ—А, –њ–Њ–Ї–∞ –њ—А–µ–Њ–±–ї–∞–і–∞—О—В —В–Ї–∞–љ–µ–≤—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –њ–µ—А–≤—Л—Е 3-—Е —Б—В–∞–і–Є–є –Љ–Њ—А—Д–Њ–≥–µ–љ–µ–Ј–∞ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–љ–Є–Њ–Ј–∞: –∞–ї—М–≤–µ–Њ–ї—П—А–љ–Њ–≥–Њ –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–Њ–Ј–∞, —Б–µ—А–Њ–Ј–љ–Њ-–і–µ—Б–Ї–≤–∞–Љ–∞—В–Є–≤–љ–Њ–≥–Њ –∞–ї—М–≤–µ–Њ–ї–Є—В–∞ –Є –Ї–Њ–љ–Є–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–Є–Љ—Д–∞–љ–≥–Є—В–∞. –Я–µ—А–≤—Л–є –њ–µ—А–Є–Њ–і –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ-–і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –Ј–∞–≤–µ—А—И–∞–µ—В—Б—П —Б—В–∞–і–Є–µ–є –Ї–Њ–љ–Є–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–Є–Љ—Д–∞–љ–≥–Є—В–∞. –Т —Н—В–Њ—В –њ–µ—А–Є–Њ–і —Д–Њ—А–Љ–Є—А—Г—О—В—Б—П –њ—А–µ–і–њ–Њ—Б—Л–ї–Ї–Є —Б–ї–µ–і—Г—О—Й–µ–≥–Њ –Ј–∞ –љ–Є–Љ –њ–µ—А–Є–Њ–і–∞ вАУ –њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ-—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є. –Я—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Н—В–Њ—В 2-–є –њ–µ—А–Є–Њ–і —Б–Њ–≤–њ–∞–і–∞–µ—В —Б IV —Б—В–∞–і–Є–µ–є –Љ–Њ—А—Д–Њ–≥–µ–љ–µ–Ј–∞ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–љ–Є–Њ–Ј–∞ вАУ —Б—В–∞–і–Є–µ–є –Ї–Њ–љ–Є–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–љ–µ–≤–Љ–Њ—Д–Є–±—А–Њ–Ј–∞. –У–ї–∞–≤–љ–Њ–є —З–µ—А—В–Њ–є —Н—В–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ —А–∞–Ј–≤–Є—В–Є–µ –њ–љ–µ–≤–Љ–Њ—Д–Є–±—А–Њ–Ј–∞ –≤–Њ –≤—Б–µ—Е —Б—В—А—Г–Ї—В—Г—А–∞—Е –∞—Ж–Є–љ—Г—Б–Њ–≤ –Є –і–Њ–ї–µ–Ї –ї–µ–≥–Ї–Њ–≥–Њ. –Я—А–Є —Н—В–Њ–Љ –≤ –Њ—Б–љ–Њ–≤–µ –±—Г—А–љ–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є –ї–µ–ґ–Є—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ—А–Є—З–Є–љ. –Ю—Б–љ–Њ–≤–љ–Њ–є –Є–Ј –љ–Є—Е —П–≤–ї—П–µ—В—Б—П –љ–∞—А—Г—И–µ–љ–Є–µ –ї–Є–Љ—Д–Њ–і–Є–љ–∞–Љ–Є–Ї–Є –Њ—А–≥–∞–љ–∞. –Т—Л–≤–µ–і–µ–љ–Є–µ –њ—Л–ї–µ–≤—Л—Е —З–∞—Б—В–Є—Ж –ї–Є–Љ—Д–Њ–≥–µ–љ–љ–Њ, —З–µ—А–µ–Ј –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ –Ї–Њ–ї–ї–µ–Ї—В–Њ—А—Л –∞—Ж–Є–љ—Г—Б–∞, –≤ —Г—Б–ї–Њ–≤–Є—П—Е –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–µ–≥–Њ—Б—П –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –њ—Л–ї–Є —П–≤–ї—П–µ—В—Б—П —Ж–µ–љ—В—А–∞–ї—М–љ—Л–Љ –Ј–≤–µ–љ–Њ–Љ –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –Ї–Њ–љ–Є–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –ї–µ–≥–Ї–Є—Е [4вАУ6]. –Я–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –љ–∞ –њ–µ—А–≤—Л—Е –µ–≥–Њ —Н—В–∞–њ–∞—Е –≤–Ї–ї—О—З–∞—О—В—Б—П –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ –Ї–∞–њ–Є–ї–ї—П—А—Л –≤–Њ–Ї—А—Г–≥ –њ–Њ—Б—В–Ї–∞–њ–Є–ї–ї—П—А–љ—Л—Е –≤–µ–љ—Г–ї –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ –Љ–∞–ї–Њ–≥–Њ –Ї—А—Г–≥–∞ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П. –С–Њ–ї–µ–µ –Ї—А—Г–њ–љ—Л–µ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ –Ї–Њ–ї–ї–µ–Ї—В–Њ—А—Л –Є –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л–µ —Б–Њ—Б—Г–і—Л –≤–Њ–≤–ї–µ–Ї–∞—О—В—Б—П –≤ –њ—А–Њ—Ж–µ—Б—Б –њ–Њ–Ј–і–љ–µ–µ.
–Т —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –Њ—В–і–µ–ї–∞—Е –ї–µ–≥–Ї–Є—Е —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Б–µ—А–Њ–Ј–љ–Њ-–і–µ—Б–Ї–≤–∞–Љ–∞—В–Є–≤–љ—Л–є –∞–ї—М–≤–µ–Њ–ї–Є—В, –Ї–Њ—В–Њ—А–Њ–Љ—Г –њ—А–µ–і—И–µ—Б—В–≤—Г–µ—В –∞–ї—М–≤–µ–Њ–ї—П—А–љ—Л–є –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–Њ–Ј. –£–Ї–∞–Ј–∞–љ–љ—Л–є –∞–ї—М–≤–µ–Њ–ї–Є—В –Ј–∞–≤–µ—А—И–∞–µ—В—Б—П –і–µ—Б–Ї–≤–∞–Љ–∞—В–Є–≤–љ–Њ–є –Є–љ—Д–Є–ї—М—В—А–∞—В–Є–≤–љ–Њ–є –Њ–±—В—Г—А–∞—Ж–Є–µ–є –∞–ї—М–≤–µ–Њ–ї –Є –±—А–Њ–љ—Е–Є–Њ–ї, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –Ї–Њ–љ–Є–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–Є–Љ—Д–∞–љ–≥–Є—В–∞.
–Я—А–Є —Н—В–Њ–Љ –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –±—А–Њ–љ—Е–Њ–≤ —А–∞–Ј–≤–Њ—А–∞—З–Є–≤–∞—О—В—Б—П –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–Њ-–њ—А–Є—Б–њ–Њ—Б–Њ–±–Є—В–µ–ї—М–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–ґ–љ–Њ –Њ–±–Њ–Ј–љ–∞—З–Є—В—М –Ї–∞–Ї —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В, –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–є –Њ—В –Ї–∞—В–∞—А–∞–ї—М–љ–Њ–≥–Њ –і–Њ –Ї–∞—В–∞—А–∞–ї—М–љ–Њ-—Б–Ї–ї–µ—А–Њ–Ј–Є—А—Г—О—Й–µ–≥–Њ –Є —Б–Ї–ї–µ—А–Њ–Ј–Є—А—Г—О—Й–µ–≥–Њ –≤–Є–і–∞ —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В–∞ [4вАУ6].
–Т—Л—И–µ–Њ–њ–Є—Б–∞–љ–љ—Л–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є—П —П–≤–Є–ї–Є—Б—М —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є–Љ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –Є–Ј—Г—З–µ–љ–Є—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –і–ї—П –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–Є–ї–Є–Ї–Њ–Ј–∞ –ї–Є–Љ—Д–Њ—В—А–Њ–њ–љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ –Ы–Є–Љ—Д–Њ–Љ–Є–Њ–Ј–Њ—В, –њ—А–µ–њ–∞—А–∞—В–∞ –љ–Њ—А–Љ–∞–ї–Є–Ј—Г—О—Й–µ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –±—А–Њ–љ—Е–Њ–≤ вАУ –Ь—Г–Ї–Њ–Ј–∞ –Ї–Њ–Љ–њ–Њ–Ј–Є—В—Г–Љ –Є —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ–Њ–≥–Њ –∞–љ—В–Є—В—А–∞–≤–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ вАУ –Ґ—А–∞—Г–Љ–µ–ї—М –°.
–¶–µ–ї—М: –Є–Ј—Г—З–Є—В—М –ї–µ—З–µ–±–љ—Л–є —Н—Д—Д–µ–Ї—В –≥–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –њ—А–Є —Б–Є–ї–Є–Ї–Њ–Ј–µ –Є –Є—Е –њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –≤ –≥—А—Г–њ–њ–µ –ї–Є—Ж, –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї –њ–Њ—Б—В–∞–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј ¬Ђ–њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ –љ–∞ —Б–Є–ї–Є–Ї–Њ–Ј¬ї.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Ф–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –Є–ї–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П –і–Є–∞–≥–љ–Њ–Ј–∞ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —В—А–µ–±–Њ–≤–∞–љ–Є—П–Љ–Є, –њ—А–µ–і—К—П–≤–ї—П–µ–Љ—Л–Љ–Є –Ї —Н—В–Њ–є –њ—А–Њ—Ж–µ–і—Г—А–µ. –§—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤ –і—Л—Е–∞–љ–Є—П –Є –±—А–Њ–љ—Е–Њ—Д–Є–±—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–≥–Њ –њ–љ–µ–≤–Љ–Њ—В–∞—Е–Њ–≥—А–∞—Д–∞ ¬ЂCusto Vit¬ї (–У–µ—А–Љ–∞–љ–Є—П). –Ш—Б—Б–ї–µ–і—Г–µ–Љ—Л–µ –≤–µ–ї–Є—З–Є–љ—Л –≤—Л—А–∞–ґ–∞–ї–Є—Б—М –≤ –њ—А–Њ—Ж–µ–љ—В–∞—Е –Ї –і–Њ–ї–ґ–љ—Л–Љ.
–†–∞–і–Є–Њ–Є–Ј–Њ—В–Њ–њ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤—Л–њ–Њ–ї–љ–µ–љ—Л –љ–∞ –Ї–∞—Д–µ–і—А–µ –ї—Г—З–µ–≤–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –°–∞–Љ–У–Ь–£.
–Ф–ї—П –Њ—Ж–µ–љ–Ї–Є —А–µ–≥–Є–Њ–љ–∞—А–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –ї–µ–≥–Ї–Є—Е –љ–∞ —Д–Њ–љ–µ –≥–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є —Г 14 —З–µ–ї–Њ–≤–µ–Ї –њ—А–Є–Љ–µ–љ—П–ї–∞—Б—М –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–∞—П –∞—Н—А–Њ–Ј–Њ–ї—М–љ–∞—П —Б—Ж–Є–љ—В–Є–≥—А–∞—Д–Є—П –ї–µ–≥–Ї–Є—Е, –Ї–Њ—В–Њ—А–∞—П –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М c –њ–Њ–Љ–Њ—Й—М—О —Г—Б—В–∞–љ–Њ–≤–Ї–Є ¬ЂVenticis II¬ї (CIS International, –§—А–∞–љ—Ж–Є—П). –Ш–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ—Б—В—М –і–∞–љ–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –≤ –≤—Л—П–≤–ї–µ–љ–Є–Є —А–µ–≥–Є–Њ–љ–∞—А–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —В–µ—Б—В–Њ–≤ –Є –Њ–±–ї–∞–і–∞–µ—В –љ–µ–Ї–Њ—В–Њ—А—Л–Љ–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞–Љ–Є –њ–µ—А–µ–і –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —А–∞–і–Є–Њ–љ—Г–Ї–ї–Є–і–Њ–≤ –Є–љ–µ—А—В–љ—Л—Е –≥–∞–Ј–Њ–≤ [12].
–С—А–Њ–љ—Е–Њ—Д–Є–±—А–Њ—Б–Ї–Њ–њ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ–Њ–і –Љ–µ—Б—В–љ–Њ–є –∞–љ–µ—Б—В–µ–Ј–Є–µ–є 10% —А–∞—Б—В–≤–Њ—А–Њ–Љ –ї–Є–і–Њ–Ї–∞–Є–љ–∞ –љ–∞ –∞–њ–њ–∞—А–∞—В–µ ¬ЂOlympus BF¬ї —В–Є–њ P10 c –Ј–∞–њ–Є—Б—М—О –љ–∞ –≤–Є–і–µ–Њ–±–ї–Њ–Ї–µ OTB/F-3 —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –±–Є–Њ–њ—Б–Є–µ–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є —Б–Њ —И–њ–Њ—А —Б–µ–≥–Љ–µ–љ—В–∞—А–љ—Л—Е –±—А–Њ–љ—Е–Њ–≤ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ –і–µ—А–µ–≤–∞ –Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ –±–Є–Њ–њ—В–∞—В–Њ–≤.
–§–Є–Ї—Б–∞—Ж–Є—П –±–Є–Њ–њ—Б–Є–є–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М –≤ 10% —А–∞—Б—В–≤–Њ—А–µ —Д–Њ—А–Љ–∞–ї–Є–љ–∞ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –Ј–∞–ї–Є–≤–Ї–Њ–є –≤ –њ–∞—А–∞—Д–Є–љ–Њ–≤—Л–µ –±–ї–Њ–Ї–Є. –°—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є –і–Њ 10 –Љ–Ї–Љ –Њ–Ї—А–∞—И–Є–≤–∞–ї–Є—Б—М –≥–µ–Љ–∞—В–Њ–Ї—Б–Є–ї–Є–љ-—Н–Њ–Ј–Є–љ–Њ–Љ. –Ь–Є–Ї—А–Њ–њ—А–µ–њ–∞—А–∞—В—Л –Ї–Њ–љ—Б—Г–ї—М—В–Є—А–Њ–≤–∞–љ—Л –љ–∞ –Ї–∞—Д–µ–і—А–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–љ–∞—В–Њ–Љ–Є–Є –°–∞–Љ–У–Ь–£. –Я—А–Є –±—А–Њ–љ—Е–Њ—Д–Є–±—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є–Ј—Г—З–µ–љ–Є–Є –±–Є–Њ–њ—В–∞—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –±—А–Њ–љ—Е–Њ–≤ –і–Њ –ї–µ—З–µ–љ–Є—П –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –Њ–±—Й–µ–Є–Ј–≤–µ—Б—В–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–µ–љ–љ–Њ–є –њ—Л–ї–Є [2, 6].
–Ф–ї—П –Є–Ј—Г—З–µ–љ–Є—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —А–∞—Б—И–Є—А–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –±—Л–ї–∞ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–∞ —Б–Њ–±—Б—В–≤–µ–љ–љ–∞—П –њ—А–Њ–≥—А–∞–Љ–Љ–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є. –°–Њ–≥–ї–∞—Б–љ–Њ –њ—А–Є–љ—Ж–Є–њ–∞–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є –љ–∞—Б—В–Њ—П—Й–∞—П —А–∞–±–Њ—В–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ—В–љ–µ—Б–µ–љ–∞ –Ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –Є—Б–њ—Л—В–∞–љ–Є—П–Љ IV —Д–∞–Ј—Л, —Б—Г—В—М –Ї–Њ—В–Њ—А—Л—Е –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —А–∞—Б—И–Є—А–µ–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л—Е –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –ї–µ–Ї–∞—А—Б—В–≤ —Г –±–Њ–ї—М–љ—Л—Е —Б–Є–ї–Є–Ї–Њ–Ј–Њ–Љ. –Я—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ –њ—А–Њ—Б—В—Л–Љ —Б–ї–µ–њ—Л–Љ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л–Љ. –Т –Ї–∞—З–µ—Б—В–≤–µ –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –њ–ї–∞—Ж–µ–±–Њ –Є–ї–Є –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–µ –ї–µ—З–µ–љ–Є–µ —Б–Є–ї–Є–Ї–Њ–Ј–∞. –Ґ–∞–Ї –Ї–∞–Ї –љ–Є –Њ–і–љ–Њ –Є–Ј –Є–Ј–≤–µ—Б—В–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –љ–µ –Є–Љ–µ–µ—В –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є —Б–Є–ї–Є–Ї–Њ–Ј–µ –Є –љ–∞ –њ–µ—А–≤—Л—Е —Н—В–∞–њ–∞—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –і–∞–ґ–µ –±–µ–Ј –ї–µ—З–µ–љ–Є—П –њ—А–Њ—В–µ–Ї–∞–µ—В –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ, –і–ї—П –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Б—А–∞–≤–љ–µ–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б –≥—А—Г–њ–њ–Њ–є –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ–ї–∞—Ж–µ–±–Њ. –Я–Њ –≤–љ–µ—И–љ–µ–Љ—Г –≤–Є–і—Г –њ–ї–∞—Ж–µ–±–Њ –Є –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–µ —Б—А–µ–і—Б—В–≤–Њ –±—Л–ї–Є –Є–і–µ–љ—В–Є—З–љ—Л–Љ–Є. –Ф–ї—П —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є —Б–ї–µ–њ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –Ї–Њ–љ—В—А–Њ–ї—П —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–≥–Њ –Є–Ј–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –≤–µ—Й–µ—Б—В–≤ –љ–µ —В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М. –§–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —А–∞—Б—В–≤–Њ—А –њ—А–Є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –Є –≤–Њ–і–љ–Њ-—Б–њ–Є—А—В–Њ–≤–Њ–є —А–∞—Б—В–≤–Њ—А —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ–Њ –≤–љ–µ—И–љ–µ–Љ—Г –≤–Є–і—Г, –Ї–Њ–љ—Б–Є—Б—В–µ–љ—Ж–Є–Є, –≤–Ї—Г—Б—Г –±—Л–ї–Є –Є–і–µ–љ—В–Є—З–љ—Л –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ —Б—А–µ–і—Б—В–≤–∞–Љ.
–Я—А–Њ—Ж–µ–і—Г—А–∞ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є –±—Л–ї–∞ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–∞ –і–Њ –љ–∞—З–∞–ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є. –°–ї—Г—З–∞–є–љ–Њ–µ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –≤–Є–і–∞ –ї–µ—З–µ–љ–Є—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Њ –Љ–µ—В–Њ–і–Њ–Љ —Б–ї—Г—З–∞–є–љ—Л—Е —З–Є—Б–µ–ї –љ–∞ –Ї–Њ–Љ–њ—М—О—В–µ—А–µ. –Я–µ—А–µ–і –њ—А–Њ–≤–µ–і–µ–љ–Є–µ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л–µ –Є –±–Њ–ї—М–љ—Л–µ –±—Л–ї–Є —Б—В—А–∞—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ—Л –њ–Њ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ, –≤–Ї–ї—О—З–∞—П –њ—А–Њ—Д–Љ–∞—А—И—А—Г—В (—А–∞–±–Њ—В–∞ –љ–∞ –Њ–і–љ–Њ–Љ –њ—А–µ–і–њ—А–Є—П—В–Є–Є вАУ –≥–Њ—А–љ–Њ-–Њ–±–Њ–≥–∞—В–Є—В–µ–ї—М–љ–Њ–Љ –Ї–Њ–Љ–±–Є–љ–∞—В–µ), —Б–∞–љ–Є—В–∞—А–љ–Њ-–≥–Є–≥–Є–µ–љ–Є—З–µ—Б–Ї–Є–µ —Г—Б–ї–Њ–≤–Є—П —В—А—Г–і–∞.
–Э–∞–±–ї—О–і–µ–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –≤ –Ј–∞—А–∞–љ–µ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–Љ –њ—А–Њ–Љ–µ–ґ—Г—В–Ї–Є –≤—А–µ–Љ–µ–љ–Є: –і–Њ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П, –≤ —Е–Њ–і–µ –ї–µ—З–µ–љ–Є—П, –њ–Њ –Ј–∞–≤–µ—А—И–µ–љ–Є–Є –ї–µ—З–µ–љ–Є—П. –Ю—Ж–µ–љ–Ї—Г —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ–≥–Њ –Є 2-—Е –њ–Њ—Б–ї–µ–і—Г—О—Й–Є—Е –Ї—Г—А—Б–Њ–≤ –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ (—З–µ—А–µ–Ј 1 –Є 2 –≥–Њ–і–∞). –С–Њ–ї—М–љ—Л–µ –≤ —В–µ—З–µ–љ–Є–µ –≥–Њ–і–∞, –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ, –љ–µ –ї–µ—З–Є–ї–Є—Б—М –Њ—В –і–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –њ—А–Є–љ—Ж–Є–њ–∞–Љ–Є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л [9вАУ11]. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –Њ–њ—А–µ–і–µ–ї—П–ї–∞—Б—М —З–Є—Б–ї–Њ–Љ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е –њ—А–Њ–Є–Ј–Њ—И–ї–Њ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–ї–Є–љ–Є–Ї–Њ-—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є —Б–Є—Б—В–µ–Љ—Г –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е —И–Ї–∞–ї вАУ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є –љ–∞–±–Њ—А –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ. –Т—Л—Б–Њ–Ї–∞—П –Њ—Ж–µ–љ–Ї–∞ –≤ –±–∞–ї–ї–∞—Е –Љ–Њ–≥–ї–∞ –±—Л—В—М –і–∞–љ–∞ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Є –Њ–±—К–µ–Ї—В–Є–≤–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —З–µ–Љ –Љ–µ–љ—М—И–µ —Б—В–µ–њ–µ–љ—М –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—П —Н—В–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤, —В–µ–Љ –≤—Л—И–µ –Њ—Ж–µ–љ–Ї–∞ –≤ –±–∞–ї–ї–∞—Е. –Ю—Ж–µ–љ–Ї–Є –њ—А–µ–і—Б—В–∞–≤–ї—П–ї–Є —Б–Њ–±–Њ–є –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ–Њ –≤—Л–±—А–∞–љ–љ—Л–µ —З–Є—Б–ї–∞, –Ї–Њ—В–Њ—А—Л–µ –љ–µ—Б–ї–Є —В–Њ–ї—М–Ї–Њ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О, –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—Й—Г—О, —З—В–Њ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ ¬Ђ6 –±–∞–ї–ї–Њ–≤¬ї —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–Њ–ї—М–љ–Њ–≥–Њ –ї—Г—З—И–µ, —З–µ–Љ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ ¬Ђ3 –±–∞–ї–ї–∞¬ї, –љ–Њ –љ–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Є, —З—В–Њ —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–µ—А–≤–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ –≤ 2 —А–∞–Ј–∞ –ї—Г—З—И–µ, —З–µ–Љ –≤—В–Њ—А–Њ–≥–Њ.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
–Ф–Є–∞–≥–љ–Њ–Ј ¬Ђ—Б–Є–ї–Є–Ї–Њ–Ј¬ї –≤—Л—Б—В–∞–≤–ї—П–ї—Б—П —Б —Г—З–µ—В–Њ–Љ —Б–∞–љ–Є—В–∞—А–љ–Њ-–≥–Є–≥–Є–µ–љ–Є—З–µ—Б–Ї–Є—Е —Г—Б–ї–Њ–≤–Є–є —В—А—Г–і–∞, –і–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ, —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–µ–є –њ–љ–µ–≤–Љ–Њ–Ї–Њ–љ–Є–Њ–Ј–Њ–≤.
–°–Њ–і–µ—А–ґ–∞–љ–Є–µ –Ї—А–µ–Љ–љ–Є–є—Б–Њ–і–µ—А–ґ–∞—Й–µ–є (–Ї–≤–∞—А—Ж–µ–≤–Њ–є) –њ—Л–ї–Є –≤ –≤–Њ–Ј–і—Г—Е–µ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –њ–Њ–Љ–µ—Й–µ–љ–Є–є –≤ –Њ—В–і–µ–ї—М–љ—Л–µ –Љ–Њ–Љ–µ–љ—В—Л —В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ—А–µ–≤—Л—И–∞–ї–Њ –њ—А–µ–і–µ–ї—М–љ–Њ –і–Њ–њ—Г—Б—В–Є–Љ—Л–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є, —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —Б–≤–Њ–±–Њ–і–љ–Њ–є –і–≤—Г–Њ–Ї–Є—Б–Є –Ї—А–µ–Љ–љ–Є—П –і–Њ—Б—В–Є–≥–∞–ї–Њ 98,2%, —Б —А–∞–Ј–Љ–µ—А–∞–Љ–Є –њ—Л–ї–µ–≤—Л—Е —З–∞—Б—В–Є—Ж –Љ–µ–љ–µ–µ 2 –Љ–Ї–Љ вАУ 26%, 2вАУ5 –Љ–Ї–Љ вАУ 65%. –Т—Л—Б–Њ–Ї–∞—П —Б—В–µ–њ–µ–љ—М –і–Є—Б–њ–µ—А—Б–љ–Њ—Б—В–Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –і–ї–Є—В–µ–ї—М–љ–Њ–µ –њ—А–µ–±—Л–≤–∞–љ–Є–µ –њ—Л–ї–Є –≤ –≤–Њ–Ј–і—Г—Е–µ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –њ–Њ–Љ–µ—Й–µ–љ–Є–є –Є –≥–ї—Г–±–Њ–Ї–Њ–µ –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –≤ –Њ—А–≥–∞–љ—Л –і—Л—Е–∞–љ–Є—П —А–∞–±–Њ—В–∞—О—Й–Є—Е. –£—Б–ї–Њ–≤–Є—П —В—А—Г–і–∞ –±—Л–ї–Є –Њ—В–љ–µ—Б–µ–љ—Л –Ї III —Б—В–µ–њ–µ–љ–Є –≤—А–µ–і–љ–Њ—Б—В–Є —Б –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –Њ–њ–∞—Б–љ–Њ—Б—В—М—О —А–∞–Ј–≤–Є—В–Є—П –њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –њ–Њ –њ—Л–ї–µ–≤–Њ–Љ—Г —Д–∞–Ї—В–Њ—А—Г. –Ю—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –љ–∞ –Є–Ј—Г—З–∞–µ–Љ–Њ–Љ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–µ –њ—А–µ–≤—Л—И–∞–ї–Є –Њ–±–ї–∞—Б—В–љ–Њ–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Є –±—Л–ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤ —Ж–µ–ї–Њ–Љ –њ–Њ –Њ—В—А–∞—Б–ї–Є.
–Т–ї–Є—П–љ–Є–µ –Є–Ј—Г—З–∞–µ–Љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –љ–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Є –Њ–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤
–Ю—Б–љ–Њ–≤–љ–Њ–µ –њ—А–µ–њ—П—В—Б—В–≤–Є–µ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–Є–ї–Є–Ї–Њ–Ј–∞ –Є–Ј—Г—З–∞–µ–Љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є вАУ —Н—В–Њ —Б–Ї—Г–і–љ–Њ—Б—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є —Б–Є–ї–Є–Ї–Њ–Ј–∞ –Є –Љ–∞–ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ—П–µ–Љ–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є [2, 3, 8]. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –Њ—Ж–µ–љ–Ї–∞ —Б–Њ—Б—В–Њ—П–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ (—Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П) –њ–Њ –Ї–Њ–љ–µ—З–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –і–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є–Ј—Г—З–∞–µ–Љ—Л—Е –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –±—Л–ї–∞ –Ј–∞—В—А—Г–і–љ–µ–љ–∞. –Я–Њ—Н—В–Њ–Љ—Г —А–∞—Б—Б—З–Є—В—Л–≤–∞—В—М –љ–∞ –≤—Л—Б–Њ–Ї—Г—О –і–µ–Љ–Њ–љ—Б—В—А–∞—В–Є–≤–љ–Њ—Б—В—М –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—П —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Є –Њ–±—К–µ–Ї—В–Є–≤–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–ї–Њ—Б—М –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ. –°—А–Њ–Ї–Є —А–∞–Ј—А–µ—И–µ–љ–Є—П –Њ–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Є —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –ї–Є—И—М –≤ –Є–Ј–≤–µ—Б—В–љ–Њ–є –Љ–µ—А–µ –Љ–Њ–≥–ї–Є —Б–ї—Г–ґ–Є—В—М –Ї—А–Є—В–µ—А–Є–µ–Љ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є—Б–њ—Л—В—Л–≤–∞–µ–Љ–Њ–є –Є –Њ–±—Л—З–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Б–Є–ї–Є–Ї–Њ–Ј–∞ –Њ—Ж–µ–љ–µ–љ–∞ –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –≤ —В–µ—З–µ–љ–Є–µ 2-—Е –ї–µ—В —Г 89 —З–µ–ї–Њ–≤–µ–Ї: 29 –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ; 30 вАУ –њ–ї–∞—Ж–µ–±–Њ; 30 вАУ –Њ–±—Л—З–љ—Г—О –Њ–±—Й–µ–њ—А–Є–љ—П—В—Г—О —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—О.
–Я–Њ –≤–Њ–Ј—А–∞—Б—В—Г –Є —Б—В–∞–ґ—Г —А–∞–±–Њ—В—Л –≥—А—Г–њ–њ–∞ –Ї–Њ–љ—В–∞–Ї—В–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –≥—А—Г–њ–њ–∞ –±–Њ–ї—М–љ—Л—Е –љ–µ –Є–Љ–µ–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е –Њ—В–ї–Є—З–Є–є (—А>0,05). –Ь—Г–ґ—З–Є–љ—Л —Б–Њ—Б—В–∞–≤–ї—П–ї–Є 78%, –ґ–µ–љ—Й–Є–љ—Л вАУ 22%. –Ы–Є—Ж–∞ —Б–Њ —Б—В–∞–ґ–µ–Љ —А–∞–±–Њ—В—Л –±–Њ–ї–µ–µ 10 –ї–µ—В —Б–Њ—Б—В–∞–≤–Є–ї–Є 80%.
–Я–∞—Ж–Є–µ–љ—В—Л 1-–є –≥—А—Г–њ–њ—Л –њ–Њ–ї—Г—З–∞–ї–Є –ї–µ—З–µ–љ–Є–µ –Є–Ј—Г—З–∞–µ–Љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ 21 –і–љ—П –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ –њ—А–Њ—Д—Ж–µ–љ—В—А–µ –њ–Њ —Б—Е–µ–Љ–µ: –Ь—Г–Ї–Њ–Ј–∞ –Ї–Њ–Љ–њ–Њ–Ј–Є—В—Г–Љ –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ –њ–Њ 2,2 –Љ–ї 2 —А–∞–Ј–∞ –≤ –љ–µ–і–µ–ї—О —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ –≤ 3 –і–љ—П. –Т –њ—А–Њ–Љ–µ–ґ—Г—В–Ї–∞—Е –Љ–µ–ґ–і—Г –і–љ—П–Љ–Є –Є–љ—К–µ–Ї—Ж–Є–є —З–µ—А–µ–Ј –і–µ–љ—М —З–µ—А–µ–і–Њ–≤–∞–ї–Є 3-—А–∞–Ј–Њ–≤—Л–є –њ—А–Є–µ–Љ –њ–Њ 10 –Ї–∞–њ–µ–ї—М –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ы–Є–Љ—Д–Њ–Љ–Є–Њ–Ј–Њ—В –Є –Ґ—А–∞—Г–Љ–µ–ї—М –° –≤ 1/4 —Б—В–∞–Ї–∞–љ–∞ –≤–Њ–і—Л. –Т—В–Њ—А–∞—П –≥—А—Г–њ–њ–∞ –њ–Њ–ї—Г—З–∞–ї–∞ –њ–ї–∞—Ж–µ–±–Њ, —В—А–µ—В—М—П вАУ –Њ–±—Л—З–љ–Њ–µ, –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–µ –≤ –Њ–±–ї–∞—Б—В–љ–Њ–Љ –њ—А–Њ—Д—Ж–µ–љ—В—А–µ –ї–µ—З–µ–љ–Є–µ.
–Т–Њ 2-–є –Є 3-–є –≥—А—Г–њ–њ–∞—Е –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –ї–µ—З–µ–љ–Є—П —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л–µ –Є –Њ–±—К–µ–Ї—В–Є–≤–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Њ–і–Є–љ–∞–Ї–Њ–≤—Л. –Я–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, —Н—В–Њ —Б–≤—П–Ј–∞–љ–Њ –љ–µ —В–Њ–ї—М–Ї–Њ —Б –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Б–Є–ї–Є–Ї–Њ–Ј–∞, –љ–Њ –Є —Б —В–µ–Љ, —З—В–Њ –µ–≥–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ –Є–ї–Є –≤–Њ–Њ–±—Й–µ –љ–µ –њ—А–Њ–≤–Њ–і–Є—В—Б—П. –Т —Б–≤—П–Ј–Є —Б –≤—Л—И–µ–Є–Ј–ї–Њ–ґ–µ–љ–љ—Л–Љ –Љ—Л —Б–Њ—З–ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –Є –Ї–Њ—А—А–µ–Ї—В–љ—Л–Љ –њ—А–Є–≤–Њ–і–Є—В—М —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є–Ј—Г—З–∞–µ–Љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ–ї–∞—Ж–µ–±–Њ.
–Э–∞ —А–Є—Б—Г–љ–Ї–∞—Е 1 –Є 2 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Є –Њ–±—К–µ–Ї—В–Є–≤–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ —Б–Є–ї–Є–Ї–Њ–Ј–∞ –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –ї–µ—З–µ–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ –Є–Ј—Г—З–∞–µ–Љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ (1-—П –≥—А—Г–њ–њ–∞) –Є –Љ–µ—В–Њ–і–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ (2-—П –≥—А—Г–њ–њ–∞). –Ш–Ј —А–Є—Б—Г–љ–Ї–Њ–≤ –≤–Є–і–љ–Њ, —З—В–Њ –њ–Њ—Б–ї–µ 1-–≥–Њ –Ї—Г—А—Б–∞ –ї–µ—З–µ–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ –≤ 1-–є –≥—А—Г–њ–њ–µ —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є–µ –Є —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–Њ–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–Є–ї–Њ—Б—М –≤ –±–Њ–ї—М—И–µ–є –Љ–µ—А–µ, —З–µ–Љ –≤–Њ 2-–є –Є 3-–є –≥—А—Г–њ–њ–∞—Е.
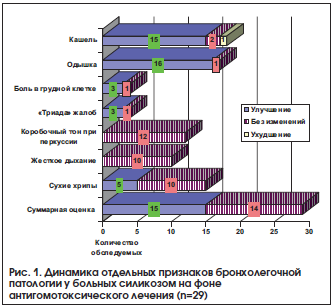

–Ю—Б–Њ–±–µ–љ–љ–Њ —З–µ—В–Ї–Њ —Н—В–Њ –њ—А–Њ—Б–ї–µ–ґ–Є–≤–∞–µ—В—Б—П –њ—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є —Б—Г–Љ–Љ–∞—А–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П. –Э–∞ —А–Є—Б—Г–љ–Ї–µ 3 –њ—А–Є–≤–µ–і–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–Њ–љ—В—А–Њ–ї—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б—Г–Љ–Љ–∞—А–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Є –Њ–±—К–µ–Ї—В–Є–≤–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ–∞—В–Њ–ї–Њ–≥–Є–Є –±—А–Њ–љ—Е–Њ–ї–µ–≥–Њ—З–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л.
–°—Г–Љ–Љ–∞—А–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ —Б–Ї–ї–∞–і—Л–≤–∞–ї–∞—Б—М –Є–Ј 7 –Њ—В–і–µ–ї—М–љ—Л—Е –Њ—Ж–µ–љ–Њ–Ї –Њ—В 0 (—Б–Є–Љ–њ—В–Њ–Љ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В) –і–Њ 1 вАУ —Б–Є–Љ–њ—В–Њ–Љ –Є–Љ–µ–µ—В—Б—П. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –і–Њ—Б—В–Є–ґ–Є–Љ–∞—П —Б—Г–Љ–Љ–∞—А–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 7 –±–∞–ї–ї–Њ–≤. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –і–Њ –Є –њ–Њ—Б–ї–µ 1-–≥–Њ –Ї—Г—А—Б–∞ –ї–µ—З–µ–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ, —З–µ—А–µ–Ј 1 –Є 2 –≥–Њ–і–∞ (–њ–Њ–≤—В–Њ—А–љ–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –Є –ї–µ—З–µ–љ–Є–µ –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ).
–Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е, —Б—Г–Љ–Љ–∞—А–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –≥–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–Ј–Є–ї–∞—Б—М –њ–Њ—Б–ї–µ –Ї—Г—А—Б–∞ –ї–µ—З–µ–љ–Є—П –Є –Є–Љ–µ–ї–∞ —В–µ–љ–і–µ–љ—Ж–Є—О –Ї —Б–љ–Є–ґ–µ–љ–Є—О –њ–Њ—Б–ї–µ –њ–Њ–≤—В–Њ—А–љ—Л—Е –Ї—Г—А—Б–Њ–≤ –ї–µ—З–µ–љ–Є—П. –Ю–±—Й–µ–њ—А–Є–љ—П—В–Њ–µ –ї–µ—З–µ–љ–Є–µ –Є –њ–ї–∞—Ж–µ–±–Њ-–ї–µ—З–µ–љ–Є–µ —В–Њ–ґ–µ –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї —Б–љ–Є–ґ–µ–љ–Є—О –і–∞–љ–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П, –љ–Њ –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, –Є –љ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —В–µ–љ–і–µ–љ—Ж–Є–Є –Ї –µ–≥–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є—О –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –њ–Њ–≤—В–Њ—А–љ—Л—Е –Ї—Г—А—Б–Њ–≤ –Њ–±—Л—З–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є.
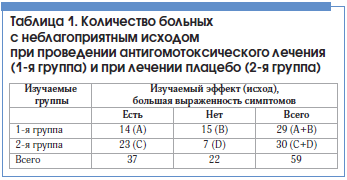
–Ш—Б–њ–Њ–ї—М–Ј—Г—П —Б—Г–Љ–Љ–∞—А–љ—Г—О –Њ—Ж–µ–љ–Ї—Г, –Љ—Л —Б–Њ—Б—В–∞–≤–Є–ї–Є —В–∞–±–ї–Є—Ж—Г —Б–Њ–њ—А—П–ґ–µ–љ–љ–Њ—Б—В–Є, –≥–і–µ –њ—А–Є–≤–µ–і–µ–љ—Л –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –Є—Б—Е–Њ–і—Л —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–±–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П (—В–∞–±–ї. 1).
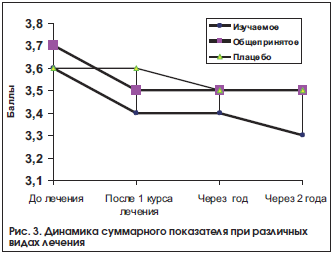
–Т –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–Љ –≤—Л—А–∞–ґ–µ–љ–Є–Є –і–Є–љ–∞–Љ–Є–Ї–∞ —Б—Г–Љ–Љ–∞—А–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –≤ 1-–є –≥—А—Г–њ–њ–µ –≤—Л–≥–ї—П–і–µ–ї–∞ —Б–ї–µ–і—Г—О—Й–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ: —Г 15 –±–Њ–ї—М–љ—Л—Е –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Г–ї—Г—З—И–µ–љ–Є–µ, —Г 14 вАУ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ. –Т–Њ 2-–є –≥—А—Г–њ–њ–µ –љ–∞ —Д–Њ–љ–µ –њ–ї–∞—Ж–µ–±–Њ —Г–ї—Г—З—И–µ–љ–Є–µ –Њ—В–Љ–µ—З–µ–љ–Њ —В–Њ–ї—М–Ї–Њ —Г 7, —Г 21 –Є–Ј–Љ–µ–љ–µ–љ–Є–є –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ, —Г 2-—Е –±–Њ–ї—М–љ—Л—Е –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г—Е—Г–і—И–µ–љ–Є–µ. –Ґ–Њ –µ—Б—В—М —Г 23 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–µ–љ–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Н—Д—Д–µ–Ї—В–∞ –≤ –ї–µ—З–µ–љ–Є–Є, –љ–∞–ї–Є—З–Є–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞, –±–Њ–ї—М—И–∞—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤.
–°–Њ–≥–ї–∞—Б–љ–Њ —Н—В–Є–Љ –і–∞–љ–љ—Л–Љ —А–∞—Б—Б—З–Є—В–∞–љ—Л –Ї–ї—О—З–µ–≤—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –≤ 1-–є –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї—Г—О —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—О, –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б–Њ 2-–є –≥—А—Г–њ–њ–Њ–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ–ї–∞—Ж–µ–±–Њ (—В–∞–±–ї. 2).

–†–µ–Ј—Г–ї—М—В–∞—В—Л, –њ—А–Є–≤–µ–і–µ–љ–љ—Л–µ –≤ —В–∞–±–ї–Є—Ж–µ 2, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В –і–Њ–≤–Њ–ї—М–љ–Њ –≤—Л—Б–Њ–Ї—Г—О —З–∞—Б—В–Њ—В—Г –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–љ—В—А–Њ–ї—П вАУ 77% (—Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ–ї–∞—Ж–µ–±–Њ) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –±–Њ–ї—М–љ—Л—Е, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ вАУ 48% (p<0,05). –°–љ–Є–ґ–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ (–°–Ю–†): 38% –њ—А–Є –Ї–Њ–ї–µ–±–∞–љ–Є–Є –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є–љ—В–µ—А–≤–∞–ї–∞ (–Ф–Ш) 6вАУ60. –°–љ–Є–ґ–µ–љ–Є–µ –∞–±—Б–Њ–ї—О—В–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ (–°–Р–†) вАУ 29% –њ—А–Є –Ф–Ш 4вАУ50. –І–Є—Б–ї–Њ –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –ї–µ—З–Є—В—М, —З—В–Њ–±—Л –њ—А–µ–і—Г–њ—А–µ–і–Є—В—М –Њ–і–Є–љ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –Є—Б—Е–Њ–і (–І–С–Э–Ы) (–±–Њ–ї—М—И–∞—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤) —А–∞–≤–љ–Њ 3 –њ—А–Є –Ф–Ш 2вАУ27. –Ю–±—А–∞—Й–∞–µ—В –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ –≤—Л—Б–Њ–Ї–∞—П –≥—А–∞–љ–Є—Ж–∞ –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–µ—А—Е–љ–µ–≥–Њ –Є–љ—В–µ—А–≤–∞–ї–∞. –Ю–і–љ–∞–Ї–Њ –Њ—В–љ–Њ—И–µ–љ–Є–µ —И–∞–љ—Б–Њ–≤ (–Ю–®) 0,28 –њ—А–Є –Ф–Ш 0,09вАУ0,87 —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В, —З—В–Њ —А–Є—Б–Ї –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ –њ—А–Є –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–Љ –ї–µ—З–µ–љ–Є–Є –≤ 3 —А–∞–Ј–∞ –Љ–µ–љ—М—И–µ, —З–µ–Љ –њ—А–Є –њ—А–Є–µ–Љ–µ –њ–ї–∞—Ж–µ–±–Њ (—А<0,03). –Ґ–Њ –µ—Б—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є–Ј—Г—З–∞–µ–Љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –≤ –њ–ї–∞–љ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ —Б–Є–ї–Є–Ї–Њ–Ј–∞ –≤—Л—И–µ, —З–µ–Љ –њ—А–Є –њ—А–Є–µ–Љ–µ –њ–ї–∞—Ж–µ–±–Њ –Є –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–є —В–µ—А–∞–њ–Є–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Д—Г–љ–Ї—Ж–Є–Є –≤–љ–µ—И–љ–µ–≥–Њ –і—Л—Е–∞–љ–Є—П –Є —А–µ–≥–Є–Њ–љ–∞—А–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –ї–µ–≥–Ї–Є—Е
–§—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –њ–∞—А–∞–Љ–µ—В—А—Л –і—Л—Е–∞–љ–Є—П –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –љ–Њ—А–Љ—Л. –Р–љ–∞–ї–Є–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –Њ–±—Й—Г—О —В–µ–љ–і–µ–љ—Ж–Є—О –њ—А–Є—А–Њ—Б—В–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ј–∞ –њ–µ—А–Є–Њ–і 1-–≥–Њ –Ї—Г—А—Б–∞ –ї–µ—З–µ–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е. –Т—Л—П–≤–ї–µ–љ–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П —З–µ—А–µ–Ј 1 –Є 2 –≥–Њ–і–∞. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Љ—Л –љ–µ —Б–Ї–ї–Њ–љ–љ—Л –њ–µ—А–µ–Њ—Ж–µ–љ–Є–≤–∞—В—М –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Є–Ј-–Ј–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–∞–Ј–±—А–Њ—Б–∞ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—А–∞–Љ–µ—В—А–∞ –≤ –≥—А—Г–њ–њ–∞—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е. –Ш–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–є —З–∞—Б—В–Њ—В–љ—Л–є –∞–љ–∞–ї–Є–Ј –љ–∞—А—Г—И–µ–љ–Є–є —Д—Г–љ–Ї—Ж–Є–Є –≤–љ–µ—И–љ–µ–≥–Њ –і—Л—Е–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ —Н—В–Њ—В –њ–∞—А–∞–Љ–µ—В—А –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –Є–Ј–Љ–µ–љ—П–µ—В—Б—П –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є —Г –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –≤ –Ї–ї–Є–љ–Є–Ї–Њ-—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–µ –і–Є–∞–≥–љ–Њ–Ј–∞ ¬Ђ—Б–Є–ї–Є–Ї–Њ–Ј¬ї –±—Л–ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ ¬Ђ—Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –±—А–Њ–љ—Е–Є—В¬ї. –Ю–±—А–∞—Й–∞—О—В –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В–∞—В—Л –Њ—Ж–µ–љ–Ї–Є —А–µ–≥–Є–Њ–љ–∞—А–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –ї–µ–≥–Ї–Є—Е –љ–∞ —Д–Њ–љ–µ –Є–Ј—Г—З–∞–µ–Љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є.
–£ 4-—Е –Є–Ј 7 –±–Њ–ї—М–љ—Л—Е —Б–Є–ї–Є–Ї–Њ–Ј–Њ–Љ, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –≥–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б–Ї—Г—О —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—О, –Њ—В–Љ–µ—З–µ–љ–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞. –Т –≥—А—Г–њ–њ–µ –ї–Є—Ж, –Ї–Њ—В–Њ—А—Л–Љ –љ–∞–Ј–љ–∞—З–∞–ї–∞—Б—М –Њ–±—Л—З–љ–∞—П —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П, —Г–ї—Г—З—И–µ–љ–Є–µ —А–µ–≥–Є–Њ–љ–∞—А–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –њ—А–Њ–Є–Ј–Њ—И–ї–Њ —В–Њ–ї—М–Ї–Њ –≤ 1 —Б–ї—Г—З–∞–µ –Є–Ј 7.
–Ш–Ј—Г—З–µ–љ–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–є —А–µ–≥–Є–Њ–љ–∞—А–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –ї–µ–≥–Ї–Є—Е –љ–∞ —Д–Њ–љ–µ –Є–Ј—Г—З–∞–µ–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ –і–∞–љ–љ—Л–Љ –∞—Н—А–Њ–Ј–Њ–ї—М–љ–Њ–є —Б—Ж–Є–љ—В–Є–≥—А–∞—Д–Є–Є –і–Њ–≤–Њ–ї—М–љ–Њ –љ–∞–≥–ї—П–і–љ–Њ –њ–Њ–Ї–∞–Ј–∞–ї–Њ —Г–ї—Г—З—И–µ–љ–Є–µ –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –ї–µ–≥–Ї–Є—Е –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Є–Ј—Г—З–∞–µ–Љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Ф–Њ –ї–µ—З–µ–љ–Є—П: –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–µ –Ј–Њ–љ—Л —Б–љ–Є–ґ–µ–љ–Є—П –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –Є —П—А–Ї–Є–µ –Њ—З–∞–≥–Є –≥–Є–њ–µ—А—Д–Є–Ї—Б–∞—Ж–Є–Є –∞—Н—А–Њ–Ј–Њ–ї—П –≤ —Г—З–∞—Б—В–Ї–∞—Е –Њ–±—Б—В—А—Г–Ї—Ж–Є–Є –±—А–Њ–љ—Е–Њ–≤.
–Я–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П: –Ј–∞–Љ–µ—В–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ —А–µ–≥–Є–Њ–љ–∞—А–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є: –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ –Њ—З–∞–≥–Њ–≤ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –∞—Н—А–Њ–Ј–Њ–ї—П –≤ –±—А–Њ–љ—Е–∞—Е –Є –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ –Ј–Њ–љ —А–µ–Ј–Ї–Њ–є –≥–Є–њ–Њ–≤–µ–љ—В–Є–ї—П—Ж–Є–Є, —Г–ї—Г—З—И–µ–љ–Є–µ –Њ–і–љ–Њ—А–Њ–і–љ–Њ—Б—В–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –∞—Н—А–Њ–Ј–Њ–ї—П.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –±—А–Њ–љ—Е–Њ—Д–Є–±—А–Њ—Б–Ї–Њ–њ–Є–Є –Є –∞–љ–∞–ї–Є–Ј –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–ї–Є–Ј–Є—Б—В–Њ–є –±—А–Њ–љ—Е–Њ–≤
–Т –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤—Л—П–≤–ї—П–ї—Б—П –і–≤—Г—Б—В–Њ—А–Њ–љ–љ–Є–є –і–Є—Д—Д—Г–Ј–љ—Л–є —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В, —Б–Њ—З–µ—В–∞—О—Й–Є–є—Б—П —Б —В—А–∞—Е–µ–Њ–±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –і–Є—Б–Ї–Є–љ–µ–Ј–Є–µ–є —А–∞–Ј–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є. –Ф–≤–µ –њ–µ—А–≤—Л–µ —Д–Њ—А–Љ—Л —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В–∞ –≤—Б—В—А–µ—З–∞–ї–Є—Б—М –≥–Њ—А–∞–Ј–і–Њ —А–µ–ґ–µ.
–Ю—Б–Њ–±–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є –±—А–Њ–љ—Е–Њ—Д–Є–±—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є–і–∞–≤–∞–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—О –њ—А–Є–Ј–љ–∞–Ї–Њ–≤, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є—Е –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Њ—В–Њ—А–Є–Ї–Є –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ –і–µ—А–µ–≤–∞ (–Є–Ј–Љ–µ–љ–µ–љ–Є–µ –і—Л—Е–∞—В–µ–ї—М–љ–Њ–є –њ–Њ–і–≤–Є–ґ–љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—В–і–µ–ї–Њ–≤, –љ–∞–ї–Є—З–Є–µ –і–Є—Б—В–Њ–љ–Є–Є –Љ–µ–Љ–±—А–∞–љ–Њ–Ј–љ–Њ–є —Б—В–µ–љ–Ї–Є —В—А–∞—Е–µ–Є –Є –≥–ї–∞–≤–љ—Л—Е –±—А–Њ–љ—Е–Њ–≤, –і–Є—Б–Ї–Є–љ–µ–Ј–Є–Є —Б–µ–≥–Љ–µ–љ—В–∞—А–љ—Л—Е –±—А–Њ–љ—Е–Њ–≤), –µ–≥–Њ –∞—А—Е–Є—В–µ–Ї—В–Њ–љ–Є–Ї–Є –≤ –≤–Є–і–µ –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є –Є –∞–Ї—Б–Є–∞–ї—М–љ–Њ–є –і–µ–≤–Є–∞—Ж–Є–Є (—А–∞–Ј–≤–Њ—А–Њ—В—Л, –Ј–∞–≥–Є–±—Л –±—А–Њ–љ—Е–Њ–≤), —Г–≤–µ–ї–Є—З–µ–љ–Є—П —Б–Ї–ї–∞–і—З–∞—В–Њ—Б—В–Є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є. –£—З–Є—В—Л–≤–∞–ї–Є—Б—М —А–∞–Ј–ї–Є—З–љ—Л–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П –Њ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В—А–Њ–µ–љ–Є—П –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ –і–µ—А–µ–≤–∞ –Є —В—А–∞—Е–µ–Є, —Б—В–µ–њ–µ–љ—М –Њ–±—В—Г—А–∞—Ж–Є–Є –±—А–Њ–љ—Е–Њ–≤ —Б–ї–Є–Ј—М—О. –Ґ–∞–Ї–Њ–є –њ—А–Є–Ј–љ–∞–Ї –њ—Л–ї–µ–≤–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П, –Ї–∞–Ї —В–∞—В—Г–Є—А–Њ–≤–Ї–∞ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –±—А–Њ–љ—Е–Њ–≤ (—Б–Ї–Њ–њ–ї–µ–љ–Є–µ –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤, –Ј–∞–њ–Њ–ї–љ–µ–љ–љ—Л—Е –њ—Л–ї—М—О, –≤ –њ–Њ–і—Б–ї–Є–Ј–Є—Б—В–Њ–Љ —Б–ї–Њ–µ), –≤ –љ–∞—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Њ–±–љ–∞—А—Г–ґ–µ–љ –љ–µ –±—Л–ї.
–£ –њ–Њ–ї–Њ–≤–Є–љ—Л –±–Њ–ї—М–љ—Л—Е –≤—Л—П–≤–ї—П–ї–∞—Б—М –і–Є—Б—В–Њ–љ–Є—П –Љ–µ–Љ–±—А–∞–љ–Њ–Ј–љ–Њ–є —Б—В–µ–љ–Ї–Є —В—А–∞—Е–µ–Є, –≥–ї–∞–≤–љ—Л—Е –±—А–Њ–љ—Е–Њ–≤ –Є –і–Є—Б–Ї–Є–љ–µ–Ј–Є—П —Б–µ–≥–Љ–µ–љ—В–∞—А–љ—Л—Е –±—А–Њ–љ—Е–Њ–≤. –Я—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–Є—Б—М –і–Є—Д—Д—Г–Ј–љ—Л–µ –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ –Є —Б–Ї–ї–µ—А–Њ–Ј–Є—А—Г—О—Й–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є. –Я—А–Є –∞—В—А–Њ—Д–Є–Є –Њ—В–Љ–µ—З–∞–ї–∞—Б—М —З–µ—В–Ї–∞—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Е—А—П—Й–µ–≤—Л—Е –Ї–Њ–ї–µ—Ж —Б –≥–ї—Г–±–Њ–Ї–Є–Љ –Ј–∞–њ–∞–і–µ–љ–Є–µ–Љ –Љ–µ–ґ—Е—А—П—Й–µ–≤—Л—Е –њ—А–Њ–Љ–µ–ґ—Г—В–Ї–Њ–≤, —А–∞—Б—И–Є—А–µ–љ–Є–µ –Є –Ј–∞–њ—Г—Б—В–µ–≤–∞–љ–Є–µ –±—А–Њ–љ—Е–Є–∞–ї—М–љ—Л—Е –ґ–µ–ї–µ–Ј, –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –Ј–∞–Њ—Б—В—А–µ–љ–љ–Њ—Б—В—М —И–њ–Њ—А –±—А–Њ–љ—Е–Њ–≤. –°—Г–±–∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ –Є –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –њ—А–Њ—П–≤–ї—П–ї–Є—Б—М –µ–µ –Є—Б—В–Њ–љ—З–µ–љ–Є–µ–Љ, –±–ї–µ–і–љ—Л–Љ —Ж–≤–µ—В–Њ–Љ, –Ј–∞–Њ—Б—В—А–µ–љ–Є–µ–Љ –Ї–∞—А–Є–љ—Л —В—А–∞—Е–µ–Є –Є —И–њ–Њ—А –±—А–Њ–љ—Е–Њ–≤, —Е–Њ—А–Њ—И–µ–є –Ї–Њ–љ—В—Г—А–Є—А—Г–µ–Љ–Њ—Б—В—М—О —Е—А—П—Й–µ–є –±—А–Њ–љ—Е–Њ–≤, —А–∞—Б—И–Є—А–µ–љ–Є–µ–Љ –Є—Е —Г—Б—В—М–µ–≤, –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є –і–Њ –±—А–Њ–љ—Е–Њ–≤ 5вАУ6-–≥–Њ –њ–Њ—А—П–і–Ї–∞. –†–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–∞—Б—М –Ї–Њ–љ—В–∞–Ї—В–љ–∞—П –Ї—А–Њ–≤–Њ—В–Њ—З–Є–≤–Њ—Б—В—М, —А–∞—Б—И–Є—А–µ–љ–Є–µ —Г—Б—В—М–µ–≤ –±—А–Њ–љ—Е–Є–∞–ї—М–љ—Л—Е –ґ–µ–ї–µ–Ј. –Ґ—А–∞—Е–µ–Њ–±—А–Њ–љ—Е–Є–∞–ї—М–љ–∞—П –і–Є—Б–Ї–Є–љ–µ–Ј–Є—П –њ—А–Њ—П–≤–ї—П–ї–∞—Б—М –њ—А–Њ–ї–∞–±–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Б—В–µ–љ–Њ–Ї —В—А–∞—Е–µ–Є –Є –±—А–Њ–љ—Е–Њ–≤ 2вАУ6-–≥–Њ –њ–Њ—А—П–і–Ї–∞.
–Ш–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤, –њ—А–µ—В–µ—А–њ–µ–≤—И–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –ї–µ—З–µ–љ–Є—П, –Љ—Л –Љ–Њ–ґ–µ–Љ –ї–Є—И—М –Њ—В–Љ–µ—В–Є—В—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Г 25 –Є–Ј 89 –±–Њ–ї—М–љ—Л—Е. –Ш–Ј–Љ–µ–љ–µ–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ—Л –њ–Њ –≤—Б–µ–є –њ—А–Њ—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є —З–∞—Б—В–Є –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ –і–µ—А–µ–≤–∞, –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–ї–Є—Б—М –≥–ї–∞–≤–љ—Л–Љ–Є –Є —Б–µ–≥–Љ–µ–љ—В–∞—А–љ—Л–Љ–Є –±—А–Њ–љ—Е–∞–Љ–Є, —Г–Љ–µ–љ—М—И–∞—П—Б—М –Ї –і–Є—Б—В–∞–ї—М–љ—Л–Љ –Њ—В–і–µ–ї–∞–Љ.
–Ь—Л –њ—Л—В–∞–ї–Є—Б—М –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М —З–∞—Б—В–Њ—В—Г —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г —Б—Г–±–∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ–Є –Є –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є —Б–ї–Є–Ј–Є—Б—В–Њ–є –≤ –≥—А—Г–њ–њ–∞—Е –і–Њ –Є –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П, –Њ–і–љ–∞–Ї–Њ –Њ–љ–Є –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ–Є.
–Ф–ї—П —А–∞—Б—И–Є—Д—А–Њ–≤–Ї–Є —Е–∞—А–∞–Ї—В–µ—А–∞ —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –Њ—В–і–µ–ї—М–љ—Л—Е —Г—З–∞—Б—В–Ї–∞—Е —Б—В–µ–љ–Ї–Є –±—А–Њ–љ—Е–Њ–≤ –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –±—А–Њ–љ—Е–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є–µ –±–Є–Њ–њ—Б–Є–Є.
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Ї–∞–ґ–і–∞—П —Б—В—А—Г–Ї—В—Г—А–∞ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є —Б—В–µ–љ–Ї–Є –≤—Л–њ–Њ–ї–љ—П–µ—В —Б–≤–Њ—О –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О, –љ–Њ —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–Њ–Ї—А–Њ–≤–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –Љ–Њ–ґ–љ–Њ —Б—З–Є—В–∞—В—М —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ—Л–Љ. –Т —Н—В–Њ–Љ –њ–ї–∞–љ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ —П–≤–ї—П–µ—В—Б—П —Б–Њ—Б—В–Њ—П–љ–Є–µ —А–µ—Б–љ–Є—В—З–∞—В–Њ–≥–Њ –њ–Њ–Ї—А–Њ–≤–∞ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –∞–≤—В–Њ—А–Њ–≤ [1, 2, 5, 6] —Б—З–Є—В–∞—О—В –љ–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є —А–µ—Б–љ–Є—З–µ–Ї, –∞ —В–µ–Љ –±–Њ–ї–µ–µ –њ–Њ—В–µ—А—О –Є—Е –љ–∞–Є–±–Њ–ї–µ–µ –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л–Љ –Љ–Њ–Љ–µ–љ—В–Њ–Љ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±—А–Њ–љ—Е–Є—В–∞. –Я–Њ—В–µ—А—П —А–µ—Б–љ–Є—В—З–∞—В–Њ–≥–Њ –Њ–Ї–∞–є–Љ–ї–µ–љ–Є—П –і–∞–ґ–µ –њ—А–Є –њ–Њ–ї–љ–Њ–Љ –Є–ї–Є —З–∞—Б—В–Є—З–љ–Њ–Љ —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є —Б–µ–Ї—А–µ—В–Њ–Њ–±—А–∞–Ј—Г—О—Й–µ–є —Д—Г–љ–Ї—Ж–Є–Є –±–Њ–Ї–∞–ї–Њ–≤–Є–і–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є –Є —Б–ї–Є–Ј–Є—Б—В–Њ-–±–µ–ї–Ї–Њ–≤—Л–Љ–Є –ґ–µ–ї–µ–Ј–∞–Љ–Є –њ–Њ–і—Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–∞—А—Г—И–µ–љ–Є—О –і–≤–Є–ґ–µ–љ–Є—П —Б–ї–Є–Ј–Є –њ–Њ –Ї–ї–µ—В–Њ—З–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ —Б–Њ–Ј–і–∞–µ—В—Б—П –њ–Њ—А–Њ—З–љ—Л–є –Ї—А—Г–≥, —В. –Ї. –љ–∞—А—Г—И–µ–љ–Є–µ –≤—Л–≤–µ–і–µ–љ–Є—П —Б–ї–Є–Ј–Є —Г–≥–љ–µ—В–∞–µ—В –µ–µ —Б–µ–Ї—А–µ—Ж–Є—О.
–Я—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–Њ–Ї—А–Њ–≤–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –≤—Л–і–µ–ї—П—О—В 4 —Д–Њ—А–Љ—Л –µ–≥–Њ —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, –Ї–∞–ґ–і–∞—П –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —Б–≤—П–Ј–∞–љ–∞ —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є —Б—В–µ–њ–µ–љ—М—О –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є.
–Ъ 1-–є —Д–Њ—А–Љ–µ –Њ—В–љ–Њ—Б—П—В —Б–ї—Г—З–∞–Є, –Ї–Њ–≥–і–∞ –њ–Њ–Ї—А–Њ–≤–љ—Л–є —Н–њ–Є—В–µ–ї–Є–є –Є–Љ–µ–µ—В —Е–∞—А–∞–Ї—В–µ—А –Љ–љ–Њ–≥–Њ—А—П–і–љ–Њ–≥–Њ —Ж–Є–ї–Є–љ–і—А–Є—З–µ—Б–Ї–Њ–≥–Њ. –ѓ–і—А–∞ –Ї–ї–µ—В–Њ–Ї –Њ–≤–∞–ї—М–љ—Л–µ, –Ї—А—Г–њ–љ—Л–µ, —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ —Б–≤–µ—В–ї—Л–µ, —Б–Њ–і–µ—А–ґ–∞—В –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Њ–і–љ–Њ —П–і—А—Л—И–Ї–Њ. –С–Њ–Ї–∞–ї–Њ–≤–Є–і–љ—Л–µ –Ї–ї–µ—В–Ї–Є –Ј–∞–њ–Њ–ї–љ–µ–љ—Л –±–Њ–ї—М—И–Є–Љ–Є —Б–≤–µ—В–ї—Л–Љ–Є –≥—А–∞–љ—Г–ї–∞–Љ–Є —Б–µ–Ї—А–µ—В–∞, –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Є–Ј –љ–Є—Е –≤—Л–і–µ–ї—П—О—В—Б—П –≤ –њ—А–Њ—Б–≤–µ—В. –Я–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Ї–ї–µ—В–Њ–Ї, –њ–µ—А–µ–њ–Њ–ї–љ–µ–љ–љ—Л—Е –≥—А–∞–љ—Г–ї–∞–Љ–Є, –≤—Л–±—Г—Е–∞–µ—В —Б–≤–Њ–µ–є ¬Ђ–≤–µ—А—И–Є–љ–Њ–є¬ї –≤ –њ—А–Њ—Б–≤–µ—В –±—А–Њ–љ—Е–∞. ¬Ђ–Я—Г—Б—В—Л–µ¬ї –±–Њ–Ї–∞–ї–Њ–≤–Є–і–љ—Л–µ –Ї–ї–µ—В–Ї–Є –≤—Б—В—А–µ—З–∞—О—В—Б—П –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ. –°–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –±–Њ–Ї–∞–ї–Њ–≤–Є–і–љ—Л—Е –Є —А–µ—Б–љ–Є—В—З–∞—В—Л—Е –Ї–ї–µ—В–Њ–Ї –љ–∞ —Н—В–Њ–є —Б—В–∞–і–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1:4; 1:5. –Ґ–∞–Ї–Є–µ –±–Є–Њ–њ—В–∞—В—Л –±—А–Њ–љ—Е–Њ–≤ –≤—Б—В—А–µ—З–∞—О—В—Б—П –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –±—А–Њ–љ—Е–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ–µ. –£ –љ–∞—И–Є—Е –±–Њ–ї—М–љ—Л—Е –Њ–љ–Є –љ–µ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М.
–Т—В–Њ—А–∞—П —Д–Њ—А–Љ–∞ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —В–µ–Љ, —З—В–Њ –њ—А–Є –Њ–±—Й–µ–Љ —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є —Б—В—А—Г–Ї—В—Г—А—Л –Љ–љ–Њ–≥–Њ—А—П–і–љ–Њ–≥–Њ —Ж–Є–ї–Є–љ–і—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –њ–Њ—П–≤–ї—П—О—В—Б—П –њ—А–Є–Ј–љ–∞–Ї–Є –∞–ї—М—В–µ—А–∞—Ж–Є–Є –Њ—В–і–µ–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї. –Ш–љ–Њ–≥–і–∞ –≤–Є–і–љ—Л —Ж–µ–ї—Л–µ –≥—А—Г–њ–њ—Л –±–Њ–Ї–∞–ї–Њ–≤–Є–і–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –Ј–∞–љ–Є–Љ–∞—О—Й–Є–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Г—О —З–∞—Б—В—М —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–Ї—А–Њ–≤–∞, –Є—Е –≥—А–∞–љ—Г–ї—Л –≤—Л–і–µ–ї—П—О—В—Б—П –≤ –њ—А–Њ—Б–≤–µ—В. –Т —Н–њ–Є—В–µ–ї–Є–Є –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В –і–µ–≥–µ–љ–µ—А–Є—А—Г—О—Й–Є–µ –Ї–ї–µ—В–Ї–Є. –С–∞–Ј–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є –Њ–±—Л—З–љ–Њ –Љ–∞–ї–Њ –Є–Ј–Љ–µ–љ–µ–љ—Л. –Ю—В–Љ–µ—З–∞–µ—В—Б—П —А–∞—Б—И–Є—А–µ–љ–Є–µ –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ—Л—Е –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤, –Ї–Њ—В–Њ—А—Л–µ –Ј–∞–њ–Њ–ї–љ–µ–љ—Л —Н–Ї—Б—Б—Г–і–∞—В–Њ–Љ.
–Ґ—А–µ—В—М—П —Д–Њ—А–Љ–∞ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —А–µ—Б–љ–Є—В—З–∞—В–Њ–≥–Њ –њ–Њ–Ї—А–Њ–≤–∞. –°—В–∞–і–Є—П –≥–Є–њ–µ—А—Б–µ–Ї—А–µ—Ж–Є–Є, –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ–Љ–∞—П —А–∞–љ–µ–µ –≤ –±–Њ–Ї–∞–ї–Њ–≤–Є–і–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е, —Б–Љ–µ–љ—П–µ—В—Б—П –Є—Е –і–µ–≥–µ–љ–µ—А–∞—Ж–Є–µ–є: –Ї–ї–µ—В–Ї–Є —Г–Љ–µ–љ—М—И–∞—О—В—Б—П –≤ –Њ–±—К–µ–Љ–µ. –Ф–µ–≥–µ–љ–µ—А–Є—А—Г—О—Й–Є–µ –Ї–ї–µ—В–Ї–Є –≤—Л–і–µ–ї—П—О—В—Б—П –≤ –њ—А–Њ—Б–≤–µ—В –±—А–Њ–љ—Е–∞. –Ш–Ј–Љ–µ–љ–µ–љ–Є—П –њ—А–Є —Н—В–Њ–є —Д–Њ—А–Љ–µ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Б—В—А—Г–Ї—В—Г—А—Л –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –Є –≤—Л—П–≤–ї–µ–љ–Є–µ–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –љ–∞—З–Є–љ–∞—О—Й–µ–є—Б—П –њ–ї–Њ—Б–Ї–Њ–Ї–ї–µ—В–Њ—З–љ–Њ–є –Љ–µ—В–∞–њ–ї–∞–Ј–Є–Є.
–Я—А–Є 4-–є —Д–Њ—А–Љ–µ –≤ —Н–њ–Є—В–µ–ї–Є–Є –Є–Љ–µ—О—В—Б—П —Г–±–µ–і–Є—В–µ–ї—М–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є –Є—Б—В–Є–љ–љ–Њ–є –µ–≥–Њ –Љ–µ—В–∞–њ–ї–∞–Ј–Є–Є. –†–µ—Б–љ–Є—В—З–∞—В–Њ–µ –Њ–Ї–∞–є–Љ–ї–µ–љ–Є–µ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В, —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–є –њ–ї–∞—Б—В —Б–Њ—Б—В–Њ–Є—В –Є–Ј –њ–ї–Њ—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї. –ѓ–і—А–∞ –њ–ї–Њ—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї –Ї—А—Г–њ–љ—Л–µ, –љ–µ–њ—А–∞–≤–Є–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, 1-—П —Д–Њ—А–Љ–∞ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ —Б—В—А–Њ–µ–љ–Є–µ–Љ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П, –Љ–Њ–≥—Г—В –љ–∞–±–ї—О–і–∞—В—М—Б—П –ї–Є—И—М –њ—А–Є–Ј–љ–∞–Ї–Є –≥–Є–њ–µ—А—Б–µ–Ї—А–µ—Ж–Є–Є. –Я—А–Є 2-–є —Д–Њ—А–Љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П –і–Њ–≤–Њ–ї—М–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –љ–Њ –Њ–љ–Є –љ–Њ—Б—П—В –Њ–±—А–∞—В–Є–Љ—Л–є —Е–∞—А–∞–Ї—В–µ—А. –Э–∞–Ї–Њ–љ–µ—Ж, 3-—П –Є 4-—П —Д–Њ—А–Љ—Л —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –≥–ї—Г–±–Њ–Ї–Є–Љ–Є –Є –љ–µ–Њ–±—А–∞—В–Є–Љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є —Н–њ–Є—В–µ–ї–Є—П.
–У–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±–Є–Њ–њ—В–∞—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –±—А–Њ–љ—Е–Њ–≤ –±–Њ–ї—М–љ—Л—Е —Б–Є–ї–Є–Ї–Њ–Ј–Њ–Љ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–ї–Є —Е–∞—А–∞–Ї—В–µ—А –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤: –≤—Л—П–≤–ї—П–ї–∞—Б—М –∞—В—А–Њ—Д–Є—П –Є –Љ–µ—В–∞–њ–ї–∞—Б—В–Є—З–µ—Б–Ї–∞—П –њ–µ—А–µ—Б—В—А–Њ–є–Ї–∞ –Ї–ї–µ—В–Њ–Ї –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П —Б–ї–Є–Ј–Є—Б—В–Њ–є –±—А–Њ–љ—Е–Њ–≤ –≤ –Љ–љ–Њ–≥–Њ—Б–ї–Њ–є–љ—Л–є –њ–ї–Њ—Б–Ї–Є–є, —Г–Љ–µ–љ—М—И–∞–ї–Є—Б—М —В–Њ–ї—Й–Є–љ–∞ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–≥–Њ –њ–ї–∞—Б—В–∞ –Є –µ–≥–Њ —А—П–і–љ–Њ—Б—В—М, –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Г—В–Њ–ї—Й–µ–љ–Є–µ –±–∞–Ј–∞–ї—М–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л.
–Ш–Ј—Г—З–µ–љ–Є–µ –±—А–Њ–љ—Е–Є–∞–ї—М–љ—Л—Е –±–Є–Њ–њ—В–∞—В–Њ–≤ –і–Њ –Є –њ–Њ—Б–ї–µ –Є–Ј—Г—З–∞–µ–Љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –Њ–±–љ–∞—А—Г–ґ–Є—В—М –Є–љ—В–µ—А–µ—Б–љ—Л–є —Д–µ–љ–Њ–Љ–µ–љ. –Т –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є–Ј—Г—З–∞–µ–Љ–Њ–µ –ї–µ—З–µ–љ–Є–µ, –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–∞ —А–µ–≤–µ—А—Б–Є—П –Љ–љ–Њ–≥–Њ—Б–ї–Њ–є–љ–Њ–≥–Њ –њ–ї–Њ—Б–Ї–Њ–≥–Њ –Є–ї–Є –∞—В—А–Њ—Д–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –≤ –Љ–љ–Њ–≥–Њ—А—П–і–љ—Л–є —Ж–Є–ї–Є–љ–і—А–Є—З–µ—Б–Ї–Є–є. –°—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ, —З—В–Њ –≥–Є–њ–µ—А–њ–ї–∞—Б—В–Є—З–µ—Б–Ї–∞—П —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є—П –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –њ–Њ—Б–ї–µ –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–∞ —З–∞—Й–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ —Б –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л–Љ –ї–µ—З–µ–љ–Є–µ–Љ. –Ч–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Є–Ј–Љ–µ–љ–µ–љ–Є–є –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –Њ—В –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Д–µ–љ–Њ—В–Є–њ–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 3.
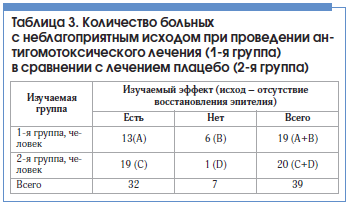
–°–Њ–≥–ї–∞—Б–љ–Њ —Н—В–Є–Љ –і–∞–љ–љ—Л–Љ —А–∞—Б—Б—З–Є—В–∞–љ—Л –Ї–ї—О—З–µ–≤—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї—Г—О —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—О (1вАУ—П –≥—А—Г–њ–њ–∞), –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –≥—А—Г–њ–њ–Њ–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ–ї–∞—Ж–µ–±–Њ (2-—П –≥—А—Г–њ–њ–∞) (—В–∞–±–ї. 4).
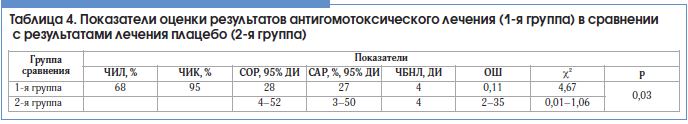
–†–µ–Ј—Г–ї—М—В–∞—В—Л, –њ—А–Є–≤–µ–і–µ–љ–љ—Л–µ –≤ —В–∞–±–ї–Є—Ж–∞—Е 3 –Є 4, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В –≤—Л—Б–Њ–Ї—Г—О, –љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И—Г—О —З–∞—Б—В–Њ—В—Г –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–Ї–Њ–≤–Њ–є –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ.
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —В–∞–±–ї–Є—Ж—Л 4 –Њ–±—А–∞—Й–∞–µ—В –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ —Б–ї–µ–і—Г—О—Й–µ–µ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ: –љ–µ–≤—Л—Б–Њ–Ї–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –°–Ю–† –Є –°–Р–†, –≤—Л—Б–Њ–Ї–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –≤–µ—А—Е–љ–Є—Е –≥—А–∞–љ–Є—Ж –Ф–Ш –і–ї—П –І–С–Э–Ы –Є –Ю–®. –≠—В–Њ –њ–Њ–Ј–≤–Њ–ї—П—В –Њ—В–Љ–µ—В–Є—В—М –ї–Є—И—М —В–µ–љ–і–µ–љ—Ж–Є—О –Ї —А–µ–≤–µ—А—Б–Є–Є –Љ–љ–Њ–≥–Њ—Б–ї–Њ–є–љ–Њ–≥–Њ –њ–ї–Њ—Б–Ї–Њ–≥–Њ –Є–ї–Є –∞—В—А–Њ—Д–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –≤ –Љ–љ–Њ–≥–Њ—А—П–і–љ—Л–є —Ж–Є–ї–Є–љ–і—А–Є—З–µ—Б–Ї–Є–є –љ–∞ —Д–Њ–љ–µ –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є. –С–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —В—А–µ–±—Г—О—В—Б—П —Ж–µ–ї–µ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ю–і–љ–∞–Ї–Њ –≤—Л—П–≤–ї–µ–љ–љ–Њ–µ –љ–∞–Љ–Є –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ —Г–ґ–µ —Б–µ–є—З–∞—Б –Ј–∞—Б–ї—Г–ґ–Є–≤–∞–µ—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ –≤–љ–Є–Љ–∞–љ–Є—П, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Є –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–Љ –ї–µ—З–µ–љ–Є–Є –Є –њ—А–Є–µ–Љ–µ –њ–ї–∞—Ж–µ–±–Њ —В–∞–Ї–Њ–≥–Њ —Д–µ–љ–Њ–Љ–µ–љ–∞ –љ–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ —Б–Є–ї–Є–Ї–Њ–Ј–∞
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ —Б–Є–ї–Є–Ї–Њ–Ј–∞ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–∞–Љ–Є —А–∞–љ–µ–µ [13].
–£ 62 —З–µ–ї–Њ–≤–µ–Ї —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ —Б–Є–ї–Є–Ї–Њ–Ј (—Б–Є–ї–Є–Ї–Њ–Ј 0-1) –њ–Њ—Б–ї–µ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є –њ—А–Њ–≤–µ–і–µ–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤: 32 –њ–∞—Ж–Є–µ–љ—В–∞ –њ–Њ–ї—Г—З–∞–ї–Є –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –Є 30 вАУ –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–∞—П —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М –њ—А–Є –Њ—З–µ—А–µ–і–љ–Њ–Љ –µ–ґ–µ–≥–Њ–і–љ–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є. –Я–∞—Ж–Є–µ–љ—В–∞–Љ —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ —Б–Є–ї–Є–Ї–Њ–Ј (—Б–Є–ї–Є–Ї–Њ–Ј 0-1) –љ–∞–Ј–љ–∞—З–∞–ї–Њ—Б—М –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –Ь—Г–Ї–Њ–Ј–∞ –Ї–Њ–Љ–њ–Њ–Ј–Є—В—Г–Љ 3 —А–∞–Ј–∞ –≤ –љ–µ–і–µ–ї—О —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ —З–µ—А–µ–Ј –і–µ–љ—М –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ –њ–Њ 2,2 –Љ–ї (9вАУ10 –∞–Љ–њ—Г–ї) –≤ —В–µ—З–µ–љ–Є–µ 3-—Е –љ–µ–і–µ–ї—М. –І–µ—А–µ–Ј 6 –Љ–µ—Б. –Ї—Г—А—Б –њ–Њ–≤—В–Њ—А—П–ї–Є –≤ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е.
–Ъ–Њ–љ–µ—З–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ–±–Њ—Б–љ–Њ–≤—Л–≤–∞–ї–Є—Б—М –і–µ–є—Б—В–≤–Є–µ–Љ –Є–Ј—Г—З–∞–µ–Љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –љ–∞ –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–µ —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Э–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –Є—Б—Е–Њ–і–Њ–Љ —Б—З–Є—В–∞–ї–Њ—Б—М –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ –і–Є–∞–≥–љ–Њ–Ј–∞ –≤ –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ —Б–Є–ї–Є–Ї–Њ–Ј, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –≤ —В–µ—З–µ–љ–Є–µ 2-—Е –ї–µ—В. –†–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї—Г—О —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—О (1-—П –≥—А—Г–њ–њ–∞), –њ–Њ–Ї–∞–Ј–∞–ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –љ–∞ —Д–Њ–љ–µ –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ–Ї–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ (2-—П –≥—А—Г–њ–њ–∞). –°–љ–Є–ґ–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞: 65%, –њ—А–Є –Ї–Њ–ї–µ–±–∞–љ–Є–Є –Ф–Ш 11вАУ88. –І–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ —Б–Є–ї–Є–Ї–Њ–Ј, –Ї–Њ—В–Њ—А—Л–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–µ—Б—В–Є –њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –≥–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤, —З—В–Њ–±—Л –љ–µ –і–Њ–њ—Г—Б—В–Є—В—М —А–∞–Ј–≤–Є—В–Є—П —Б–Є–ї–Є–Ї–Њ–Ј–∞ —Г –Њ–і–љ–Њ–≥–Њ –Є–Ј –љ–Є—Е, —А–∞–≤–љ–Њ 4 (–Ф–Ш 3вАУ34). –Ю—В–љ–Њ—И–µ–љ–Є–µ —И–∞–љ—Б–Њ–≤ 0,25 –њ—А–Є –Ф–Ш 0,07вАУ0,89 –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ (—А<0,05) —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В, —З—В–Њ —А–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Г–Љ–µ–љ—М—И–∞–ї—Б—П –≤ 4 —А–∞–Ј–∞.
–Т—Л–≤–Њ–і—Л
1. –Ф–∞–љ–Њ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Є–µ –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–Є–ї–Є–Ї–Њ–Ј–∞ –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є.
2. –¶–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–Є–ї–Є–Ї–Њ–Ј–∞ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –њ—А–Є–љ—Ж–Є–њ–∞–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є, –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–Њ—Б—В–Њ–≥–Њ —Б–ї–µ–њ–Њ–≥–Њ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
3. –Ю–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —Б–Є–ї–Є–Ї–Њ–Ј–Њ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Є –Њ–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Д—Г–љ–Ї—Ж–Є–Є –≤–љ–µ—И–љ–µ–≥–Њ –і—Л—Е–∞–љ–Є—П, –±—А–Њ–љ—Е–Њ—Д–Є–±—А–Њ—Б–Ї–Њ–њ–Є–Є –Є –≥–Є—Б—В–Њ–≥—А–∞–Љ–Љ –±–Є–Њ–њ—В–∞—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –±—А–Њ–љ—Е–Њ–≤.
4. –Я—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –≤ –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ —Б–Є–ї–Є–Ї–Њ–Ј. –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ —Б–љ–Є–ґ–∞–ї–∞ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞. –Э–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –Є—Б—Е–Њ–і–Њ–Љ —Б—З–Є—В–∞–ї—Б—П —Б–ї—Г—З–∞–є –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –і–Є–∞–≥–љ–Њ–Ј–∞ –≤ –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ —Б–Є–ї–Є–Ї–Њ–Ј, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –≤ —В–µ—З–µ–љ–Є–µ 2-—Е –ї–µ—В.
5. –°—Е–µ–Љ–∞ –ї–µ—З–µ–љ–Є—П —Б–Є–ї–Є–Ї–Њ–Ј–∞ –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є: –Ь—Г–Ї–Њ–Ј–∞ –Ї–Њ–Љ–њ–Њ–Ј–Є—В—Г–Љ 2 —А–∞–Ј–∞ –≤ –љ–µ–і–µ–ї—О —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ –≤ 3 –і–љ—П –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ –њ–Њ 2,2 –Љ–ї. –Т –њ—А–Њ–Љ–µ–ґ—Г—В–Ї–∞—Е –Љ–µ–ґ–і—Г –і–љ—П–Љ–Є –Є–љ—К–µ–Ї—Ж–Є–є —З–µ—А–µ–і–Њ–≤–∞—В—М —З–µ—А–µ–Ј –і–µ–љ—М 3-—А–∞–Ј–Њ–≤—Л–є –њ—А–Є–µ–Љ –њ–Њ 10 –Ї–∞–њ–µ–ї—М –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ы–Є–Љ—Д–Њ–Љ–Є–Њ–Ј–Њ—В –Є –Ґ—А–∞—Г–Љ–µ–ї—М –° –≤ 1/4 —Б—В–∞–Ї–∞–љ–∞ –≤–Њ–і—Л.
6. –°—Е–µ–Љ–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –∞–љ—В–Є–≥–Њ–Љ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є: –≤–≤–µ–і–µ–љ–Є–µ –Ь—Г–Ї–Њ–Ј–∞ –Ї–Њ–Љ–њ–Њ–Ј–Є—В—Г–Љ 2 —А–∞–Ј–∞ –≤ –љ–µ–і–µ–ї—О —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ –≤ 3 –і–љ—П –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ –њ–Њ 2,2 –Љ–ї (10 –∞–Љ–њ—Г–ї) 2 —А–∞–Ј–∞ –≤ –≥–Њ–і –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ —Б–Є–ї–Є–Ї–Њ–Ј (—Б–Є–ї–Є–Ї–Њ–Ј 0-1).
–Т–њ–µ—А–≤—Л–µ —Б—В–∞—В—М—П –±—Л–ї–∞ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–∞ –≤ –ґ—Г—А–љ–∞–ї–µ ¬Ђ–С–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Љ–µ–і–Є—Ж–Є–љ–∞¬ї. 2003. вДЦ 1. –°. 45вАУ55.












