–Т–≤–µ–і–µ–љ–Є–µ
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ –Љ–µ–і–Є—Ж–Є–љ—Л –Є —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є, —Г—В–≤–µ—А–ґ–і–µ–љ–Є–µ –Р.–Ф–ґ. –Ъ–Њ–Ї–Ї–Є–љ–Є—Б–∞ –Њ –Љ–µ–Ј–µ–љ—В–µ—А–Є–∞–ї—М–љ–Њ–Љ —В—А–Њ–Љ–±–Њ–Ј–µ: ¬Ђ–Ф–Є–∞–≥–љ–Њ–Ј –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–µ–љ, –њ—А–Њ–≥–љ–Њ–Ј –±–µ–Ј–љ–∞–і–µ–ґ–љ—Л–є –Є –ї–µ—З–µ–љ–Є–µ –±–µ—Б–њ–Њ–ї–µ–Ј–љ–Њ¬ї, –≤—Л—Б–Ї–∞–Ј–∞–љ–љ–Њ–µ –Є–Љ –≤ 1926 –≥., –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –љ–µ –њ–Њ—В–µ—А—П–ї–Њ —Б–≤–Њ–µ–є –∞–Ї—В—Г–∞–ї—М–љ–Њ—Б—В–Є [1]. –Я—А–Є—З–Є–љ–∞ —Н—В–Њ–≥–Њ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –≤ —В–Њ–Љ, —З—В–Њ –Њ—Б—В—А–Њ–µ –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–µ–Ј–µ–љ—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П (–Ю–Э–Ь–Ј–Ъ) –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г—О—В —Б–ї–Є—И–Ї–Њ–Љ –њ–Њ–Ј–і–љ–Њ, –љ–Њ –Є –≤ —В–Њ–Љ, —З—В–Њ –ї–µ—З–µ–±–љ–∞—П —В–∞–Ї—В–Є–Ї–∞ –љ–µ –≤–Ї–ї—О—З–∞–µ—В –≤ —Б–µ–±—П –і–Њ–ї–ґ–љ—Г—О –Є —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ—Г—О —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—О –њ–Њ—А–∞–ґ–µ–љ–љ—Л—Е –∞—А—В–µ—А–Є–є –Є—И–µ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ –Ї–Є—И–Ї–Є.
–Т–њ–µ—А–≤—Л–µ –њ—А–Њ–±–ї–µ–Љ–∞ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Њ—А–≥–∞–љ–Њ–≤ –њ–Є—Й–µ–≤–∞—А–µ–љ–Є—П –±—Л–ї–∞ –Њ–њ–Є—Б–∞–љ–∞ –Є—В–∞–ї—М—П–љ—Б–Ї–Є–Љ –њ–∞—В–Њ–ї–Њ–≥–Њ–∞–љ–∞—В–Њ–Љ–Њ–Љ A. Benivieni –≤ 1507 –≥., –Њ—Б–љ–Њ–≤–љ–Њ–є –ґ–µ –њ–µ—А–Є–Њ–і –Ї–ї–Є–љ–Є–Ї–Њ-–њ–∞—В–Њ–ї–Њ–≥–Њ–∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–Ј—Г—З–µ–љ–Є—П –љ–∞—А—Г—И–µ–љ–Є—П –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П –Ї–Є—И–Ї–Є –љ–∞—З–∞–ї—Б—П —Б —Б–µ—А–µ–і–Є–љ—Л XIX –≤. –Э–∞—З–∞–ї–Њ–Љ –µ–≥–Њ –Љ–Њ–ґ–љ–Њ —Б—З–Є—В–∞—В—М —Б–Њ–Њ–±—Й–µ–љ–Є–µ Desprez (1834 –≥.) –Њ —Б–ї—Г—З–∞–µ –Ї–Є—И–µ—З–љ–Њ–є –≥–∞–љ–≥—А–µ–љ—Л –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П –∞—А—В–µ—А–Є–є, –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–∞—О—Й–Є—Е –Ї–Є—И–Ї—Г. –Ш–і–µ—П –њ–µ—А–≤–Њ–≥–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ–Њ –≤–µ—А—Е–љ–µ–є –±—А—Л–ґ–µ–µ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є (–Т–С–Р) –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –Т.–У. –¶–µ–≥–µ-–Ь–∞–љ—В–µ–є—Д–µ–ї—О, –≤—Л—Б–Ї–∞–Ј–∞–≤—И–µ–Љ—Г –µ–µ –≤ 1913 –≥. –Т 1940 –≥. –ѓ.–С. –†—Л–≤–ї–Є–љ –њ–µ—А–≤—Л–Љ –Њ—Б—Г—Й–µ—Б—В–≤–Є–ї —В—А–Њ–Љ–±—Н–Ї—В–Њ–Љ–Є—О –њ—А–Є –Љ–µ–Ј–µ–љ—В–µ—А–Є–∞–ї—М–љ–Њ–Љ —В—А–Њ–Љ–±–Њ–Ј–µ, –љ–Њ –±–Њ–ї—М–љ–Њ–є —Г–Љ–µ—А –Љ–µ–љ–µ–µ —З–µ–Љ —З–µ—А–µ–Ј —Б—Г—В–Ї–Є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є. –Я–µ—А–≤—Г—О —Г—Б–њ–µ—И–љ—Г—О —В—А–Њ–Љ–±—Н–Љ–±–Њ–ї—Н–Ї—В–Њ–Љ–Є—О –њ—А–Є –Њ–Ї–Ї–ї—О–Ј–Є–Є –Т–С–Р –≤—Л–њ–Њ–ї–љ–Є–ї –≤ 1951 –≥. Steward, –∞ –≤ 1963 –≥. –Є–Љ –ґ–µ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –њ–µ—А–≤–Њ–µ –∞–Њ—А—В–Њ-–Љ–µ–Ј–µ–љ—В–µ—А–Є–∞–ї—М–љ–Њ–µ —И—Г–љ—В–Є—А–Њ–≤–∞–љ–Є–µ [2].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Ю–Э–Ь–Ј–Ъ –љ–µ —П–≤–ї—П–µ—В—Б—П —А–µ–і–Ї–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ. –Я–Њ –і–∞–љ–љ—Л–Љ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —З–∞—Б—В–Њ—В–∞ –Њ—Б—В—А–Њ–є –Њ–Ї–Ї–ї—О–Ј–Є–Є –Т–С–Р –≤ 1,5 —А–∞–Ј–∞ –≤—Л—И–µ, —З–µ–Љ —З–∞—Б—В–Њ—В–∞ —А–∞–Ј—А—Л–≤–∞ –∞–љ–µ–≤—А–Є–Ј–Љ—Л –±—А—О—И–љ–Њ–є –∞–Њ—А—В—Л. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б—В–∞—А—И–µ 75 –ї–µ—В –Ю–Э–Ь–Ј–Ъ —П–≤–ї—П–µ—В—Б—П –±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є –Њ—Б—В—А–Њ–≥–Њ –ґ–Є–≤–Њ—В–∞, —З–µ–Љ –Њ—Б—В—А—Л–є –∞–њ–њ–µ–љ–і–Є—Ж–Є—В [3]. –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В–∞–Ї—В–Є–Ї–Є –ї–µ—З–µ–љ–Є—П –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –≤–∞—А—М–Є—А—Г–µ—В –≤ –њ—А–µ–і–µ–ї–∞—Е 60вАУ97% [4вАУ6].
–Ю—Б–љ–Њ–≤–љ–Њ–є –Ј–∞–і–∞—З–µ–є –ї–µ—З–µ–љ–Є—П –Ю–Э–Ь–Ј–Ъ —П–≤–ї—П–µ—В—Б—П —Б–Ї–Њ—А–µ–є—И–µ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Т–С–Р –Є –µ–µ –≤–µ—В–≤–µ–є —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —А–µ–Ј–µ–Ї—Ж–Є–µ–є –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ –Ї–Є—И–Ї–Є, –і–Њ —А–∞–Ј–≤–Є—В–Є—П –њ–µ—А–Є—В–Њ–љ–Є—В–∞.
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –Є–Ј—Г—З–Є—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≥–Є–±—А–Є–і–љ–Њ–є —В–∞–Ї—В–Є–Ї–Є –ї–µ—З–µ–љ–Є—П —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Т–С–Р –Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –њ—А–Є –Ю–Э–Ь–Ј–Ъ.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Є –њ–∞—Ж–Є–µ–љ—В—Л —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–µ–Ј–µ–љ—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П (–Ъ–Ґ) —Б –Ї–Њ–љ—В—А–∞—Б—В–љ—Л–Љ —Г—Б–Є–ї–µ–љ–Є–µ–Љ. –Я–Њ –і–∞–љ–љ—Л–Љ –Ъ–Ґ, —Г 52 –±–Њ–ї—М–љ—Л—Е –≤—Л—П–≤–ї–µ–љ–Њ –Ј–љ–∞—З–Є–Љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Т–С–Р –Є –µ–µ –≤–µ—В–≤–µ–є —Б –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б—В–µ–љ–Ї–Є –Ї–Є—И–Ї–Є (—Б–љ–Є–ґ–µ–љ–Є–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —Б—В–µ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є, —Г—В–Њ–ї—Й–µ–љ–Є–µ –Є —Б–ї–Њ–Є—Б—В–Њ—Б—В—М, –љ–∞–ї–Є—З–Є–µ –≥–∞–Ј–∞ –≤ —Б—В–µ–љ–Ї–µ –Ї–Є—И–Ї–Є). –Т–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤ вАФ –Њ—В 52 –і–Њ 91 –≥–Њ–і–∞, –≤ —Б—А–µ–і–љ–µ–Љ 70,21¬±6,43 –≥–Њ–і–∞ (M¬±ѕГ). –Ь—Г–ґ—З–Є–љ —Б—А–µ–і–Є –љ–Є—Е –±—Л–ї–Њ 24 (46,2%), –ґ–µ–љ—Й–Є–љ вАФ 28 (53,8%).
–Ъ–Њ–Љ–њ—М—О—В–µ—А–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–∞—П –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П (–Ъ–Ґ–Р) –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ –≤–≤–µ–і–µ–љ–Є–µ–Љ –љ–µ–Є–Њ–љ–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞. –Ф–ї—П –≤–≤–µ–і–µ–љ–Є—П –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–є –Є–ї–Є —Ж–µ–љ—В—А–∞–ї—М–љ—Л–є –≤–µ–љ–Њ–Ј–љ—Л–µ –Ї–∞—В–µ—В–µ—А—Л, —Б–Ї–Њ—А–Њ—Б—В—М –≤–≤–µ–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 3вАУ5 –Љ–ї/—Б, –њ–Њ–і–∞—З–∞ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ–ґ–µ–Ї—В–Њ—А–∞. –Ф–ї—П –∞–љ–∞–ї–Є–Ј–∞ –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М –Љ—Г–ї—М—В–Є–њ–ї–∞–љ–∞—А–љ–∞—П –Є –Њ–±—К–µ–Љ–љ–∞—П 3D-—А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є—П. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ъ–Ґ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Б–Њ—Б—В–Њ—П–љ–Є–µ –Њ—А–≥–∞–љ–Њ–≤ –Є —Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б—В—А—Г–Ї—В—Г—А –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є, —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б—В–µ–љ–Ї–Є –Ї–Є—И–Ї–Є, –њ—А–Њ–≤–Њ–і–Є–ї–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г —Б –і—А—Г–≥–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —А–∞–Ј–Љ–µ—А—Л –Є —Г—А–Њ–≤–µ–љ—М –њ–Њ—А–∞–ґ–µ–љ–Є—П –Т–С–Р –Є –µ–µ –≤–µ—В–≤–µ–є, –љ–∞–ї–Є—З–Є–µ –≥–∞–Ј–∞ –≤ –њ–Њ—А—В–∞–ї—М–љ–Њ–є –Є –≤–µ—А—Е–љ–µ–±—А—Л–ґ–µ–µ—З–љ–Њ–є –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ–µ [7вАУ10].
–Я–Њ—Б–ї–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –Ъ–Ґ –Є –≤—Л—П–≤–ї–µ–љ–Є—П –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Ї–Є—И–Ї–Є —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ —Б–Є—Б—В–µ–Љ–µ –±—А—Л–ґ–µ–µ—З–љ—Л—Е –∞—А—В–µ—А–Є–є –±–Њ–ї—М–љ—Л–Љ –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–Љ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ–Љ. –Т–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ –≤—Л–њ–Њ–ї–љ—П–ї–Є —В—А–∞–љ—Б—Д–µ–Љ–Њ—А–∞–ї—М–љ—Л–Љ, –∞–Ї—Б–Є–ї–ї—П—А–љ—Л–Љ –Є–ї–Є –±—А–∞—Е–Є–∞–ї—М–љ—Л–Љ –і–Њ—Б—В—Г–њ–Њ–Љ. –Ь–µ–Ј–µ–љ—В–µ—А–Є–Ї–Њ–≥—А–∞—Д–Є—О –њ—А–Њ–≤–Њ–і–Є–ї–Є —В–Њ–ї—М–Ї–Њ –љ–∞ —Д–Њ–љ–µ –≤–љ—Г—В—А–Є–∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П 5000 –Ь–Х –≥–µ–њ–∞—А–Є–љ–∞. –Ф–ї—П –Љ–µ–Ј–µ–љ—В–µ—А–Є–Ї–Њ–≥—А–∞—Д–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ –Ї–∞—В–µ—В–µ—А—Л –і–Є–∞–Љ–µ—В—А–Њ–Љ 5вАУ6 Fr. –Т—Б–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤—Л–њ–Њ–ї–љ—П–ї–Є –≤ 2 –њ—А–Њ–µ–Ї—Ж–Є—П—Е. –Я—А–Њ–µ–Ї—Ж–Є—П 60вАУ90¬∞ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–ї–∞ —Е–Њ—А–Њ—И—Г—О –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—О —Г—Б—В—М—П –Т–С–Р.
–Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –њ–Њ—Б–ї–µ —Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –≤—Л–њ–Њ–ї–љ—П–ї–Є —А–µ–≤–Є–Ј–Є—О –Њ—А–≥–∞–љ–Њ–≤ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є —Б —А–µ–Ј–µ–Ї—Ж–Є–µ–є –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е —Г—З–∞—Б—В–Ї–Њ–≤ –Ї–Є—И–Ї–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Т—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ –≤–љ–∞—З–∞–ї–µ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—П –Т–С–Р (—В–∞–±–ї. 1).

–£ 48 (92,3%) –±–Њ–ї—М–љ—Л—Е –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ –Њ–Ї–Ї–ї—О–Ј–Є—П –≤ —Б–Є—Б—В–µ–Љ–µ –Т–С–Р, –≤ 3 (5,7%) —Б–ї—Г—З–∞—П—Е –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є–є —Б—В–µ–љ–Њ–Ј –≤ –±–∞—Б—Б–µ–є–љ–µ –Т–С–Р —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ–Њ –Ї–Њ–ї–ї–∞—В–µ—А–∞–ї—П–Љ, —Г 1 (1,9%) –±–Њ–ї—М–љ–Њ–≥–Њ вАФ —Б–њ–∞–Ј–Љ –њ–Њ–і–≤–Ј–і–Њ—И–љ–Њ-–Њ–±–Њ–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –љ–µ–Ї—А–Њ–Ј–Њ–Љ –њ–Њ–і–≤–Ј–і–Њ—И–љ–Њ–є –Ї–Є—И–Ї–Є. –С–Њ–ї—М–љ—Л–Љ —Б –Њ–Ї–Ї–ї—О–Ј–Є–Њ–љ–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –≤ —Б–Є—Б—В–µ–Љ–µ –Т–С–Р –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –њ–Њ–њ—Л—В–Ї–∞ —Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–≥–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Т–С–Р. –Т 39 (81,2%) —Б–ї—Г—З–∞—П—Е –Є–Ј 48 –≤—Л–њ–Њ–ї–љ—П–ї–Є —А–µ–Ї–∞–љ–∞–ї–Є–Ј–∞—Ж–Є—О –Т–С–Р –Ї–Њ—А–Њ–љ–∞—А–љ—Л–Љ–Є –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ–≤–Њ–і–љ–Є–Ї–∞–Љ–Є 0,14 –і—О–є–Љ–∞ –Є 0,35 –і—О–є–Љ–∞. –Я–Њ–і–∞–≤–ї—П—О—Й–µ–Љ—Г –±–Њ–ї—М—И–Є–љ—Б—В–≤—Г (39 –±–Њ–ї—М–љ—Л–Љ) –≤—Л–њ–Њ–ї–љ—П–ї–Є –∞—Б–њ–Є—А–∞—Ж–Є–Њ–љ–љ—Г—О —В—А–Њ–Љ–±—Н–Ї—Б—В—А–∞–Ї—Ж–Є—О —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Љ–∞—Б—Б –Є–Ј –Т–С–Р –Є –µ–µ –≤–µ—В–≤–µ–є, —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–µ –Љ–∞—Б—Б—Л —Г–і–∞–ї–Њ—Б—М –њ–Њ–ї—Г—З–Є—В—М –≤ 34 (70,8%) —Б–ї—Г—З–∞—П—Е. –Ф–∞–ї–µ–µ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ –±–∞–ї–ї–Њ–љ–љ–∞—П –∞–љ–≥–Є–Њ–њ–ї–∞—Б—В–Є–Ї–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —В—А–Њ–Љ–±–Њ–∞—Б–њ–Є—А–∞—Ж–Є–µ–є, –≤ 9 (18,7%) —Б–ї—Г—З–∞—П—Е вАФ —Б–Њ —Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Т–С–Р –Є –µ–µ –≤–µ—В–≤–µ–є. 3 –±–Њ–ї—М–љ—Л–Љ —Б–Њ –Ј–љ–∞—З–Є–Љ—Л–Љ —Б—В–µ–љ–Њ–Ј–Њ–Љ –Т–С–Р –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М –±–∞–ї–ї–Њ–љ–љ–∞—П –∞–љ–≥–Є–Њ–њ–ї–∞—Б—В–Є–Ї–∞ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є–µ–Љ. –Я–∞—Ж–Є–µ–љ—В—Г —Б –љ–µ–Њ–Ї–Ї–ї—О–Ј–Є–Њ–љ–љ–Њ–є —Д–Њ—А–Љ–Њ–є –љ–∞—А—Г—И–µ–љ–Є—П –Љ–µ–Ј–µ–љ—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П (—Б–њ–∞–Ј–Љ —В–µ—А–Љ–Є–љ–∞–ї—М–љ—Л—Е –≤–µ—В–≤–µ–є –Т–С–Р —Б –љ–µ–Ї—А–Њ–Ј–Њ–Љ –њ–Њ–і–≤–Ј–і–Њ—И–љ–Њ–є –Ї–Є—И–Ї–Є) —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ –≤ –Т–С–Р –±—Л–ї –≤–≤–µ–і–µ–љ –њ–∞–њ–∞–≤–µ—А–Є–љ —Б –љ–Є—В—А–Њ–≥–ї–Є—Ж–µ—А–Є–љ–Њ–Љ —Б –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–Љ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ. –Я–Њ—Б–ї–µ —Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —А–µ–≤–Є–Ј–Є—П –Ї–Є—И–Ї–Є —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —А–µ–Ј–µ–Ї—Ж–Є–µ–є –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞.
–Ю—В–Ї—А—Л—В–Њ–µ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤ 52 (100%) —Б–ї—Г—З–∞—П—Е. –Я–∞–ї–ї–Є–∞—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ (–ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є—П) –њ—А–Њ–≤–µ–і–µ–љ–Њ 6 (11,5%) –±–Њ–ї—М–љ—Л–Љ –≤ —Б–≤—П–Ј–Є —Б —В–Њ—В–∞–ї—М–љ—Л–Љ –љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є.
–†–µ–Ј–µ–Ї—Ж–Є—П –Ї–Є—И–Ї–Є –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –≤ 46 (89,5%) —Б–ї—Г—З–∞—П—Е. –Я—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В—М —А–µ–Ј–µ–Ї—Ж–Є–Є –Ј–∞–≤–Є—Б–µ–ї–∞ –Њ—В —Г—А–Њ–≤–љ—П –Њ–Ї–Ї–ї—О–Ј–Є–Є –Є —Б—А–Њ–Ї–Њ–≤ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Т–С–Р (—В–∞–±–ї. 2).
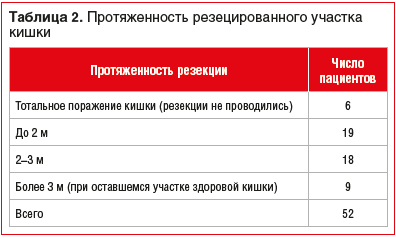
–Т—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ —А–µ–Ј–µ–Ї—Ж–Є—П –Ї–Є—И–Ї–Є –Ј–∞–≤–µ—А—И–∞–ї–∞—Б—М —Г—И–Є–≤–∞–љ–Є–µ–Љ –љ–∞–≥–ї—Г—Е–Њ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Є –і–Є—Б—В–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–Њ–≤ –≤ —Б–≤—П–Ј–Є —Б –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –Ј–∞ –Ї–Њ—А–Њ—В–Ї–Њ–µ –≤—А–µ–Љ—П –њ–Њ—Б–ї–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –∞–і–µ–Ї–≤–∞—В–љ–Њ –Њ—Ж–µ–љ–Є–≤–∞—В—М –ґ–Є–Ј–љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї–Є—И–Ї–Є.
–Я–Њ—Б–ї–µ —А–µ–Ј–µ–Ї—Ж–Є–Є –Ї–Є—И–Ї–Є –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –Є–љ—В—Г–±–∞—Ж–Є—П –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–Њ–≤ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є —Б —Ж–µ–ї—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–Њ–≤—Л—И–µ–љ–Є—П –Є–љ—В—А–∞–ї—О–Љ–Є–љ–∞—А–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, –≤–Ј–і—Г—В–Є—П –Ї–Є—И–µ—З–љ—Л—Е –њ–µ—В–µ–ї—М, —Б–њ–∞–Ј–Љ–∞ –Є–љ—В—А–∞–Љ—Г—А–∞–ї—М–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ –Є –Њ—В–Ї—А—Л—В–Є—П –∞—А—В–µ—А–Є–Њ–ї–Њ–≤–µ–љ—Г–ї—П—А–љ—Л—Е —И—Г–љ—В–Њ–≤, —З—В–Њ –≤ –Є—В–Њ–≥–µ –±–µ–Ј –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –Ј–Њ–љ–і–Њ–≤–Њ–є –і–µ–Ї–Њ–Љ–њ—А–µ—Б—Б–Є–Є –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –≤–њ–ї–Њ—В—М –і–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П –Ј–Њ–љ —Б–µ–≥–Љ–µ–љ—В–∞—А–љ—Л—Е –љ–µ–Ї—А–Њ–Ј–Њ–≤ [11].
–Т—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —А–∞–Ј–≤–Є—В–Є—П –Є–љ—В—А–∞–∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є –Є —Б–Њ–Ї—А–∞—Й–µ–љ–Є—П –≤—А–µ–Љ–µ–љ–Є –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є—О –Ј–∞–Ї–∞–љ—З–Є–≤–∞–ї–Є –љ–∞–ї–Њ–ґ–µ–љ–Є–µ–Љ –і–µ–Ї–Њ–Љ–њ—А–µ—Б—Б–Є–≤–љ—Л—Е –њ—А–Њ–≤–Є–Ј–Њ—А–љ—Л—Е —И–≤–Њ–≤.
–Ю–њ–µ—А–∞—Ж–Є–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є —З–µ—А–µ–Ј 18вАУ24 —З, –њ—А–Є—З–µ–Љ –≤ 14 (26,9%) –љ–∞–±–ї—О–і–µ–љ–Є—П—Е –њ—А–Є –њ—А–Њ—Е–Њ–і–Є–Љ–Њ–є –Т–С–Р –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–∞—Б—М –њ–Њ–≤—В–Њ—А–љ–∞—П —А–µ–Ј–µ–Ї—Ж–Є—П –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ –Ї–Є—И–Ї–Є, –≤ 3 (5,7%) —Б–ї—Г—З–∞—П—Е –њ—А–Є —А–µ—В—А–Њ–Љ–±–Њ–Ј–µ вАФ –њ–Њ–≤—В–Њ—А–љ–Њ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞. –Я—А–Є —Н—В–Њ–Љ –≤—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–є —А–µ–Ј–µ–Ї—Ж–Є–Є –±—Л–ї–Њ –љ–∞–ї–Њ–ґ–µ–љ–Њ –Љ–µ–ґ–Ї–Є—И–µ—З–љ–Њ–µ —Б–Њ—Г—Б—В—М–µ. –Я–Њ—Б–ї–µ —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ –Ї–Є—И–Ї–Є —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М —Д—Г–љ–Ї—Ж–Є—О –њ–Њ—З–µ–Ї –Є –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ—П—В—М –Љ–µ—В–Њ–і—Л —Н–Ї—Б—В—А–∞–Ї–Њ—А–њ–Њ—А–∞–ї—М–љ–Њ–є –і–µ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –±–Њ—А–Њ—В—М—Б—П —Б —Н–љ–і–Њ—В–Њ–Ї—Б–Є–Ї–Њ–Ј–Њ–Љ. –Ф–∞–љ–љ—Л–є –Љ–µ—В–Њ–і –±—Л–ї –њ—А–Є–Љ–µ–љ–µ–љ –≤ 2 (3,8%) —Б–ї—Г—З–∞—П—Е, –≤ –Ї–Њ—В–Њ—А—Л—Е –њ–Њ—Б–ї–µ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Т–С–Р —А–∞–Ј–≤–Є–ї–∞—Б—М –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є—П –Є —В—П–ґ–µ–ї—Л–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞.
–Ы–µ—В–∞–ї—М–љ—Л–Љ –Є—Б—Е–Њ–і–Њ–Љ –Ј–∞–Ї–Њ–љ—З–Є–ї–Њ—Б—М –ї–µ—З–µ–љ–Є–µ 23 (44,2%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –£ 6 –Є–Ј –љ–Є—Е –њ–Њ—Б–ї–µ —Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –њ—А–Є –ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є–Є –±—Л–ї –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ —В–Њ—В–∞–ї—М–љ—Л–є –љ–µ–Ї—А–Њ–Ј —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є, —Б–Љ–µ—А—В—М –±–Њ–ї—М–љ—Л—Е –±—Л–ї–∞ —Б–≤—П–Ј–∞–љ–∞ —Б –љ–∞—А–∞—Б—В–∞—О—Й–µ–є –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–µ–є. –£ 2 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–∞–Ј–≤–Є–ї—Б—П —А–µ—В—А–Њ–Љ–±–Њ–Ј —Б –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М—О –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —А–µ–Ј–µ–Ї—Ж–Є–Є —Г—З–∞—Б—В–Ї–∞ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є. –£ 14 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –±—Л–ї–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Њ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Є –≤–Њ–Ј—А–∞—Б—В–Њ–Љ, —Б–Љ–µ—А—В—М —Г —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е –љ–∞—Б—В—Г–њ–Є–ї–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –љ–∞—А–∞—Б—В–∞—О—Й–µ–є —Б–µ—А–і–µ—З–љ–Њ-–ї–µ–≥–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є. –£ 1 –±–Њ–ї—М–љ–Њ–≥–Њ —Б —В—А–Њ–Љ–±–Њ–Ј–Њ–Љ –≥–ї—Г–±–Њ–Ї–Є—Е –≤–µ–љ –њ—А–∞–≤–Њ–є –љ–Є–ґ–љ–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –ї–µ—В–∞–ї—М–љ—Л–є –Є—Б—Е–Њ–і –±—Л–ї —Б–≤—П–Ј–∞–љ —Б –њ–Њ–≤—В–Њ—А–љ–Њ–є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–µ–є –ї–µ–≥–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є –Є –љ–∞—А–∞—Б—В–∞—О—Й–µ–є –ї–µ–≥–Њ—З–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є. –°—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В—М —А–µ–Ј–µ–Ї—Ж–Є–Є –Ї–Є—И–Ї–Є —Г –Ї–Њ—В–Њ—А—Л—Е —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ –±–Њ–ї–µ–µ 3 –Љ, —Б–Љ–µ—А—В—М –љ–∞—Б—В—Г–њ–Є–ї–∞ –≤ 5 —Б–ї—Г—З–∞—П—Е, —Б –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В—М—О —А–µ–Ј–µ–Ї—Ж–Є–Є 2вАУ3 –Љ вАФ –≤ 7 —Б–ї—Г—З–∞—П—Е, –Љ–µ–љ–µ–µ 2 –Љ вАФ –≤ 5 —Б–ї—Г—З–∞—П—Е.
–Ш–Ј —В–∞–±–ї–Є—Ж—Л 3 –≤–Є–і–љ–Њ, —З—В–Њ —Б—А–µ–і–љ–µ–µ —З–Є—Б–ї–Њ –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ –≤ 1-–µ —Б—Г—В —Г –≤—Л–ґ–Є–≤—И–Є—Е —А–∞–Ј–ї–Є—З–љ–Њ (p<0,05). –Т—Л—П–≤–ї–µ–љ–∞ —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Б—А–µ–і–љ–µ–≥–Њ —З–Є—Б–ї–∞ –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ —Г –≤—Л–ґ–Є–≤—И–Є—Е –±–Њ–ї—М–љ—Л—Е –Є –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О вАФ —Г —Г–Љ–µ—А—И–Є—Е –±–Њ–ї—М–љ—Л—Е. –Ґ–∞–Ї–ґ–µ –≤—Л—П–≤–ї–µ–љ–∞ —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Б—А–µ–і–љ–µ–≥–Њ —З–Є—Б–ї–∞ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Г –≤—Л–ґ–Є–≤—И–Є—Е –Є —Г–Љ–µ—А—И–Є—Е –±–Њ–ї—М–љ—Л—Е –Ї 4-–Љ —Б—Г—В, —З—В–Њ, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –≥–µ–Љ–Њ–і–Є–ї—О—Ж–Є–µ–є. –£ –≤—Л–ґ–Є–≤—И–Є—Е –±–Њ–ї—М–љ—Л—Е —Б—А–µ–і–љ–µ–µ —З–Є—Б–ї–Њ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Б 4-—Е —Б—Г—В –≤–Њ–Ј—А–∞—Б—В–∞–ї–Њ –Є –Ї 12-–Љ —Б—Г—В –і–Њ—Б—В–Є–≥–∞–ї–Њ –≤—Л—Б–Њ–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є. –£ —Г–Љ–µ—А—И–Є—Е –±–Њ–ї—М–љ—Л—Е —Б—А–µ–і–љ–µ–µ —З–Є—Б–ї–Њ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Б 4-—Е —Б—Г—В —В–∞–Ї–ґ–µ –≤–Њ–Ј—А–∞—Б—В–∞–ї–Њ, –љ–Њ –Ї 12-–Љ —Б—Г—В —Б–љ–Є–ґ–∞–ї–Њ—Б—М (—А<0,01), —З—В–Њ, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, —Б–≤—П–Ј–∞–љ–Њ —Б –≥–µ–Љ–Њ–ї–Є–Ј–Њ–Љ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤. –Я–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—О —Б—А–µ–і–љ–µ–≥–Њ —Г—А–Њ–≤–љ—П –ї–∞–Ї—В–∞—В–∞ –Љ–Њ–ґ–љ–Њ —Б—Г–і–Є—В—М –Њ –љ–∞—А—Г—И–µ–љ–Є–Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Є —В–Ї–∞–љ–µ–≤–Њ–є –≥–Є–њ–Њ–Ї—Б–Є–Є: —Г –≤—Л–ґ–Є–≤—И–Є—Е –Є —Г–Љ–µ—А—И–Є—Е –Ї 4-–Љ —Б—Г—В —Б—А–µ–і–љ–Є–є —Г—А–Њ–≤–µ–љ—М –ї–∞–Ї—В–∞—В–∞ —Б–љ–Є–ґ–∞–ї—Б—П (p>0,05), –і–∞–ї–µ–µ —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –µ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—О —Г –≤—Л–ґ–Є–≤—И–Є—Е –±–Њ–ї—М–љ—Л—Е —Б–Њ—Е—А–∞–љ—П–ї–∞—Б—М, —В–Њ–≥–і–∞ –Ї–∞–Ї —Г —Г–Љ–µ—А—И–Є—Е –±–Њ–ї—М–љ—Л—Е —Б—А–µ–і–љ–Є–є —Г—А–Њ–≤–µ–љ—М –ї–∞–Ї—В–∞—В–∞ –њ–Њ–≤—Л—И–∞–ї—Б—П –Ї 12-–Љ —Б—Г—В (—А<0,05). –Ш–Ј–Љ–µ–љ–µ–љ–Є–µ —Б—А–µ–і–љ–µ–≥–Њ —Г—А–Њ–≤–љ—П –±–µ–ї–Ї–∞ –Њ—В—А–∞–ґ–∞–µ—В –њ—А–Њ—Ж–µ—Б—Б –Ї–∞—В–∞–±–Њ–ї–Є–Ј–Љ–∞: –љ–∞ 1-–µ —Б—Г—В —Г –≤—Л–ґ–Є–≤—И–Є—Е –Є –Ї 4-–Љ —Б—Г—В —Г —Г–Љ–µ—А—И–Є—Е —Б—А–µ–і–љ–Є–є —Г—А–Њ–≤–µ–љ—М –Њ–±—Й–µ–≥–Њ –±–µ–ї–Ї–∞ –њ–Њ–≤—Л—И–∞–ї—Б—П (p>0,05), –Ї 12-–Љ —Б—Г—В –Њ–љ –љ–∞—З–Є–љ–∞–ї —Б–љ–Є–ґ–∞—В—М—Б—П —Г —Г–Љ–µ—А—И–Є—Е, —Г –≤—Л–ґ–Є–≤—И–Є—Е вАФ –њ–Њ–≤—Л—И–∞–ї—Б—П (—А<0,01).
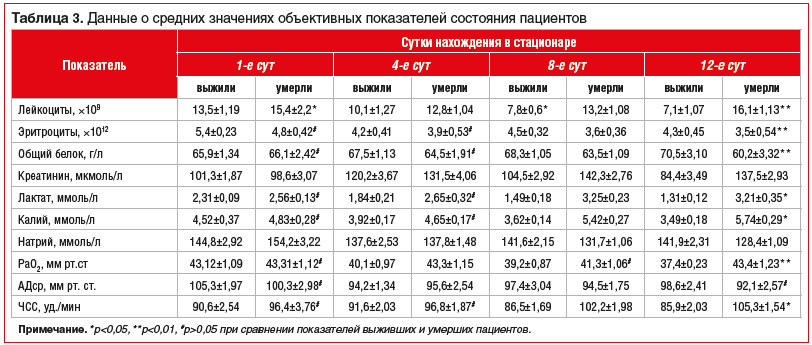
–Я–Њ –і–Є–љ–∞–Љ–Є–Ї–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Ї–∞–ї–Є—П –Є –љ–∞—В—А–Є—П –≤ –Ї—А–Њ–≤–Є –Љ–Њ–ґ–љ–Њ —Б—Г–і–Є—В—М –Њ –љ–∞—А—Г—И–µ–љ–Є–Є –≤–Њ–і–љ–Њ-—Н–ї–µ–Ї—В—А–Њ–ї–Є—В–љ–Њ–≥–Њ –±–∞–ї–∞–љ—Б–∞, –њ—А–Њ—П–≤–ї—П—О—Й–µ–≥–Њ—Б—П –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –Є–Њ–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –Ї—А–Њ–≤–Є. –Ґ–∞–Ї, –љ–∞–њ—А–Є–Љ–µ—А, –Ї 4-–Љ —Б—Г—В —Б—А–µ–і–љ–Є–є —Г—А–Њ–≤–µ–љ—М –Ї–∞–ї–Є—П —Б–љ–Є–ґ–∞–ї—Б—П –Є —Г –≤—Л–ґ–Є–≤—И–Є—Е, –Є —Г —Г–Љ–µ—А—И–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –µ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—О —Г –≤—Л–ґ–Є–≤—И–Є—Е –±–Њ–ї—М–љ—Л—Е —Б–Њ—Е—А–∞–љ—П–ї–∞—Б—М –Є –љ–∞ 12-–µ —Б—Г—В, —В–Њ–≥–і–∞ –Ї–∞–Ї —Г —Г–Љ–µ—А—И–Є—Е –±–Њ–ї—М–љ—Л—Е –Њ–љ –њ–Њ–≤—Л—И–∞–ї—Б—П –Ї 12-–Љ —Б—Г—В (—А<0,05). –Э–∞—А—Г—И–µ–љ–Є—П –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є –≤ —В–Ї–∞–љ—П—Е –≤—Л—П–≤–ї—П—О—В—Б—П –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ –≥–∞–Ј–Њ–≤–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –Ї—А–Њ–≤–Є. –Ґ–∞–Ї, –љ–∞–њ—А–Є–Љ–µ—А, –Ї 8-–Љ —Б—Г—В —Б—А–µ–і–љ–Є–є —Г—А–Њ–≤–µ–љ—М –њ–∞—А—Ж–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –≤ –≤–µ–љ–Њ–Ј–љ–Њ–є –Ї—А–Њ–≤–Є —Б–љ–Є–ґ–∞–ї—Б—П —Г –≤—Л–ґ–Є–≤—И–Є—Е –±–Њ–ї–µ–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ, —З–µ–Љ —Г —Г–Љ–µ—А—И–Є—Е (p>0,05), –і–∞–ї–µ–µ —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –µ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—О —Б–Њ—Е—А–∞–љ—П–ї–∞—Б—М —Г –≤—Л–ґ–Є–≤—И–Є—Е –±–Њ–ї—М–љ—Л—Е, —Г —Г–Љ–µ—А—И–Є—Е –±–Њ–ї—М–љ—Л—Е –Њ–љ –Ї 12-–Љ —Б—Г—В –њ–Њ–≤—Л—И–∞–ї—Б—П (—А<0,01).
–°—А–µ–і–љ–µ–µ –Р–Ф –љ–∞ 1-–µ —Б—Г—В —Г –≤—Л–ґ–Є–≤—И–Є—Е –±—Л–ї–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤—Л—И–µ, —З–µ–Љ —Г —Г–Љ–µ—А—И–Є—Е (p>0,05), –Ї 12-–Љ —Б—Г—В —Б–Њ—Е—А–∞–љ—П–ї–∞—Б—М —В–∞–Ї–∞—П –ґ–µ —В–µ–љ–і–µ–љ—Ж–Є—П. –І–°–° –љ–∞ 1-–µ —Б—Г—В —Г –≤—Л–ґ–Є–≤—И–Є—Е –±—Л–ї–∞ –љ–Є–ґ–µ, —З–µ–Љ —Г —Г–Љ–µ—А—И–Є—Е (p>0,05), –Ї 4-–Љ —Б—Г—В —Б—А–µ–і–љ–Є–є —Г—А–Њ–≤–µ–љ—М –І–°–° —Б–љ–Є–ґ–∞–ї—Б—П –Є —Г –≤—Л–ґ–Є–≤—И–Є—Е, –Є —Г —Г–Љ–µ—А—И–Є—Е –±–Њ–ї—М–љ—Л—Е (p>0,05), –і–∞–ї–µ–µ –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –І–°–° —Г –≤—Л–ґ–Є–≤—И–Є—Е –Є –Ї —А–Њ—Б—В—Г —Б—А–µ–і–љ–µ–≥–Њ —Г—А–Њ–≤–љ—П –І–°–° —Г —Г–Љ–µ—А—И–Є—Е (—А<0,05).
–Ф–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ —И–Ї–∞–ї–µ —В—П–ґ–µ—Б—В–Є –Њ—А–≥–∞–љ–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є SOFA –Њ—В—А–∞–ґ–∞–µ—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–є –Њ—А–≥–∞–љ–Њ–≤ –Є —Б–Є—Б—В–µ–Љ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е. –°—А–µ–і–љ–Є–є –±–∞–ї–ї –њ–Њ —И–Ї–∞–ї–µ SOFA –љ–∞ 1-–µ —Б—Г—В —Г –≤—Л–ґ–Є–≤—И–Є—Е —Б–Њ—Б—В–∞–≤–ї—П–ї 2,8¬±0,28, —Г —Г–Љ–µ—А—И–Є—Е вАФ 3,71¬±0,49 (p>0,05). –Э–∞ 3-–Є —Б—Г—В —Б—А–µ–і–љ–Є–є –±–∞–ї–ї —Г —Г–Љ–µ—А—И–Є—Е –Є –≤—Л–ґ–Є–≤—И–Є—Е –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Є–Ј–Љ–µ–љ—П–ї—Б—П, –і–∞–ї–µ–µ –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –µ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—О: —Г –≤—Л–ґ–Є–≤—И–Є—Е –±–Њ–ї—М–љ—Л—Е –љ–∞ 8-–µ —Б—Г—В –Њ–љ —Б–Њ—Б—В–∞–≤–ї—П–ї 2,52¬±0,81, —Г —Г–Љ–µ—А—И–Є—Е вАФ 6,3¬±0,37 (—А<0,01).
–£ –±–Њ–ї—М–љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е –њ—А–Є–Љ–µ–љ—П–ї–∞—Б—М –≥–Є–±—А–Є–і–љ–∞—П —В–∞–Ї—В–Є–Ї–∞ –ї–µ—З–µ–љ–Є—П, –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–Є–ї–∞ 44,2%.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ
–С–Њ–ї—М–љ–Њ–є –Р., 79 –ї–µ—В, –њ–Њ—Б—В—Г–њ–Є–ї —Б –ґ–∞–ї–Њ–±–∞–Љ–Є –љ–∞ –±–Њ–ї–Є –≤ —Н–њ–Є–≥–∞—Б—В—А–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є, –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–µ –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –≤ –њ—А–∞–≤–Њ–Љ –њ–Њ–і—А–µ–±–µ—А—М–µ, —В–Њ—И–љ–Њ—В—Г, —А–≤–Њ—В—Г –Є –і–≤—Г–Ї—А–∞—В–љ—Л–є –ґ–Є–і–Ї–Є–є —Б—В—Г–ї. –С–Њ–ї–µ–љ –≤ —В–µ—З–µ–љ–Є–µ 15 —З. –Ш–Ј –∞–љ–∞–Љ–љ–µ–Ј–∞ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –±–Њ–ї—М–љ–Њ–є —Б—В—А–∞–і–∞–µ—В –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є. –Ш–С–°: —Б—В–µ–љ–Њ–Ї–∞—А–і–Є—П –љ–∞–њ—А—П–ґ–µ–љ–Є—П 2-–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞. –Я–Њ—Б—В–Є–љ—Д–∞—А–Ї—В–љ—Л–є –Ї–∞—А–і–Є–Њ—Б–Ї–ї–µ—А–Њ–Ј, –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–∞—П –∞—А–Є—В–Љ–Є—П. –Р–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –љ–µ –њ—А–Є–љ–Є–Љ–∞–ї.
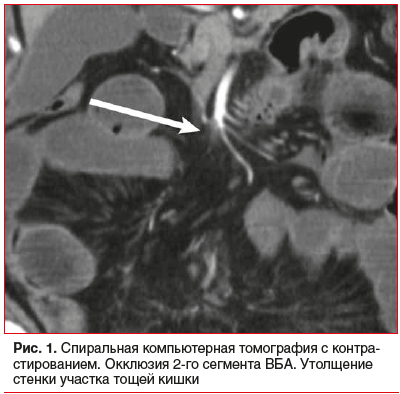
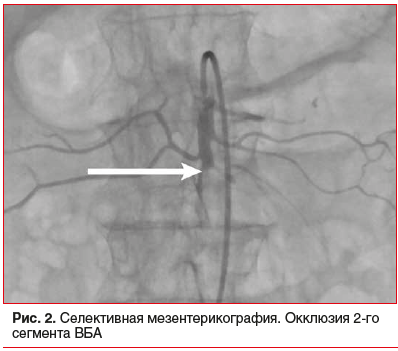
–Я—А–Є –њ–∞–ї—М–њ–∞—Ж–Є–Є –ґ–Є–≤–Њ—В –Љ—П–≥–Ї–Є–є, –±–Њ–ї–µ–Ј–љ–µ–љ–љ—Л–є –≤ –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–∞—Е –Є —Б–њ—А–∞–≤–∞. –Я–µ—А–Є—В–Њ–љ–µ–∞–ї—М–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –љ–µ—В. –Ю–±—Й–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є –Є –Ї–Њ–∞–≥—Г–ї–Њ–≥—А–∞–Љ–Љ–∞: —В—А–Њ–Љ–±–Њ—Ж–Є—В—Л 395√Ч109/–ї, –ї–µ–є–Ї–Њ—Ж–Є—В—Л 18,7√Ч109/–ї, —Н—А–Є—В—А–Њ—Ж–Є—В—Л 3,74√Ч1012/–ї, –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ 104 –≥/–ї, D-–і–Є–Љ–µ—А 2780 –µ–і. –° –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –Ю–Э–Ь–Ј–Ъ –±—Л–ї–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –°–Ъ–Ґ —Б –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є–µ–Љ, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –Њ–Ї–Ї–ї—О–Ј–Є—О 2-–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ –Т–С–Р, —Г—В–Њ–ї—Й–µ–љ–Є–µ —Б—В–µ–љ-–Ї–Є —Г—З–∞—Б—В–Ї–∞ —В–Њ—Й–µ–є –Ї–Є—И–Ї–Є –Є –≥–∞–Ј –≤ —Б—В–µ–љ–Ї–µ –Ї–Є—И–Ї–Є (—А–Є—Б. 1). –С–Њ–ї—М–љ–Њ–Љ—Г –±—Л–ї–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –Љ–µ–Ј–µ–љ—В–µ—А–Є–Ї–Њ–≥—А–∞—Д–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –±—Л–ї–∞ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ –Њ–Ї–Ї–ї—О–Ј–Є—П 2-–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ –Т–С–Р (—А–Є—Б. 2).
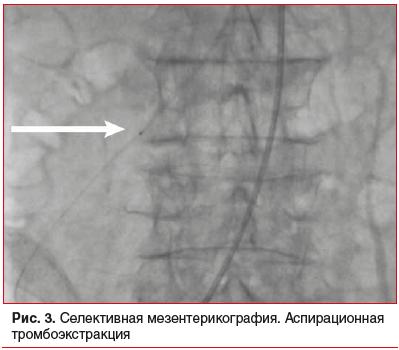
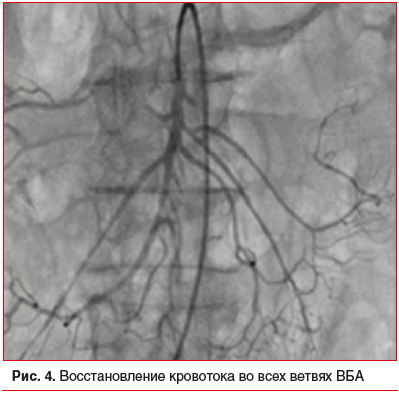
–Ф–∞–ї–µ–µ –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ —А–µ–Ї–∞–љ–∞–ї–Є–Ј–∞—Ж–Є—П –Т–С–Р –њ—А–Њ–≤–Њ–і–љ–Є–Ї–∞–Љ–Є –Є –∞—Б–њ–Є—А–∞—Ж–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Љ–∞—Б—Б –Ї–Њ—А–Њ–љ–∞—А–љ—Л–Љ –∞—Б–њ–Є—А–∞—Ж–Є–Њ–љ–љ—Л–Љ –Ї–∞—В–µ—В–µ—А–Њ–Љ EXPORT APCE 7 Fr (Medtronic Inc., –°–®–Р) (—А–Є—Б. 3). –Т —Е–Њ–і–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –і–Њ—Б—В–Є–≥–љ—Г—В —Е–Њ—А–Њ—И–Є–є –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–є —А–µ–Ј—Г–ї—М—В–∞—В, –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ–Њ –Т–С–Р –Є –µ–µ –≤–µ—В–≤—П–Љ (—А–Є—Б. 4).
–Я–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Т–С–Р –±–Њ–ї—М–љ–Њ–є —В—А–∞–љ—Б–њ–Њ—А—В–Є—А–Њ–≤–∞–љ –≤ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Г—О. –Т—Л–њ–Њ–ї–љ–µ–љ–∞ –≤–µ—А—Е–љ–µ—Б—А–µ–і–Є–љ–љ–∞—П –ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є—П. –Я–µ—В–ї–Є —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є —Г–Љ–µ—А–µ–љ–љ–Њ —А–∞–Ј–і—Г—В—Л, –≥–Є–њ–µ—А–µ–Љ–Є—А–Њ–≤–∞–љ—Л, —Б–µ—А–Њ–Ј–љ–∞—П –Њ–±–Њ–ї–Њ—З–Ї–∞ –±–ї–µ—Б—В—П—Й–∞—П, –њ–µ—А–Є—Б—В–∞–ї—М—В–Є–Ї–∞ –Њ—Б–ї–∞–±–ї–µ–љ–∞. –Т –≤–µ—А—Е–љ–Є—Е –Є –љ–Є–ґ–љ–Є—Е –Њ—В–і–µ–ї–∞—Е –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ —Г–Љ–µ—А–µ–љ–љ—Л–є —Б–њ–∞–µ—З–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б. –Э–∞ —Г—З–∞—Б—В–Ї–µ –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В—М—О –і–Њ 40 —Б–Љ (–≤ 80 —Б–Љ –Њ—В —Б–≤—П–Ј–Ї–Є –Ґ—А–µ–є—В—Ж–∞) —В–Њ—Й–∞—П –Ї–Є—И–Ї–∞ —З–µ—А–љ–Њ-–±—Г—А–Њ–≥–Њ —Ж–≤–µ—В–∞. –Ф–∞–ї–µ–µ –Ї–Є—И–Ї–∞ –Њ–±—Л—З–љ–Њ–≥–Њ —Ж–≤–µ—В–∞, —Б –њ–µ—А–Є—Б—В–∞–ї—М—В–Є–Ї–Њ–є, –њ—Г–ї—М—Б–∞—Ж–Є—П —Б–Њ—Б—Г–і–Њ–≤ –±—А—Л–ґ–µ–є–Ї–Є –Њ—В—З–µ—В–ї–Є–≤–∞—П. –Я—А–Њ–≤–µ–і–µ–љ–∞ —А–µ–Ј–µ–Ї—Ж–Є—П –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є. –Я—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л–є –Є –і–Є—Б—В–∞–ї—М–љ—Л–є —Г—З–∞—Б—В–Ї–Є –Ј–∞–≥–ї—Г—И–µ–љ—Л –Њ–±–≤–Є–≤–љ—Л–Љ–Є —И–≤–∞–Љ–Є. –Т –љ–∞—З–∞–ї—М–љ—Л–є –Њ—В–і–µ–ї —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є –Ј–∞–≤–µ–і–µ–љ –Ј–Њ–љ–і.
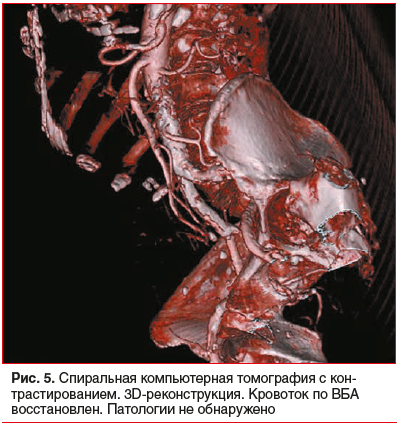
–С–Њ–ї—М–љ–Њ–є –њ–µ—А–µ–≤–µ–і–µ–љ –≤ –Њ—В–і–µ–ї–µ–љ–Є–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –≥–і–µ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–∞—П (–≥–µ–њ–∞—А–Є–љ 1000 –Ь–Х/—З) –Є –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–љ–∞—П —В–µ—А–∞–њ–Є—П (–Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї 75 –Љ–≥), –Ї–Њ–љ—В—А–Њ–ї—М —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї. –І–µ—А–µ–Ј 24 —З –њ—А–Њ–≤–µ–і–µ–љ–∞ —А–µ–≤–Є–Ј–Є—П —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є, —Г—З–∞—Б—В–Ї–Њ–≤ –µ–µ –љ–µ–Ї—А–Њ–Ј–∞ –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ, –љ–µ–њ—А–µ—А—Л–≤–љ–Њ—Б—В—М —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –∞–љ–∞—Б—В–Њ–Љ–Њ–Ј–Њ–Љ ¬Ђ–±–Њ–Ї –≤ –±–Њ–Ї¬ї. –І–µ—А–µ–Ј 24 —З –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П –љ–∞ –Љ—Г–ї—М—В–Є—Б–њ–Є—А–∞–ї—М–љ–Њ–Љ –Ъ–Ґ, –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –Ї–Њ—В–Њ—А–Њ–є –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ —Б–Є—Б—В–µ–Љ–µ –Т–С–Р (—А–Є—Б. 5).
–Я–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–є –њ–µ—А–Є–Њ–і –њ—А–Њ—В–µ–Ї–∞–ї –±–µ–Ј –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –±–Њ–ї—М–љ–Њ–є –≤—Л–њ–Є—Б–∞–љ –љ–∞ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Ґ—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –њ—А–Є –Њ–Ї–Ї–ї—О–Ј–Є–Є 1-–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ –Т–С–Р –≤—Л–њ–Њ–ї–љ—П—О—В –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Г—О —А–µ–≤–Є–Ј–Є—О –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ–Њ –Т–С–Р —Б —А–µ–Ј–µ–Ї—Ж–Є–µ–є –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ –Ї–Є—И–Ї–Є –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –њ–Њ–≤—В–Њ—А–љ—Л–Љ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ–Љ –і–ї—П –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –≥—А–∞–љ–Є—Ж —А–µ–Ј–µ–Ї—Ж–Є–Є –Є –љ–∞–ї–Њ–ґ–µ–љ–Є—П –∞–љ–∞—Б—В–Њ–Љ–Њ–Ј–∞. –Я—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є–Є 2-–≥–Њ –Є 3-–≥–Њ —Б–µ–≥–Љ–µ–љ—В–Њ–≤ –Т–С–Р –Є –µ–µ –і–Є—Б—В–∞–ї—М–љ—Л—Е –≤–µ—В–≤–µ–є –і–µ–ї–∞—О—В —В–Њ–ї—М–Ї–Њ —А–µ–Ј–µ–Ї—Ж–Є—О –Ї–Є—И–Ї–Є. –≠—В–∞ —В–∞–Ї—В–Є–Ї–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –Љ–µ–љ—М—И–Є–Љ –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –њ–µ—А–≤–Њ–Љ—Г —Б–µ–≥–Љ–µ–љ—В—Г –Њ–±—К–µ–Љ–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є—П —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є –Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Љ–µ–ї–Ї–Є–Љ –Ї–∞–ї–Є–±—А–Њ–Љ —Б–Њ—Б—Г–і–Њ–≤ –і–ї—П –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В—А–Њ–Љ–±—Н–Љ–±–Њ–ї—Н–Ї—В–Њ–Љ–Є–Є. –Ґ–∞–Ї—В–Є—З–µ—Б–Ї–Є –і–Њ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ —Б–Њ—Б—В–Њ—П–љ–Є—П —Б—В–µ–љ–Ї–Є –Ї–Є—И–Ї–Є –љ–µ –≤—Л–њ–Њ–ї–љ—П–µ—В—Б—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ —В–Њ–≥–Њ, —З—В–Њ –±–Њ–ї—М–љ–Њ–є –њ–Њ–і–ї–µ–ґ–Є—В –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є —А–µ–≤–Є–Ј–Є–Є –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –њ—А–Є –ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є–Є.
–Т –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –ї–µ—З–µ–±–љ–∞—П —В–∞–Ї—В–Є–Ї–∞ –Њ—В–ї–Є—З–∞–ї–∞—Б—М –Њ—В –≤—Л—И–µ–Є–Ј–ї–Њ–ґ–µ–љ–љ–Њ–є: –≤—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ –њ–Њ–њ—Л—В–Ї–∞ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ–Њ –Т–С–Р –Є –µ–µ –≤–µ—В–≤—П–Љ –љ–∞ –≤—Б–µ—Е —Г—А–Њ–≤–љ—П—Е –Њ–Ї–Ї–ї—О–Ј–Є–Є, –∞ –Љ–µ—В–Њ–і–Њ–Љ –њ–µ—А–≤–Њ–≥–Њ –≤—Л–±–Њ—А–∞ –±—Л–ї–∞ —А–µ–љ—В–≥–µ–љ—Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П –Љ–µ—В–Њ–і–Є–Ї–∞ —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Т–С–Р —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —А–µ–Ј–µ–Ї—Ж–Є–µ–є —Г—З–∞—Б—В–Ї–∞ –Ї–Є—И–Ї–Є. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Њ—В–Ї—А—Л—В—Л—Е —Б–њ–Њ—Б–Њ–±–Њ–≤ —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є, –і–∞–љ–љ–∞—П –Љ–µ—В–Њ–і–Є–Ї–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В—М –Љ–µ–Ј–µ–љ—В–µ—А–Є–∞–ї—М–љ—Л–є –Ї—А–Њ–≤–Њ—В–Њ–Ї –≤ —Б–Њ—Б—Г–і–∞—Е –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –ї—О–±–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є.
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤—Б–µ —З–∞—Й–µ —Б—В–∞–ї–Є –њ–Њ—П–≤–ї—П—В—М—Б—П –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є, –≤ –Ї–Њ—В–Њ—А—Л—Е –Њ–њ–Є—Б—Л–≤–∞—О—В—Б—П —Б–ї—Г—З–∞–Є —Г—Б–њ–µ—И–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–µ—В–Њ–і–Њ–≤ –Є–љ—В–µ—А–≤–µ–љ—Ж–Є–Њ–љ–љ–Њ–є —А–∞–і–Є–Њ–ї–Њ–≥–Є–Є –≤ –ї–µ—З–µ–љ–Є–Є –Ю–Э–Ь–Ј–Ъ [12вАУ18]. –Ш–љ—В–µ—А–≤–µ–љ—Ж–Є–Њ–љ–љ–∞—П —А–∞–і–Є–Њ–ї–Њ–≥–Є—П —П–≤–ї—П–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –Љ–µ—В–Њ–і–Њ–Љ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —А–∞–љ–љ–µ–є —Б—В–∞–і–Є–Є –Ю–Э–Ь–Ј–Ъ, –љ–Њ –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤ –Ї—А–∞—В—З–∞–є—И–Є–µ —Б—А–Њ–Ї–Є –≤—Л–њ–Њ–ї–љ–Є—В—М –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –ї–µ—З–µ–±–љ—Л—Е –Љ–∞–љ–Є–њ—Г–ї—П—Ж–Є–є –њ–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ–Њ –Љ–µ–Ј–µ–љ—В–µ—А–Є–∞–ї—М–љ—Л–Љ —Б–Њ—Б—Г–і–∞–Љ, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Е–Є—А—Г—А–≥–Њ–≤ [4].
–Т–Њ –Љ–љ–Њ–≥–Є—Е —Б—В—А–∞–љ–∞—Е –Љ–Є—А–∞ —Г—Б–њ–µ—И–љ–Њ –њ—А–Њ–≤–Њ–і–Є—В—Б—П —Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–µ–Ј–µ–љ—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ [14, 19вАУ21]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Raupach —Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –±—Л–ї–Њ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ –≤ 34 —Б–ї—Г—З–∞—П—Е –Є–Ј 37 (91,9%) [17]. –Ю–і–љ–Њ–є –Є–Ј –≤–∞–ґ–љ—Л—Е —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е –ї–µ—З–µ–љ–Є—П –Ю–Э–Ь–Ј–Ъ —П–≤–ї—П–µ—В—Б—П —В—А–Њ–Љ–±–Њ—Н–Ї—Б—В—А–∞–Ї—Ж–Є—П –Є–Ј –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–є –∞—А—В–µ—А–Є–Є [13, 22вАУ24]. –Т –†–Њ—Б—Б–Є–Є –њ–µ—А–≤–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ —Г—Б–њ–µ—И–љ–Њ–є —А–µ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —В—А–Њ–Љ–±—Н–Ї—В–Њ–Љ–Є–Є (AngioJet) —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Є —Е–Њ—А–Њ—И–Є–Љ –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–Љ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б —В—А–Њ–Љ–±–Њ–Ј–Њ–Љ –Т–С–Р –±—Л–ї–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –Т.–Э. –®–Є–њ–Њ–≤—Б–Ї–Є–Љ [25].
–Т —А–∞–±–Њ—В–µ –Р.–Ш. –•—А–Є–њ—Г–љ–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л —Г—Б–њ–µ—И–љ—Л–µ —Б–ї—Г—З–∞–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В—А–Њ–Љ–±–Њ—Н–Ї—Б—В—А–∞–Ї—Ж–Є–Є –Ї–∞–Ї —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —А–µ–Њ¬≠–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —В—А–Њ–Љ–±—Н–Ї—В–Њ–Љ–Є–Є, —В–∞–Ї –Є –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –≤–∞–Ї—Г—Г–Љ–љ–Њ–є –∞—Б–њ–Є—А–∞—Ж–Є–Є. –Ю–і–љ–∞–Ї–Њ –≤ —Б–ї—Г—З–∞–µ —Н–Љ–±–Њ–ї–Є–Є —А–µ–Њ–ї–Є—В–Є—З–µ—Б–Ї–∞—П —В—А–Њ–Љ–±–Њ—Н–Ї—Б—В—А–∞–Ї—Ж–Є—П –љ–µ –≤—Б–µ–≥–і–∞ —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є [26]. –Я–Њ –Љ–љ–µ–љ–Є—О —А—П–і–∞ –∞–≤—В–Њ—А–Њ–≤, –∞—Б–њ–Є—А–∞—Ж–Є–Њ–љ–љ–∞—П —В—А–Њ–Љ–±–Њ—Н–Ї—Б—В—А–∞–Ї—Ж–Є—П —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —Б–њ–Њ—Б–Њ–±–Њ–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Т–С–Р [17, 24, 27]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Б —Г—Б–њ–µ—Е–Њ–Љ –≤—Л–њ–Њ–ї–љ—П—О—В—Б—П –≥–Є–±—А–Є–і–љ—Л–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –љ–∞ —Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ —Б —А–µ–Ј–µ–Ї—Ж–Є–µ–є –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ –Ї–Є—И–Ї–Є [28вАУ30].
–Я—А–Є –Њ–Ї–Ї–ї—О–Ј–Є–Є 1-–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ –Т–С–Р –Љ–љ–Њ–≥–Є–µ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В—Л –≤—Л–њ–Њ–ї–љ—П—О—В —А–µ–Ј–µ–Ї—Ж–Є—О –Ї–Є—И–Ї–Є –≤–Љ–µ—Б—В–µ —Б ¬Ђ–Њ—В–Ї—А—Л—В—Л–Љ–Є¬ї —Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞–Љ–Є –Є–Ј-–Ј–∞ –±–Њ–ї—М—И–Њ–є –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В–Є –љ–µ–Ї—А–Њ–Ј–∞, –∞ –њ—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є–Є 2-–≥–Њ –Є 3-–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ –Т–С–Р –Є –≤–µ—В–≤–µ–є –њ—А–Њ–≤–Њ–і—П—В —В–Њ–ї—М–Ї–Њ —А–µ–Ј–µ–Ї—Ж–Є—О –Ї–Є—И–Ї–Є, –±–µ–Ј –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ–Њ –Т–С–Р, —З—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–Њ —Б–Њ —Б–ї–Њ–ґ–љ–Њ—Б—В—П–Љ–Є –і–Њ—Б—В—Г–њ–∞ –њ—А–Є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Њ—Н–Ї—В–Њ–Љ–Є–Є –Є–Ј –і–Є—Б—В–∞–ї—М–љ—Л—Е —Б–µ–≥–Љ–µ–љ—В–Њ–≤ –Є –≤–µ—В–≤–µ–є –Т–С–Р.
–Т –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –≤—Л–њ–Њ–ї–љ—П–ї–Є –њ–Њ–њ—Л—В–Ї—Г –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Т–С–Р –Є –µ–µ –≤–µ—В–≤—П—Е –љ–∞ –≤—Б–µ—Е —Г—А–Њ–≤–љ—П—Е –њ–Њ—А–∞–ґ–µ–љ–Є—П, –Є—Б–њ–Њ–ї—М–Ј—Г—П —А–µ–љ—В–≥–µ–љ–Њ—Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —А–µ–Ј–µ–Ї—Ж–Є–µ–є –Ї–Є—И–Ї–Є. –°–Њ—Б—В–Њ—П–љ–Є–µ –Ї–Є—И–Ї–Є –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –Њ—Ж–µ–љ–µ–љ–Њ –њ—А–Є –ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є–Є –њ–Њ —В—А–µ–±–Њ–≤–∞–љ–Є—О, —В. –µ. –µ—Б–ї–Є —Б–Є–Љ–њ—В–Њ–Љ—Л —Б–Њ—Е—А–∞–љ—П—О—В—Б—П –Є–ї–Є —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В —Г—Е—Г–і—И–∞—В—М—Б—П. –Ы–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є—П –љ–µ –Є–Љ–µ–µ—В –±–Њ–ї—М—И–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є —Ж–µ–љ–љ–Њ—Б—В–Є –њ—А–Є –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–µ –Є—И–µ–Љ–Є–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –њ—А–Є –Ю–Э–Ь–Ј–Ъ, –Њ–і–љ–∞–Ї–Њ –Њ–љ–∞ –Љ–Њ–ґ–µ—В –њ–Њ–Љ–Њ–≥–∞—В—М –≤ –Њ—Ж–µ–љ–Ї–µ –ґ–Є–Ј–љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –њ–Њ—Б–ї–µ —Г—Б–њ–µ—И–љ–Њ–є —Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є.
–Ю–і–љ–Є–Љ –Є–Ј –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Ї–Є—И–Ї–Є —П–≤–ї—П–µ—В—Б—П —Б–Є—Б—В–µ–Љ–љ—Л–є —А–µ–њ–µ—А—Д—Г–Ј–Є–Њ–љ–љ—Л–є —Б–Є–љ–і—А–Њ–Љ, –Њ–і–љ–∞–Ї–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ–љ –≤—Л—П–≤–ї–µ–љ –љ–µ –±—Л–ї.
–І–∞—Б—В–Њ –і–∞–ґ–µ –Њ–њ—Л—В–љ–Њ–Љ—Г —Е–Є—А—Г—А–≥—Г –±—Л–≤–∞–µ—В —В—А—Г–і–љ–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М, –Ї–∞–Ї–∞—П —З–∞—Б—В—М –Ї–Є—И–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–∞ –Є –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–њ–∞—Б–µ–љ–∞. –Я–љ–µ–≤–Љ–∞—В–Њ–Ј, –Є—И–µ–Љ–Є—П —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є (–њ—А–Њ—Б–≤–µ—З–Є–≤–∞—О—Й–Є–µ —В–µ–Љ–љ—Л–µ –њ—П—В–љ–∞), –±–ї–µ–і–љ–∞—П –Є –њ–∞—А–∞–ї–Є—В–Є—З–µ—Б–Ї–∞—П –Ї–Є—И–Ї–∞ –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–±—А–∞—В–Є–Љ—Л–Љ–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є, —В–Њ–≥–і–∞ –Ї–∞–Ї —В–µ–Љ–љ—Л–є –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є –Ї–Є—И–µ—З–љ–Є–Ї вАФ –љ–µ—В. –Т–∞–ґ–љ–Њ –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ –Ї–Є—И–µ—З–љ–Є–Ї–µ –њ—А–Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е, –њ—А–Є –Ю–Э–Ь–Ј–Ъ –±—А—Л–ґ–µ–є–Ї—Г –љ–µ –љ—Г–ґ–љ–Њ —Г–і–∞–ї—П—В—М, –і–∞–ґ–µ –µ—Б–ї–Є –Њ–љ–∞ –Ї–∞–ґ–µ—В—Б—П –Њ—В–µ—З–љ–Њ–є –Є–ї–Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–є. –Ы–Є–љ–Є—О —А–µ–Ј–µ–Ї—Ж–Є–Є —Б–ї–µ–і—Г–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М —А—П–і–Њ–Љ —Б –Ї–Є—И–µ—З–љ–Є–Ї–Њ–Љ. –£ —В—П–ґ–µ–ї–Њ–±–Њ–ї—М–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –Њ–њ–µ—А–∞—Ж–Є—П –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –±—Л—Б—В—А–Њ–є –Є –±–µ—Б–Ї—А–Њ–≤–љ–Њ–є. –Х—Б–ї–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞ —А–µ–Ј–µ–Ї—Ж–Є—П —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є, –Љ–Њ–ґ–µ—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ –∞–њ–њ–∞—А–∞—В –і–ї—П –±—Л—Б—В—А–Њ–≥–Њ —Г–њ–ї–Њ—В–љ–µ–љ–Є—П –Є —А–∞–Ј—А–µ–Ј–∞–љ–Є—П –≤–і–Њ–ї—М –≥—А–∞–љ–Є—Ж—Л –±—А—Л–ґ–µ–µ—З–љ–Њ–є –Ї–Є—И–Ї–Є.
–Я–Њ—Б–ї–µ —А–µ–Ј–µ–Ї—Ж–Є–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ —Е–Є—А—Г—А–≥ –і–Њ–ї–ґ–µ–љ —Б–і–µ–ї–∞—В—М –Њ—З–µ–љ—М –≤–∞–ґ–љ—Л–є –≤—Л–±–Њ—А –Љ–µ–ґ–і—Г –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –њ—А–Њ–Њ–њ–µ—А–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Є—И–Ї–Є –Є –њ–µ—А–≤–Є—З–љ–Њ–є –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–µ–є. –Ґ–∞–Ї—В–Є–Ї–∞, –њ–Њ–ї—Г—З–Є–≤—И–∞—П –љ–∞–Ј–≤–∞–љ–Є–µ Damage Control (—В–∞–Ї—В–Є–Ї–∞ –Ї–Њ–љ—В—А–Њ–ї—П –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є), –Њ–Ј–љ–∞—З–∞–µ—В, —З—В–Њ –њ—А–Є –љ–∞—З–∞–ї—М–љ–Њ–є –ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є–Є –≤—Л–њ–Њ–ї–љ—П—О—В—Б—П —В–Њ–ї—М–Ї–Њ —В–µ –њ—А–Њ—Ж–µ–і—Г—А—Л, –Ї–Њ—В–Њ—А—Л–µ –∞–±—Б–Њ–ї—О—В–љ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–ї—П –≤—Л–ґ–Є–≤–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞ –≤ —В–µ—З–µ–љ–Є–µ —Б–ї–µ–і—Г—О—Й–Є—Е –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–љ–µ–є. –Т —Б–ї—Г—З–∞–µ –Ю–Э–Ь–Ј–Ъ —В–∞–Ї—В–Є–Ї–Њ–є Damage Control —П–≤–ї—П—О—В—Б—П —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—П –Є —А–µ–Ј–µ–Ї—Ж–Є—П –Ї–Є—И–µ—З–љ–Є–Ї–∞ –±–µ–Ј –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –∞–љ–∞—Б—В–Њ–Љ–Њ–Ј–Њ–≤. –Ч–∞—В–µ–Љ –њ–∞—Ж–Є–µ–љ—В —Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г–µ—В—Б—П –≤ –Њ—В–і–µ–ї–µ–љ–Є–Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –∞ —А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є—П –Ї–Є—И–µ—З–љ–Є–Ї–∞ –≤—Л–њ–Њ–ї–љ—П–µ—В—Б—П –њ–Њ–Ј–ґ–µ, –Ї–∞–Ї –њ–ї–∞–љ–Њ–≤–∞—П –Њ–њ–µ—А–∞—Ж–Є—П.
–Ч–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ–є –±—Л–ї–∞ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В–Є –љ–µ–Ї—А–Њ–Ј–∞ –Ї–Є—И–Ї–Є –Њ—В —Г—А–Њ–≤–љ—П –њ–Њ—А–∞–ґ–µ–љ–Є—П –Т–С–Р: —З–µ–Љ –≤—Л—И–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Т–С–Р, —В–µ–Љ –±–Њ–ї—М—И–Є–є —Г—З–∞—Б—В–Њ–Ї –Ї–Є—И–Ї–Є –≤–Њ–≤–ї–µ—З–µ–љ –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, —А–µ–Ј–µ—Ж–Є—А–Њ–≤–∞–љ. –Ґ–∞–Ї, —Г 5 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В–Њ—В–∞–ї—М–љ—Л–Љ –љ–µ–Ї—А–Њ–Ј–Њ–Љ –≤—Л—П–≤–ї–µ–љ–Њ –њ–Њ—А–∞–ґ–µ–љ–Є–µ 1-–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ –Т–С–Р. –°—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–±—К–µ–Љ–Њ–Љ —А–µ–Ј–µ–Ї—Ж–Є–Є –±–Њ–ї–µ–µ 3 –Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ 1-–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ –≤—Л—П–≤–ї–µ–љ–Њ —Г 7 —З–µ–ї–Њ–≤–µ–Ї, 2-–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ вАФ —Г 2. –Т –≥—А—Г–њ–њ–µ —Б –Њ–±—К–µ–Љ–Њ–Љ —А–µ–Ј–µ–Ї—Ж–Є–Є 2вАУ3 –Љ —Г 6 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—А–∞–ґ–µ–љ 1-–є —Б–µ–≥–Љ–µ–љ—В, —Г 9 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ вАФ 2-–є —Б–µ–≥–Љ–µ–љ—В –Т–С–Р, —Г 3 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ вАФ 3-–є —Б–µ–≥–Љ–µ–љ—В –Є/–Є–ї–Є –≤–µ—В–≤–Є –Т–С–Р. –Т –≥—А—Г–њ–њ–µ —Б –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В—М—О —А–µ–Ј–µ–Ї—Ж–Є–Є –і–Њ 2 –Љ —Г 4 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—А–∞–ґ–µ–љ 1-–є —Б–µ–≥–Љ–µ–љ—В –Т–С–Р, —Г 10 вАФ 2-–є —Б–µ–≥–Љ–µ–љ—В –Т–С–Р, —Г 5 вАФ 3-–є —Б–µ–≥–Љ–µ–љ—В –Є/–Є–ї–Є –≤–µ—В–≤–Є –Т–С–Р. –Ю–і–љ–∞–Ї–Њ —В–∞–Ї –Ї–∞–Ї –љ–µ–Ї—А–Њ–Ј –Ї–Є—И–Ї–Є –љ–∞—З–Є–љ–∞–µ—В—Б—П —Б –і–Є—Б—В–∞–ї—М–љ—Л—Е —Г—З–∞—Б—В–Ї–Њ–≤, –њ—А–Є —А–∞–љ–љ–µ–є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є —Г–і–∞–≤–∞–ї–Њ—Б—М –≤—Л–њ–Њ–ї–љ—П—В—М –±–Њ–ї–µ–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л–µ —А–µ–Ј–µ–Ї—Ж–Є–Є, –љ–µ —Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ –і–ї—П –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е —Г—А–Њ–≤–љ–µ–є –њ–Њ—А–∞–ґ–µ–љ–Є—П –Т–С–Р.
–Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —А–µ–љ—В–≥–µ–љ—Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є —В–µ—Е–љ–Є–Ї–Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —А–µ—И–Є—В—М –њ—А–Њ–±–ї–µ–Љ—Г –љ–∞—А—Г—И–µ–љ–Є—П –Љ–µ–Ј–µ–љ—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Ї–∞–Ї –њ—А–Є –Њ–Ї–Ї–ї—О–Ј–Є—П—Е, —В–∞–Ї –Є –њ—А–Є —Б—В–µ–љ–Њ–Ј–∞—Е –Т–С–Р –љ–∞ —Г—А–Њ–≤–љ–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –ї—О–±–Њ–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ –Є –≤–µ—В–≤–Є, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Т–С–Р.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Љ–Њ–ґ–љ–Њ —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і, —З—В–Њ –ї–µ—З–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Э–Ь–Ј–Ъ —Б–ї–µ–і—Г–µ—В –љ–∞—З–Є–љ–∞—В—М —Б –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Т–С–Р –Ї–Є—И–Ї–Є, –Є—Б–њ–Њ–ї—М–Ј—Г—П —Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–µ —А–µ–љ—В–≥–µ–љ—Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л –љ–∞ –≤—Б–µ—Е —Г—А–Њ–≤–љ—П—Е –њ–Њ—А–∞–ґ–µ–љ–Є—П. –≠–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ —П–≤–ї—П—О—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Є –Љ–∞–ї–Њ—В—А–∞–≤–Љ–∞—В–Є—З–љ—Л–Љ —Б–њ–Њ—Б–Њ–±–Њ–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П—Е –ї—О–±—Л—Е –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–є –Т–С–Р –Є —Б–њ–Њ—Б–Њ–±–љ—Л —Б–Њ–Ї—А–∞—В–Є—В—М –≤—А–µ–Љ—П –Є—И–µ–Љ–Є–Є –Ї–Є—И–Ї–Є, –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М —А–∞–Ј–≤–Є—В–Є–µ –Є–љ—Д–∞—А–Ї—В–∞ –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, –Њ–≥—А–∞–љ–Є—З–Є—В—М –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В—М –њ–Њ—А–∞–ґ–µ–љ–Є—П –Ї–Є—И–Ї–Є.












