–Т–≤–µ–і–µ–љ–Є–µ
–Ш–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –ї–µ–≥–Ї–Є—Е (–Ш–Ч–Ы) –≤ —Ж–µ–ї–Њ–Љ, –≤ —В. —З. –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–є –ї–µ–≥–Њ—З–љ—Л–є —Д–Є–±—А–Њ–Ј (–Ш–Ы–§), вАУ –Љ–љ–Њ–≥–Њ–≥—А–∞–љ–љ—Л–µ –њ–Њ —Б–≤–Њ–µ–є –њ—А–Є—А–Њ–і–µ –ї–µ–≥–Њ—З–љ—Л–µ –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –њ–µ—А–≤–Њ–µ –Њ–њ–Є—Б–∞–љ–Є–µ –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –ї–µ–≥–Ї–Є—Е —Б–і–µ–ї–∞–ї G. E. Rindfleisch –≤ 1897 –≥., –љ–∞–Ј–≤–∞–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ cirrhosis cystica, –∞ –≥–Њ–і–Њ–Љ –њ–Њ–Ј–ґ–µ P. von Hansemann –≤ —Б–≤–Њ–µ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї —В–µ—А–Љ–Є–љ lymphangitis reticularis [1]. –° –±–Њ–ї–µ–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –њ–Њ–Ј–Є—Ж–Є–є –њ–µ—А–≤–Њ–µ –Њ–њ–Є—Б–∞–љ–Є–µ –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –ї–µ–≥–Ї–Є—Е –њ—А–µ–і—Б—В–∞–≤–Є–ї–Є –•–∞–Љ–Љ–∞–љ –Є –†–Є—З, –Ї–Њ—В–Њ—А—Л–µ —Б–≤–Њ–µ–Љ—Г —Б–ї—Г—З–∞—О –і–∞–ї–Є –љ–∞–Є–Љ–µ–љ–Њ–≤–∞–љ–Є–µ ¬Ђ—Д—Г–ї—М–Љ–Є–љ–∞–љ—В–љ—Л–є –і–Є—Д—Д—Г–Ј–љ—Л–є –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ—Л–є —Д–Є–±—А–Њ–Ј –ї–µ–≥–Ї–Є—Е¬ї (fulminating diffuse interstitial fibrosis of the lungs), –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –Є–Ј–Љ–µ–љ–µ–љ–љ–Њ–µ –љ–∞ ¬Ђ—Б–Є–љ–і—А–Њ–Љ –•–∞–Љ–Љ–∞–љ–∞ вАФ –†–Є—З–∞¬ї [2]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Н—В–Њ –љ–∞–Ј–≤–∞–љ–Є–µ –љ–µ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П, –Њ—В–Ї—А—Л—В–Є–µ —Б–Є–љ–і—А–Њ–Љ–∞ –•–∞–Љ–Љ–∞–љ–∞ вАФ –†–Є—З–∞ –≤–љ–µ—Б–ї–Њ –≤–∞–ґ–љ—Л–є –≤–Ї–ї–∞–і –≤ –њ–Њ–љ–Є–Љ–∞–љ–Є–µ –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –ї–µ–≥–Ї–Є—Е. –Т–Њ-–њ–µ—А–≤—Л—Е, –љ–∞ –Њ—Б–љ–Њ–≤–µ –љ–∞–±–ї—О–і–µ–љ–Є–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–∞–љ–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –±—Л–ї –≤—Л–і–µ–ї–µ–љ –њ–µ—А–≤—Л–є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ–∞—В—В–µ—А–љ, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–є —Б –Ї–Њ–љ–Ї—А–µ—В–љ—Л–Љ –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –ї–µ–≥–Ї–Є—Е, –Є, –≤–ЊвАС–≤—В–Њ—А—Л—Е, —Б—В–∞–ї–Њ –њ–Њ–љ—П—В–љ–Њ, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –њ–∞—Ж–Є–µ–љ—В—Л –Љ–Њ–≥—Г—В –Њ—В–≤–µ—З–∞—В—М –љ–∞ —В–µ—А–∞–њ–Є—О –Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–∞–Љ–Є, –∞ —Г –і—А—Г–≥–Є—Е –і–∞–љ–љ–∞—П –≥—А—Г–њ–њ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤—Л–Ј—Л–≤–∞–µ—В –Њ–±–Њ—Б—В—А–µ–љ–Є–µ –±–Њ–ї–µ–Ј–љ–Є. –Т 1948 –≥. –†–Њ–±–±–Є–љ—Б –њ–µ—А–≤—Л–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї —В–µ—А–Љ–Є–љ ¬Ђ–Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–є –ї–µ–≥–Њ—З–љ—Л–є —Д–Є–±—А–Њ–Ј¬ї –і–ї—П –Њ–њ–Є—Б–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –љ–∞ —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞–Љ–Љ–∞—Е –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є –њ–Њ—Е–Њ–ґ–Є –љ–∞ –ї–µ–≥–Њ—З–љ—Л–є —Д–Є–±—А–Њ–Ј, –љ–Њ –±–µ–Ј –Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –њ—А–Є—З–Є–љ—Л. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б —Н—В–Є–Љ –±—Л–ї–∞ –њ—А–Є–Ј–љ–∞–љ–∞ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Д–Є–±—А–Њ–Ј–Њ–Љ –ї–µ–≥–Ї–Є—Е –Є –њ–Њ—Б—В–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ —Д–Є–±—А–Њ–Ј–Њ–Љ, –њ–љ–µ–≤–Љ–Њ–Ї–Њ–љ–Є–Њ–Ј–Њ–Љ, –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П–Љ–Є –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є, –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, —В–∞–Ї–Є–Љ–Є –Ї–∞–Ї —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В –Є–ї–Є —Б–Є—Б—В–µ–Љ–љ—Л–є —Б–Ї–ї–µ—А–Њ–Ј.–°–Њ–≥–ї–∞—Б–љ–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ—Г –њ–Њ–љ–Є–Љ–∞–љ–Є—О –Ш–Ы–§ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–∞–Ї –Њ—Б–Њ–±–∞—П —Д–Њ—А–Љ–∞ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є —Д–Є–±—А–Њ–Ј–Є—А—Г—О—Й–µ–є –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –љ–µ–Є–Ј–≤–µ—Б—В–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є, –Ї–Њ—В–Њ—А–∞—П –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г –ї—О–і–µ–є —Б—В–∞—А—И–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –њ–Њ—А–∞–ґ–∞–µ—В —В–Њ–ї—М–Ї–Њ –ї–µ–≥–Ї–Є–µ –Є —Б–≤—П–Ј–∞–љ–∞ —Б –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є/–Є–ї–Є —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –њ–∞—В—В–µ—А–љ–Њ–Љ –Њ–±—Л—З–љ–Њ–є –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є [3]. –†—П–і —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є —Б—З–Є—В–∞—О—В, —З—В–Њ –і–∞–љ–љ–Њ–µ –љ–∞–Ј–≤–∞–љ–Є–µ –љ–µ –Њ—В–≤–µ—З–∞–µ—В –∞–Ї—В—Г–∞–ї—М–љ—Л–Љ –Њ—В–Ї—А—Л—В–Є—П–Љ –≤ –Є–Ј—Г—З–µ–љ–Є–Є –Ш–Ы–§ [4]. –Э–∞–Ї–Њ–њ–ї–µ–љ–љ—Л–µ —Б–≤–µ–і–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П—О—В –≤—Л–і–µ–ї–Є—В—М –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ –њ—А–Є—З–Є–љ —А–∞–Ј–≤–Є—В–Є—П —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —З—В–Њ –і–µ–ї–∞–µ—В —В–µ—А–Љ–Є–љ ¬Ђ–Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–є¬ї —Г–ґ–µ –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л–Љ.
–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –≤–Њ–њ—А–Њ—Б—Л –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞
–Ф–Њ—Б—В–∞—В–Њ—З–љ–Њ –±—Л—Б—В—А–Њ —Б—В–∞–ї–Њ –њ–Њ–љ—П—В–љ–Њ, —З—В–Њ –≤ –Њ—Б–љ–Њ–≤–µ –Ш–Ы–§ –ї–µ–ґ–Є—В —А–∞–Ј—А–∞—Б—В–∞–љ–Є–µ —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є. –Я–µ—А–≤–Њ–є –Ї–Њ–љ—Ж–µ–њ—Ж–Є–µ–є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Ш–Ы–§ –±—Л–ї–∞ –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –∞–ї—М–≤–µ–Њ–ї—П—А–љ–Њ–є —Б—В–µ–љ–Ї–Є, –≤–µ–і—Г—Й–µ–≥–Њ –Ї –њ—А–Њ–і—Г–Ї—Ж–Є–Є —Д–Є–±—А–Њ–≥–µ–љ–љ—Л—Е –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤. –Ю–і–љ–∞–Ї–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ –і–∞–ї–Њ –ґ–µ–ї–∞–µ–Љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є –њ—А–Є–≤–Њ–і–Є–ї–Њ —В–Њ–ї—М–Ї–Њ –Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Я–Њ—Б—В–µ–њ–µ–љ–љ–Њ –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –∞–ї—М–≤–µ–Њ–ї—П—А–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –≤—Л–ї–Є–ї–∞—Б—М –≤ —В–µ–Њ—А–Є—О –Њ 3-—Б—В–∞–і–Є–є–љ–Њ–Љ —А–∞–Ј–≤–Є—В–Є–Є –Ш–Ы–§ (—А–Є—Б. 1) [5].![–†–Є—Б. 1. –°—Е–µ–Љ–∞ —В—А–µ—Е —Б—В–∞–і–Є–є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Ш–Ы–§ [5] –†–Є—Б. 1. –°—Е–µ–Љ–∞ —В—А–µ—Е —Б—В–∞–і–Є–є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Ш–Ы–§ [5]](/upload/medialibrary/2b1/6-1.png)
–°—В–∞–і–Є—П I вАФ –њ—А–µ–і–Є—Б–њ–Њ–Ј–Є—Ж–Є—П (–њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М). –°—Г—В—М –µ–µ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –љ–∞–ї–Є—З–Є–Є —Д–∞–Ї—В–Њ—А–Њ–≤, –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—Й–Є—Е –њ–Њ–≤—Л—И–µ–љ–љ—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –∞–ї—М–≤–µ–Њ–ї—П—А–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –Ї –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ—Л–Љ —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –∞–≥–µ–љ—В–∞–Љ. –Т –Ї–∞—З–µ—Б—В–≤–µ —Н—В–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П —В–∞–Ї–Є–µ –≤–Є—А—Г—Б—Л, –Ї–∞–Ї –≤–Є—А—Г—Б –≠–њ—И—В–µ–є–љ–∞ вАФ –С–∞—А—А, —Ж–Є—В–Њ–Љ–µ–≥–∞–ї–Њ–≤–Є—А—Г—Б, –≤–Є—А—Г—Б –≥–µ–њ–∞—В–Є—В–∞ –°, influenza, –∞ —В–∞–Ї–ґ–µ —В–∞–±–∞—З–љ—Л–є –і—Л–Љ, –і—А–µ–≤–µ—Б–љ–∞—П –њ—Л–ї—М, –і–Њ–Љ–∞—И–љ–Є–є —Б–Ї–Њ—В, —Н–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–≤–Њ–і—П—В –Ї —Г—Б–Ї–Њ—А–µ–љ–љ–Њ–Љ—Г –і–µ–ї–µ–љ–Є—О –∞–ї—М–≤–µ–Њ–ї–Њ—Ж–Є—В–Њ–≤ II —В–Є–њ–∞ —Г –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –ї–Є—Ж, –Њ–њ–Њ—Б—А–µ–і—Г–µ–Љ–Њ–Љ—Г —Н–љ–і–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ —А–µ—В–Є–Ї—Г–ї—Г–Љ–Њ–Љ (ER-—Б—В—А–µ—Б—Б–Њ–Љ), –∞–Ї—В–Є–≤–∞—Ж–Є–Є —А–∞–Ј–≤–µ—А–љ—Г—В–Њ–≥–Њ –±–µ–ї–Ї–Њ–≤–Њ–≥–Њ –Њ—В–≤–µ—В–∞ (UPR), –∞–њ–Њ–њ—В–Њ–Ј–∞, —З—В–Њ –≤ –Є—В–Њ–≥–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–Љ—Г –Є—Б—В–Њ—Й–µ–љ–Є—О (—Г–Ї–Њ—А–Њ—З–µ–љ–Є—О) —В–µ–ї–Њ–Љ–µ—А. –Э–∞ –і–∞–љ–љ–Њ–Љ —Н—В–∞–њ–µ –њ—А–Є–Њ–±—А–µ—В–∞–µ—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б—Г—А—Д–∞–Ї—В–∞–љ—В–∞, —В. –Ї. —Б –љ–Є–Љ –Ї–Њ–љ—В–∞–Ї—В–Є—А—Г—О—В –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–Є–µ —Д–∞–Ї—В–Њ—А—Л. –Р–љ–Њ–Љ–∞–ї–Є–Є –±–µ–ї–Ї–Њ–≤ —Б—Г—А—Д–∞–Ї—В–∞–љ—В–∞ SP-A –Є SP-D –Љ–Њ–≥—Г—В –Њ–њ—А–µ–і–µ–ї—П—В—М —Б–Є–ї—Г –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –≤—Л—И–µ –∞–љ—В–Є–≥–µ–љ–Њ–≤ [6].
–°—В–∞–і–Є—П II вАФ –∞–Ї—В–Є–≤–∞—Ж–Є—П.
–Э–∞–Ї–Њ–њ–ї–µ–љ–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Њ–Ї—А—Г–ґ–∞—О—Й–µ–є —Б—А–µ–і—Л —Г –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –ї–Є—Ж –њ—А–Є–≤–Њ–і—П—В –Ї –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ –ї–µ–≥–Њ—З–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П (–±—А–Њ–љ—Е–Њ–∞–ї—М–≤–µ–Њ–ї—П—А–љ–Њ–≥–Њ –Є –∞–ї—М–≤–µ–Њ–ї—П—А–љ–Њ–≥–Њ): –њ–µ—А–µ–њ—А–Њ–≥—А–∞–Љ–Љ–Є—А–Њ–≤–∞–љ–Є—О —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В–∞—А–µ–љ–Є—П –Ї–ї–µ—В–Њ–Ї –Є –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—О –∞–ї—М–≤–µ–Њ–ї—П—А–љ—Л–Љ —Н–њ–Є—В–µ–ї–Є–µ–Љ –њ—А–Њ—Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї —В—А–∞–љ—Б—Д–Њ—А–Љ–Є—А—Г—О—Й–Є–є —А–Њ—Б—В–Њ–≤–Њ–є —Д–∞–Ї—В–Њ—А ќ≤ (TGFќ≤) –Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–є —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞ –ї–Є–≥–∞–љ–і ќ± (PDGFќ±). –≠—В–Є –Љ–µ–і–Є–∞—В–Њ—А—Л –њ—А—П–Љ–Њ –Є–ї–Є –Ї–Њ—Б–≤–µ–љ–љ–Њ —З–µ—А–µ–Ј –ї–µ–є–Ї–Њ—Ж–Є—В—Л –∞–Ї—В–Є–≤–Є—А—Г—О—В —Д–Є–±—А–Њ–±–ї–∞—Б—В—Л, –Ї–Њ—В–Њ—А—Л–µ –љ–∞—З–Є–љ–∞—О—В –≤—Л—А–∞–±–∞—В—Л–≤–∞—В—М –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ—Л–є –Љ–∞—В—А–Є–Ї—Б (–Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ) [6, 7].
–°—В–∞–і–Є—П III вАФ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ. –Ь–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–µ —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ –≤ –Љ–Є–Њ—Д–Є–±—А–Њ–±–ї–∞—Б—В—Л, –Ї–Њ—В–Њ—А—Л–µ –Њ—В–Ї–ї–∞–і—Л–≤–∞—О—В –µ—Й–µ –±–Њ–ї—М—И–µ –Љ–∞—В—А–Є–Ї—Б–∞ –Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –∞–Ї—В–Є–≤–Є—А—Г—О—В —Д–Є–±—А–Њ–±–ї–∞—Б—В—Л, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—О —В–Ї–∞–љ–Є –ї–µ–≥–Ї–Њ–≥–Њ. –†–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –ї–µ–≥–Њ—З–љ–Њ–є —В–Ї–∞–љ–Є –Є–Ј–Љ–µ–љ—П–µ—В —Н–Ї—Б–њ—А–µ—Б—Б–Є—О —А—П–і–∞ –≤–µ—Й–µ—Б—В–≤ –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞, –Љ–љ–Њ–≥–Є–µ –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —Б–њ–Њ—Б–Њ–±–љ—Л –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞—В—М –њ—А–Њ—Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Є–µ —Б–Є–≥–љ–∞–ї—М–љ—Л–µ –њ—Г—В–Є –≤ –Љ–µ–Ј–µ–љ—Е–Є–Љ–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е. –§–Є–±—А–Њ–±–ї–∞—Б—В—Л –њ—А–Є –Ш–Ы–§ –њ—А–Є–Њ–±—А–µ—В–∞—О—В –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞, —З—В–Њ –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ—Г —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—О [6, 7].
–†–Њ–ї—М –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є–Є, –Њ—Ж–µ–љ–Ї–µ –њ—А–Њ–≥–љ–Њ–Ј–∞ –Ш–Ы–§
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –±–Є–Њ–Љ–∞—А–Ї–µ—А—Л –Ш–Ы–§ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П —А–∞–Ј–≤–Є—В–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –Њ—В–≤–µ—В–∞ –љ–∞ –ї–µ—З–µ–љ–Є–µ.–Ю–±—Й–µ–њ—А–Є–Ј–љ–∞–љ–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ –ї–µ–≥–Њ—З–љ–Њ–≥–Њ —Д–Є–±—А–Њ–Ј–∞ –љ–∞ –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В. –Ь—Л —А–∞–Ј–і–µ–ї–Є–ї–Є –≤—Б–µ –Њ—Б–љ–Њ–≤–љ—Л–µ –±–Є–Њ–Љ–∞—А–Ї–µ—А—Л –љ–∞ —В—А–Є –±–Њ–ї—М—И–Є–µ –≥—А—Г–њ–њ—Л, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–µ –љ–∞ –Є—Е –Ј–љ–∞—З–µ–љ–Є–Є:
вАУ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ш–Ы–§;
вАУ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ—А–Њ–≥–љ–Њ–Ј–∞ –Ш–Ы–§;
вАУ –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–∞—А–≥–µ—В–љ–Њ–є –∞–љ—В–Є—Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є.
–С–Є–Њ–Љ–∞—А–Ї–µ—А—Л –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ш–Ы–§
–Э–∞–Є–±–Њ–ї—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤ –Њ–±–ї–∞—Б—В–Є –Њ—Ж–µ–љ–Ї–Є –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ –Ї–∞–Ї –Љ–µ—В–Њ–і–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ш–Ы–§ –Є –µ–≥–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Б –і—А—Г–≥–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –ї–µ–≥–Ї–Є—Е. –Я–µ—А–≤—Л–Љ–Є –Є –љ–∞–Є–±–Њ–ї–µ–µ –Є–Ј—Г—З–µ–љ–љ—Л–Љ–Є —П–≤–ї—П—О—В—Б—П –±–µ–ї–Ї–Є —Б—Г—А—Д–∞–Ї—В–∞–љ—В–∞. –£—А–Њ–≤–µ–љ—М SP-A –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –±–Њ–ї—М–љ—Л—Е –Ш–Ы–§ –±—Л–ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і—А—Г–≥–Є–Љ–Є –Ш–Ч–Ы [8]. –Ґ–∞–Ї–ґ–µ —Г—А–Њ–≤–µ–љ—М SP-A –±—Л–ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ —Г –±–Њ–ї—М–љ—Л—Е –Ш–Ы–§, —З–µ–Љ —Г –±–Њ–ї—М–љ—Л—Е —Б–∞—А–Ї–Њ–Є–і–Њ–Ј–Њ–Љ –ї–µ–≥–Ї–Є—Е –Є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є [8]. –£—А–Њ–≤–µ–љ—М SP-D –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –±–Њ–ї—М–љ—Л—Е –Ш–Ы–§ –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ SP-A —В–∞–Ї–ґ–µ –Њ–Ї–∞–Ј–∞–ї—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ, —З–µ–Љ —Г –±–Њ–ї—М–љ—Л—Е –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є, —Б–∞—А–Ї–Њ–Є–і–Њ–Ј–Њ–Љ –ї–µ–≥–Ї–Є—Е –Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В SP-A, –љ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–є —А–∞–Ј–љ–Є—Ж—Л –≤ —Б–Њ–і–µ—А–ґ–∞–љ–Є–Є SP-D —Г –±–Њ–ї—М–љ—Л—Е –Ш–Ы–§ –Є –і—А—Г–≥–Є–Љ–Є –Ш–Ч–Ы (–≤–Ї–ї—О—З–∞—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–є —Б–Є—Б—В–µ–Љ–љ—Л–є —Б–Ї–ї–µ—А–Њ–Ј, –ї–µ–≥–Њ—З–љ—Л–є –∞–ї—М–≤–µ–Њ–ї—П—А–љ—Л–є –њ—А–Њ—В–µ–Є–љ–Њ–Ј, –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї—Г—О –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї—Г—О –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ—Г—О –њ–љ–µ–≤–Љ–Њ–љ–Є—О –Є —Б–∞—А–Ї–Њ–Є–і–Њ–Ј).–Ь–∞—В—А–Є–Ї—Б–љ—Л–µ –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј—Л (–Ь–Ь–†). –Я—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є —Б–µ–Љ–µ–є—Б—В–≤–Њ —Ж–Є–љ–Ї- –Є –Ї–∞–ї—М—Ж–Є–є–Ј–∞–≤–Є—Б–Є–Љ—Л—Е —Н–љ–і–Њ–њ–µ–њ—В–Є–і–∞–Ј. –Ю–љ–Є –Є–≥—А–∞—О—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤–Њ –Љ–љ–Њ–≥–Є—Е –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е, —В–∞–Ї–Є—Е –Ї–∞–Ї —Н–Љ–±—А–Є–Њ–љ–∞–ї—М–љ–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ, –Љ–Њ—А—Д–Њ–≥–µ–љ–µ–Ј, —А–µ–њ—А–Њ–і—Г–Ї—Ж–Є—П –Є —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ —В–Ї–∞–љ–Є, –∞ —В–∞–Ї–ґ–µ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е: –∞—А—В—А–Є—В–∞—Е, –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–Љ —А–Њ—Б—В–µ –Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е. –£—А–Њ–≤–µ–љ—М –Ь–Ь–† –≤ –Ј–і–Њ—А–Њ–≤–Њ–є –ї–µ–≥–Њ—З–љ–Њ–є —В–Ї–∞–љ–Є –љ–Є–ґ–µ, —З–µ–Љ –≤ –ї–µ–≥–Ї–Њ–Љ –њ—А–Є –Ш–Ы–§ [9]. –Я–Њ —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є –Ь–Ь–† —А–∞–Ј–і–µ–ї—П—О—В—Б—П –љ–∞ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞–Ј—Л (–Ь–Ь–†-1,-8 –Є -13), –ґ–µ–ї–∞—В–Є–љ–∞–Ј—Л (–Ь–Ь–†-2 –Є -9) –Є —Б—В—А–Њ–Љ–µ–ї–Є–Ј–Є–љ—Л (–Ь–Ь–†-3 –Є -10). –Ц–µ–ї–∞—В–Є–љ–∞–Ј–∞ A (MMP-2) –Є –ґ–µ–ї–∞—В–Є–љ–∞–Ј–∞ B (MMP-9), –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, —Г—З–∞—Б—В–≤—Г—О—В –≤ –ї–µ–≥–Њ—З–љ–Њ–Љ —Д–Є–±—А–Њ–Ј–µ, –љ–Њ –Є—Е –Њ—Б–Њ–±–∞—П —А–Њ–ї—М –≤ —Н—В–Њ–Љ –њ—А–Њ—Ж–µ—Б—Б–µ –Њ—Б—В–∞–µ—В—Б—П –љ–µ—П—Б–љ–Њ–є [10]. –Т —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї MMP-9 —Б–Ї–Њ—А–µ–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞–µ—В—Б—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є –Є –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–∞ —Б –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ, –≤—Л–Ј–≤–∞–љ–љ—Л–Љ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ–Љ —В–Ї–∞–љ–µ–є, MMP-2 —Б–Є–љ—В–µ–Ј–Є—А—Г–µ—В—Б—П —Б—В—А—Г–Ї—В—Г—А–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є, –≤–Ї–ї—О—З–∞—П —Д–Є–±—А–Њ–±–ї–∞—Б—В—Л, —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л–µ –Є —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є, –Є –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–∞ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є –љ–∞—А—Г—И–µ–љ–љ—Л–Љ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ–Љ —В–Ї–∞–љ–µ–є, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –∞–љ–Њ–Љ–∞–ї—М–љ–Њ–Љ—Г –Њ—Б–∞–ґ–і–µ–љ–Є—О –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ [10].
–Э–Њ—А–Љ–∞–ї—М–љ—Л–µ –ї–µ–≥–Њ—З–љ—Л–µ —Д–Є–±—А–Њ–±–ї–∞—Б—В—Л –љ–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г—О—В MMP-9 in vitro, —В–Њ–≥–і–∞ –Ї–∞–Ї —Д–Є–±—А–Њ–±–ї–∞—Б—В—Л –Є–Ј –ї–µ–≥–Ї–Є—Е, –њ–Њ—А–∞–ґ–µ–љ–љ—Л—Е –Ш–Ы–§, –љ–∞–њ—А–Њ—В–Є–≤, —Г—Б–Є–ї–µ–љ–љ–Њ –µ–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г—О—В. –Я–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, —Н—В–Њ—В –њ—А–Њ—Ж–µ—Б—Б, –њ–Њ –Љ–µ–љ—М—И–µ–є –Љ–µ—А–µ —З–∞—Б—В–Є—З–љ–Њ, —Б–≤—П–Ј–∞–љ —Б —Б–µ–Ї—А–µ—Ж–Є–µ–є –ґ–µ–ї–∞—В–Є–љ–∞–Ј MMP-2 –Є MMP-9. –Т —Н—В–Њ–Љ –Ї–Њ–љ—В–µ–Ї—Б—В–µ –Ї–∞–Ї MMP-2, —В–∞–Ї –Є MMP-9 –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –≤ —Б—Г–±—Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –Љ–Є–Њ—Д–Є–±—А–Њ–±–ї–∞—Б—В–∞—Е, –∞ –Є–љ–Њ–≥–і–∞ –Є –≤ –Ј–Њ–љ–∞—Е –Њ–±–љ–∞–ґ–µ–љ–љ–Њ–є –∞–ї—М–≤–µ–Њ–ї—П—А–љ–Њ–є –±–∞–Ј–∞–ї—М–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л, —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ —В–Њ, —З—В–Њ —Н—В–Є –Ь–Ь–† –Љ–Њ–≥—Г—В –Є–≥—А–∞—В—М —А–Њ–ї—М –≤ –Љ–Є–≥—А–∞—Ж–Є–Є –Љ–Є–Њ—Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ –≤ –∞–ї—М–≤–µ–Њ–ї—П—А–љ—Л–µ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–∞. MMP-7 —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В—Б—П –≤ –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–љ—Л—Е —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е. MMP-7 —Б–Є–љ—В–µ–Ј–Є—А—Г–µ—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Њ–њ—Г—Е–Њ–ї—П–Љ–Є: –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, —В–Њ–ї—Б—В–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞, –њ—А–Њ—Б—В–∞—В—Л, –ґ–µ–ї—Г–і–Ї–∞, –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –Є –њ–Є—Й–µ–≤–Њ–і–∞, –ї–µ–≥–Ї–Є—Е –Є –Ї–Њ–ґ–Є.
–Я–µ—А–Є–Њ—Б—В–Є–љ. –°–Њ–Њ–±—Й–∞–ї–Њ—Б—М, —З—В–Њ –њ–µ—А–Є–Њ—Б—В–Є–љ –±—Л–ї –њ–Њ–≤—Л—И–µ–љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§, –љ–Њ –µ–≥–Њ –Є—Б—В–Њ—З–љ–Є–Ї–Є –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П –Њ—Б—В–∞—О—В—Б—П –љ–µ—П—Б–љ—Л–Љ–Є [11]. –Р–≤—В–Њ—А—Л –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є, —З—В–Њ —Г—А–Њ–≤–µ–љ—М –њ–µ—А–Є–Њ—Б—В–Є–љ–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –њ–Њ–≤—Л—И–∞–µ—В—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§, —З—В–Њ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –ґ–Є–Ј–љ–µ–љ–љ–Њ–є –µ–Љ–Ї–Њ—Б—В–Є –ї–µ–≥–Ї–Є—Е (FVC) –Є –і–Є—Д—Д—Г–Ј–Є–Њ–љ–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –ї–µ–≥–Ї–Є—Е (DL—Б–Њ) [12]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–µ—А–Є–Њ—Б—В–Є–љ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –≤ –Њ–ї–Є–≥–Њ–Љ–µ—А–љ–Њ–є —Д–Њ—А–Љ–µ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Є –Љ–Њ–љ–Њ–Љ–µ—А–љ—Л–є –њ–µ—А–Є–Њ—Б—В–Є–љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –Ї–∞–Ї –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞—П –µ–≥–Њ —Д—А–∞–Ї—Ж–Є—П [13]. –Ф–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є–і–∞–µ—В—Б—П –Є–Љ–µ–љ–љ–Њ –Љ–Њ–љ–Њ–Љ–µ—А–љ–Њ–Љ—Г –њ–µ—А–Є–Њ—Б—В–Є–љ—Г, —Г—А–Њ–≤–µ–љ—М –Ї–Њ—В–Њ—А–Њ–≥–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –њ—А–Є –Ш–Ы–§ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, —В–∞–Ї–ґ–µ —Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є —Б —Г—А–Њ–≤–љ–µ–Љ –њ–µ—А–Є–Њ—Б—В–Є–љ–∞ (–±–Њ–ї–µ–Ј–љ—М –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞, —Б–Є—Б—В–µ–Љ–љ–∞—П —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–Є—П –Є –±—А–Њ–љ—Е–Є–∞–ї—М–љ–∞—П –∞—Б—В–Љ–∞).
–С–Є–Њ–Љ–∞—А–Ї–µ—А—Л –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ—А–Њ–≥–љ–Њ–Ј–∞ –Ш–Ы–§
–Э–∞ –Њ–±–Њ—Б—В—А–µ–љ–Є–µ –Ш–Ы–§ –Љ–Њ–ґ–µ—В —Г–Ї–∞–Ј—Л–≤–∞—В—М –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ–µ–є —Б—Г—А—Д–∞–Ї—В–∞–љ—В–Њ–≤. –Т —А–∞–±–Њ—В–∞—Е –Њ—В–Љ–µ—З–∞–ї–∞—Б—М —Б–≤—П–Ј—М –≤—Л—Б–Њ–Ї–Њ–≥–Њ —Г—А–Њ–≤–љ—П SP-A —Б–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —Б–Љ–µ—А—В–Є –±–Њ–ї—М–љ—Л—Е –Ш–Ы–§. –Т—Л—П–≤–ї–µ–љ–∞ —В–∞–Ї–ґ–µ –∞–љ–∞–ї–Њ–≥–Є—З–љ–∞—П –≤—Л—А–∞–ґ–µ–љ–љ–∞—П —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ SP-D –Є –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —Б–Љ–µ—А—В–Є [8]. –Т –Њ–і–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Љ–†–Э–Ъ IL-8 –Є –±–µ–ї–Њ–Ї IL-8 –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Є —Б —В—П–ґ–µ—Б—В—М—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [12]. Ley et al. —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–і–Є–Ї—В–Њ—А–∞ —Б–Љ–µ—А—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§ –Є–љ–і–µ–Ї—Б GAP, –≤–Ї–ї—О—З–∞—О—Й–Є–є –њ–Њ–ї, –≤–Њ–Ј—А–∞—Б—В –Є 2 –њ–µ—А–µ–Љ–µ–љ–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Є –ї–µ–≥–Ї–Є—Е (FVC –Є DLco), –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–є –љ–∞ –њ—А–Њ—Б—В–Њ–є —Б–Є—Б—В–µ–Љ–µ –њ–Њ–і—Б—З–µ—В–∞ –Њ—З–Ї–Њ–≤ –Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л–є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П 558 –±–Њ–ї—М–љ—Л—Е —Б –Ш–Ы–§ [14]. –Ґ–Њ–ї—М–Ї–Њ –Є–љ–і–µ–Ї—Б GAP, –ї—Г—З–µ–≤–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Є –±–Є–Њ–Љ–∞—А–Ї–µ—А—Л —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ –Љ–Њ–≥—Г—В –њ–Њ–≤—Л—Б–Є—В—М —В–Њ—З–љ–Њ—Б—В—М –Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ—А–Њ–≥–љ–Њ–Ј–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§.–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ —П–њ–Њ–љ—Б–Ї–Є–Љ–Є —Г—З–µ–љ—Л–Љ–Є, –∞–≤—В–Њ—А—Л —Б—А–∞–≤–љ–Є–ї–Є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О –Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О —Ж–µ–љ–љ–Њ—Б—В—М —А—П–і–∞ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ—Л—Е –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ (–Ь–Ь–†-7, CCL18, KL-6, SP-A –Є SP-D) –≤ –≥—А—Г–њ–њ–µ –Ш–Ы–§ –Є –≥—А—Г–њ–њ–∞—Е —Б—А–∞–≤–љ–µ–љ–Є—П [15]. –Т —В–∞–±–ї–Є—Ж–µ 1 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ —Б—Г–±—К–µ–Ї—В–Њ–≤, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є [15].
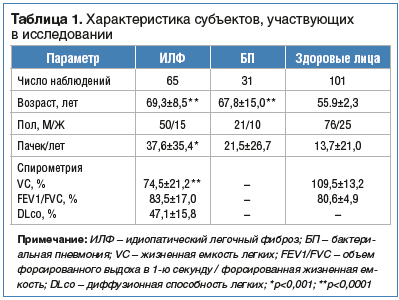
–†–∞–Ј–ї–Є—З–Є—П –Ј–љ–∞—З–µ–љ–Є–є –њ—П—В–Є –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ (–Ь–Ь–†-7, CCL18, KL-6, SP-A –Є SP-D) –Љ–µ—В–Њ–і–Њ–Љ –∞–љ–∞–ї–Є–Ј–∞ –Ї—А–Є–≤–Њ–є ROC —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§ (n=65), –±–Њ–ї—М–љ—Л—Е —Б –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є (n=31) –Є –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж (n=101) –Њ—В—А–∞–ґ–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 2 [15].
![–Ґ–∞–±–ї–Є—Ж–∞ 2. –†–∞–Ј–ї–Є—З–Є—П –Ј–љ–∞—З–µ–љ–Є–є –њ—П—В–Є –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ (–Ь–Ь–†-7, CCL18, KL-6, SP-A –Є SP-D) –Љ–µ—В–Њ–і–Њ–Љ –∞–љ–∞–ї–Є–Ј–∞ –Ї—А–Є–≤–Њ–є ROC —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§ (n=65), –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є (n=31) –Є –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж (n=101) [15] –Ґ–∞–±–ї–Є—Ж–∞ 2. –†–∞–Ј–ї–Є—З–Є—П –Ј–љ–∞—З–µ–љ–Є–є –њ—П—В–Є –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ (–Ь–Ь–†-7, CCL18, KL-6, SP-A –Є SP-D) –Љ–µ—В–Њ–і–Њ–Љ –∞–љ–∞–ї–Є–Ј–∞ –Ї—А–Є–≤–Њ–є ROC —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§ (n=65), –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є (n=31) –Є –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж (n=101) [15]](/upload/medialibrary/f4a/6-3.png)
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П —Г—А–Њ–≤–љ–µ–є –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ MMP-7, CCL18, KL-6, SP-A –Є SP-D —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§, –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є –Є –≥—А—Г–њ–њ–Њ–є –Ї–Њ–љ—В—А–Њ–ї—П (–Ј–і–Њ—А–Њ–≤—Л–µ –ї–Є—Ж–∞) –њ–Њ–Ї–∞–Ј–∞–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 2 [15].
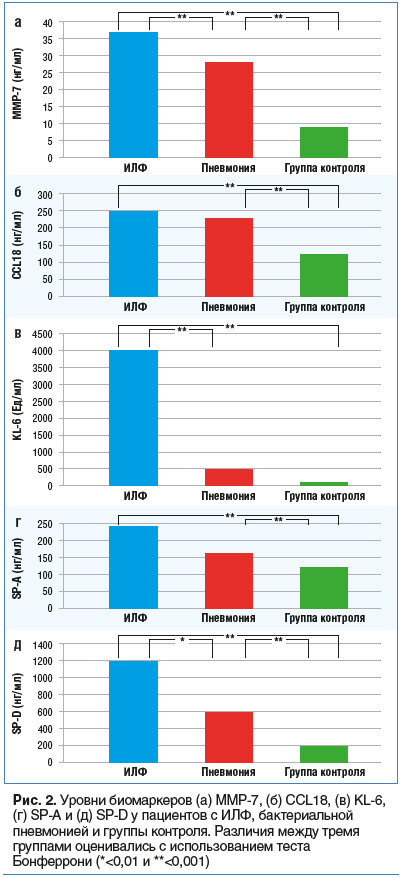
–Ґ–∞–Ї–ґ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Њ, –Ї–∞–Ї–Є–µ –±–Є–Њ–Љ–∞—А–Ї–µ—А—Л —П–≤–ї—П—О—В—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ–Є –њ—А–µ–і–Є–Ї—В–Њ—А–∞–Љ–Є –њ—А–Њ–≥–љ–Њ–Ј–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§. –Ь–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ—Л–є –∞–љ–∞–ї–Є–Ј –Ъ–Њ–Ї—Б–∞ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є, –Є–Ј—Г—З–µ–љ–љ—Л—Е –≤ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ –≤ –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§, –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є –Є –≥—А—Г–њ–њ–µ –Ї–Њ–љ—В—А–Њ–ї—П, –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ —Г—А–Њ–≤–љ–Є –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ MMP-7 –Є KL-6 —П–≤–ї—П—О—В—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ–Є –њ—А–µ–і–Є–Ї—В–Њ—А–∞–Љ–Є –њ—А–Њ–≥–љ–Њ–Ј–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ MMP-7 –Є KL-6 –±—Л–ї–Є –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є, –∞ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –і–≤—Г—Е –Љ–∞—А–Ї–µ—А–Њ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–∞ –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–Љ—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—О —Б–Љ–µ—А—В–љ–Њ—Б—В–Є. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В, —З—В–Њ –Є MMP-7, –Є KL-6 —П–≤–ї—П—О—В—Б—П –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ–Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ–Є –Љ–∞—А–Ї–µ—А–∞–Љ–Є –Ш–Ы–§, –∞ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –і–≤—Г—Е –Љ–∞—А–Ї–µ—А–Њ–≤ —Б–њ–Њ—Б–Њ–±–љ–∞ —Г–ї—Г—З—И–Є—В—М –Њ—Ж–µ–љ–Ї—Г –њ—А–Њ–≥–љ–Њ–Ј–∞ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –∞–≤—В–Њ—А—Л –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ MMP-7 –Є KL-6 –Љ–Њ–≥—Г—В —З–µ—В–Ї–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§ –Њ—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є –Є –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж, —З—В–Њ –µ—Й–µ —А–∞–Ј —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –Є—Е –њ–Њ—В–µ–љ—Ж–Є–∞–ї –Ї–∞–Ї –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤.
–Ъ–Њ—А—А–µ–ї—П—Ж–Є–Є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§, —А–∞–Ј–і–µ–ї–µ–љ–љ—Л—Е –љ–∞ 3 –≥—А—Г–њ–њ—Л –њ–Њ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—О —А–∞–Ј–ї–Є—З–љ—Л—Е –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ –Є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 3.

–Э–∞—Б—В–Њ—П—Й–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –Ї–∞–Ї MMP-7, —В–∞–Ї –Є KL-6 –±—Л–ї–Є –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В–Њ–Љ, —З—В–Њ –Њ—Ж–µ–љ–Ї–∞ –Њ–±–Њ–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –њ—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –њ–Њ–і–≥—А—Г–њ–њ—Л –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞, —З–µ–Љ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–µ –Њ—Ж–µ–љ–Ї–Є –Њ–±–Њ–Є—Е –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П, —З—В–Њ MMP-7, —Б–µ–Љ–µ–є—Б—В–≤–Њ —Ж–Є–љ–Ї—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ —Б –њ—А–Њ—В–µ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –Є KL-6, –≤—Л—Б–Њ–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–є –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ, –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –Ї–∞–Ї –Љ—Г—Ж–Є–љ MUC1, —Г—З–∞—Б—В–≤—Г—О—В –≤ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –Ш–Ы–§ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є –Є —В—А–µ–±—Г—О—В –і–∞–ї—М–љ–µ–є—И–Є—Е –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [16].
–С–Є–Њ–Љ–∞—А–Ї–µ—А—Л –і–ї—П –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–∞—А–≥–µ—В–љ–Њ–є –∞–љ—В–Є—Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є
–£–≤–µ–ї–Є—З–µ–љ–Є–µ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–∞ –Ь–Ь–†-8 –Є –Ь–Ь–†-9 –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Є—Е –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ –Є–љ–≥–Є–±–Є—В–Њ—А–∞, —В–Ї–∞–љ–µ–≤–Њ–≥–Њ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј—Л-1 (TIMP-1) [17]. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –Њ–±—К–µ–і–Є–љ–µ–љ–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Н—В–Є—Е –і–≤—Г—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ –Љ–Њ–ґ–µ—В —А–∞–Ј—А—Г—И–Є—В—М —Д–Є–±—А–Є–ї–ї—П—А–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ –Є –±–∞–Ј–∞–ї—М–љ—Л–µ –Љ–µ–Љ–±—А–∞–љ—Л –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤ –ї–µ–≥–Њ—З–љ–Њ–≥–Њ –Є–љ—В–µ—А—Б—В–Є—Ж–Є—П, –Є—Е —Г—Б–Є–ї–µ–љ–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –±—Г–і–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —А–∞–Ј—А—Г—И–µ–љ–Є—О –Љ–∞—В—А–Є—Ж—Л –Є —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—О –≤ —А–∞–Ј–≤–Є—В–Є–Є —Д–Є–±—А–Њ–Ј–∞. –Р–љ–∞–ї–Є–Ј –Ь–Ь–†-8 –Є –Ь–Ь–†-9 –Є–Ј –±—А–Њ–љ—Е–Њ–∞–ї—М–≤–µ–Њ–ї—П—А–љ–Њ–є –ї–∞–≤–∞–ґ–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –Љ–Њ–ґ–µ—В –Њ–±–µ—Б–њ–µ—З–Є—В—М –њ–Њ–ї–µ–Ј–љ—Л–µ –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –Љ–∞—А–Ї–µ—А—Л –і–ї—П –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е –Ш–Ы–§ –Є —Б–∞—А–Ї–Њ–Є–і–Њ–Ј–Њ–Љ –ї–µ–≥–Ї–Є—Е –≤ –±—Г–і—Г—Й–µ–Љ.–Ш–љ—В–µ—А–µ—Б–љ–Њ –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М, –Љ–Њ–ґ–µ—В –ї–Є –Љ–Њ–љ–Њ–Љ–µ—А–љ—Л–є –њ–µ—А–Є–Њ—Б—В–Є–љ –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і–≤—Г—Е –Њ–і–Њ–±—А–µ–љ–љ—Л—Е –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–Љ –Ї–Њ–Љ–Є—В–µ—В–Њ–Љ –њ–Њ –Ш–Ы–§ ATS/ERS/JRS/ALAT –∞–љ—В–Є—Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ вАФ –њ–Є—А—Д–µ–љ–Є–і–Њ–љ–∞ –Є –љ–Є–љ—В–∞–і–∞–љ–Є–±–∞ [18]. –•–Њ—В—П –Є –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Н—В–Є –њ—А–µ–њ–∞—А–∞—В—Л —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ы–§, –љ–Њ –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ –љ–∞–є–і–µ–љ—Л —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–µ –±–Є–Њ–Љ–∞—А–Ї–µ—А—Л –њ—А–Њ–≥–љ–Њ–Ј–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—В–Є—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –±—Л —А–∞–Ј—А–∞–±–Њ—В–∞—В—М –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Г—О —В–∞–Ї—В–Є–Ї—Г –≤–µ–і–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –Ш–Ы–§.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –љ–∞—Г—З–љ—Л—Е –њ–Њ–Ј–Є—Ж–Є–є –њ–∞—В–Њ–≥–µ–љ–µ–Ј –Ш–Ы–§ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї 3-—Б—В–∞–і–Є–є–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –ї–µ–≥–Њ—З–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П (–±—А–Њ–љ—Е–Њ–∞–ї—М–≤–µ–Њ–ї—П—А–љ–Њ–≥–Њ –Є –∞–ї—М–≤–µ–Њ–ї—П—А–љ–Њ–≥–Њ) —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Д–Є–±—А–Њ–Ј –ї–µ–≥–Ї–Є—Е.–Ю—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ –Ш–Ы–§ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —Б–ї–µ–і—Г—О—Й–µ–µ. –° –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ-–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –њ—А–Є –њ–Њ–і–Њ–Ј—А–µ–љ–Є–Є –љ–∞ –Ш–Ы–§ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М —Г—А–Њ–≤–µ–љ—М —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ SP-A. –Ф–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П —А–Њ–ї—М –і—А—Г–≥–Є—Е –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ –љ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞. –Я—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –њ—А–Њ–≥–љ–Њ–Ј–∞ –Ш–Ы–§ –Љ–Њ–ґ–µ—В –Є–Љ–µ—В—М –Ј–љ–∞—З–µ–љ–Є–µ IL-8, —Г—А–Њ–≤–µ–љ—М –Ї–Њ—В–Њ—А–Њ–≥–Њ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б —В—П–ґ–µ—Б—В—М—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –Њ–±—А–∞—В–љ–Њ –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ–ґ–і—Г –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ –Ь–Ь–†-7 –Є KL-6 –Є –њ—А–Њ–≥–љ–Њ–Ј–Њ–Љ 5-–ї–µ—В–љ–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –Ш–Ы–§, –Њ–і–љ–∞–Ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г—Б—В–∞–љ–Њ–≤–Є—В—М –Є—Е –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О –Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О —А–Њ–ї—М –µ—Й–µ –њ—А–µ–і—Б—В–Њ–Є—В. –Я—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Є–љ—В–µ—А–µ—Б –Є–Ј—Г—З–µ–љ–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ –Ш–Ы–§ –љ–µ –њ–Њ –Њ—В–і–µ–ї—М–љ–Њ—Б—В–Є, –∞ –≤ —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є. –Ь–∞–ї–Њ —Б–µ—А—М–µ–Ј–љ—Л—Е —А–∞–±–Њ—В –≤ –Њ–±–ї–∞—Б—В–Є –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –њ–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤, –Є –Є–Љ–µ—О—Й–Є—Е—Б—П –і–∞–љ–љ—Л—Е –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–∞–ґ–µ –і–ї—П –≤—Л–і–µ–ї–µ–љ–Є—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –њ—А–Є–≥–Њ–і–љ–Њ–≥–Њ –±–Є–Њ–Љ–∞—А–Ї–µ—А–∞ –і–ї—П —В–∞–Ї–Є—Е —Ж–µ–ї–µ–є. –Х—Й–µ –Њ–і–љ–Є–Љ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е –Ї –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —П–≤–ї—П–µ—В—Б—П –Є—Е –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ф–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П –Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –±–Є–Њ–Љ–∞—А–Ї–µ—А–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –Ш–Ы–§ –Љ–Њ–ґ–µ—В –±—Л—В—М —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —В–Њ–ї—М–Ї–Њ —Б —Г—З–µ—В–Њ–Љ –Ї–ї–Є–љ–Є–Ї–Њ-–∞–љ–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є—Е, —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є, –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤, –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.








.gif)



