Дефиниции и эпидемиология
Неалкогольная жировая болезнь печени (НАЖБП) — термин, объединяющий различные патологические состояния печени, при которых происходит отложение жировых капель в ее паренхиме, что в дальнейшем может приводить к формированию гепатита, фиброза, цирроза и, в некоторых случаях, гепатоцеллюлярной карциномы. Наиболее частыми формами заболевания являются неалкогольный стеатогепатоз, характеризующийся стеатозом печени, затрагивающим более 5% паренхимы, без признаков повреждения гепатоцитов. Неалкогольный стеатогепатит (НАСГ) представляет собой воспалительный процесс, при котором происходит повреждение гепатоцитов на фоне стеатоза [1].Согласно эпидемиологическим исследованиям DIREG 1 и DIREG 2 (обследовано более 50 тыс. человек), у 37% пациентов, обращающихся к врачам общей практики, имеется НАЖБП. Распространенность неалкогольной нецирротической жировой болезни печени прогрессивно возрастала по мере увеличения возраста пациентов с 2,9% (12–17 лет) до 42,96% (60–69 лет). Максимальная распространенность неалкогольного стеатоза отмечена в возрастной группе 70–80 лет (34,26%), НАСГ — у пациентов 50–59 лет (10,95%). Особую обеспокоенность вызывает неуклонный рост распространенности НАЖБП у детей и подростков, что связано с увеличением числа детей, страдающих ожирением, – в этой когорте НАЖБП встречается в 40–70% случаев [2].
Наиболее частыми причинами смерти на фоне НАЖБП являются сердечно-сосудистые заболевания (ССЗ) (смертность от 13 до 30%), онкологические заболевания (смертность от 6 до 28%) и смерть, связанная с заболеваниями печени (заболеваемость от 2,8 до 19%). Однако НАЖБП не только предиктор сердечно-сосудистых событий — она вовлечена в их патогенез путем секреции гепатокинов — белков, которые влияют на метаболические процессы при помощи аутокринного, паракринного и эндокринного сигналинга. НАЖБП может сочетаться с алкогольным поражением печени у пациентов с метаболическим синдромом (МС) при приеме алкоголя более 40 г/сут для мужчин и более 20 г/сут для женщин, что может привести к более агрессивному течению заболевания [3].
Теория «множественных ударов»
В 1998 г. была предложена гипотеза «двух ударов», получившая широкое распространение. Согласно этой гипотезе, «первый удар» — это формирование стеатоза печени в результате увеличенного поступления в нее свободных жирных кислот (СЖК) и инсулинорезистентности (ИР). Этот удар повышает чувствительность печени ко «второму удару» — окислительному стрессу, который вызывает воспаление,клеточную гибель и фиброз с формированием НАСГ [4].
В свете новых данных эта теория кажется чересчур упрощенной, и все больше внимания получает гипотеза «множественных ударов» (рис. 1). Под воздействием диетических, экологических факторов, ожирения повышается уровень СЖК и холестерола (ХС), развиваются ИР, пролиферация и дисфункция адипоцитов, а также изменения в кишечном микробиоме. ИР воздействует на жировую ткань, усугубляя дисфункцию адипоцитов, индуцирует липолиз и выброс адипокинов, гепатокинов, провоспалительных цитокинов, таких как фактор некроза опухоли альфа (ФНО-α) и интерлейкин (ИЛ)-6, которые, в свою очередь, тоже вносят вклад в поддержание состояния ИР.
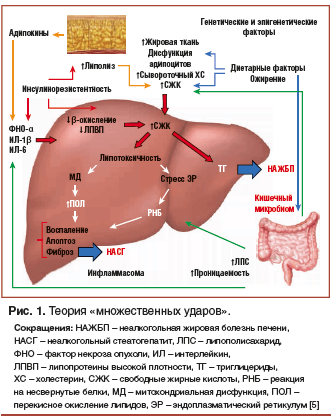
Печеночная ИР способствует липогенезу de novo. Увеличенный поток СЖК в печень, который провоцируется как вышеназванными процессами, так и изменением активности кишечного микробиома, приводит к двум патогенетическим сценариям: синтезу и аккумуляции триглицеридов (ТГ) и «токсическому» уровню СЖК, свободного ХС и других липидных метаболитов, которые приводят к митохондриальной дисфункции с оксидативным стрессом и продукцией реактивных форм кислорода; стрессу эндоплазматического ретикулума с активацией «реакции на несвернутые белки» (unfolded protein response). Эти факторы в совокупности потенцируют воспаление печени. Кроме того, проницаемость тонкого кишечника усиливается, что приводит к повышению уровня ряда циркулирующих молекул, в т. ч. полисахаридов, которые вносят значительный вклад в развитие стресса эндоплазматического ретикулума, активации инфламмасом и выброса провоспалительных цитокинов. Содержание жира в гепатоцитах зависит также от генетических и эпигенетических факторов [1, 3, 5, 6].
В последние годы интенсивно изучаются молекулярно-клеточные механизмы развития НАЖБП, в первую очередь связанные c функциональной активностью печеночных рецепторов, в частности, печеночного фарнезоидного Х-рецептора (FXR). FXR — рецептор желчных кислот, который экспрессируется в печени, кишечнике, почках и жировой ткани. Он является регулятором большого числа генов, ответственных за синтез и транспорт желчных кислот, метаболизм липидов и гомеостаз глюкозы. FXR также контролирует метаболизм глюкозы и гликогенолиз в печени, «метаболическую память» гепатоцита, чувствительность к инсулину периферических тканей (поперечно-полосатых мышц и жировой ткани) [6].
Вопросы диагностики НАЖБП
Диагноз НАЖБП является классическим примером диагноза исключения и правомочен, когда имеются признаки печеночного стеатоза (по данным визуализирующих методов исследования или гистологии) в отсутствие других причин, способствующих накоплению жира в печени, таких как прием алкоголя в гепатотоксичных дозах, гепатотоксичных препаратов, наличие вирусных гепатитов или наследственных заболеваний. Если у пациента предполагается наличие НАЖБП, очень важно исключить другие хронические заболевания печени, такие как гемохроматоз, аутоиммунные заболевания печени и болезнь Вильсона. Небольшое повышение уровня ферритина в крови — распространенный признак у пациентов с НАЖБП, который не требует дополнительного исследования уровня сывороточного железа. При повышении уровня ферритина и насыщения трансферрина у пациентов с предполагаемой НАЖБП показано проведение дополнительного исследования, исключающего наследственный гемохроматоз. Наличие повышенного титра аутоантител в ассоциации с другими признаками, которые заставляют предположить наличие аутоиммунного заболевания печени (значительное повышение уровня аминотрансфераз, высокий уровень глобулина), должно привести к целенаправленному поиску аутоиммунного заболевания печени.Биопсия печени является наиболее достоверным методом для выявления наличия НАСГ или фиброза у пациентов с НАЖБП, но общеизвестно, что данный метод ограниченно применяется в практическом здравоохранении в связи с высокой стоимостью, вариабельностью результатов в зависимости от локализации участка забора материала, инвазивностью и риском осложнений. Уровень печеночных аминотрансфераз и визуализирующие методы исследования (ультразвуковой метод, компьютерная томография и магнитно-резонансный метод) не являются надежными для исключения НАСГ и фиброза [3, 7].
В настоящее время повышен интерес к поиску неинвазивных методик исследования печени. Для оценки фиброза неинвазивным методом используются Шкала оценки стадии фиброза при НАЖБП (NAFLD fibrosis score), расширенная панель фиброза печени (ELF) и транзиентная эластография. NAFLD fibrosis score основана на 6 параметрах, которые включают в себя возраст, индекс массы тела (ИМТ), наличие диабета/предиабета, соотношение АСТ/АЛТ, количество тромбоцитов, уровень альбумина. Значение NAFLD fibrosis score ≤1,455 позволяет исключить наличие выраженного фиброза печени (стадии 3–4), показатель >0,676 свидетельствует в пользу стадии фиброза F3. Транзиентная эластография впервые была разработана для оценки фиброза печени у пациентов с хроническим гепатитом С, у которых она показала хорошую корреляцию со стадией фиброза по шкале METAVIR. Данный метод исследования позволяет судить об изменении эластических свойств печени на основании отраженных вибрационных импульсов и их последующего компьютерного анализа [3].
Применение эластографии возможно на всех стадиях фиброза (F0–F4). К преимуществам метода относятся неинвазивность, воспроизводимость (в 100–200 раз большая, чем при биопсии), оцениваемый объем ткани печени, быстрота и удобство применения, немедленный ответ, оценка эффективности терапии, возможность обследования детей. С помощью этих тестов можно также определить субгруппы пациентов с высоким риском развития осложнений и смерти [8]. Интерпретация результатов эластографии затруднена в случаях избыточной массы тела (ИМТ > 35 кг/м2), выраженного стеатоза печени, значительной активности АЛТ и АСТ (выше верхней границы нормы в 3 и более раз). Метод транзиентной эластографии является хорошим скрининговым методом для принятия решения о необходимости проведения биопсии печени. Проведение биопсии печени может потребоваться пациентам с упругостью печени >7,9 кПа с использованием М-датчика (7,2 кПа с XL-датчиком). Предполагалось, что цитокератин-18 может стать новым биомаркером наличия НАСГ у пациентов с НАЖБП. Необходимо проведение дальнейших исследований для получения достоверных результатов [3].
НАЖБП и кишечный микробиом
В кишечнике взрослого человека находится примерно 1013–1014 бактерий, а их геном более чем в 100 раз больше, чем человеческий. Для понимания роли кишечного микробиома в развитии хронических неинфекционных заболеваний V. Ridaura et al. (2013) провели ряд экспериментов на мышах (рис. 2) [9]. В частности, они брали экскременты 4 пар близнецов, дискордантных по ожирению, и помещали их в кишечник стерильных мышей. Животные, получавшие трансплантаты от близнецов с ожирением, сами в последующем приобретали избыточную массу тела, а мыши, которым пересаживался кал от близнецов с низкой массой тела, оставались худыми [10]. Последовавшие эксперименты на людях также продемонстрировали вовлеченность кишечной микробиоты в патогенетические механизмы развития ожирения и ИР [11–13].![Рис. 2. Опыт V. Ridaura et al., свидетельствующий о роли кишечной микробиоты в развитии ожирения [9] Рис. 2. Опыт V. Ridaura et al., свидетельствующий о роли кишечной микробиоты в развитии ожирения [9]](/upload/medialibrary/cc6/23-2.png)
Несмотря на широкое микробное разнообразие, наиболее распространены 4 типа кишечных бактерий: фирмикуты и бактероиды, которые составляют 90% микробиома, а также актинобактерии и протеобактерии [14]. При ожирении увеличивается относительная доля фирмикутов по отношению к бактероидам. Одним из возможных объяснений этого служит то, что фирмикуты, содержащие больше генов, ассоциированных с метаболизмом углеводов и липидов, обеспечивают более полный метаболизм данных энергетических ресурсов и гликолиз трудноперевариваемых полисахаридов, что обусловливает более эффективную абсорбцию калорий и последующий набор массы тела [15, 16]. В последующем эктопированные депозиты висцерального жира приводят к избыточной продукции адипокинов и СЖК, что вносит вклад в развитие ИР и поддержание общего воспалительного фона. Также микробиом инициирует воспалительный процесс за пределами кишки через поступление эндотоксинов, липополисахаридов и короткоцепочечных жирных кислот в кровь, что активизирует ядерный фактор κB (NF-κB), который, в свою очередь, способствует повышению уровня многофункциональных провоспалительных цитокинов ФНО-α и ИЛ-1β [12]. Необходимо также отметить, что кишечная микрофлора участвует в производстве ферментов, катализирующих трансформацию холина в его токсические провоспалительные метаболиты. С другой стороны, дефицит холина сам по себе способствует накоплению ТГ в печени и гепатостеатозу [17].
Одним из дополнительных механизмов, связывающих ИР с кишечным дисбиозом, является метаболизм желчных кислот. Тонкокишечный дисбиоз приводит к нарушению билиарного обмена ХС, а поврежденные желчные кислоты в тонкой кишке могут ослаблять кишечную микробиоту. FXR — один из главных регуляторов желчного метаболизма, вовлеченный во все фазы их биосинтетического пути. При дефиците FXR у мышей на 1% холестероловой диете увеличивалось содержание печеночного ХС и ТГ, отражая потенциальную роль FXR в превенции НАЖБП. Стимуляция FXR ингибирует NF-κB и уменьшает выраженность печеночного воспаления. В последнее время этому направлению уделяется особое внимание. Едва уловимые изменения в структуре желчных кислот могут привести к значительным изменениям их сигнальных характеристик. Для наглядного примера достаточно указать, что этиловая группа хенодезоксихолевой кислоты в 6-м положении углерода влияет на возможность связи этой молекулы с FXR [3, 18].
Концепция локальных жировых депо
НАЖБП традиционно рассматривается как печеночная манифестация МС, в основе которого лежат ИР и андроидное ожирение. Хорошо известно, что МС ассоциирован с высоким риском ССЗ, однако в последние годы появились резонансные данные о том, что пациенты с избыточной массой тела и ожирением I степени живут дольше, чем лица с нормальным весом, имея при этом лучший сердечно-сосудистый прогноз. Этот феномен известен как «парадокс ожирения», признан мировым медицинским сообществом и вошел в ряд клинических рекомендаций для кардиологов, терапевтов и эндокринологов [19, 20].В связи с этим интересна концепция локальных жировых депо, которые, в отличие от общего ожирения, возможно, обусловленного избытком подкожного жира, ассоциированы с эктопией висцеральной жировой ткани, локализованной в эпикарде, паранефруме, печени и периваскулярно. Такие жировые депо представлены белой жировой тканью и выделяют ряд проатерогенных и провоспалительных хемокинов и цитокинов (ИЛ-1, ИЛ-6, ИЛ-8, ФНО-α, трансформирующий фактор роста, моноцитарный хемоаттрактивный протеин-1, регулятор активности нормальной экспрессии и секреции Т-клеток, индуцируемый интерфероном белок, ингибитор активатора плазминогена I типа), что вызывает воспаление сосудистой стенки, эндотелиальную дисфункцию, формирование и прогрессирование атеросклеротических бляшек [21]. Есть мнение, что наличие локального жирового депо в печени как эктопического компартмента белого жира может быть более значимым предиктором ССЗ и нарушений углеводного обмена, чем абдоминальное ожирение per se, традиционно считающееся классическим фактором риска сахарного диабета 2 типа (СД2) и ишемической болезни сердца (ИБС) [22]. Эту позицию разделяет и Т. И. Романцова с соавт., много лет глубоко изучающая проблемы ожирения, которая подчеркивает сопряженность наличия жировых отложений в печени с гиперинсулинемией, ИР, оксидативным стрессом, увеличенным уровнем ТГ, сниженными уровнями ХС ЛПВП и адипонектина [23, 24].
Диссоциация ИР и печеночного стеатоза
Взаимосвязь между ИР и НАЖБП позволяет предположить, что НАЖБП является маркером и активатором ИР/гиперинсулинемии. Однако стоит вспомнить, что иногда можно увидеть диссоциацию между печеночным стеатозом и ИР, причины которой на сегодняшний день не до конца понятны. Например, пациенты с липодистрофией, ассоциированной с высокоинтенсивной антиретровирусной терапией, часто имеют выраженную ИР при отсутствии ожирения и НАЖБП [25]. И, напротив, у мышей чрезмерная экспрессия диацилглицеролацетилтрансферазы в печени, блокада секреции липидов очень низкой плотности (ЛПОНП) и фармакологическая блокада бета-оксидации могут вызывать печеночный стеатоз в отсутствие печеночной и мышечной ИР, в то время как ингибирование синтеза ТГ у мышей с ожирением уменьшает печеночный стеатоз, но не улучшает ИР. Также стоит упомянуть, что печеночный стеатоз, вызванный генетическим дефектом синтеза аполипопротеина В и сниженной секрецией ЛПОНП при семейной гипобеталипопротеинемии, не сопровождается ИР [3].НАЖБП и сердечно-сосудистые заболевания
Доказана взаимосвязь НАЖБП и высокого риска ССЗ, поэтому осуществлялись попытки включения НАЖБП в калькуляторы кардиоваскулярного риска. Своеобразный кардиологический плейотропизм НАЖБП в рамках кардиометаболического континуума продемонстрирован в научных работах, определивших, что у пациентов с НАЖБП, наряду с большей распространенностью традиционных факторов риска развития кардиоваскулярной патологии (ожирение, СД, МС и др.), встречаются «новые» (или «замещающие») маркеры высокого риска, такие как увеличение толщины перикардиального жира, эндотелиальная дисфункция, скорость пульсовой волны, утолщение комплекса интима — медиа, высокая концентрация С-реактивного белка, высокий индекс коронарного кальциноза, а также позиции, объединенные Фремингемской шкалой (пол, возраст, артериальная гипертензия (АГ), гиперлипидемия, курение). По современным представлениям, данные факторы риска ассоциированы с развитием ССЗ не меньше, а в некоторых случаях — даже больше, чем «традиционные» [26–31].Патогенетические связи НАЖБП и ССЗ можно проследить с детского возраста. S. Madan et al. (2015) провели метаанализ 5 клинических исследований на педиатрической популяции, проводившихся с 2008 г., включавший 1121 участника в возрасте от 10 до 13,3 года. Было установлено, что у детей с НАЖБП частота субклинического атеросклероза сонных артерий достигала 62,5% по сравнению с 12,4% в группе контроля [32].
Новые обсервационные исследования у взрослых демонстрируют, что пациенты с НАЖБП имеют более высокий риск нарушений сердечного ритма и проводимости, включая фибрилляцию предсердий, удлинение интервала QT и желудочковые аритмии [30], что может быть ассоциировано с параллелизмом развития фибротических изменений, представляющих аритмогенный субстрат, не только в печени, но и в миокарде. Показано, что избыточная продукция атерогенных липидов и провоспалительных медиаторов коррелирует с ультраструктурными и клеточными изменениями в миокарде, такими как выраженные нарушения диастолической функции, изменения потенциала действия и порога возбудимости кардиомиоцита [33, 34].
Ряд публикаций свидетельствует о наличии гендерных особенностей ассоциаций НАЖБП с факторами риска ССЗ, в частности, более благоприятного липидного спектра у женщин: у мужчин с НАЖБП выше уровень ТГ, отношение ТГ/ХС ЛПВП [35]. Однако клиническая значимость выявленных различий дискутабельна, поскольку повышение уровня ТГ на 1,0 ммоль/л в большей степени влияет на относительный риск развития ИБС у женщин — повышение на 69% в сравнении с 30-процентной эскалацией риска у мужчин [36]. Накопленные на сегодняшний день данные доказательной медицины не вызывают сомнений в вопросах безопасности применения статинов у пациентов с НАЖБП, в т. ч. при повышении уровня печеночных трансаминаз до трех верхних границ нормы. В то же время некоторые исследователи получили результаты, свидетельствующие об их меньшей эффективности при наличии НАЖБП, поскольку экспрессия рецепторов ЛПНП у таких пациентов является менее выраженной [37].
НАЖБП и сахарный диабет 2 типа
НАЖБП в 2–3 раза чаще встречается у пациентов с СД2 [38], а СД2 в 5–9 раз чаще встречается у пациентов с НАЖБП [39]. Наличие стеатогепатоза ассоциировано с худшими исходами в отношении сердечно-сосудистых, почечных и офтальмологических осложнений СД2, худшим гликемическим контролем, более выраженной гиперинсулинемией, дислипидемией, ИР жировой и печеночной ткани [40–42]. Наряду с этим в настоящее время появились убедительные доказательства того, что НАЖБП — не просто сопутствующее заболевание и «печеночная манифестация» МС у пациента с ожирением, а истинный предиктор и решающий фактор развития СД2. В 2016 г. опубликован систематический обзор, посвященный взаимосвязи НАЖБП и риска развития СД2. По данным включенных в этот обзор исследований, наличие НАЖБП связано с повышенным риском развития СД2, причем он варьирует в зависимости от тяжести НАЖБП. Дальнейшие исследования в этой области необходимы ввиду того, что почти все работы были проведены на различных азиатских популяциях [3].Предполагаемые механизмы, связывающие развитие НАЖБП и СД2, были описаны выше и включают атерогенную дислипидемию, печеночную и системную ИР, дисгликемию, увеличенную секрецию провоспалительных биомаркеров и гемостатико-фибринолитических факторов. В дополнение нужно упомянуть увеличенную продукцию глюкозы печенью и дисбаланс гепатокинов, в частности селенопротеина Р, фетуина А, фактора роста фибробластов 21, ретинол-связывающего протеина 4, ангиопоэтинподобного протеина [43]. Таким образом, печень наряду с эндотелием и жировой тканью можно рассматривать как эндокринный орган, вырабатывающий разнообразные гормоны, а нарушения в системе их продукции реализуются в манифестацию СД2.
НАЖБП у лиц с дефицитом массы тела
Не все пациенты с ожирением имеют НАЖБП, и, с другой стороны, возможно развитие НАЖБП у лиц с нормальной массой или с ее дефицитом, что вызывает ряд вопросов, ответы на которые пока четко не сформулированы. Интересно, что НАЖБП у лиц с дефицитом массы тела наиболее часто встречается среди лиц азиатской расы, даже с поправкой на более строгие значения ИМТ. По данным D. Kim et al. (2017), у азиатов встречаемость НАСГ и фиброза не отличается у лиц с ожирением и без такового [44]. В то же время у лиц с дефицитом массы тела НАЖБП имеет более мягкую гистологическую картину фибротических изменений [45]. В этом году были опубликованы результаты шведского исследования Н. Hagström et al. (2018), изучавших долгосрочный риск развития тяжелых печеночных осложнений у пациентов c НАЖБП, верифицированной путем биопсии, со средним периодом наблюдения 19,3 года. Около 19% пациентов составляли лица с ИМТ < 25 кг/м2. Исследователи обнаружили, что лица с дефицитом массы тела и НАЖБП обычно старше по возрасту и имеют более благоприятный базовый печеночный прогностический профиль (меньший уровень трансаминаз, меньшую выраженность фиброза, более низкую встречаемость НАСГ) по сравнению с таковыми у пациентов с избыточной массой тела и ожирением. Наряду с этим выявлен парадоксально худший прогноз в плане развития тяжелого НАСГ у пациентов с дефицитом массы тела и НАЖБП в долгосрочной перспективе (рис. 3) [46]. В то же время проведенный в 2017 г. крупный метаанализ 15 исследований показал, что НАЖБП у лиц с дефицитом массы тела несет те же метаболические и кардиоваскулярные риски, в конечном итоге приводящие к развитию СД2 и ИБС, что и НАЖБП при наличии ожирения [47].
НАЖБП у пациентов без ожирения и с его наличием может иметь ряд схожих патофизиологических механизмов, однако детальный патоморфоз заболевания не совсем понятен. Возможно, лидирующую роль играют генетические факторы, приверженность диете с повышенным содержанием простых сахаров и ХС, высокий процент висцерального жира (так называемое саркопеническое ожирение), а также дислипидемия [48–50]. А. Feld-
man et al. (2017) в недавнем наблюдательном исследовании на лицах европеоидной расы обнаружили, что у пациентов с дефицитом массы тела и НАЖБП чаще отмечаются нарушение толерантности к глюкозе и дисбаланс адипоцитокинов, в частности, более низкие концентрации адипонектина [51]. Возможно, печеночный стеатоз является маркером метаболического нездоровья, вне зависимости от ИМТ. В пользу этой теории свидетельствует ретроспективное когортное исследование, включившее 14 тыс. японцев, с периодом наблюдения 8 лет. Исходно исследуемые были разделены на 3 группы: метаболически здоровые без ожирения, метаболически здоровые с избыточной массой тела, метаболически здоровые с ожирением; жировая дегенерация печени диагностировалась методом УЗИ. В результате наблюдения было установлено, что НАЖБП является независимым от веса пациента фактором риска развития метаболически нездорового фенотипа, определяемого как наличие двух и более критериев: нарушение толерантности к глюкозе, АГ, гипертриглицеридемия и низкий уровень ХС ЛПВП [52].
Методы коррекции НАЖБП
До настоящего времени не существует фармакологических интервенций, имеющих прочную доказательную платформу. Пациентам необходимо рекомендовать физическую активность и снижение массы тела, что сложно достигнуть и еще сложнее поддерживать в долгосрочной перспективе. Метформин в совокупности с незначительной редукцией веса приводит к деликатному улучшению гистологической картины стеатоза, не влияя на процессы фиброза. Согласно клиническим рекомендациям Российского общества по изучению печени и Российской гастроэнтерологической ассоциации, метформин исключен из схемы лечения НАЖБП (применяется только при НАСГ у детей) [53].Тиазолидиндионы показывают положительные результаты в отношении фиброза, но терапия ими сопряжена с набором массы тела и риском переломов [54]. Витамин Е является одним из возможных агентов, который снижает оксидативный стресс, обладает умеренной эффективностью в отношении печеночных ферментов и гистологической структуры, но в высоких дозах (≥800 мг/сут) обладает проканцерогенным эффектом, в частности, в отношении предстательной железы [55]. Применение пиоглитазона и витамина Е в дозе 400 мг/сут возможно у пациентов без сопутствующего СД2 при доказанном морфологически НАСГ [53]. Клинические рекомендации EASL-EASD-EASO предлагают медикаментозное лечение тех лиц, у которых верифицировано наличие НАСГ, особенно при выраженном фиброзе (стадия F2 и выше) (умеренное качество доказательств, сильная рекомендация). В этой ситуации рассматриваются пиоглитазон и витамин Е в дозе 800 мг/сут (умеренное качество доказательств, слабая рекомендация). Оптимальная длительность терапии при этом не определена, но лечение следует прекратить, если после 6 мес. приема препаратов уровень АЛТ не снижается у тех пациентов, у которых исходно была повышена ее концентрация (слабое качество доказательств, слабая рекомендация) [56].
Действие агонистов глюкагоноподобного пептида-1 на течение НАЖБП изучается. В мультицентровом двойном слепом рандомизированном плацебо-контролируемом исследовании показано, что подкожные инъекции 1,8 мг лираглутида приводили к разрешению явлений НАСГ у 39% пациентов по сравнению с 9% в группе плацебо (р<0,05) [57]. Гайдлайны Американской ассоциации по изучению печени (AASLD) 2018 г. ссылаются и на другие РКИ, демонстрирующие положительный эффект лираглутида на течение НАСГ, но все еще считают преждевременным рассматривать этот класс препаратов как специфические агенты для лечения НАЖБП или НАСГ [58].
Есть данные, что применение урсодезоксихолевой кислоты в дозе 30 мг/кг массы тела приводит к достоверному снижению активности сывороточных трансаминаз, однако убедительных данных о ее положительном влиянии на некровоспалительные изменения и фиброз печени, а также на долгосрочный прогноз пациентов с НАЖБП не полу-
чено [59]. Видимо, поэтому EASL не рекомендует УДХК для лечения НАЖБП [60]. В 5 РКИ были продемонстри-рованы положительные результаты долгосрочного применения эссенциальных фосфолипидов в дозе 1800 мг/сут до 12 нед. Данные гепатопротекторы рекомендованы российскими руководствами [61, 62] и утверждены Научным обществом гастроэнтерологов России и Российским научно-медицинским обществом терапевтов в 2015 г.
Перспективные агенты для лечения НАЖБП активно изучаются, многие из них находятся в поздних фазах РКИ:
агонисты фарнезоидных X-рецепторов — обетихолевая кислота;
конъюгаты жирных и желчных кислот — арамхол;
агонисты PPARα/δ — элафибранор;
антагонисты рецепторов хемокинов типа 2 и 5 —
ценикривирок;
антифибротики — моноклональные антитела к лизилоксидазе (GS 6624) — симтузумаб [63, 64].












