Введение
Дефицит витамина D широко распространен во всем ми-ре среди людей всех возрастов [1]. В Российской Федерации распространенность дефицита витамина D среди населения составляет 43–63%, в Европе – 57–64%, в США – 36%.Даже в регионах с высоким уровнем инсоляции — на Ближнем Востоке, в Южной Америке и Африке — отмечается высокий уровень дефицита витамина D. Как ни странно, в странах с длинной зимой распространенность дефицита витамина D чуть ниже, чем в солнечных странах. Это, вероятно, связано с потреблением жирной рыбы и регулярным использованием добавок витамина D [2].
Низкий уровень витамина D ассоциирован с нарушением регуляции ряда белковых факторов, участвующих в пролиферации, дифференцировке и апоптозе различных клеток организма человека. Снижение содержания витамина D способствует развитию заболеваний опорно-двигательной системы, аутоиммунных процессов, онкологических и сердечно-сосудистых заболеваний, эндокринных нарушений, метаболических осложнений, снижению работы иммунной системы, повышению риска инсулинорезистентности, когнитивных расстройств, депрессий, болезни Паркинсона и ряду других последствий.
Оптимальная концентрация витамина D крайне важна для репродуктивного здоровья. У молодых женщин при концентрации в крови витамина D ≥ 30 нг/мл наблюдаются достаточный уровень эстрогенов, высокое либидо [3, 4]; полноценная дифференцировка и созревание фолликулов [5]; отсутствие предменструального синдрома (ПМС), первичной дисменореи [6]. Нормальные уровни витамина D способствуют повышению показателя фертильности и рождению здорового потомства [7]. Доказано, что вероятность наступления беременности при помощи экстракорпорального оплодотворения повышается у женщин с уровнем витамина D ≥ 30 нг/мл, также у них выше скорость имплантации [7, 8]. Поддержание достаточного уровня витамина D важно и на протяжении самой беременности. Дефицит витамина D связан с повышенным риском преждевременных родов, гестационного диабета, преэклампсии, кесарева сечения [7, 9].
Именно поэтому беременным и кормящим женщинам рекомендовано профилактически принимать как минимум 800–1000 МЕ витамина D в сутки, а при наличии факторов риска дефицита витамина D (темная кожа, ожирение, гестационный диабет, редкое пребывание на солнце) рекомендуется исследование уровня 25 (OH) D в крови [7] и в случае его дефицита — проведение адекватной коррекции колекальциферолом в дозе 1500–4000 МЕ/сут [10]. Установлено, что концентрации 25 (OH) D в сыворотке крови матери и рожденного младенца имеют высокую прямую корреляционную зависимость (R=0,64) [10]. Чтобы обеспечить достаточный уровень витамина D младенцу, получающему исключительно грудное вскармливание без дополнительного приема витамина D, мать должна принимать 4000–6000 МЕ колекальциферола в сутки [10].
Активный метаболит витамина D реализует свои эндокринные, паракринные и аутокринные биологические эффекты путем связывания с рецептором витамина D (VDR). В клеточных ядрах VDR влияет на транскрипцию почти 3% всего человеческого генома, а в плазматических мембранах модулирует активность ионных каналов [11, 12]. VDR имеется в большинстве клеток организма: эндотелиальных, клетках островков поджелудочной железы, кроветворных клетках, клетках сердечной и скелетных мышц, моноцитах, нейронах, Т-лимфоцитах, плацентарных клетках и др., что подтверждает плейотропные эффекты витамина D [1].
В нашей стране информация о распространенности дефицита витамина D очень ограниченна, поэтому необходимо привлечь внимание к этой актуальной теме.
Цель исследования: изучить частоту встречаемости дефицита и недостаточности витамина D и генетических особенностей чувствительности к нему среди пациентов поликлиники.
Материал и методы
Был проведен ретроспективный анализ 6034 медицинских карт, из них отобраны карты тех пациентов, кому проводился анализ крови на 25 (OH) D (метаболит витамина D). В исследование были включены 565 пациентов (373 женщины, из них 72 беременные, 192 мужчины). Средний возраст женщин — 40,8±13,9 года, мужчин — 41,5±12,5 года. Помимо 25 (OH) D собирались данные об уровне общего кальция (Ca), креатинина, липопротеинов низкой плотности (ЛПНП), аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гликированного гемоглобина (HbA1c), паратиреоидного гормона (ПТГ), тиреотропного гормона (ТТГ); индексе массы тела (ИМТ), выполнялся анализ мочи на белок.
Заведомо были исключены пациенты, у которых уровни ПТГ и ТТГ выходили за пределы референсных значений.
На основании результатов экспериментальных исследований выявлено несколько генов-кандидатов, мутации в которых влияют на концентрацию 25 (OH) D: GC, CYP24A1, CYP2R1, CYP27B1, VDR, NADSYN1/DHCR7. В генетическом тесте определялись гены, связанные с 25 (OH) D, которые участвуют в транспортировке, активации и синтезе витамина D соответственно: GC (хромосома 4q12-q13) (ген специфической группы), DHCR7 (хромосома 11q13.4) (7-дегидрохолестеринредуктаза), CYP2R1 (хромосома 11p15.2) (цитохром P450, семейство 2, подсемейство R, полипептид 1) [13, 14]. GC кодирует связывающий белок витамина D (DBP), варианты которого отличаются сродством к 25 (OH) D [15]. Генетические полиморфизмы гена GC могут влиять на эффективность транспортировки, биодоступность при преобразовании в тканях организма 25 (OH) D в активную гормональную форму — 1,25 (OH) 2D [16]. Индуцированный ультрафиолетом синтез витамина D3 в коже из 7-дегидрохолестерина катализируется DHCR7 (НАДФ-зависимая 7-дегидрохолестеринредуктаза). В печени под влиянием фермента 25-гидроксилазы митохондрий (CYP27A1) и микросом (CYP2R1) происходит преобразование витамина D в его прогормональные формы 25 (OH) D3 (кальцидиол) и 25 (OH) D2 (эргокальцидиол). Последние являются основными циркулирующими формами витамина D, которые через кровоток поступают в почки [13, 17].
Установлена ассоциация показателей риска развития определенных заболеваний с наличием мутаций в генах, участвующих в метаболизме витамина D, и, соответственно, приводящих к снижению концентрации последнего [18]: GC (rs2282679): остеопороз, болезнь Грейвса; CYP2R1 (rs10741657): колоректальный рак, сахарный диабет 1-го типа [19]; CYP2R1 (rs10741657), GC (rs2282679): хронический гепатит С [20], рецидив рака толстой кишки [21]; GC (rs2282679), DHCR7 (rs7944926): рак яичников [22]. Концентрация 25 (OH) D ассоциируется с 18 однонуклеотидными полиморфизмами (SNP) в регионах вышеуказанных генов [23], в генетическом тесте проводился анализ 3 SNP (rs2282679 для гена GC (наиболее выраженная связь с показателем 25 (OH) D [14, 24]); rs7944926 для гена DHCR7 и rs10741657 для гена CYP2R1).
В генетическом тесте определялись гаплотипы (цис-положение двух или больше полиморфизмов, расположенных на одной хромосоме) и идентифицировались с концентрацией 25 (OH) D. Для гена GC (rs2282679) были характерны гаплотипы TGA, TT, TG, GG; для гена DHCR7SNP (rs7944926) — GG, AG, AA; для гена CYP2R1 (rs10741657) — AG, AA, GG.
Из 565 пациентов у 449 был проведен генетический тест на полиморфизм генов GC (DBP), CYP2R1, DHCR7 (методом секвенирования HiSeq2000 на ДНК чипах (Illumina)).
Расчет скорости клубочковой фильтрации (СКФ) выполнялся при помощи калькулятора CKD-EPI CREATININE EQ (2009) (mdrd.com). Деление на группы по уровню СКФ соответствовало «Национальным клиническим нефрологическим рекомендациям» (2016) [25, 26].
По уровню концентрации 25 (OH) D пациенты были поделены на группы: группа 0 — нормальный уровень витамина D ≥ 30 нг/мл (≥75 нмоль/л); группа 1 — недостаточность витамина D — 20–29 нг/мл (50–74 нмоль/л); группа 2 — дефицит витамина D < 20 нг/мл (<50 нмоль/л) [27].
Кроме того, проводилось деление на группы пациентов в зависимости от времени года, когда совершался забор крови на витамин D: группа 1 — зима, группа 2 — осень, группа 3 — весна, группа 4 — лето.
Выполнялось деление на группы в зависимости от ИМТ в соответствии с рекомендациями Американской ассоциации клинических эндокринологов по ведению и лечению пациентов с ожирением (2016): группа 1 — нормальная масса тела (18,5–24,9 кг/м2); группа 2 — избыточная масса тела (25,0–29,9 кг/м2); группа 3 — ожирение I степени (30,0–34,9 кг/м2); группа 4 — ожирение II степени (35,0–39,9 кг/м2); группа 5 — ожирение III степени (морбидное) (≥40 кг/м2) [28].
Проводилась интерпретация генетического теста на особенности концентрации 25 (OH) D: группа 1 — с концентрацией без особенностей; группа 2 — с предрас-
положенностью к снижению концентрации 25 (OH) D;
группа 3 — с предрасположенностью к значительному снижению концентрации 25 (OH) D.
Статистический анализ данных проводился при помощи пакета прикладных программ Statistica 10.0.1011.0. Критический уровень достоверности нулевой гипотезы был принят равным 0,05.
Результаты и обсуждение
Нормальная концентрация витамина D выявлена у 38% пациентов клиники (n=213) (39,7±9,6 нг/мл), дефицит витамина D — у 25% (n=141) (16,2±3,4 нг/мл), а недостаточность — у 37% (n=211) (24,9±2,5 нг/мл).Таким образом, у 62% пациентов отмечается низкий уровень витамина D. Что касается беременных, то распространенность дефицита и недостаточности у них была такой же — из 72 беременных пациенток, вошедших в исследование, низкий уровень выявлен у 45 (62,5%), дефицит витамина D отмечался у 25% (n=18), а недостаточность — у 37,5% (n=27) испытуемых.
Статистически значимого различия по полу ни в одной из групп по уровню витамина D выявлено не было (p=0,98, p=0,23 и p=0,18). Отсутствие достоверных различий между уровнем витамина D у мужчин и женщин, в отличие от других работ [2, 29, 30], вероятно, связано с тем, что избыточная масса тела и ожирение практически равно распространены у обоих полов в нашей популяции, хотя, по мировым данным, женщины страдают ожирением и, соответственно, дефицитом витамина D несколько чаще, чем мужчины [41].
При попарном сравнении (t-tests) выявлены достоверные различия между уровнем витамина D зимой (24,9±9,97 нг/мл) и летом (31,2±13,42 нг/мл), а также между уровнем витамина D весной (26,9±10,9 нг/мл) и осенью (29,8±10,18 нг/мл) (p=0,00003 и p=0,01 соответственно).
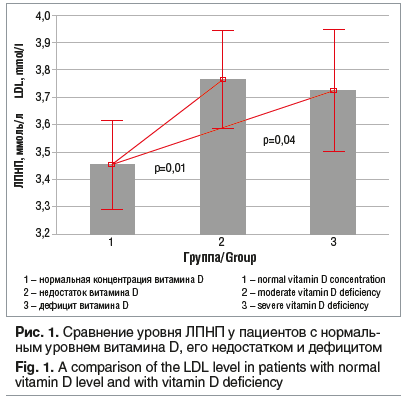
Концентрация ЛПНП достоверно отличается в группах с нормальным уровнем витамина D (3,4±0,87 ммоль/л), с недостатком (3,7±0,93 ммоль/л), а также с дефицитом витамина D (3,7±0,99 ммоль/л) (p=0,01 и p=0,04 соответственно) (рис. 1). Любая концентрация 25 (OH) D ниже целевых уровней ассоциировалось с повышением уровня ЛПНП выше референсных значений. Выявлена слабая отрицательная корреляция между уровнем витамина D и уровнем ЛПНП (p<0,05, r= –0,16).
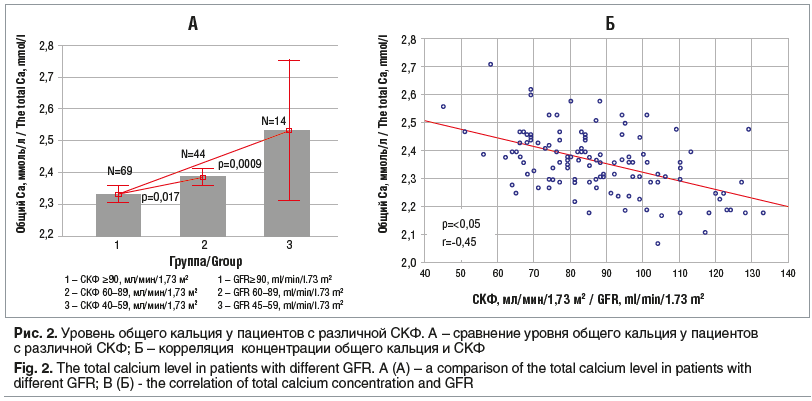
Достоверные различия наблюдаются между уровнем общего кальция при СКФ ≥90 мл/мин/1,73 м2 (n=69, 2,33±0,1 ммоль/л), при СКФ 60–89 мл/мин/1,73 м2 (n=44, 2,38±0,09 ммоль/л), при СКФ 45–59 мл/мин/1,73 м2 (n=14, 2,53±0,13 ммоль/л) (p=0,017 и p=0,0009 соответственно) (рис. 2 А). Наличие умеренной отрицательной корреляционной связи уровня общего кальция и СКФ (p<0,05, r= -0,45) позволяет рассматривать уровень общего кальция в роли раннего предиктора снижения СКФ, возможно, без явного вовлечения в этот процесс паратиреоидного гормона (концентрация в пределах нормы) (рис. 2 Б).
Отсутствие корреляции между уровнем витамина D и уровнем общего кальция в крови (p>0,05) подтверждает
более раннее вовлечение последнего в процесс формирования ХБП. Эта тема требует дальнейшего изучения.
Концентрация витамина D у пациентов с нормальной массой отличается (n=262, 28,71±11,02 нг/мл) от концентрации у пациентов с избыточной массой тела (n=85, 28,63±11,88 нг/мл), с ожирением I степени (n=45, 27,44±14,11 нг/мл), с ожирением
II степени (достоверно) (n=32, 22,73±6,57 нг/мл) и с ожирением III степени (≥40 кг/м2) (n=12, 24,14±8,3 нг/мл) (p=0,95, p=0,49, p=0,02, p=0,15 соответственно) (рис. 3 А). Выявлена слабая отрицательная корреляционная связь концентрации 25 (OH) D и ИМТ (p<0,05, r= -0,22) (рис. 3 Б).

Концентрация 25 (OH) D имеет обратную зависимость от ИМТ, что связано с депонированием метаболита витамина D в подкожно-жировой клетчатке, со снижением активности CYP2R1 (25-гидроксилазы) в инфильтрированной жиром печени (при стеатозе) [26, 31].
Достоверные различия выявлены между сывороточной концентрацией 25 (OH) D в крови у пациентов с генетической предрасположенностью к концентрации
без особенностей (n=419, 28,54±11,37 нг/мл) и с пред-
расположенностью к сниженному уровню 25 (OH) D (n=21, 33,67±10,9 нг/мл), а также с предрасположенностью к значительному снижению концентрации (n=9, 25,73±11,99 нг/мл) (p=0,04 и p=0,46 соответственно).
По результатам генетического теста мутации в полиморфизмах генов, связанных с концентрацией 25 (OH) D, не так часты (30 из 449 человек); и даже если мутация присутствует, это не всегда влечет недостаток и дефицит витамина D (группа 2). Концентрации сывороточного 25 (OH) D зависят как от полиморфизмов генов, так и от внешних факторов, поэтому их следует рассматривать сообща. Что касается лиц с генетическими факторами риска (группа 3), то они нуждаются в приеме более высоких доз препаратов витамина D [32, 33].
Заключение
Роль витамина D в нашем организме не сводится исключительно к его участию в фосфорно-кальциевом обмене. Поддержание оптимального уровня витамина D необходимо как для профилактики сахарного диабета 2-го типа, ожирения, сердечно-сосудистых, нейродегенеративных заболеваний, так и в случае наличия этих состояний. Широко обсуждается роль витамина D в профилактике ряда онкологических и при иммуноопосредованных заболеваниях.Что касается репродуктивного здоровья, то достижение нормальной концентрации витамина D необходимо не только на этапе планирования беременности, но и во время нее для минимизации рисков неблагоприятных исходов и, конечно, профилактики рахита у ребенка.
В нашем исследовании были выявлены высокие показатели распространенности недостатка и дефицита витамина D среди пациентов поликлиники (62%), в т. ч. среди беременных.
Недостижение целевых значений уровня витамина D даже летом может быть связано со следующими факторами: географическим расположением (Москва находится на 55°45´ с. ш.): небольшим количеством солнечных дней, продолжительностью светового дня; смогом, облачностью, использованием солнцезащитных кремов, высоким содержанием меланина в эпидермисе, пожилым возрастом. Как известно, в целях предупреждения дефицита и недостатка витамина D необходимо находиться под воздействием солнечных лучей от 15 до 20 мин в интервале с 10:00 до 15:00 не менее 2 раз в неделю (с открытым лицом и плечами). Если такая возможность отсутствует, то необходим профилактический прием препаратов [34–36].
Наличие гаплотипа TGA в полиморфизме rs2282679 гена GC, продуцирующего DBP и влияющего на эффективность транспортировки 25 (OH) D, соответствовало снижению показателей сродства к вышеуказанному метаболиту витамина D, что совпадает с результатами других авторов [37]. Cо снижением показателей 25 (OH) D в общей группе обследованных сочеталось наличие гаплотипа GG полиморфизма гена CYP2R1 rs10741657, подобные результаты наблюдались в работе J. Nissen et al. (2014). По результатам работ различных авторов влияние генотипа на концентрацию 25 (OH) D составляет от 23–43% до 77–80% [32, 38–40]. Выявление генетических полиморфизмов, влияющих на уровни витамина D, имеет важное значение для выявления лиц, подверженных риску дефицита витамина D, назначения стандартных либо высоких доз препаратов витамина D.
Существуют нативные (колекальциферол и эргокальциферол) и активные (альфакальцидиол и кальцитриол) метаболиты витамина D. Нативным формам необходимо пройти две реакции гидроксилирования (в печени и почках) для образования D-гормона. В организме эти препараты накапливаются в неактивной форме и превращаются в 1,25 (ОН) D по мере необходимости. Именно с этим связаны их низкая токсичность, широкий терапевтический диапазон и возможность применения в высоких дозах (1 р./нед. или 1 р./мес.).
Активные формы уже гидроксилированы (альфакальцидол в положении 1, кальцитриол в положении 1 и 25), поэтому обладают гораздо большей биологической активностью. Кальцитриол не требует превращения в активную форму и уже через 2–6 ч вызывает повышение абсорбции кальция в кишечнике, однако из-за короткого периода полувыведения (3–6 ч) его назначают 2–3 р./сут. Альфакальцидол (Альфа Д3-Тева®) превращается в активную форму, гидроксилируясь в печени. Именно эта особенность (гидроксилирование главным образом в печени, а не в почках) позволяет использовать его у пациентов с почечной патологией и у пожилых пациентов со снижением СКФ ≤ 60 мл/мин/1,73 м2. Хотя альфакальцидол начинает действовать чуть медленнее, чем кальцитриол, его действие продолжительнее, что позволяет применять препарат 1–2 р./сут.
Использование активных метаболитов витамина D ограничено риском гиперкальциемии и гиперкальциурии, поэтому они могут назначаться только специалистом [42]. Стартовая доза составляет 1 мкг 1 р./сут под контролем уровня кальция, фосфора для своевременной коррекции доз препарата. При резистентности к витамину D возможно значительное увеличение дозы активных метаболитов до 2–3 мкг/cут и более.
Несмотря на широкую распространенность дефицита и недостаточности витамина D среди людей самых разных возрастов с различными сопутствующими заболеваниями и состояниями, имеющиеся данные о факторах риска и генетическом полиморфизме в сочетании с выбором оптимального препарата позволяют быстро, эффективно и безопасно достигать необходимого уровня и поддерживать его в течение длительного времени.
На основании проведенного исследования нами были сделаны следующие выводы:
Распространенность недостатка и дефицита витамина D среди пациентов клиники составляет 62%. Несмотря на то, что распространенность этих состояний у беременных соответствует распространенности в популяции, повышенный риск преждевременных родов, гестационного диабета, преэклампсии, кесарева сечения, ассоциированный с нехваткой витамина D, требует незамедлительной коррекции.Связь витамина D с дислипидемией позволяет предположить, что поддержание целевых уровней витамина D может помочь в профилактике сердечно-сосудистой патологии.
Уровень общего кальция в крови в большей степени зависит от фильтрационных особенностей почек, чем от концентрации витамина D.
Существенное влияние на статус витамина D оказывают полиморфизмы в генах GC, CYP2R1 и DHCR7/NADSYN1.
Сведения об авторах: 1Полуэктова Алена Юрьевна — студентка лечебного факультета; 2Мартынова Евгения Юрьевна — аспирантка кафедры эндокринологии лечебного факультета; 3Фатхутдинов Илдус Рифкатович — врач-педиатр, главный врач; 1Демидова Татьяна Юльевна — д.м.н., профессор, заведующая кафедрой эндокринологии лечебного факультета; 1,3Потешкин Юрий Евгеньевич — к.м.н., доцент кафедры эндокринологии, врач-эндокринолог. 1ФГБОУ ВО Российский национальный исследовательский медицинский университет им. Н. И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1. 2ФГАОУ ВО Первый Московский государственный медицинский университет им. И. М. Сеченова Минздрава России. 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2. 3ООО «Медицинский центр «Атлас». 121170, Россия, г. Москва, пр-т Кутузовский, д. 34/14. Контактная информация: Полуэктова Алена Юрьевна, е-mail: alenapoluektova.068@gmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 21.07.2018.
About the authors: 1Alena Y. Poluektova — a student of medical faculty; 2Evgenia Y. Martynova — post-graduate student; 3Ildus R. Fatkhutdinov — pediatrician, head physician; 1Tatyana Y. Demidova — professor, Head of department; 1,3Yury E. Poteshkin — Ph.D., associate professor of department. 1Russian National Research Medical University. 1, Ostrovityanova str., Moscow, 117997, Russian Federation. 2Sechenov University. 8–2, Trubezhkaya str., Moscow, 119991, Russian Federation. 3Medical Center “Atlas”. 34/14, Kutuzovsky Ave., Moscow, 121170, Russian Federation. Contact information: Alena Y. Poluektova, e-mail: alenapoluektova.068@gmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 21.07.2018.












