Минимально достаточная концентрация фолатов в эритроцитах крови составляет 906 нмоль/л [1] и встречается всего у 13% людей в популяции [2], поэтому повсеместно проводятся программы дотации фолатов. Однако, признавая результативность таких программ для здоровья населения в целом, специалисты отмечают, что снижение частоты дефектов нервной трубки (ДНТ) у плодов оказалось все-таки недостаточно эффективным. Так, сравнение программ повышения уровня фолатов в популяции с помощью обогащения пищевых продуктов с пропагандой здорового питания и при отсутствии таких программ в Европе за 1999–2001 гг., показало снижение частоты ДНТ на 32%, 17% и 9% соответственно по сравнению с периодом 1989–1991 гг. [3]. Применение муки, обогащенной фолиевой кислотой, в Канаде привело к сокращению аномалий у плода на 46% за период 1991–1999 гг.[4].
Дотация фолиевой кислоты в виде лекарственных препаратов оказалась более эффективным методом снижения риска ДНТ и других аномалий развития плода [5]. Результаты рандомизированных исследований показали снижение частоты аномалий плода на 75% [6] и выявили значительный защитный эффект фолиевой кислоты (ОР=0,28; 95% ДИ: 0,12–0,71) по сравнению с другими витаминами (ОР=0,80; 95% ДИ: 0,32–1,72) [7].
В информационном письме, опубликованном в январе 2015 г. рабочей группой Международной федерации акушеров-гинекологов (FIGO) [8], указывается, что прием фолиевой кислоты в прегравидарный период и в течение беременности не ограничивается только профилактикой пороков развития у плода. Показано, что дополнительный прием этого витамина до и после зачатия достоверно снижает риск преждевременных родов и рождения детей с низкой массой тела [9, 10], синдромом Дауна [11, 12], врожденным пороком сердца, челюстно-лицевыми дефектами [13, 14], аутизмом [15]. Экспериментальные исследования [16]свидетельствуют о свойствах фолиевой кислоты предотвращать развитие врожденных пороков у мышей с моделью сахарного диабета. У пациенток с полиморфизмом генотипа MTHFR назначение препаратов фолиевой кислоты снижает уровень гомоцистеина и предотвращает развитие осложнений, связанных с гипергомоцистеинемией [17, 18].
В 2015 г. в базе Кокрейна был опубликован подробный анализ результатов применения фолиевой кислоты в профилактических целях (табл. 1) [19].

Важными факторами эффективности и безопасности приема фолиевой кислоты являются сроки начала ее использования и дозирование. Согласно нормам, установленным приказом Министерства здравоохранения РФ № 572н, рекомендуется ежедневный прием 400 мкг фолиевой кислоты на протяжении I триместра беременности [20]. Данные рекомендации согласуются с мнением экспертов других профессиональных сообществ, и такое же значение минимально необходимой дозы фолиевой кислоты было установлено ранее США, Канадой, Австралией и Новой Зеландией [21, 22]. Она также была принята Всемирной организацией здравоохранения (ВОЗ) и Продовольственной и сельскохозяйственной Организацией Объединенных Наций [23].
Однако измерение показателя «доза/эффект» на основе анализа данных 13 РКИ и результатов большого когортного исследования риска ДНТ в соответствии с концентрацией фолатов в сыворотке крови показало различное прогностическое снижение риска. При фоновой концентрации фолата в сыворотке 5 нг/мл и употреблении фолиевой кислоты в дозе 0,2 мг/сут (уровень фортификации продуктов в США) отмечается уменьшение количества ДНТ примерно на 20%, приеме 0,4 мг/сут – на 36%, 1 мг/сут – на 57%, а ежедневном приеме 5 мг – на 85% [24]. Поэтому в 2015–2016 гг. ведущими профессиональными сообществами были пересмотрены диетические эталонные значения фолиевой кислоты с целью переоценки требований к различным группам населения, выделены группы низкого, среднего и высокого риска среди беременных женщин. Были также тщательно проанализированы рекомендации относительно времени начала приема фолиевой кислоты и продолжительности ее приема.
Начинать прием фолиевой кислоты рекомендуется за 8–12 нед. до планируемой беременности – столько времени необходимо для накопления клетками достаточного количества фолатов для профилактики осложнений беременности и пороков развития у плода [25].
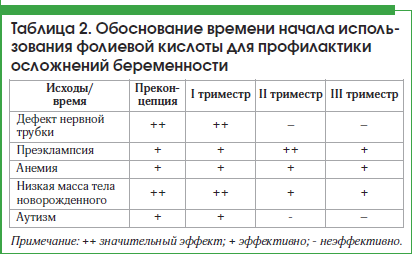
Женщины, не принимавшие фолиевую кислоту до зачатия, попадают в зону риска развития ДНТ, поскольку формирование нервной трубки завершается к 28-му дню внутриутробного развития, и даже раннее начало приема фолиевой кислоты по факту задержки менструации не позволяет надеяться при исходном дефиците фолатов на достижение их оптимального уровня в столь ограниченные сроки. В популяционном исследовании, проведенном в Великобритании, охватившем около 110 тыс. беременных женщин, обнаружено, что только стартовая терапия фолиевой кислотой в прегравидарном периоде позитивно влияет на течение и исход беременности, тогда как начало приема после наступления беременности такого эффекта не имеет [26]. Работы разных авторов подтверждают, что начало приема фолиевой кислоты в период преконцепции имеет наибольший эффект для профилактики осложнений периода гестации (табл. 2) [27–30].
Поэтому при первичном назначении витаминов уже беременной женщине надо помнить, что ежедневный прием 400 мкг фолиевой кислоты доводит исходно низкий уровень фолатов в крови до оптимального значения в течение длительного времени (в среднем около 14 нед.), а в некоторых случаях так и не позволяет выйти на нормальную концентрацию фолата в эритроцитах [25]. Прием 800 мкг фолиевой кислоты повышает уровень фолатов в эритроцитах крови до необходимой концентрации в течение более короткого времени – в среднем за 4 нед. [25]. Исследования фармакодинамики фолиевой кислоты позволили немецким и швейцарским исследователям [21] вынести на рассмотрение медицинского сообщества вопрос о необходимости увеличения профилактической дотации фолиевой кислоты беременным женщинам до 800 мкг.
В настоящее время рекомендуется дифференцированный подход к срокам назначения и выбору дозы фолиевой кислоты для женщин вне беременности, планирующих беременность и во время беременности [31–33].
К группе низкого риска были отнесены женщины или их партнеры без личного или семейного анамнеза рисков для чувствительных к фолиевой кислоте врожденных дефектов. Рекомендации по приему ими препаратов фолиевой кислоты представлены в таблице 3 [15, 31–33].

К группе среднего риска отнесены женщины и/или их мужчины-партнеры с семейным анамнезом ДНТ (второй-третьей степени родства), с личным или семейным анамнезом других фолат-чувствительных врожденных аномалий (аномалии сердца, конечности, неба, мочевыводящих путей, гидроцефалия). Принимается во внимание также образ жизни матери (низкий социально-экономический статус, плохое/ограниченное питание, употребление наркотиков). Рекомендации по приему ими препаратов фолиевой кислоты представлены в таблице 4 [15, 31–33].

Высокий риск дефектов нервной трубки и других аномалий имеют женщины и их мужчины-партнеры с персональным анамнезом ДНТ, семейным анамнезом ДНТ (первой степени родства), женщины, принимающие антиэпилептические средства или ингибиторы фолата (карбамазепин, вальпроевая кислота, фенитоин, фенобарбитал, метформин, метотрексат, сульфасалазин, триметоприм), имеющие ожирение (ИМТ>30 кг/м2 или 80 кг) до беременности, страдающие мальабсорбцией (воспаление кишечника, болезнь Крона, целиакия) и предгестационным неконтролируемым сахарным диабетом (тип I или II) [8, 15, 31–33], а также женщины с полиморфизмом MTHFR (генотип 677TT гомозиготных носителей, 677CST гетерозиготных носителей или рецепторов), женщины, не принимавшие фолиевую кислоту в период преконцепции, принимавшие КОК перед наступлением беременности, курящие и употребляющие алкоголь [5]. Рекомендации по приему ими препаратов фолиевой кислоты представлены в таблице 5 [5, 8, 15, 31–33].

![Основные положения по приему фолатов беременными женщинами [15, 31, 48] Основные положения по приему фолатов беременными женщинами [15, 31, 48]](/upload/medialibrary/7d0/1096-6.png)
Ежедневное потребление 5 мг фолиевой кислоты было ассоциировано также с 31% снижением риска преждевременных родов (ОР=0,69; 95% ДИ: 0,44–0,99), 60% – низкого веса новорожденных (ОР=0,40; 95% ДИ: 0,21–0,76), 66% – небольшого веса новорожденного для гестационного возраста (ОР=0,34; 95% ДИ: 0,16–0,73) [34] и достоверным снижением риска самопроизвольного выкидыша в ранние сроки беременности (p = 0,001) [35].
В соответствии с инструкцией к препарату Фолацин [36] показанием для назначения 5 мг фолиевой кислоты являются: лечение и профилактика дефицита фолиевой кислоты на фоне несбалансированного или неполноценного питания; лечение и профилактика анемии на фоне дефицита фолиевой кислоты: макроцитарной гиперхромной анемии, анемии и лейкопении, вызванных лекарственными средствами и ионизирующей радиацией, мегалобластной анемии, пострезекционной анемии, сидеробластной анемии в пожилом возрасте, анемии, связанной с болезнями тонкой кишки, спру и синдромом мальабсорбции; лечение и профилактика анемии при беременности и кормлении грудью; при беременности — профилактика развития дефектов нервной трубки у плода; продолжительное лечение антагонистами фолиевой кислоты (метотрексат, комбинация сульфаметоксазола и триметоприма), противосудорожными препаратами (фенитоин, примидон, фенобарбитал) при наличии соответствующего диагноза:
• Q05 Spina bifida (неполное закрытие позвоночного канала) (в анамнезе).
• Q07.9 Порок развития нервной системы неуточненный.
• D52.0 Фолиеводефицитная анемия, связанная с питанием.
• D52.1 Фолиеводефицитная анемия медикаментозная.
• K63.9 Болезнь кишечника неуточненная.
• K90.0 Целиакия.
• K90.3 Панкреатическая стеаторея.
• K90.8 Другие нарушения всасывания в кишечнике.
• O25 Недостаточность питания при беременности.
Ранее в литературе отмечалось, что прием фолатов в дозах, превышающих физиологические, может обусловить неблагоприятное действие фолиевой кислоты у пожилых пациентов (маскировка В12-дефицитной анемии, повышение риска онкологических заболеваний, депрессии, когнитивных нарушений) [37]. Единичные исследования свидетельствовали о возможном влиянии избытка фолиевой кислоты на зрение у новорожденного, повышенные риски респираторных аллергических заболеваний в старшем возрасте [38, 39]. Однако большинство источников, в т. ч. три метаанализа, в настоящее время отрицают риск онкологических заболеваний: прием фолиевой кислоты не имеет связи с колоректальным раком (ОР=1,00; 95% ДИ: 0,82–1,22) и другими видами рака (ОР=1,07; 95% ДИ: 1,00–1,14), показана защитная роль фолиевой кислоты в развитии рака ротоглотки, пищевода, желудка, поджелудочной железы, легких, шейки матки, яичников, молочной железы, нейробластомы и лейкемии, в то время как дефицит фолиевой кислоты усиливает канцерогенез [40–43]. Отмечается, что добавка фолиевой кислоты усиливает прогрессирование уже возникшей опухоли, причем независимо от дозы фолиевой кислоты (у пожилых пациентов) [42]. Еще более важно, что беременные женщины будут подвергаться воздействию 5 мг/сут фолиевой кислоты в течение всего нескольких месяцев, а не за многие годы, на чем были сосредоточены эти исследования [43]. Доказано отсутствие риска респираторных аллергических заболеваний у ребенка на основании метаанализа (ОР=1,05; 95% ДИ: 1,02–1,09) [44]. Несколько РКИ и метаанализов сообщили, что пренатальный прием поливитаминов, содержащих фолиевую кислоту, связан со значительным защитным действием на педиатрические раковые заболевания: лейкемию, опухоли головного мозга и нейробластому [45–47].
Таким образом, эффективной и безопасной профилактической суточной дозой фолиевой кислоты является доза в пределах 400–800 мкг, и начинать ее принимать надо на этапе подготовки к беременности. Повышение дозы до лечебного уровня 5 мг обоснованно только при наличии подтвержденной предрасположенности к нарушению фолатного цикла.
Фолаты применяются как в виде монопрепаратов, так и в составе витаминных комплексов и даже оральных контрацептивов [48, 49] в двух формах. Синтетическая фолиевая кислота (проверенный способ дотации фолатов), попадая в организм, подвергается серии ферментных реакций, в результате которых образуются как депо-формы, так и активные формы. Прием синтетической фолиевой кислоты имеет прямую связь с повышением уровня фолатов в плазме крови и эритроцитах и обратную — с уровнем гомоцистеина. Основные исследования эффективности и безопасности были проведены именно с использованием синтетической фолиевой кислоты.
Еще одна форма витамина B9 — левомефолат (левовращающий изомер 5-МТГФ, L-метилфолат) кальция обеспечивает достаточное присутствие фолатов в тканях, независимое от полиморфизма генов, кодирующих активность метилтетрафолатредуктазы. 5-МТГФ не нуждается в ферментных преобразованиях, и преимущество его состоит в возможности более быстрого увеличения концентрации фолата в эритроцитах по сравнению с фолиевой кислотой [25] благодаря различию в их биодоступности (например, характеристики поглощения фолата варьируются примерно от 100% для добавок фолиевой кислоты, принимаемых натощак, до примерно 50% для фолата, содержащегося в пищевых продуктах, дополнения, принимаемые с пищей, имеют биодоступность 85%) [50]. FDA напоминает, что 5–МТГФ и фолиевая кислота не являются эквивалентными веществами, и обязывает производителей указывать, какой именно фолат содержит биодобавка или лекарственный препарат [50]. Однако различия в биодоступности являются недостаточной основой для определения эффективности. После абсорбции фолиевая кислота превращается в идентичные 5-МТГФ метаболически активные восстановленные производные, и обе формы увеличивают концентрацию фолатов в крови на аналогичном уровне [25].
Кроме того, представления об эффективности и безопасности 5-МТГФ опираются только на данные о фолиевой кислоте, что методически не вполне корректно. До получения дополнительных сведений применение 5-МТГФ в составе витаминных комплексов более обоснованно у женщин с подтвержденной недостаточностью метилтетрафолатредуктазы. В настоящее время европейские эксперты рекомендуют на этапе прегравидарной подготовки и во время беременности прием синтетической фолиевой кислоты, т. к. было показано, что фолиевая кислота при применении до и во время беременности доказательно снижает риск развития ДНТ, а данные о том, снижает ли 5-МТГФ риск развития ДНТ, отсутствуют.








.gif)



