Введение
По данным различных авторов, от 140 до 250 млн человек во всем мире имеют лимфедему конечностей [1, 2], наиболее распространенной причиной которой является хирургическое лечение онкологических заболеваний, сопровождающееся лимфаденэктомией с последующей лучевой терапией [3]. Частота развития лимфедемы отличается в зависимости от варианта хирургического лечения при N0 в различных регионах, статистические исследования затруднены в связи с отсутствием единого регистра фиксации случаев и доступности основных методов диагностики [4, 5].
После радикальных операций на молочной железе, включающих лимфаденэктомию, со стороны верхней конечности наблюдаются нарушение лимфооттока, вызывающее лимфатический отек конечности, нарушение венозного оттока (стеноз и/или окклюзия подмышечной и/или подключичной вен), грубые рубцы, ограничивающие функцию конечности в плечевом суставе, и брахиоплексит [6–16]. Определение понятия «постмастэктомический синдром» было дано Н.О. Милановым в 1984 г. [15, 16], термин «синдром постмастэктомической руки» был впервые введен в 1979 г. B. Mc. O`Brien, который описал этот синдром как сочетание лимфатического отека конечности с плечевым невритом.
Лимфедема, возникшая в результате лечения рака молочной железы, является хроническим заболеванием, характеризующимся деформацией верхней конечности, болевыми ощущениями, ограничением использования конечности и эмоциональными расстройствами, часто приводящими к изоляции [17], считается «неизлечимой» или невосприимчивой к традиционным методам лечения.
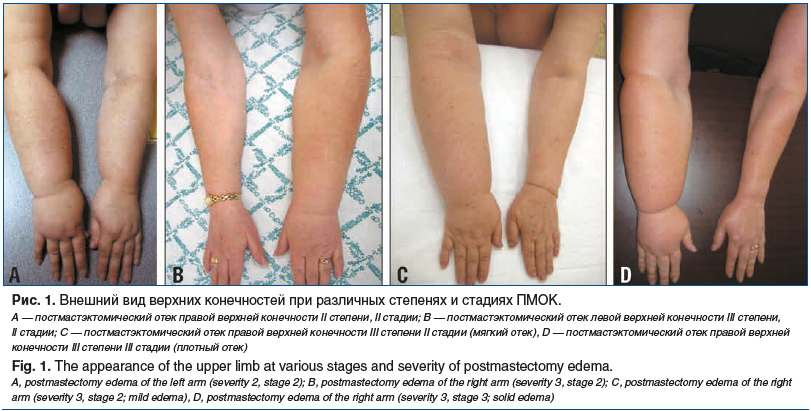
Постмастэктомический отек конечности (ПМОК) — наиболее часто встречающееся проявление постмастэктомического синдрома. По данным различных авторов, ПМОК развивается в 2,7–87,5% случаев [16–19]. Хронический лимфатический отек конечности (рис. 1 A, B) может привести к видимому внешнему дефекту, вызвать депрессию и даже привести к суицидальной попытке [20].
Классификация ПМОК
Разработано немало классификаций [19–24], которые помогают хирургам диагностировать и выбирать тактику лечения лимфедемы. Одна из самых простых и часто используемых — классификация В.Н. Герасименко [10], согласно которой выделяют 3 степени ПМОК: легкую (увеличение длины окружности плеча над локтевым суставом до 2 см), среднюю (от 2 до 6 см) и тяжелую (более 6 см). К.Г. Абалмасов предложил 4 степени отека: I — до 1–2 см, II — 2–6 см, III — 6–10 см, IV — более 10 см [22]. В 1980 г. в Институте хирургии им. А.В. Вишневского была разработана классификация лимфедемы нижних конечностей, которая может быть применима и для постмастэктомической лимфедемы [16]. Она определяет 4 степени заболевания:
I степень: отек локализуется в дистальном отделе, разница в окружностях здоровой и больной конечностей не превышает 2 см; отек проходит к утру после отдыха, но возобновляется к вечеру на фоне физической нагрузки; кожа без видимых изменений, легко собирается в складку.
II степень: отек плотный, распространяется выше, уменьшается после отдыха; разница в окружности конечностей составляет 4–6 см; кожа утолщена и с трудом собирается в складку, иногда отмечается индурация тканей дистальной трети конечности.
III степень: отек постоянный; разница в окружности превышает 6–10 см; кожа сухая, визуально как лимонная корка, ее невозможно собрать в складку, может быть мацерация кожи межпальцевых промежутков.
IV степень: плотный отек; слоновость: на фоне деформации конечности отмечаются трофические нарушения; кожа и подкожная клетчатка представляют собой грубую фиброзную ткань, наблюдаются гиперкератоз, папилломатоз, изъязвления, трещины и лимфорея.
Классификация хронических лимфатических отеков на основании клинико-рентгенологических данных [21–24]:
А. По этиологии:
I. Первичные лимфатические отеки:
1. врожденные;
2. идиопатические.
II. Вторичные лимфатические отеки:
1. воспалительные:
- специфические;
- неспецифические;
2. невоспалительные:
- ятрогенные;
- травматические;
- бластоматозные.
Б. По степени нарушения лимфооттока:
компенсация;
субкомпенсация;
декомпенсация.
В. По состоянию лимфатических коллекторов и сосудов:
1. аплазия;
2. гипоплазия;
3. гиперплазия.
Г. По уровню поражения:
1. объем патологии:
- тотальный;
- проксимальный;
- дистальный;
2. уровень блока оттока:
- проксимальный;
- средний;
- дистальный;
1. вид блока:
- полный;
- неполный.
А.О. Левин и М.О. Мясникова [25] описали этапы развития осложнения и предложили выделять преходящий, мягкий (рис. 1 B), плотный (рис. 1 C) и деформирующий отек.
Международное сообщество лимфологов классифицирует тяжесть лимфедемы как легкую при увеличении объема конечности менее 20%, умеренную — при увеличении на 20–40% и тяжелую — более 40% [26]. Объем конечности рекомендуют измерять при помощи рулетки, пирометрией или методом вытеснения воды, однако последние 2 метода имеют историческое и научное значение.
Диагностика постмастэктомического синдрома
Примерно в 90% случаев лимфедема может быть диагностирована на основании анамнеза и физического осмотра [27]. Лабораторные тесты неспецифичны для лимфатического отека и необходимы в ограниченном количестве ситуаций для дифференциальной диагностики и исключения филяриоза. При первичном обследовании пациента с ПМОК необходимы опрос, осмотр и пальпация. Сбор жалоб и осмотр помогают выявить безболезненный односторонний отек конечностей. Частая жалоба — на тяжесть в пораженной конечности [27]. При сборе анамнеза следует уточнить вариант хирургического лечения с определением сторожевого лимфатического узла или лимфаденэктомии и последующей лучевой терапии. В качестве дифференциальной диагностики следует выяснить историю поездок в районы, эндемичные по филяриозу (Африка или Азия).
В заключение осмотра необходимо классифицировать степень отека (по Герасименко В.Н., Абалмасову К.Г.) с помощью измерения окружностей здоровой и больной конечностей на 9 стандартных уровнях и стадии заболевания в соответствии с классификацией А.О. Левина и М.О. Мясниковой [25]. Измерение объема конечности — простой и экономически выгодный метод, оно полезно для оценки прогрессирования заболевания, а также ответа на лечение. В некоторых источниках литературы метод вытеснения воды рассматривают как более точный, но в то же время и наиболее сложный в исполнении [28]. Среди других методик описана пирометрия (использование инфракрасного света) и биоимпедансная спектроскопия (оценка электрической проводимости тканей) [29–31].
При осмотре и пальпации диагностическую ценность имеет определение признака или симптома Стеммера. В классическом варианте он описывается как невозможность собрать кожную складку над фалангой пальца ноги, но может быть использован и для диагностики лимфедемы верхней конечности [32].
Для исключения тромбофлебита при осмотре и пальпации следует уделять особое внимание расширению подкожных вен, болезненности в их проекции, наличию эритемы, боли, повышения температуры над областью поражения. Дифференциальную диагностику с хронической венозной недостаточностью осуществляют по отсутствию боли, изъязвлений, ямок при надавливании на область отека, изменений пигментации и отрицательному симптому Стеммера.
В редких случаях дифференциальную диагностику лимфедемы осуществляют с хронической сердечной недостаточностью (для которой характерен двусторонний отек как нижних, так и верхних конечностей), гипоальбуминемией (характерен двусторонний отек), злокачественными заболеваниями, такими как лимфангиосаркома, ангиосаркома и саркома, идиопатическим увеличением конечности как диагнозом исключения [33].
Лимфосцинтиграфия — наиболее точный тест для диагностики лимфедемы [24]. Она имеет 96% чувствительность и 100% специфичность в отношении этого заболевания [34] и является методом выбора для исследования лимфатической системы верхней конечности наравне с флюоресцентной лимфографией. Оба исследования позволяют выявить уровень блока лимфооттока, оценить сохраненные лимфатические коллекторы для последующего формирования лимфовенозных анастомозов (ЛВА).
При лимфосцинтиграфии радиоизотоп с Tc99m вводят подкожно во II межпальцевой промежуток пораженной руки, получают изображение через 10–15, 30–40 и 60–90 мин после инъекции радиофармпрепарата (РФП), по некоторым данным, последнюю фиксацию изображения выполняют через 2 ч [35]. В норме исследование позволяет визуализировать проксимальные лимфатические узлы, миграцию меченного РФП и отсутствие обратного внутрикожного потока после инъекции. При ожирении III степени (ИМТ≥40 кг/м2) диффузный избыток жировой ткани и симметричное увеличение конечностей могут затруднять диагностику лимфедемы. Лимфосцинтиграфия помогает в точной диагностике. Для послеоперационной оценки эффективности хирургического лечения радио-изотопную лимфосцинтиграфию выполняют в статическом и динамическом состояниях: таким образом проводят оценку проходимости коллекторных лимфатических сосудов, вычисляют скорость лимфооттока и среднее время транспорта [36, 37].
Наиболее современное исследование, обязательное для определения стадии и тактики лечения лимфатического отека, — флуоресцентная лимфография [38]. Стадию лимфедемы определяют по типу распределения индоцианина зеленого при введении в межпальцевые промежутки [38–41]. При определении диффузного распределения флюоресцентного препарата (сочетание splash/diffuse patterns) при данном виде лимфографии пациентам рекомендуют консервативное лечение или липосакцию в зависимости от стадии заболевания.
Лимфоангиография — метод, позволяющий оценить органические и функциональные изменения лимфатических сосудов после введения в последние рентгеноконтрастного препарата [42], может быть использован для определения местоположения конкретной анатомической обструкции при предоперационном планировании процедуры шунтирования [27]. Лимфографию в настоящее время применяют редко вследствие болезненности (повышает риск лимфангита (19%) и обострения заболевания (32%)) [27], а также инвазивности методики, возможных аллергических реакций, риска инфицирования и т. д. [16].
Лечение больных с лимфедемой при начальных стадиях необходимо начинать с терапии [30], в случае ее неэффективности рекомендовать хирургическое лечение [15, 16, 25].
Сочетанное использование методов терапии на протяжении всей жизни пациентов с ПМОК может демонстрировать удовлетворительные результаты [26, 43–54]. В первую очередь назначают комплексную противоотечную терапию (complex decongestive therapy — CDТ). Она включает в себя мануальный лимфатический дренаж, пневмокомпрессионное лечение, индивидуальные физические упражнения и уход за кожей [43–49]. Применяют компрессионный эластический трикотаж, обеспечивающий статическую компрессию (минимум 30 мм рт. ст.) [55], а также методы чередующейся дозированной контролируемой пневмокомпрессии, которая позволяет уменьшить объем верхней конечности примерно на 47% [28].
Хирургические методы лечения лимфедемы могут быть паллиативными и радикальными [15, 16, 25]. Существует несколько типов хирургических операций, которые показали эффективность для лечения лимфедемы:
-
резекционные операции;
-
дренирующие — создающие новые пути лимфооттока;
-
комбинация резекционного и дренирующего методов [15, 16, 20, 25, 56–63];
-
аспирационная методика (липосакция) [27, 28, 64, 65].
Липосакция конечности может приводить к уменьшению объема конечности на 97% с улучшением лимфооттока в отдаленном периоде при правильном ведении пациентов и применении дополнительных консервативных методов [66].
Дренирующие операции (лимфангиопластика, создание лимфонодулярных анастомозов, ЛВА, аутотрансплантация лимфатических узлов [67–71]) считают менее предсказуемыми в сравнении с резекционными. Лимфовенозное анастомозирование наиболее эффективно на ранних стадиях заболевания, при более поздних необходимо сочетание нескольких хирургических методов или аспирационная методика.
Представляем собственный опыт изучения индивидуальных особенностей лимфооттока верхней конечности на основании данных лимфографии у здоровых женщин и больных раком молочной железы (РМЖ) до и после хирургического лечения, результаты оценки эффективности микрохирургических операций и липосакции при ПМОК.
Собственный опыт
На первом этапе исследования были изучены особенности лимфооттока верхней конечности до и после лечения. Было обследовано 670 больных (658 женщин и 12 мужчин), из них у 620 был диагностирован РМЖ, 50 больных имели заболевания, не влиявшие на лимфоотток из верхней конечности, и составили группу контроля. Все пациенты прошли специализированное обследование, были разделены на группы в зависимости от стадии заболевания и проведенного лечения.
В целом развитие ПМОК после радикальной мастэктомии констатировали у 464 пациенток, преимущественно — в 84% наблюдений — в течение первых 2 лет после операции. Отягчающим фактором служило рожистое воспаление, которое диагностировали почти в половине (45%) наблюдений и которое у 32,5% пациенток носило рецидивирующий характер. Самое позднее обращение в связи с отеком было спустя 23 года от его развития.
Согласно классификации В.Н. Герасименко ПМОК соответствовал легкой степени у 17% пациентов, средней — у 36%, тяжелой — у 47%. Стадию ПМОК определяли по собственной клинической классификации (1988). I стадия («преходящий» отек) была диагностирована у 17% пациенток, II стадия («мягкий» отек) — у 59%, III стадия («плотный» отек) — у 20%, IV стадия («деформирующий» отек) – у 4%.
Постмастэктомический отек верхней конечности диагностировали на основании данных радионуклидной динамической лимфосцинтиграфии, лимфоманометрии, флебографии и флебоманометрии.
Радионуклидная лимфосцинтиграфия и флюоресцентная лимфография позволяют оценить своевременность и интенсивность контрастирования основных лимфатических коллекторов и лимфатических узлов. РФП при лимфо-сцинтиграфии вводили подкожно в объеме 0,1–0,5 мл в количестве 74–185 МБк во II межпальцевый промежуток кисти. Сцинтиграммы записывали непосредственно после введения РФП, через 10–15 мин, 30–40 мин и 1–1,5 ч. Всего было исследовано 515 конечностей: 200 здоровых (50 из группы контроля, а также контралатеральные здоровые конечности пациенток с РМЖ), 150 — с признаками ПМОК, 80 — у больных РМЖ на стороне поражения, 70 — после лечения РМЖ без отека конечности, 15 — в различные сроки после наложения ЛВА [20, 81–84].
Лимфосцинтиграфия «здоровых» конечностей позволила выделить три основных варианта лимфооттока: коллекторный (магистральный), диффузный и узловой [72–74].
На рисунке 2 представлен коллекторный тип лимфооттока (обнаружен у 56% пациенток с ПМОК), который соответствует анатомо-топографическим представлениям.

На рисунке 3 лимфатические коллекторы четко не визуализируются, так как лимфоотток характеризуется диффузным распределением РФП в мягких тканях конечности (встретился у 42% пациенток с ПМОК).

У 3% больных с ПМОК выявлен узловой тип лимфооттока: наблюдалась преимущественная визуализация регионарных и вставочных лимфатических узлов при незначительном или отсутствующем контрастировании лимфатических сосудов.
Второй этап настоящей работы — анализ результатов лечения постмастэктомической лимфедемы у 10 пациенток, госпитализированных в МНИОИ им. П.А. Герцена и ГБУЗ «ГКОБ № 1 ДЗМ» для хирургического лечения данного осложнения. Стадии РМЖ на момент операции pT1–4bN1–3M0, срок развития ПМОК от 2 до 6 лет. Измерение конечностей выполнено на 9 стандартных уровнях, разница в окружностях составила от 2,5 до 17 см. Показания к операции определяли на основании клинико-инструментальных данных. Пациенткам была выполнена флюоресцентная лимфография с использованием препарата, содержащего индоцианин зеленый, и портативного оборудования зарубежного производства. Препарат, содержащий индоцианин зеленый, вводили в сосуды I, II, IV межпальцевых промежутков кисти. Результат с помощью портативной камеры с источником света оценивали непосредственно после введения и в течение последующих 15 мин c фиксацией изображений с экрана монитора.
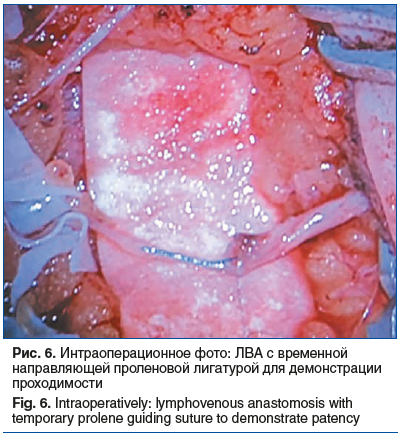
У 9 пациенток данной группы наблюдался диффузный тип лимфооттока (рис. 4) и у 1 — коллекторный тип, установленные по данным лимфосцинтиграфии. Липосакцию предплечья, плеча и в 5 случаях тыльной поверхности кисти выполняли с использованием аппарата водоструйных технологий [84] до достижения показателей окружностей меньше здоровой конечности у 9 больных, наложение ЛВА в верхней трети предплечья около локтевой области (рис. 5) с использованием операционного микроскопа — в 1 наблюдении (рис. 6).


Итого хирургическое лечение на двух этапах исследования было применено у 299 пациенток со II, III, IV стадиями ПМОК, выполнено 370 операций (табл. 1).
Всем пациенткам осуществляли измерение окружностей конечностей с записью показателей на 1, 3, 7, 14-е сутки, через 1, 3, 6–8 мес., 2, 3 года после операции.
Из 212 пациенток, которым были выполнены микрохирургические операции ЛВА (изолированно или в рамках выполнения комбинированных операций), хорошие результаты в сроки от 1 года до 7 лет были отмечены у 36% больных (редукция отека на 75%), удовлетворительные (редукция отека на 50%) — у 58,3%, плохие — у 5,7%. Установлено, что операции формирования ЛВА эффективны только в начальных стадиях лимфедемы конечности. Причем максимальное количество ЛВА, влияющих на результат микрохирургической операции, составляет 6, а дальнейшее увеличение их числа не повышает эффективность операции. Из 29 больных с ПМОК III–IV стадий, которым были выполнены резекционные операции типа Homans и Servelle, хорошие непосредственные результаты были отмечены у 25,6% больных, у остальных 74,4% — удовлетворительные. Однако уже через 2 года у 11 больных результаты лечения оценены как плохие, а через 5 лет доля плохих результатов возросла до 50%. Таким образом, резекционные операции при ПМОК позволяют достичь временного эффекта, но не обеспечивают стойкого удовлетворительного результата в отдаленные сроки [15, 25, 63].
У всех 9 пациенток, которым была выполнена водоструйная липосакция верхней конечности, получены отличные и хорошие стабильные результаты в течение 1 года — 5 лет наблюдения (редукция отека на 70–100%).
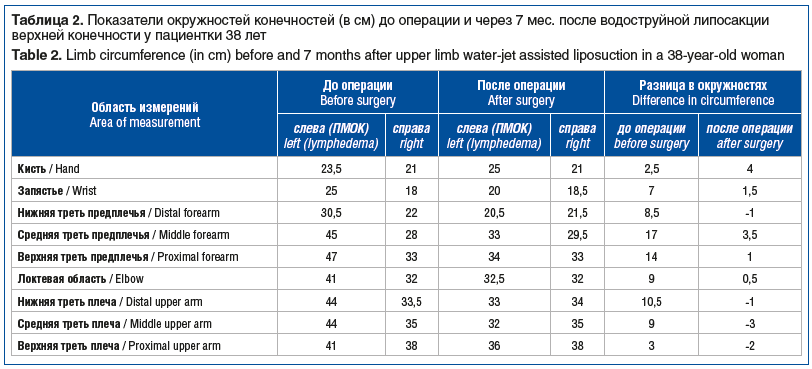
В качестве примера приводим результаты измерения окружностей конечности до и после водоструйной липосакции (табл. 2, рис. 7), выполненной пациентке 38 лет с диагнозом: [С50.4] Рак левой молочной железы IIIC ст. рТ2mN3M0. Люминальный тип В, Her2/neu-позитивный. Состояние после комплексного лечения с 2012 г. (О + ЛТ + 6ПХТ + ОЭ + ГТ тамоксифеном). [I97.2] Постмастэктомический отек левой верхней конечности III степени II стадии.

Заключение
Хирургическая реабилитация больных с постмастэктомической лимфедемой является сложной, во многих случаях многоэтапной и должна быть начата своевременно при неэффективности консервативного лечения. При II степени (разница в окружностях конечностей 2–6 см) [18, 21, 22] и II стадии (мягкий отек) лечение необходимо начинать (при наличии показаний на основании данных лимфосцинтиграфии и/или флюоресцентной лимфографии) с микрохирургических операций — наложения ЛВА [20, 72–80]. Наибольшее количество ЛВА, влияющих на результат микрохирургической операции, составляет 6, и дальнейшее увеличение их числа не повышает эффективность операции [25]. При III, IV степенях, II стадии ПМОК, неэффективности консервативного лечения или отсутствии стабильного результата последней показана липосакция конечности. Методика щадящей водоструйной липосакции доказала свою эффективность [28, 81–87]. Успех хирургического лечения зависит от комплексного подхода с включением консервативной терапии [15, 16, 25, 8–91].
Сведения об авторах:
Ермощенкова Мария Владимировна — д.м.н., заведующая отделением онкомаммологии и реконструктивно- пластической хирургии ГБУЗ «ГКОБ № 1 ДЗМ»; 117152, Россия, г. Москва, Загородное ш., д. 18А, стр. 7; доцент кафедры онкологии, радиотерапии и реконструктивной хирургии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-4178-9592.
Мясникова Марина Олеговна — д.м.н., профессор кафедры факультетской хирургии ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8.
Зикиряходжаев Азизжон Дильшодович — д.м.н., профессор кафедры онкологии, радиотерапии и реконструктивной хирургии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский Университет) Минздрава России; 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; заведующий отделением онкологии и реконструктивно-пластической хирургии молочной железы МНИОИ им. П.А. Герцена — филиала ФГБУ «НМИЦ радиологии» Минздрава России; 125284, Россия, г. Москва. 2-й Боткинский пр-д, д. 3; ORCID iD 0000-0001-7141-2502.
Галкин Всеволод Николаевич — д.м.н., главный врач ГБУЗ «ГКОБ № 1 ДЗМ»; 117152, Россия, г. Москва, Загородное ш., д. 18А, стр. 7; профессор кафедры онкологии, радиотерапии и реконструктивной хирургии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-6619-6179.
Старцева Олеся Игоревна — д.м.н., профессор кафедры онкологии, радиотерапии и реконструктивной хирургии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский Университет) Минздрава России; 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; врач-онколог отделения онкомаммологии и реконструктивно-пластической хирургии ГБУЗ «ГКОБ № 1 ДЗМ»; 117152, Россия, г. Москва, Загородное ш., д. 18А, стр. 7; ORCID iD 0000-0003-4839-9973.
Решетов Игорь Владимирович — д.м.н., профессор, академик РАН, заведующий кафедрой онкологии, радиотерапии и реконструктивной хирургии, директор института кластерной онкологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский Университет) Минздрава России; 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002- 0909-6278.
Бересток Татьяна Сергеевна — врач-онколог отделения онкомаммологии и реконструктивно-пластической хирургии ГБУЗ «ГКОБ № 1 ДЗМ»; 117152, Россия, г. Москва, Загородное ш., д. 18А, стр. 7; ORCID iD 0000-0002-7261-8956.
Контактная информация: Ермощенкова Мария Владимировна, e-mail: maryerm@mail.ru.
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 11.05.2023.
Поступила после рецензирования 05.06.2023.
Принята в печать 29.06.2023.
About the authors:
Mariya V. Ermoshchenkova — Dr. Sc. (Med.), Head of the Department of Oncomammalogy and Reconstructive Plastic Surgery, City Clinical Oncological Hospital No. 1; 18А, Build. 7, Zagorodnoe road, Moscow, 117152, Russian Federation; associate professor of the Department of Oncology, Radiotherapy, and Reconstructive Surgery, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002-4178-9592.
Marina O. Myasnikova — Dr. Sc. (Med.), professor of the Department of Faculty Surgery, I.P. Pavlov First Saint-Petersburg State Medical University; 6-8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation.
Azizzhon D. Zikiryakhodzhaev — Dr. Sc. (Med.), professor of the Department of Oncology, Radiotherapy, and Reconstructive Surgery, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; Head of the Department of Oncology and Breast Reconstructive Plastic Surgery, P.A. Hertsen Moscow Oncology Research Institute — Branch of the National Medical Research Radiological Centre; 3, 2nd Botkinskiy pass., Moscow, 125284, Russian Federation; ORCID iD 0000-0001-7141-2502.
Vsevolod N. Galkin — Dr. Sc. (Med.), Head Doctor, City Clinical Oncological Hospital No. 1; 18А, Build. 7, Zagorodnoe road, Moscow, 117152, Russian Federation; professor of the Department of Oncology, Radiotherapy, and Reconstructive Surgery, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002-6619-6179.
Olesya I. Startseva — Dr. Sc. (Med.), professor of the Department of Oncology, Radiotherapy, and Reconstructive Surgery, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; oncologist, Department of Oncomammalogy and Reconstructive Plastic Surgery, City Clinical Oncological Hospital No. 1; 18А, Build. 7, Zagorodnoe road, Moscow, 117152, Russian Federation; ORCID iD 0000-0003-4839-9973.
Igor V. Reshetov— Dr. Sc. (Med.), Professor, Academician of the RAS, Head of the Department of Oncology, Radiotherapy, and Reconstructive Surgery, Director of the Institute of Cluster Oncology, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002- 0909-6278.
Tat'yana S. Berestok — oncologist, Department of Oncomammalogy and Reconstructive Plastic Surgery, City Clinical Oncological Hospital No. 1; 18А, Build. 7, Zagorodnoe road, Moscow, 117152, Russian Federation; ORCID iD 0000-0003-4839-9973.
Contact information: Mariya V. Ermoshchenkova, e-mail: maryerm@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 11.05.2023.
Revised 05.06.2023.
Accepted 29.06.2023.












