Введение
Генно-инженерный инсулин человека и аналоги инсулина человека являются биотехнологическими лекарственными препаратами (БЛП), т. е. производятся с использованием технологии рекомбинантной ДНК и являются белками по своей структуре. Будучи белковыми препаратами, БЛП могут вызывать нежелательный иммунный ответ (ИО). Способность БЛП вызывать ИО называется иммуногенностью [1]. Развитие ИО осуществляется преимущественно через гуморальные механизмы и может объективно отслеживаться по концентрации или титру образующихся в ответ на введение препарата антител (АТ) [2]. Для всех БЛП характерно наличие 3 типов АТ: 1-й — АТ, которые не оказывают никакого влияния на эффективность и безопасность; 2-й тип — элиминирующие антитела, изменяющие фармакокинетику препарата; 3-й тип — нейтрализующие АТ, вызывающие конформационные изменения и, как следствие, эффективность БЛП [3].
Последствия ИО на БЛП значительно варьируют и проявляются изменениями от преходящего появления АТ без клинических проявлений и вплоть до тяжелых, угрожающих жизни состояний. Потенциальными клиническими последствиями нежелательного ИО на БЛП в целом являются снижение эффективности препарата, тяжелые общие иммунные реакции, включая анафилаксию, а для БЛП, применяемых в качестве заместительной терапии, — потенциальная перекрестная реактивность с эндогенным аналогом, если продукция этого аналога сохранилась [1].
За время своего существования препараты инсулина прошли эволюцию от природного инсулина, получаемого из поджелудочной железы домашних животных, до рекомбинантных препаратов и аналогов человеческого инсулина [4].
Если ранее применение препаратов сопровождалось развитием таких нежелательных явлений, как аллергические реакции, отсутствие эффективности и частые гипогликемии [5], то применение аналогов инсулина практически решило эту проблему [6]. Тем не менее вопрос исследований иммуногенности инсулинов остается открытым в связи с высокой социальной значимостью сахарного диабета (СД) и наличием ряда препарат-специфических проявлений ИО. Данный обзор включает основную информацию по предикторам развития ИО, а также методам доклинического и клинического изучения иммуногенности инсулинов.
Клинические проявления развития ИО на фоне инсулинотерапии
Поскольку инсулин является жизненно необходимым, потеря эффективности экзогенного инсулина или возникновение перекрестной реактивности с эндогенным инсулином вследствие развития ИО являются крайне значимыми с клинической точки зрения. Поскольку выраженный ИО на введение современных аналогов инсулина человека и генно-инженерных человеческих инсулинов встречается достаточно редко, количество наблюдаемых случаев клинических проявлений ИО невелико, появление АТ в большинстве случаев не сопряжено с появлением клинической картины и остается только лабораторной находкой [7].
Тем не менее в случае развития клинической симптоматики ИО на вводимый экзогенный инсулин, помимо возможных неспецифических для инсулина нежелательных явлений (например, реакций гиперчувствительности), появление АТ к инсулину может быть ассоциировано с нарастанием АТ-ассоциированной инсулинорезистентности [8–10], с повышением риска развития гипогликемии, преимущественно в ночное время [8, 9, 11–13], и иногда — с повышением вариабельности гликемии и ухудшением метаболического контроля [14].
Широко используемые конечные точки эффективности (уровень гликированного гемоглобина или среднесуточное значение гликемии) в большинстве случаев оказываются нечувствительны к факту развития ИО [14], поскольку образующиеся АТ связываются с молекулами экзогенного инсулина обратимо. Когда экзогенный инсулин находится в связанном с АТ состоянии, его действие снижается за счет «деактивации» связанных молекул, что ведет к развитию гипергликемии и повышению потребности в инсулине (АТ-ассоциированная инсулинорезистентность). При незначительном изменении рН связь АТ с молекулой инсулина нарушается, и «освобожденные» молекулы инсулина оказываются резервуаром, который не был учтен при расчете дозы очередной инъекции, что в итоге приводит к гипогликемии на фоне избытка активного инсулина [7, 15]. Было показано, что частота развития гипогликемических эпизодов выше у пациентов с развитием ИО по отношению к введению экзогенного инсулина [16].
Таким образом, при повышенной суточной вариабельности гликемии показатель среднесуточной гликемии или уровня гликированного гемоглобина остается нечувствительным к наличию АТ-опосредованных колебаний в действии вводимого инсулина. Несмотря на повышение вариабельности уровня гликемии, в большинстве клинических исследований было показано отсутствие взаимосвязи между наличием микрососудистых осложнений СД и наличием антиинсулиновых АТ [14].
Кроме АТ, связывающих экзогенный инсулин, при развитии ИО на фоне инсулинотерапии могут вырабатываться нейтрализующие АТ, способные также связать молекулы эндогенного инсулина [2, 17, 18], формируя дополнительную АТ-ассоциированную инсулинорезистентность у пациентов с СД.
Возможные негативные последствия развития ИО требуют от производителей БЛП, в т. ч. оригинальных и биоаналогичных инсулинов, изучать иммуногенность разрабатываемых препаратов с целью обеспечения безопасности пациентов. Риск развития ИО может быть обусловлен рядом факторов, связанных как с самим пациентом, так и с характеристиками БЛП [2, 3].
Пациент-ассоциированные факторы, связанные с развитием ИО
Одним из ключевых пациент-ассоциированных факторов, определяющих риск развития ИО у пациента, является его иммунный статус: по сравнению с риском развития ИО у здоровых добровольцев, у пациентов с иммунной супрессией риск будет ниже (в т. ч. при иммунной супрессии, вызванной приемом лекарственных препаратов, например, метотрексата), а у пациентов с повышенной иммунной реактивностью (например, при наличии аутоиммунного заболевания) — выше [2].
Так, например, при использовании препаратов инсулина риск развития ИО на экзогенный инсулин у пациентов с СД 1 типа будет выше, чем у пациентов с СД 2 типа, в силу аутоиммунной природы СД 1 типа, при этом при проведении анализа образования АТ будет возможно разделить аутоантитела и антитела к экзогенному инсулину на основании характеристик их связывания с инсулином [19].
Другим пациент-ассоциированным фактором развития ИО является возраст пациента. Ранее было показано, что риск развития ИО в ответ на введение инсулина у инсулин-наивных пациентов (т. е. не получавших инсулин ранее) уменьшается на 3% на каждый прожитый год [20], однако механизм, лежащий в основе этого явления, до конца не ясен; на данный момент предполагается, что с возрастом снижается иммунологическая реактивность [7].
Наличие АТ при старте терапии. Пациенты, которые ранее получали любой экзогенный инсулин, могут исходно иметь АТ к инсулину, поэтому при изучении иммуногенности препаратов инсулина всем пациентам обязательно должно проводиться базовое определение наличия антиинсулиновых АТ [2].
Генетический фактор. Некоторые варианты главного комплекса гистосовместимости (HLA) также могут быть ассоциированы с большим риском развития ИО при введении инсулина, однако полученные к настоящему моменту данные противоречивы и относятся преимущественно к животным инсулинам и устаревшим препаратам человеческого инсулина [21–24].
Все эти факторы учитываются при планировании клинических исследований оригинальных инсулинов и исследований сравнительной иммуногенности биосимиляров. Это находит отражение в критериях включения и невключения пациентов, в перечнях разрешенной и запрещенной сопутствующей терапии, при рандомизации и последующем статистическом анализе данных для того, чтобы учесть особенности всех субпопуляций и исключить влияние факторов, связанных с пациентом, на результаты и выводы исследования.
Препарат-ассоциированные факторы, связанные с развитием ИО
Происхождение инсулина и первичная структура молекулы. Вероятность развития ИО при введении бычьего или свиного инсулина значительно выше, чем при введении генно-инженерного человеческого инсулина или аналогов инсулина человека. Выраженность ИО в данном случае определяется величиной различий в структуре молекулы экзогенного и эндогенного инсулина [25]. Переход к человеческим инсулинам и эволюция системы очистки привели к выраженному снижению иммуногенности препаратов инсулина, однако генно-инженерный инсулин человека, хоть и в меньшей степени, чем животные инсулины, способен вызвать ИО при введении [26], вероятнее всего, в силу иных, нежели молекулярная структура, причин (например, вспомогательных компонентов и примесей) [2, 14].
Аналоги инсулина человека в целом обладают иммуногенностью, сопоставимой с таковой генно-инженерного человеческого инсулина [27–30]. Данные непрямых сравнений иммуногенности не позволяют сказать, какие из аналогов инсулина человека являются наиболее иммуногенными: в одном исследовании было показано, что наиболее выраженный ИО развивается при введении инсулинов гларгин и аспарт [31], тогда как данные других клинических исследований опровергают это утверждение [29, 32]. Подобная неоднозначность, вероятнее всего, связана с различиями в методике регистрации образования АТ и будет разрешена с усовершенствованием и приведением аналитических методик к единообразию [7].
Примеси с адъювантной активностью. Одним из основных предикторов развития ИО являются производственные примеси микроорганизма-продуцента (чаще — бактерии), с помощью которого был произведен инсулин. Эти примеси являются антигенами, на которые реагируют рецепторы антигенпрезентирующих клеток или В-лимфоцитов, что в итоге приводит к образованию АТ [33, 34].
К основным производственным примесям относятся липополисахариды, β-глюкан, флагеллин, ДНК/РНК, фрагменты белков продуцентов (HCP) и др. [34–37]. Следует отметить, что еще 20 лет назад не было четких руководств для оценки данных примесей [38]. С этой точки зрения биосимиляры инсулинов, выпускаемые после оригинальных препаратов, находятся в более выигрышном положении, поскольку в настоящее время для рутинного анализа доступны простые в использовании методы, с помощью которых можно количественно определять низкие уровни примесей, тем самым обеспечивая качество выпускаемых инсулинов [38].
Вспомогательные вещества используются для сохранения конформации молекулы инсулина, препятствуют деградации белка и применяются для достижения необходимых фармакологических свойств, но при этом они могут влиять на иммуногенность инсулина [2].
Одной из наиболее распространенных модификаций инсулинов является добавление нейтрального протамина Хагедорна (НПХ), представляющего собой белок форели. Добавление НПХ к инсулину приводит к изменению его фармакокинетических свойств путем формирования кристаллов, которые пролонгируют время всасывания инсулина из подкожно-жировой клетчатки. Таким образом, удается получить инсулины средней продолжительности действия и миксы — готовые смеси инсулинов разной продолжительности действия. Подобная технология используется как для человеческих инсулинов (Ринсулин® НПХ, Хумулин® НПХ), так и для аналогов человеческого инсулина (НовоМикс®).
Несмотря на широкое применение, наличие НПХ потенциально может привести к развитию ИО. Например, среди лекарственных препаратов инсулин растворимый, инсулин изофан НПХ и инсулин двухфазный по данному параметру наибольшая иммуногенность ожидается у препарата инсулин изофан НПХ, поскольку в данном ряду он содержит наибольшее количество протамина.
Путь введения, доза и частота введения. Подкожный, внутрикожный и ингаляционный пути введения ассоциированы с большим риском развития ИО по сравнению с таковым при внутримышечном или внутривенном (наименее иммуногенном) введении того же БЛП, при этом риск развития ИО повышается с увеличением частоты введения БЛП [2]. Так, например, было показано, что режимы непрерывной подкожной инфузии и множественных инъекций высокоочищенного свиного инсулина ассоциированы с большей выработкой АТ, нежели двукратное введение препарата [39], а ингаляционные инсулины обладают большей иммуногенностью, чем инсулины для подкожного введения [40–43].
Препарат-ассоциированные факторы могут быть модифицированы и до некоторых пределов учтены при производстве препарата инсулина, и именно они могут определять различия в иммуногенности биосимилярного и оригинального препаратов.
Доказательство биоаналогичности препаратов инсулина
Биоаналогичный лекарственный препарат (биоаналог) содержит молекулу с такой же первичной структурой, что и оригинальный БЛП. Однако в связи со способностью белков образовывать вторичные, третичные и четвертичные конформации, а также в связи с особенностями процесса производства БЛП с участием биологических источников вещества доказательство биоаналогичности инсулина, в соответствии с международными нормами и российским законодательством [1, 3], включает в себя не только сравнительное исследование эффективности и безопасности, но и физико-химические тесты (ФХТ), а также оценку биологической активности in vitro.
ФХТ при доказательстве биоаналогичности придается особое значение, поскольку, как было показано выше, структура молекулы, примеси и вспомогательные вещества являются препарат-ассоциированными факторами, определяющими иммуногенность, путь и частота введения оригинального препарата и его биоаналога одинаковы, а влияние пациент-ассоциированных факторов в рандомизированных контролируемых испытаниях полностью нивелируется (становится равно выраженным в группах оригинального и биоаналогичного препаратов).
Роль ФХТ в доказательстве биоаналогичности столь высока, что в определенных случаях допускается не проводить сравнительное исследование иммуногенности оригинального препарата и биоаналога на предрегистрационном этапе [1]. Новый биоаналогичный инсулин допустимо регистрировать на основании сопоставимых профилей примесей и вспомогательных веществ биоаналога и оригинального препарата, а также доказывающих его биоаналогичность физико-химических исследований и доказанной сопоставимой эффективности в in vitro фармакодинамических исследованиях и сравнительных исследованиях эффективности с использованием метода гиперинсулинемического эугликемического клэмпа. Эти данные дают достаточную гарантию того, что можно ожидать одинаковую частоту возникновения нежелательных лекарственных реакций, которые опосредуются чрезмерными фармакологическими эффектами (например, гипогликемия) и/или развитием ИО [1].
Перечень ФХТ, проводимых для доказательства биоаналогичности, может незначительно различаться в зависимости от препарата, но эти тесты должны быть взаимодополняющими и ортогональными, т. е. разными методами, направленными на оценку одного и того же показателя, что позволяет его оценить максимально точно и исключить ошибку определения. ФХТ проводятся как на активной фармацевтической субстанции (в данном случае — самой молекуле инсулина, действующем веществе готовой лекарственной формы препаратов инсулина), так и на готовой лекарственной форме с целью подтверждения отсутствия изменений, связанных с процессом ее производства.
К основным ФХТ относятся определение молекулярной массы методом хромато-масс-спектрометрии, определение аминокислотного состава, определение С- и N-концевых аминокислотных последовательностей, пептидное картирование (идентификация фрагментов молекулы), исследование вторичной структуры методом инфракрасной спектрометрии, подтверждение вторичной структуры методом кругового дихроизма, анализ третичной структуры белка (агрегации) методом аналитического ультрацентрифугирования, подтверждение пространственной структуры методом ядерно-магнитного резонанса, исследование четвертичной структуры белка, определение содержания белков ДНК штамма-продуцента инсулина, определение содержания свободного цистеина, изучение посторонних примесей, определение изоэлектрической точки и изучение термической денатурации методом дифференциальной сканирующей калориметрии.
ООО «Герофарм» при создании биоаналогов инсулина проводит все необходимые ФХТ. По результатам ФХТ, проводившихся для сравнения препаратов Ринсулин® Р, Ринсулин® НПХ, Ринсулин® Микс 30/70, РинЛиз, РинЛиз Микс 25 и РинГлар с соответствующими им оригинальными препаратами, были доказаны идентичные физико-химические свойства биоаналогов.
Сравнительные исследования иммуногенности биоаналогов инсулинов
Несмотря на возможность не проводить сравнительные исследования иммуногенности на предрегистрационном этапе и перенести их на пострегистрационный период,
ООО «Герофарм» было принято решение об их проведении до регистрации препаратов. На момент написания данного обзора сравнительные исследования иммуногенности завершены (Ринсулин® НПХ и Хумулин® НПХ) или завершаются (РинЛиз Микс 25 и Хумалог® Микс 25; РинГлар и Лантус® СолоСтар®); предоставление в Мин-
здрав РФ отчета о проведении клинического исследования для препаратов РинЛиз Микс 25 и РинГлар планируется на май — июнь 2019 г.
Основной целью сравнительных исследований иммуногенности является демонстрация того, что иммуногенность биоаналога не превышает таковую у оригинального БЛП. Назначение препаратов в течение 6 мес. является достаточным, поскольку ИО на введение экзогенного инсулина развивается в меньшие сроки [1]. В связи с тем, что развитие ИО при лечении генно-инженерными инсулинами человека или аналогами человеческого инсулина происходит достаточно редко, актуальные регуляторные нормы не требуют достигать высокой мощности исследования (за счет набора тысяч пациентов в каждую группу) [1], и для расчета размера выборки как в России, так и в мире обычно используются данные ожидаемой сравнительной эффективности препаратов [44, 45].
Сравнительные исследования иммуногенности инсулинов планируются таким образом, чтобы пациент-ассоциированные факторы иммуногенности не искажали интерпретацию результатов и чтобы при проведении анализа данных была возможность изучить потенциальное влияние антиинсулиновых АТ (при их обнаружении) на контроль гликемии, потребность в инсулине и безопасность, особенно на развитие местных и системных реакций гиперчувствительности.
Важное место в исследовании иммуногенности занимает определение АТ, обладающих нейтрализующей активностью, поскольку именно они влияют на эффективность и безопасность лекарственного препарата. В случае инсулинов, как и большинства БЛП, определение нейтрализующих АТ проводят с использованием in vitro модели, характеризующей механизм фармакологического действия препарата. Для инсулина это активация инсулинового рецептора. Наличие нейтрализующих АТ снижает степень активации рецептора, что регистрируется как критерий развития у пациента ИО.
В таблице 1 представлена информация о проведенных ООО «Герофарм» сравнительных исследованиях иммуногенности биоаналогов и соответствующих оригинальных препаратов инсулина.
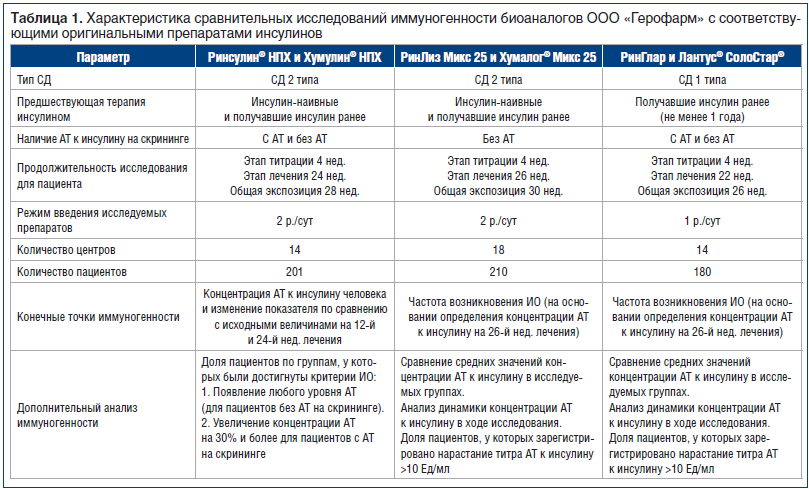
Заключение
В настоящее время в связи с отказом от использования инсулинов, полученных от животных, иммуногенный потенциал инсулинов главным образом обусловлен показателями качества препаратов, определяемых на физико-химических и доклинических стадиях изучения. Современные методы анализа и очистки БЛП позволяют практически полностью исключить различия в способности формирования АТ между оригинальным и воспроизведенным препаратами. Окончательное подтверждение отсутствия данных различий получается в ходе проведения клинических исследований иммуногенности.
Конфликт интересов: Бабенко А.Ю. заявляет об отсутствии конфликта интересов. Мосикян А.А. и Макаренко И.Е. являются сотрудниками ООО «Герофарм».








.gif)



