Введение
Осложнения, возникающие на ранних сроках гестации, зачастую приводят к неблагоприятным исходам беременности. Среди основных причин невынашивания беременности выделяют генетические, иммунологические, инфекционные, анатомические и эндокринные [1–3].
Залогом успешного наступления, течения и завершения беременности является полноценная нидация, инвазия цитотрофобласта и трансформация маточных артерий. Нарушение первой волны инвазии цитотрофобласта приводит к формированию первичной плацентарной недостаточности и прерыванию беременности до 12 нед. [4]. В норме в децидуальной ткани присутствует большое количество иммунокомпетентных клеток, которые состоят из Т-клеток (75%), макрофагов (23%) и В-клеток. Лимфоциты преимущественно представлены естественными киллерами (NК — natural killers) без цитолитической активности, способными распознавать исключительно HLA-антигены цитотрофобласта [5, 6]. При нормальном развитии беременности под действием прогестерона блокирующие антитела препятствуют распознаванию материнскими лимфоцитами чужеродного на 50% плода. В случае неполноценности иммунологической толерантности в эндометрии преобладают Т-хелперы 1 типа и активированные NK-клетки, которые продуцируют фактор некроза опухоли и интерферон-гамма, ограничивающие достаточную глубину инвазии цитотрофобласта. Все это приводит к образованию В-лимфоцитами специфических антиэмбриональных и антицитотрофобластных антител и иммунному отторжению плода.
Дефицит прогестерона нарушает процессы ангио- и васкулогенеза в децидуальной ткани, что приводит к локальной гипоксии и прерыванию беременности на ранних сроках [2, 7].
В связи с этим проблема исследования плацентарного сосудистого русла приобретает особое значение. Одним из наиболее перспективных диагностических методов остается ультразвуковое исследование (УЗИ). В акушерско-
гинекологической практике активно применяются такие диагностические технологии, как импульсная допплерометрия, цветное допплеровское картирование, 3D-реконструкция сосудов плацентарного комплекса [3]. Однако изучение внутриплацентарного кровотока на уровне микроциркуляции по-прежнему остается предметом исследований. Инновационная ультразвуковая методика SMI (Superb Micro-Vascular Imaging — высокоточная микрососудистая визуализация) позволяет изучать мельчайшие сосудистые структуры с низким уровнем кровотока, которые ранее не были доступны для исследования [3, 8, 9]. Кроме того, высокая разрешающая способность минимизирует возможные артефакты.
В связи с этим целью нашего исследования явилось
изучение влияния дефицита прогестерона в I триместре
беременности на показатели внутриплацентарного кровотока формирующейся плаценты.
Материал и методы
В исследование, проводившееся на базе кафедры акушерства и гинекологии лечебного факультета ФГБОУ ВО РНИМУ им. Н.И. Пирогова, были включены 97 пациенток с маточной одноплодной беременностью в сроке 6–8 нед. Алгоритм обследования пациенток включал: изучение анамнеза, гинекологический осмотр, общее клинико-лабораторное обследование, молекулярно-биологическую верификацию генитальных инфекций, бактериоскопическое и бактериологическое исследование влагалищных выделений с регистрацией рН влагалища, цитологическое исследование шейки матки, которые проводили по общепринятым методикам. При выявлении инфекций, передающихся половым путем, беременные в исследование не включались.
Всем пациенткам проводилось исследование концентрации прогестерона 2 раза с интервалом в 2 нед. Уровень прогестерона определялся методом иммунохемилюминесцентного анализа в сыворотке венозной крови. Забор крови осуществлялся утром натощак из кубитальной вены. В зависимости от уровня содержания прогестерона пациентки были разделены на 2 группы: I (основная) — c низким уровнем содержания прогестерона в крови (n=67); II (контрольная) — c нормальным уровнем прогестерона (n=30).
Всем пациенткам проводилось УЗИ в 11–13 нед. и 16–18 нед. с оценкой состояния плода и плаценты. Для изучения внутриплацентарного кровотока использовалась методика SMI ультразвуковой системы Aplio™ 500 компании Canon Medical Systems. В ходе исследования проводилось автоматическое вычисление количественной характеристики объемного кровотока — индекса васкуляризации (Vascularisation Index (VI) — процентное содержание сосудистых элементов в интересующем объеме ткани). В дальнейшем проводился корреляционный анализ между показателями прогестерона в крови и данными, полученными в ходе изучения внутриплацентарного кровотока. Наблюдение за течением гестационного процесса проводили до завершения беременности.
Статистическую обработку результатов проводили методами вариационной статистики с использованием лицензионных программ Microsoft Excel 5.0, Statistica 6.0.
Результаты исследования
Средний возраст беременных составлял 27,6±4,1 года (от 18 до 37 лет), из них первобеременных было 53 (54,6%), повторно беременных — 44 (45,3%). Беременность была желанной у всех пациенток, но у 35 (36%) — незапланированной. Нарушение менструального цикла в анамнезе имело место у 48 (49,4%) беременных в подростковом и репродуктивном возрасте, при этом у 16 (16,5%) — после неудачного завершения предыдущей беременности. В анамнезе 27 (27,8%) первобеременных и 18 (18,5%) повторно беременных — лечение по поводу первичного и вторичного бесплодия. В анамнезе 7 (7,2%) пациенток — артифициальный аборт. Срок беременности на момент включения в исследование составлял 6–8 нед. (в среднем 6,9±1,8 нед.). На стационарном лечении по поводу угрозы прерывания беременности находилась 31 (31,9%) пациентка, 8 (8,24%) — наблюдались в условиях стационара на дому. У всех пациенток основной жалобой были боли внизу живота, у 19 (19,5%) — незначительные темно-кровянистые выделения из влагалища.
При исследовании содержания прогестерона в крови выявлено, что в основной группе средний показатель составил 47,04±2,1 нмоль/л, что достоверно отличается от показателей, полученных в контрольной группе (74,12±1,9 нмоль/л).
УЗИ в сроке 11–13 нед. выявило нарушение в развитии плода у 1 пациентки из II группы: увеличение толщины воротникового пространства, отсутствие носовой кости, после проведения дополнительных методов исследования подтвержден синдром Дауна. В I группе отклонений по показателям фетометрии не наблюдалось. При оценке внутриплацентарного сосудистого русла в группе с дефицитом содержания прогестерона (I группа) с помощью ультразвуковой методики SMI определены обедненный кровоток и единичные сосудистые пучки на всей поверхности исследуемого участка формирующейся плаценты (рис. 1). В группе с нормальным уровнем прогестерона (II группа) определена выраженная сосудистая сеть в исследуемой зоне (рис. 2).

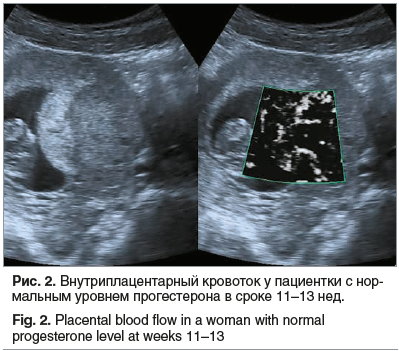
Индекс васкуляризации определялся автоматически. В исследуемых группах процентное соотношение сосудистых элементов крови (VI) в зоне исследования составило 20,3 (15,2–24,2) в I группе и 39,6 (16,1–44,1) во II группе. Достоверное повышение (р<0,05) отмечено во II группе.
На следующем этапе нашего исследования проводился корреляционный анализ уровня прогестерона в крови и значения VI. Корреляционный анализ выявил сильную прямую взаимосвязь между уровнем содержания прогестерона в крови и значением VI (r=0,95; p<0,05).
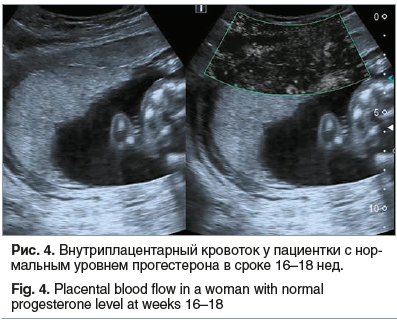
При исследовании внутриплацентарного кровотока в сроке 16–18 нед. было отмечено, что в обеих группах регистрировался активный кровоток в плаценте (рис. 3). Это связано с тем, что на данном сроке функция выработки прогестерона полностью принадлежит плаценте. Однако в I группе у 6 пациенток внутриплацентарный кровоток был скудный (рис. 4): у 3 из них беременность прервалась на сроке 19–20 нед., у 1 пациентки беременность закончилась преждевременными родами в 23–24 нед., 2 беременности закончились кесаревым сечением в 35–36 нед. по поводу синдрома задержки развития плода II и III степени.

Обсуждение
Прогестерон, вырабатываемый желтым телом, влияет на адекватные процессы трансформации эндометрия, нидации бластоцисты, первую волну инвазии трофобласта и плацентации. Его дефицит ведет к нарушению физиологического течения данных процессов. Одним из важнейших последствий такого нарушения является неполноценность сосудистой сети формирующейся плаценты.
Известно, что желтое тело активно функционирует до 10-й нед. беременности, в дальнейшем функция выработки прогестерона полностью переходит к плаценте. Нарушение функции плаценты и дефицит выработки прогестерона ведут не только к неполноценности второй волны инвазии трофобласта, но и к невынашиванию беременности. Диагностика подобных состояний на ранних сроках гестации позволяет предотвратить поздние осложнения. УЗИ с применением инновационных методик, позволяющих визуализировать сосудистую сеть на всех этапах плацентации, является вспомогательным методом выявления ранних нарушений беременности.
Заключение
Применение методики SMI с вычислением индекса васкуляризации позволяет судить о состоянии внутриплацентарной гемодинамики. Снижение уровня прогестерона на ранних сроках беременности является одним из факторов, влияющих на патологическое формирование внутриплацентарной сосудистой сети. Полученные данные могут служить ранними признаками развития первичной плацентарной недостаточности. Однако данный вопрос требует дальнейшего исследования.
Сведения об авторах:
1Дан Вальски — профессор, заведующий отделением медицины плода и пренатальной диагностики при кафедре акушерства и гинекологии, ORCID iD 0000-0000-0000-0000;
2Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии лечебного факультета, ORCID iD 0000-0003-2786-6181;
2Зубарева Елена Анатольевна — д.м.н., профессор, заведующая кафедрой ультразвуковой диагностики, ORCID iD 0000-0002-9997-4715;
2Боровкова Екатерина Игоревна — д.м.н., доцент, профессор кафедры акушерства и гинекологии лечебного факультета, ORCID iD 0000-0001-7140-262X;
2Залесская Софья Алексеевна — ассистент кафедры акушерства и гинекологии лечебного факультета, ORCID iD 0000-0003-2881-0788;
2Казанцев Сергей Николаевич — ассистент кафедры акушерства и гинекологии лечебного факультета, ORCID iD 0000-0000-0000-0000.
1Университетская клиника «Хадасса». 91120, Израиль, г. Иерусалим, Кирьят Хадасса, ПЯ 12000.
2ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Контактная информация: Залесская Софья Алексеевна, e-mail: sofa.zalesskaya@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила: 11.07.2019.
About the authors:
1Dan Valsky — MD, PhD, Head of the Ultrasound Unit and High-Risk Pregnancies of the Department of Obstetrics and Gynecology, ORCID iD 0000-0000-0000-0000;
2Yulia E. Dobrohotova — MD, PhD, Head of the Department of Obstetrics and Gynecology, ORCID iD 0000-0003-2786-6181;
2Elena A. Zubareva — MD, PhD, Head of the Department of Ultrasound Diagnostics, ORCID iD 0000-0002-9997-4715;
2Ekaterina I. Borovkova — MD, PhD, Associate Professor, Department of Obstetrics and Gynecology, ORCID iD 0000-0001-7140-262X;
2Sofia A. Zalesskaya — MD, assistant of the Department of Obstetrics and Gynecology, ORCID iD 0000-0003-2881-0788;
2Sergei N. Kazantsev — MD, PhD, assistant of the Department of Obstetrics and Gynecology, ORCID iD 0000-0000-0000-0000.
1Hadassah University Hospital. Kiryat Hadassah, p.o.b 12000, Jerusalem, 91120, Israel.
2Pirogov Russian National Research Medical University. 1, Ostrovityanova str., 117997, Moscow, Russian Federation.
Contact information: Sofia A. Zalesskaya, e-mail: sofa.zalesskaya@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 11.07.2019.












