Факт увеличения числа заболевших женщин с тенденцией к омоложению болезни является весьма тревожным, т. к. этот контингент пациенток представляет собой не только репродуктивно значимую часть населения, но и группу, активную в социальном отношении [2].
Так, за последние годы зарегистрировано увеличение почти вдвое числа заболевших женщин в возрасте от 20 до 40 лет (41,21%). Особенно заметный рост наблюдается в группе моложе 29 лет, где прирост этого показателя за прошедшее десятилетие составил 150% [3].
Важная роль в канцерогенезе РШМ отводится вирусу папилломы человека высокого канцерогенного риска (ВПЧ ВКР) [4]. Папилломавирусная инфекция (ПВИ) является одной из наиболее распространенных инфекций, передающихся половым путем, инфицированность ею сексуально активного населения планеты составляет 20–60% [5]. Принято считать, что ВПЧ-инфекция является ранним показателем предракового состояния [6], а у 15–20% инфицированных ПВИ вызывает ВПЧ-индуцированный рак генитальной сферы [7–9].
Развитию инвазивного РШМ предшествуют внутриэпителиальные клеточные атипические изменения, обозначаемые как цервикальные интраэпителиальные неоплазии (ЦИН) разной степени выраженности, и карцинома in situ — состояния, при которых в части клеток обнаруживаются признаки клеточного и ядерного атипизма и нарушения анизотропности эпителиального пласта без разрушения базальной мембраны и проникновения атипических клеток в подлежащие ткани. Считается, что ЦИН представляют собой предынвазивный аналог инвазивного плоскоклеточного рака [10].
Известно, что больные с дисплазией многослойного плоского эпителия (МПЭ) относятся к группе высокого риска развития инвазивной карциномы, тем не менее, процесс злокачественной трансформации происходит в течение достаточно длительного времени, что дает возможность проведения соответствующих лечебных мероприятий, препятствующих развитию рака [11].
В настоящее время не существует ни одного метода прогнозирования течения ЦИН у конкретной больной, определяющего возможность стойкой персистенции или прогрессии в более высокую степень либо в инвазивный РШМ, с указанием точного времени длительности этого процесса [12].
Очевидно, что недостаточность скринингового контроля, ограниченные возможности традиционных методов обследования значительно затрудняют своевременное выявление преинвазивных патологических цервикальных состояний. Особую трудность представляет диагностика латентной и субклинической форм ВПЧ-инфекции, которые часто сосуществуют с клинически манифестированными состояниями цервикального эпителия, предрасполагая к рецидивам после удаления видимого очага опухоли, связанным с персистенцией вируса в сопредельных тканях.
Известно, что даже конизация шейки матки не всегда дает полный лечебный эффект, т. к. в оставшемся МПЭ могут сохраняться нерезицированные очаги неоплазии, составляя от 5 до 28% [13–17].
Вышеизложенное диктует необходимость поиска новых методов диагностики и терапии цервикальной патологии, нацеленных на снижение хронических (персистентных) папилломатозных инфекций, которые служат предшественниками инвазивных раковых опухолей [18].
Решение этих задач стало возможным благодаря применению в клинической онкогинекологии новейших методов визуализации биотканей и усовершенствованию лечения цервикальной патологии, основанных на достижениях химии, биологии и квантовой физики.
В собственном исследовании особенностью диагностического процесса явилось включение в него оптической когерентной томографии (ОКТ) в новой, скоростной модификации. Комплекс лечебных мероприятий дополнился использованием комбинированного препарата Депантол в качестве реабилитационного мероприятия после деструкции шейки матки и фотодинамической терапии (ФДТ) в случае наличия по данным морфологии в крае резекции признаков ВПЧ-инфекции.
Цель исследования: повысить эффективность органосохраняющего лечения ЦИН у женщин репродуктивного возраста путем включения в диагностический процесс ОКТ в скоростной модификации и использования в комплексе лечебных мероприятий комбинированного препарата Депантол и ФДТ.
Материалы и методы
В исследование вошли 42 пациентки с H-SIL (ЦИН II–III), с-r in situ шейки матки в возрасте от 19 до 38 лет. Всем больным было проведено комплексное обследование: оценка биоты нижнего отдела гениталий (качественный ПЦР-анализ на абсолютные патогены, «Фемофлор», мазок на флору влагалища), ВПЧ-тестирование, типирование, определение вирусной нагрузки — ПЦР в реальном времени. Дальнейшие диагностические мероприятия, проводившиеся после восстановления биоценоза влагалища с назначением по показаниям этиотропной терапии, включали в себя жидкостное цитологическое исследование, иммуноцитохимическое обследование на наличие белка p16ink4a и/или биопсию шейки матки, ОКТ-кольпоскопию (кольпоскопия с проведением традиционных тестов + ОКТ в скоростной модификации).
ОКТ в скоростной модификации — метод прижизненной визуализации биотканей в результате зондирования их низкоинтенсивным светом ближнего инфракрасного диапазона, позволяющий в отличие от классической ОКТ охарактеризовать не только структурные, но и функциональные особенности ткани.
Основной диагностической задачей являлось определение истинных размеров патологического очага, который характеризовался совокупностью анормальных кольпоскопических и ОКТ-признаков.
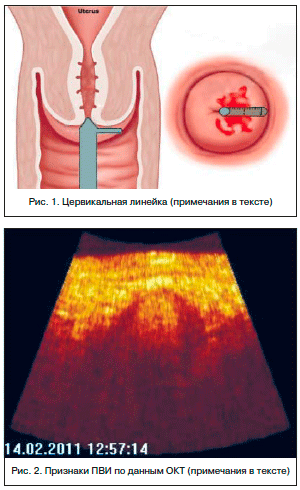
После расширенного кольпоскопического исследования с применением стандартной пробы с уксусной кислотой проводилось скоростное ОКТ-сканирование зон максимальных кольпоскопических изменений. Для этого зонд от оптического томографа прижимался к зонам интереса на 12 с целью обнаружения внутри них участков, имеющих большие степени негативных оптических характеристик. Далее осуществлялось пошаговое скоростное ОКТ-сканирование этих участков по лучу, следующему от цервикального канала до сводов влагалища. Отдаленность поражений от цервикального канала фиксировалась в миллиметрах с помощью специальной цервикальной линейки, разработанной на базе кафедры акушерства и гинекологии НижГМА (рис. 1). Граница перехода сомнительных и злокачественных ОКТ-изображений в доброкачественные, выявленная с помощью линейки, обозначалась как планируемый эктоцервикальный край резекции. В кольпоскопическом протоколе помимо общепринятых данных отмечались луч ОКТ-зондирования соответственно часам мнимого циферблата, планируемый эктоцервикальный край резекции по этому лучу в миллиметрах и наличие признаков ПВИ за пределами планируемого края резекции. К признакам ПВИ по данным ОКТ относятся: снижение скорости угасания оптического сигнала, субэпителиальный отек и полнокровие, наличие многокамерных, сообщающихся «окон» — полостей в базальных слоях многослойного плоского неороговевающего цервикального эпителия. Данные ОКТ-проявления на фоне доброкачественного изображения расценивались как резервуар ПВИ (рис. 2).
Первым этапом лечения всех пациенток явилось выполнение им электроконизации шейки матки с последующим выскабливанием цервикального канала и гистологической оценкой эндоцервикального края резекции. Эктоцервикальный край тщательно исследовался путем микроскопического обследования серийных или ступенчатых срезов с изучением маркированного нитью луча, наиболее подозрительного по данным ОКТ-кольпоскопии на наличие ВПЧ-ассоциированных эпителиальных поражений.
В послеоперационном периоде 22 пациенткам с целью профилактики воспалительных осложнений и стимуляции регенеративных свойств с 3-го дня деструкции во влагалище вводился комбинированный препарат Депантол по 1 вагинальному суппозиторию 2 р./сут в течение 10 дней. Они составили опытную группу. В контрольной группе (20 пациенток) реабилитационных мероприятий после электроконизации шейки матки не проводилось.
Депантол — комбинированный препарат, оказывающий регенерирующее, противомикробное, метаболическое действие. Форма выпуска: вагинальные суппозитории. В состав 1 вагинального суппозитория входит декспантенол — 100 мг и хлоргексидина биглюконат — 16 мг.
Хлоргексидина биглюконат активен в отношении грамположительных и грамотрицательных бактерий: Treponema pallidum, Chlamydia spp., Ureaplasma spp., Neisseria gonorrhoeae, Gardnerella vaginalis, Bacteroides fragilis, Escherichia coli, Staphylococcus spp., Streptococcus spp.; дрожжей, дерматофитов, простейших (Trichomonas vaginalis). К хлоргексидину слабочувствительны некоторые штаммы Pseudomonas spp., Proteus spp., а также устойчивы кислотоустойчивые формы бактерий, споры бактерий.
Декспантенол стимулирует регенерацию слизистых оболочек, нормализует клеточный метаболизм, ускоряет митоз и увеличивает прочность коллагеновых волокон.
Депантол не нарушает функциональную активность лактобацилл. Сохраняет активность (хотя и несколько сниженную) в присутствии крови, гноя.
Клинический мониторинг за репарацией поврежденной ткани осуществляли на 7-10-й день после деструкции и через 30 дней после вмешательства с помощью ОКТ-кольпоскопии. Микробиологическое исследование проводили через 30 дней после операции.
После получения результатов гистологического исследования операционного материала пациенткам с наличием в крае резекции признаков ВПЧ-инфекции проводилась ФДТ.
ФДТ — двухкомпонентный метод лечения опухолевых заболеваний, основанный на эффектах взаимодействия фотосенсибилизатора (ФС) и света строго определенной длины волны. В результате реализации фотодинамической реакции происходят геморрагический некроз опухолевой ткани и ее замещение соединительнотканными структурами. Фотохимическая реакция включает в себя прямую гибель клеток за счет синглетного кислорода, повреждение сосудистого русла опухолевой ткани, иммунный ответ [19–21].
Лазерное воздействие на шейку матки осуществлялось в первую фазу менструального цикла (при исключенной беременности) через 1,5–2 ч после введения фотосенсибилизатора хлоринового ряда в дозе 1 мг/кг. Препарат вводился в/в 200 мл физиологического раствора в течение 30 мин.
Использовалась полипозиционная методика лазерного воздействия (ФДТ выполнялась как на всем протяжении цервикального канала, так и на всей площади влагалищной порции шейки матки).
Плотность энергии лазерного излучения составляла 100–200 Дж/см2, плотность мощности — 250–400 мВт/см2.
Результаты исследования и обсуждение
Все пациентки имели нарушение нормальной микрофлоры влагалища, 30 из них были инфицированы ВПЧ ВКР.
Первым этапом лечения всех пациенток явилось выполнение им электроконизации шейки матки с последующим выскабливанием цервикального канала.
В послеоперационном периоде 22 пациенткам в качестве реабилитационного мероприятия с 3-го дня деструкции во влагалище вводился комбинированный препарат Депантол по 1 вагинальному суппозиторию 2 р./сут в течение 10 дней. Они составили опытную группу. В контрольной группе (20 пациенток) реабилитационных мероприятий после электроконизации шейки матки не проводилось.
Клинический мониторинг за репарацией поврежденной ткани осуществляли на 7-10-й день после деструкции и через 30 дней после вмешательства с помощью ОКТ-кольпоскопии. Микробиологическое исследование проводили через 30 дней после операции.
Динамическое наблюдение посредством ОКТ-кольпоскопии позволило определить, что эпителизация слизистой в послеоперационном периоде происходила под тонким струпом, который отторгался на 6-7-е сут в опытной группе и на 9-10-е сут — в контрольной группе. Отторжение струпа сопровождалось сукровичными либо незначительными кровянистыми выделениями, кровотечений не наблюдалось ни в одной из групп наблюдения. Полное замещение раневой поверхности МПЭ было отмечено на 3-4-й нед. после деструкции в опытной группе и на 5-6-й нед. — в контрольной группе пациенток.
Через 30 дней после операции всем пациенткам проводили контрольное исследование микрофлоры влагалища. Нормальные показатели отмечены у всех женщин опытной группы. В контрольной группе у 5 (25%) пациенток имелись различные нарушения биоценоза влагалища, в связи с чем требовалось назначение лечения.
Следует отметить, что всеми пациентками отмечена хорошая переносимость препарата Депантол.
Так, при назначении комбинированного препарата Депантол в послеоперационном периоде после электроконизации шейки матки отмечается выраженный профилактический противовоспалительный эффект и, как следствие, сокращение сроков регенерации поврежденной ткани на 2 нед. в опытной группе пациенток.
После получения результатов гистологического исследования операционного материала пациентки были разделены на 2 группы. В 1-ю группу вошли 27 женщин с отсутствием в краях резекции каких-либо эпителиальных изменений, характерных для ВПЧ-инфицирования, из них с диагнозом ЦИН II — 3 больные, ЦИН III — 20, с-r in situ — 4 пациентки. Лечение этих пациенток не включало проведения ФДТ.
При осмотре данных пациенток через 6 и 12 мес. после электроконизации цитологических и ОКТ-кольпоскопических данных, свидетельствующих о рецидиве, выявлено не было.
2-ю группу составили 15 пациенток с положительным по наличию ВПЧ-ассоциированных эпителиальных изменений краем резекции, из них у 7 определялись гистологические признаки ВПЧ-ассоциированных изменений МПЭ в виде папилломатозной гиперплазии, акантоза, дискератоза, нарушения стратификации МПЭ, наличия койлоцитов, у 5 выявлены ЦИН I, у 2 — ЦИН II.
Важно заметить, что морфологические заключения в 80% случаев во 2-й группе (12 пациенток) были прогнозируемы по скоростной ОКТ.
В 100% случаев обнаружения в крае резекции «ЦИН III минус» сомнительные и доброкачественные ОКТ-характеристики позволяли исключить инвазивный процесс, что являлось определяющим в одном клиническом случае, когда лечебная тактика была выбрана на основании ОКТ.
Данной пациентке на первом этапе была выполнена технически максимальная эксцизия, несмотря на невозможность определения планируемого эктоцервикального края резекции из-за обширности поражения, но отсутствовали данные об инвазии по скоростной ОКТ. В крае резекции была гистологически верифицирована ЦИН III, что было прогнозируемо.
Всем пациенткам 2-й группы с целью воздействия на клинические и субклинические формы ПВИ, а в последнем клиническом случае — с целью воздействия на нерезецированные очаги ЦИН, вторым этапом после деструкции выполнялась ФДТ. Выбор этого метода лечения у контингента больных фертильного возраста обусловлен максимальной возможностью сохранения архитектоники шейки матки, что является несомненным преимуществом перед проведением повторных эксцизионных процедур.
Реакция патологических очагов цервикального эпителия на ФДТ регистрировалась уже к концу сеанса лечения в виде отека и субэпителиальных кровоизлияний. На протяжении 1-й нед. происходило нарастание некротических изменений в зоне светового воздействия. Максимальная глубина и выраженность некроза, а также образование плотных фибриновых пленок, частично закрывающих просвет шеечного канала, обычно наблюдались к концу 2-й нед. после ФДТ. Постепенное очищение слизистой оболочки шейки матки от некротических тканей с четко визуализируемой границей между зоной эпителизации после ФДТ и плоскоэпителиальным покровом вне зоны светового воздействия завершилось к 3-4-й нед. после лечения. С учетом вышеизложенной оптимизации эпителизации при использовании Депантола после электроконизации препарат назначался всем пациенткам с 28-го дня после проведенного сеанса ФДТ по 1 суппозиторию 2 р./сут в течение 10 дней.
Мониторинг эффективности ФДТ осуществлялся путем проведения ОКТ-кольпоскопического, цитологического, вирусологического исследований после полного заживления шейки матки, затем каждые 4 мес. Сроки наблюдения составили 18 мес.
Полная или частичная регрессия ВПЧ-ассоциированных эпителиальных изменений достигнута у всех больных, причем с течением времени установлена тенденция их изменений на менее выраженную степень. Так, у пациентки с наличием в крае резекции ЦИН III в. динамике наблюдения к 12 мес. после 2-этапного лечения, по данным гистологического обследования биоптата, не было данных, свидетельствующих о ЦИН.
Следует обратить внимание на высокие показатели противовирусного эффекта ФДТ (по данным неоднократных исследований методом ПЦР), полная эрадикация ВПЧ достигнута у 12 женщин из 2-й группы.
Механизм противовирусного действия, вероятно, объясняется селективным накоплением ФС в клетках, инфицированных ВПЧ, с последующим их разрушением до базальных и парабазальных клеточных слоев вследствие прямого фототоксического и деструктивного лазерного воздействия.
Заключение
Таким образом, проведенные исследования показывают, что ОКТ в новой скоростной модификации делает возможным уточнение кольпоскопических картин, а использование цервикальной линейки оптимизирует планирование зоны резекции. Это позволяет при наличии обширных анормальных кольпоскопических картин, но отсутствии злокачественных ОКТ-данных в значительно отдаленных от наружного зева зонах эктоцервикса для сохранения архитектоники шейки матки выполнить максимально щадящее эксцизионное вмешательство.
Нами установлено, что включение комбинированного препарата Депантол в виде вагинальных суппозиториев в комплекс лечебных мероприятий после деструктивных вмешательств на шейке матки позволяет оптимизировать сроки реабилитации пациенток за счет выраженного профилактического противовоспалительного эффекта и, как следствие, путем ускорения регенерации поврежденных тканей.
В наших исследованиях также показана эффективность использования ФДТ у пациенток при наличии положительных ВПЧ-ассоциированных эпителиальных изменений в крае резекции после органосохраняющих операций, что можно объяснить его выраженным противовирусным эффектом, который связан с точечным воздействием на мультифокальные очаги вирусного поражения при клинической, субклинической и латентной формах ПВИ.
Данный метод обладает несомненным преимуществом перед проведением повторных эксцизионных процедур и является практически единственной возможностью предупреждения рецидивов цервикальной эпителиальной патологии при технически невозможной повторной конизации шейки матки.
Очевидно, что ФДТ у женщин репродуктивного возраста после эксцизии шейки матки снижает (а, возможно, и исключает) вероятность рецидивов интраэпителиальных неоплазий, а в итоге — предупреждает развитие РШМ.
Литература
-
Jemal A., Siegel R., Ward E. et al. Cancer Statistics, 2008 // CA Cancer. J. Clin. 2008. Vol. 58. P. 71–96.
-
Кулаков В.И., Паавонен Й., Прилепская В. Н. Профилактика рака шейки матки: руководство для врачей. М.: МЕДпресс-информ, 2007. С. 6–15.
- Чиссов В.И., Старинский В.В., Петрова Г. В. Злокачественные новообразования в России в 2010 году (заболеваемость и смертность). М., 2012. 260 с.
-
Bosch F.X., Burchell A.N., Shiffann M. et al. Epidemiology and natural history of human papillomavirus infection and timespecific implications in cervical neoplasia // Vaccine 2008. Vol. 25: 10. P. 1–16.
-
Краснопольский В.И. и др. Инфицированность вирусом папилломы человека среди девочек-подростков в Московской области // Рос. вест¬ник акушера-гинеколога. 2010. № 5. С. 46–49.
-
Spartz H., Lehr E., Zhang B. et al. Progression from productive infection to integration and oncogenic transformation in human papillomavirus type 59-immortalized foreskin keratinocytes // Virol. 2005, Vol. 336(1). P. 11–25.
- Дмитриев Г.А., Биткина О. А. Папилломавирусная инфекция. М.: Медицинская книга, 2006. 80 с.
- Ершов В.А., Нарвская О. В. Фоновые процессы и неоплазия эпителия шейки матки. СПб.: Человек, 2007. 79 с.
-
Fisher M., Rosenfeld W.D., Burk R. D. Cervicovaginal human papillomavirus infection in buburman adolescents and young adults // J. Pediatr. 2001. Vol. 119. P. 821–825.
-
Нейштадт Э.Л., Крулевский В. А. Дифференциальная диагностика опухолей шейки матки. Руководство. СПб: «КультИнформПресс», 2012. С. 85–88.
-
Новик В. И. Скрининг рака шейки матки // Практическая онкология. 2010. Т.11, № 2. С. 66–73.
-
Роговская С. И. Практическая кольпоскопия. М.: «ГЭОТАР-Медиа», 2011.
- Короленкова Л. И. Клинические и технические особенности электрохирургической конизации шейки матки у больных цервикальной интраэпителиальной неоплазией III // Акуш. и гин. 2012. № 3. С. 54–59.
-
Hamontri S., Israngura N., Rochanawutanon M. et al. Predictive factors for residual disease in the uterine cervix after large loop excision of the transformation zone in patients with cervical intraepithelial neoplasia III // J. Med. Assoc. Thai. 2010. № 93 (Suppl. 2). P. 74–80.
- Meng Q.W., Qin Z.H., Mao Y., Zhao X. D. Prognostic factors of cervical high-grade squamous intraepithelial lesions treated by knife conization with negative margin // Zhonghua Fu Chan Ke Za Zhi. 2007. Vol. 42, № 7. P. 457–459.
- Sun X.G., Ma S.Q., Zhang J.X., Wu M. Predictors and clinical significance of the positive cone margin in cervical intraepithelial neoplasia III patients // Chin. Med. J. 2009. Vol. 122, № 4. P. 367–372.
-
Tillmanns T.D., Falkner C.A., Engle D.B. et al. Preoperative predictors of positive margins after loop electrosurgical excisional procedure-Cone // Gynecol. Oncol. 2006. Vol. 100, № 2. P. 379–384.
-
Маянский А. Н. Папилломавирусы человека: возбудители доброкачественных и злокачественных неоплазий // Вопросы диагностики в педиатрии. 2010. Т. 2, № 2. С. 5–11.
-
Monk A., Brewer C., Van Nostrand K., Bems M.W. et al. Photodynamic therapy using topically applied dihematoporphyrin ether in the treatment of cervical intraepithelial neoplasia // Gynecol. Oncol. 1997. Vol. 64: 1. P. 70–75.
-
Yamaguchi S., Tsuda H., Takemori M. et al. Photodynamic therapy for cervical intraepithelial neoplasia // Oncology. 2005. Vol. 69. P. 110–116.
- Soergel P., Wang X., Stepp H. et al. Photodynamic therapy of cervical intraepithelial neoplasia with hexaminolevulinate // Lasers Surg. Med. 2008. Vol. 40, № 9. P. 611–615.













