
–Р–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М. –Т –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Њ—В –±–Њ–ї–µ–Ј–љ–µ–є —Б–Є—Б—В–µ–Љ—Л –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, –≤ —В. —З. –Њ—В –Њ—Б—В—А—Л—Е –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Є–љ–і—А–Њ–Љ–Њ–≤ (–Ю–Ъ–°), –њ—А–µ–≤—Л—И–∞—О—В —В–∞–Ї–Њ–≤—Л–µ –≤ —Б—В—А–∞–љ–∞—Е –Ч–∞–њ–∞–і–љ–Њ–є –Х–≤—А–Њ–њ—Л –Є –°–µ–≤–µ—А–љ–Њ–є –Р–Љ–µ—А–Є–Ї–Є [1, 2]. –Ю–њ—В–Є–Љ–Є–Ј–∞—Ж–Є—П –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –Њ—Б—В–∞–µ—В—Б—П –Њ–і–љ–Њ–є –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –Ј–∞–і–∞—З –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –љ–∞—И–µ–є —Б—В—А–∞–љ—Л [3]. –І—А–µ—Б–Ї–Њ–ґ–љ—Л–µ –Ї–Њ—А–Њ–љ–∞—А–љ—Л–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ (–І–Ъ–Т) —П–≤–ї—П—О—В—Б—П –Њ–±—Й–µ–њ—А–Є–Ј–љ–∞–љ–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –њ—А–Є –Ю–Ъ–°, –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ –њ–Њ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є [4, 5]. –Ю–і–љ–∞–Ї–Њ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –њ—А–Њ–і–Њ–ї–ґ–∞—О—В –±—Л—В—М –∞–Ї—В—Г–∞–ї—М–љ–Њ–є –Є –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ —А–µ—И–µ–љ–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є [6].
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ —А—П–і–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–°, –њ—А–Є —А–∞–Ј–≤–Є—В–Є–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –≤ –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ, –Ј–љ–∞—З–Є–Љ–Њ –Њ—В–ї–Є—З–∞—О—В—Б—П –Њ—В —В–∞–Ї–Њ–≤—Л—Е –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –±–Њ–ї—М–љ—Л—Е –±–µ–Ј –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –і–Њ—Б—В–Є–≥–∞—П 11% –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Я—А–Є —Н—В–Њ–Љ –≤ –≥—А—Г–њ–њ–∞—Е –±–µ–Ј –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є —З–∞—Б—В–Њ—В–∞ –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–є –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –љ–µ –њ—А–µ–≤—Л—И–∞–ї–∞ 6% [7]. –Э–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є —Н—Д—Д–µ–Ї—В ¬Ђ–±–Њ–ї—М—И–Є—Е¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є, —А–∞–Ј–≤–Є–≤—И–Є—Е—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –љ–∞ –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–Љ —Н—В–∞–њ–µ, —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –Є –≤ –Њ—В–і–∞–ї–µ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ґ–∞–Ї, –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ 3-–ї–µ—В–љ–µ–≥–Њ —Н—В–∞–њ–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° —Б –њ–Њ–і—К–µ–Љ–Њ–Љ —Б–µ–≥–Љ–µ–љ—В–∞ ST –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є HORIZONS-AMI —Б–Љ–µ—А—В–љ–Њ—Б—В—М —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е —Б —А–∞–Ј–≤–Є–≤—И–Є–Љ—Б—П –љ–∞ –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–Љ —Н—В–∞–њ–µ –ї–µ—З–µ–љ–Є—П ¬Ђ–±–Њ–ї—М—И–Є–Љ¬ї –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ–Љ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 5,8% –≤ –≥—А—Г–њ–њ–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞ –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ–∞ –Є 14,6% –≤ –≥—А—Г–њ–њ–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –≥–µ–њ–∞—А–Є–љ–∞ –Є —Н–њ—В–Є—Д–Є–±–∞—В–Є–і–∞ (—А=0,025) [8].
–Ь–µ—Е–∞–љ–Є–Ј–Љ—Л –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –љ–∞ –Є—Б—Е–Њ–і –Ю–Ъ–° –≤–Ї–ї—О—З–∞—О—В —Г—Е—Г–і—И–µ–љ–Є–µ –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є –љ–∞ —Д–Њ–љ–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Њ—В–Љ–µ–љ—Л –і–µ–Ј–∞–≥—А–µ–≥–∞–љ—В–Њ–≤ –Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤, —З—В–Њ –њ—А–Њ–≤–Њ—Ж–Є—А—Г–µ—В —А–µ—Ж–Є–і–Є–≤ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, –∞–Ї—В–Є–≤–∞—Ж–Є—О –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –љ–∞ —Д–Њ–љ–µ –≥–µ–Љ–Њ—В—А–∞–љ—Б—Д—Г–Ј–Є–Є –Є —А–µ–Ј–Њ—А–±—Ж–Є–Є –Ї—А–Њ–≤–Є [9].
–° –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –њ—А–Є –Ю–Ъ–° вАУ –љ–µ–Є–Ј–±–µ–ґ–љ–∞—П —А–∞—Б–њ–ї–∞—В–∞ –Ј–∞ –∞–Ї—В–Є–≤–љ–Њ–µ –≤–љ–µ–і—А–µ–љ–Є–µ –Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П –Є –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –њ—А–Є —Н—В–Њ–Љ –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–µ —А–∞–Ј–≤–Є—В–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –њ–Њ—З—В–Є –љ–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–µ –≤—А–∞—З–Є —З–∞—Б—В–Њ —Б–Њ–Ј–љ–∞—В–µ–ї—М–љ–Њ –Њ—В–Ї–∞–Ј—Л–≤–∞—О—В –њ–∞—Ж–Є–µ–љ—В–∞–Љ –≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Є–Ї —А–µ–њ–µ—А—Д—Г–Ј–Є–Є –Є –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –µ—Б–ї–Є –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—О—В —Г –љ–Є—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Г—Е—Г–і—И–∞—П —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ —В–µ—З–µ–љ–Є–µ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [10].
–Ю—Б–Њ–±–µ–љ–љ–Њ –Њ–њ–∞—Б–љ–∞ —В–∞–Ї–∞—П ¬Ђ–і–Є—Б–Ї—А–Є–Љ–Є–љ–∞—Ж–Є—П¬ї –і–ї—П –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ, –њ–µ—А–µ–Њ—Ж–µ–љ–Є–≤–∞—П —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –≤—Л—Б–Њ–Ї–Њ–≥–Њ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А–Є—Б–Ї–∞ (–њ–Њ–ґ–Є–ї–Њ–є –≤–Њ–Ј—А–∞—Б—В, —Д–Є–±—А–Є–ї–ї—П—Ж–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В), –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–µ –≤—А–∞—З–Є –≤ —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–µ–і–њ–Њ—З–Є—В–∞—О—В –љ–µ –љ–∞–Ј–љ–∞—З–∞—В—М –і–≤–Њ–є–љ—Г—О –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–љ—Г—О —В–µ—А–∞–њ–Є—О –±–Њ–ї–µ–µ —З–µ–Љ –≤ 70% —Б–ї—Г—З–∞–µ–≤ [11]. –Ю–і–љ–∞–Ї–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –≤—В–Њ—А–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –і–≤–Њ–є–љ–Њ–є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –Љ–Њ–ґ–µ—В –њ–Њ–≤—Л—Б–Є—В—М —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –љ–µ –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 7вИТ15% –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є [12]. –Я—А–Є —Н—В–Њ–Љ –њ–Њ–ї—М–Ј–∞ –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –њ–Њ–ї–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞ –і–µ–Ј–∞–≥—А–µ–≥–∞–љ—В–љ–Њ–є –Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –і–ї—П –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Ю–Ъ–°, –≤ —В. —З. –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П —Г–ї—Г—З—И–µ–љ–Є—П –±–ї–Є–ґ–∞–є—И–µ–≥–Њ –Є –Њ—В–і–∞–ї–µ–љ–љ–Њ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–∞ –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В —Б–Њ–Љ–љ–µ–љ–Є–є –Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [13, 14]. –Т—Л—И–µ–њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ —Д–∞–Ї—В—Л —В—А–µ–±—Г—О—В –Њ—В –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–µ–≥–Њ –≤—А–∞—З–∞ –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є —А–Є—Б–Ї–∞ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤—Б–µ—Е –і–Њ—Б—В—Г–њ–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –Є—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є [15].
–Т –њ–Њ–Є—Б–Ї–µ —А–µ—И–µ–љ–Є—П –Є–Ј–ї–Њ–ґ–µ–љ–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ—Л –≤—Л–њ–Њ–ї–љ–µ–љ –Њ–±–Ј–Њ—А –ї–Є—В–µ—А–∞—В—Г—А—Л, —Ж–µ–ї—М –Ї–Њ—В–Њ—А–Њ–≥–Њ вИТ –њ–Њ–ї—Г—З–Є—В—М –Њ–±—К–µ–Ї—В–Є–≤–љ—Г—О –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Њ —А–Є—Б–Ї–µ —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –њ—А–Є –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–Љ –≤–µ–і–µ–љ–Є–Є –≤ —Г—Б–ї–Њ–≤–Є—П—Е —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є, –Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –њ–Њ–і—Е–Њ–і–∞—Е –Ї –Њ—Ж–µ–љ–Ї–µ —А–Є—Б–Ї–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є –Є–Љ–µ—О—Й–Є—Е—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—П—Е –Є—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є.
–І–∞—Б—В–Њ—В–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–°
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ–Њ–і –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є –њ–Њ–љ–Є–Љ–∞—О—В –ї—О–±–Њ–µ –≤–љ—Г—В—А–µ–љ–љ–µ–µ –Є–ї–Є –≤–љ–µ—И–љ–µ–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–°, –≤ —В. —З. –≤—Б–µ –њ–Њ—Б—В–Ї–∞—В–µ—В–µ—А–Є–Ј–∞—Ж–Є–Њ–љ–љ—Л–µ –≥–µ–Љ–∞—В–Њ–Љ—Л –Ї–∞–Ї –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –і–Њ—Б—В—Г–њ–∞ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ї–Њ—А–Њ–љ–∞—А–Њ–≥—А–∞—Д–Є–Є [4].
–І–∞—Б—В–Њ—В–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Ю–Ъ–° –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤–∞—А—М–Є—А—Г–µ—В –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В–Є–њ–∞ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П вАУ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–ї–Є —А–µ–≥–Є—Б—В—А–Њ–≤–Њ–≥–Њ [16]. –°–Њ–≥–ї–∞—Б–љ–Њ –Ј–∞—А—Г–±–µ–ґ–љ—Л–Љ —А–µ–≥–Є—Б—В—А–Њ–≤—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ —З–∞—Б—В–Њ—В–∞ —А–∞–Ј–≤–Є—В–Є—П ¬Ђ–±–Њ–ї—М—И–Є—Е¬ї, –Є–ї–Є ¬Ђ—В—П–ґ–µ–ї—Л—Е¬ї, –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –њ—А–Є –Ю–Ъ–° –Љ–Њ–ґ–µ—В —Б–Њ—Б—В–∞–≤–ї—П—В—М –Њ—В 1 –і–Њ 10% –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–Є–і–∞ –≤—Л–њ–Њ–ї–љ—П–µ–Љ–Њ–є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Є –њ—А–Є–Љ–µ–љ—П–µ–Љ–Њ–є —В–µ—А–∞–њ–Є–Є [17].
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ —А–µ–≥–Є—Б—В—А–Њ–≤–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П CRUSADE, –і–Є–Ј–∞–є–љ –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞–ї —А—Г—В–Є–љ–љ–Њ–µ –≤—Л—П–≤–ї–µ–љ–Є–µ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —З–∞—Б—В–Њ—В–∞ –ї—О–±—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –њ—А–Є –Ю–Ъ–° –±–µ–Ј –њ–Њ–і—К–µ–Љ–∞ —Б–µ–≥–Љ–µ–љ—В–∞ ST —Б–Њ—Б—В–∞–≤–Є–ї–∞ –Њ—В 3,1 –і–Њ 19,5% –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Є—Б—Е–Њ–і–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –Є–Ј–±—А–∞–љ–љ–Њ–є —Б—В—А–∞—В–µ–≥–Є–Є –≤–µ–і–µ–љ–Є—П (–Є–љ–≤–∞–Ј–Є–≤–љ–Њ–є –Є–ї–Є –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–є) [18].
–Т —А–µ–≥–Є—Б—В—А–µ –Ю–Ъ–° вИТ ACTION Registry-GWTG, –Ї–Њ—В–Њ—А—Л–є —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А—Г–µ—В —Б 2007 –≥., —З–∞—Б—В–Њ—В–∞ ¬Ђ–±–Њ–ї—М—И–Є—Е¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –њ—А–Є –ї—О–±–Њ–Љ —В–Є–њ–µ –Ю–Ъ–° —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—В 5,5 –і–Њ 10,8%. –Я—А–Є —Н—В–Њ–Љ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —З–∞—Б—В–Њ—В–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б —В—П–ґ–µ–ї–Њ–є –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є, –±–µ–Ј –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –Ї–Њ—А–Њ–љ–∞—А–Њ–≥—А–∞—Д–Є–Є [19]. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –і—А—Г–≥–Њ–≥–Њ —А–µ–≥–Є—Б—В—А–Њ–≤–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —З–∞—Б—В–Њ—В–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –±–Њ–ї–µ–µ 10% —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –і–ї—П –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –Є –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є, –≤–Ї–ї—О—З–∞—П —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л—Е ¬Ђ—Е—А—Г–њ–Ї–Є—Е¬ї –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, —Б –љ–Є–Ј–Ї–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –Є –љ–∞–ї–Є—З–Є–µ–Љ –њ–Њ—З–µ—З–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є [20].
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—Ж–µ–љ–Ї–Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ–±—Л—В–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –≤ —А–∞–Љ–Ї–∞—Е –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –і–∞—О—В —Б—Е–Њ–і–љ—Л–µ –і–∞–љ–љ—Л–µ. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П —З–∞—Б—В–Њ—В–∞ –Њ–±—Й–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ —А—П–і–∞ –Ј–∞—А—Г–±–µ–ґ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1.
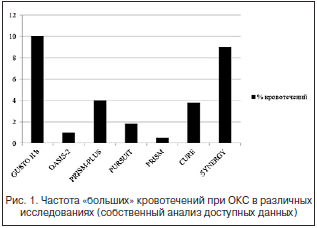
–°—В–Њ–ї—М —И–Є—А–Њ–Ї–Є–є –і–Є–∞–њ–∞–Ј–Њ–љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —З–∞—Б—В–Њ—В—Л –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ–±—Л—В–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° (–Њ—В 0,5 –і–Њ 10%) –Љ–Њ–ґ–љ–Њ –Њ–±—К—П—Б–љ–Є—В—М –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –µ–і–Є–љ—Л—Е –њ–Њ–і—Е–Њ–і–Њ–≤ –Ї –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є, —А–∞–Ј–ї–Є—З–Є–µ–Љ —Б—Е–µ–Љ –љ–∞–Ј–љ–∞—З–∞–µ–Љ–Њ–є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–є –Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –≤ —Н—В–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –Љ–љ–Њ–≥–Њ–Њ–±—А–∞–Ј–Є–µ–Љ –њ–Њ–і—Е–Њ–і–Њ–≤ –Ї —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є (—Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–є –Є–ї–Є —Н–љ–і–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є), —А–∞–Ј–љ—Л–Љ–Є —В–Є–њ–∞–Љ–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –і–Њ—Б—В—Г–њ–∞, —А–∞–Ј–ї–Є—З–Є—П–Љ–Є –≤ —В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є –Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞—А–Є–Є –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –Ї–Њ—А–Њ–љ–∞—А–Њ–≥—А–∞—Д–Є–Є, –∞ —В–∞–Ї–ґ–µ –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –≤ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —В–Є–њ–∞–Љ–Є –Ю–Ъ–°. –Т –Њ–і–љ–Њ–Љ –Є–Ј –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–Њ–≤ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –≤ –Ї–Њ–љ—Ж–µ 1990-—Е вАУ –љ–∞—З–∞–ї–µ 2000-—Е –≥–Њ–і–Њ–≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б —Г—З–∞—Б—В–Є–µ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° —Б–Њ–Њ–±—Й–∞–µ—В—Б—П, —З—В–Њ —З–∞—Б—В–Њ—В–∞ ¬Ђ–±–Њ–ї—М—И–Є—Е¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Љ–Њ–ґ–µ—В –і–Њ—Б—В–Є–≥–∞—В—М 9,5%, –∞ –Њ–±—Й–µ–µ —З–Є—Б–ї–Њ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (¬Ђ–±–Њ–ї—М—И–Є—Е¬ї –Є ¬Ђ–Љ–∞–ї—Л—Е¬ї) вИТ 17% (–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є ASSIST –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–є —Б—Е–µ–Љ—Л –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є вИТ –≥–µ–њ–∞—А–Є–љ–∞ –Є —Н–њ–Є—В–Є—Д–Є–±–∞—В–Є–і–∞ вИТ –≤—Л—П–≤–ї–µ–љ–∞ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —З–∞—Б—В–Њ—В–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є) [21].
–Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –≤—Л–њ–Њ–ї–љ–µ–љ–љ—Л—Е –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–°, –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ–∞—П —З–∞—Б—В–Њ—В–∞ ¬Ђ–±–Њ–ї—М—И–Є—Е¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є —Б–љ–Є–Ј–Є–ї–∞—Б—М –і–Њ 5,5%, —З—В–Њ —Н–Ї—Б–њ–µ—А—В—Л —Б–≤—П–Ј—Л–≤–∞—О—В, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ, —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —В—А–∞–љ—Б—А–∞–і–Є–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –і–Њ—Б—В—Г–њ–∞ –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Н–Ї—Б—В—А–µ–љ–љ–Њ–є –Ї–Њ—А–Њ–љ–∞—А–Њ–≥—А–∞—Д–Є–Є [22].
–Ф–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –њ–µ—А–µ—Е–Њ–і –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –і–Њ—Б—В—Г–њ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –Њ—В —В—А–∞–љ—Б—Д–µ–Љ–Њ—А–∞–ї—М–љ–Њ–є —В–µ—Е–љ–Є–Ї–Є –Ї —В—А–∞–љ—Б—А–∞–і–Є–∞–ї—М–љ–Њ–є –њ–Њ–Ј–≤–Њ–ї–Є–ї —Б–љ–Є–Ј–Є—В—М —Б–Љ–µ—А—В–љ–Њ—Б—В—М, —З–∞—Б—В–Њ—В—Г —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–≤—В–Њ—А–љ—Л—Е —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є –Є ¬Ђ–±–Њ–ї—М—И–Є—Е¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –Є –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–є —В–∞–Ї—В–Є–Ї–Њ–є –≤–µ–і–µ–љ–Є—П. –≠—В–Њ—В —Д–∞–Ї—В –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –≤ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–µ 17 –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –±–Њ–ї–µ–µ 17 —В—Л—Б. –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–°, –≤—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–Љ G. Ando et al. [23].
–Ю—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л—Е —А–∞–±–Њ—В, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –Њ—Ж–µ–љ–Ї–µ —З–∞—Б—В–Њ—В—Л —А–∞–Ј–≤–Є—В–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Ю–Ъ–°, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ —Н—В–Њ –і–∞–љ–љ—Л–µ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е —А–µ–≥–Є—Б—В—А–Њ–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (–†–Х–Ъ–Ю–†–Ф-1-3) [24] –Є–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–і–љ–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [25], –≤ –Ї–Њ—В–Њ—А—Л—Е —З–∞—Б—В–Њ—В–∞ –Њ–±—Й–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –≤—Б–µ—Е —В–Є–њ–∞—Е –Ю–Ъ–° –Њ—Ж–µ–љ–µ–љ–∞ –Ї–∞–Ї 10%. –Т —Н—В–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –љ–µ –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А—Г—О—В—Б—П —Б –њ–Њ–Љ–Њ—Й—М—О –Є–Ј–≤–µ—Б—В–љ—Л—Е —И–Ї–∞–ї –Њ—Ж–µ–љ–Ї–Є –Є—Е —В—П–ґ–µ—Б—В–Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —А—Г—В–Є–љ–љ–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –њ—А–∞–Ї—В–Є–Ї–∞ —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е —Б—В–∞—Ж–Є–Њ–љ–∞—А–Њ–≤ —Н—В–Њ–≥–Њ –љ–µ —В—А–µ–±—Г–µ—В. –Т –Њ—Б–љ–Њ–≤–љ–Њ–Љ —А–Њ—Б—Б–Є–є—Б–Ї–Є–µ —А–µ–≥–Є—Б—В—А–Њ–≤—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–∞–Ј–і–µ–ї–Є—В—М –≤—Б–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –љ–∞ ¬Ђ–±–Њ–ї—М—И–Є–µ¬ї –Є ¬Ђ–Љ–∞–ї—Л–µ¬ї –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Г—А–Њ–≤–љ—П —Б–љ–Є–ґ–µ–љ–Є—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –≥–µ–Љ–Њ—В—А–∞–љ—Б—Д—Г–Ј–Є–Є.
–Ю—Д–Є—Ж–Є–∞–ї—М–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Б—В–∞—В–Є—Б—В–Є–Ї–Є –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –†–§, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л–µ –њ—А–Њ–±–ї–µ–Љ–µ –Ю–Ъ–°, –љ–µ —В—А–µ–±—Г—О—В –≤—Л–і–µ–ї–µ–љ–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –њ–Њ—Н—В–Њ–Љ—Г –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ —А–µ–≥–Є—Б—В—А–Њ–≤—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –љ–∞ —Г—В–Њ—З–љ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Ю–Ъ–°, –≤ —А–Њ—Б—Б–Є–є—Б–Ї–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –∞–Ї—В—Г–∞–ї—М–љ—Л –Є –Ј–љ–∞—З–Є–Љ—Л –і–ї—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П.
–Я–Њ–і—Е–Њ–і—Л –Ї –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–°
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–ї—П –Њ—Ж–µ–љ–Ї–Є —В—П–ґ–µ—Б—В–Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Ю–Ъ–° –Є–Ј–≤–µ—Б—В–љ–Њ –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ —И–Ї–∞–ї: TIMI, GUSTO, REPLACE-2, ACUTY, PLATO, HORIZONS-AMI. –Т—Б–µ –Њ–љ–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л –∞–≤—В–Њ—А–∞–Љ–Є –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–≤ –Њ–і–љ–Њ–Є–Љ–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е —З–∞—Й–µ –≤—Б–µ–≥–Њ –Є–Ј—Г—З–µ–љ–Є—О –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –Ю–Ъ–° [26, 27].
–Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –і–ї—П –Њ—Ж–µ–љ–Ї–Є —В—П–ґ–µ—Б—В–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –≤ —А–∞–Љ–Ї–∞—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –≤ —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —И–Ї–∞–ї—Л TIMI –Є GUSTO [4]. –Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П TIMI –Њ—Б–љ–Њ–≤–∞–љ–∞ –љ–∞ –Ї–ї–Є–љ–Є–Ї–Њ-–ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П—Е. –Ґ–∞–Ї, ¬Ђ–±–Њ–ї—М—И–Є–Љ–Є¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П–Љ–Є —Б–Њ–≥–ї–∞—Б–љ–Њ —Н—В–Њ–є —И–Ї–∞–ї–µ —П–≤–ї—П—О—В—Б—П –Є–љ—В—А–∞–Ї—А–∞–љ–Є–∞–ї—М–љ—Л–µ, –∞ —В–∞–Ї–ґ–µ –ї—О–±—Л–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –Њ–±—Г—Б–ї–Њ–≤–Є–ї–Є —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –љ–∞ 50 –≥/–ї –Є –±–Њ–ї–µ–µ –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П. ¬Ђ–Ґ—П–ґ–µ–ї—Л–Љ¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ–Љ –њ–Њ —И–Ї–∞–ї–µ GUSTO —Б—З–Є—В–∞–µ—В—Б—П –Є–љ—В—А–∞–Ї—А–∞–љ–Є–∞–ї—М–љ–Њ–µ, –∞ —В–∞–Ї–ґ–µ –ї—О–±–Њ–µ –і—А—Г–≥–Њ–µ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–µ —Б–Њ–±—Л—В–Є–µ, –Ї–Њ–Љ–њ—А–Њ–Љ–µ—В–Є—А—Г—О—Й–µ–µ —Б–Є—Б—В–µ–Љ–љ—Г—О –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї—Г –Є —В—А–µ–±—Г—О—Й–µ–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ (–≥–µ–Љ–Њ—В—А–∞–љ—Б—Д—Г–Ј–Є—П, —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–∞—П –Њ—Б—В–∞–љ–Њ–≤–Ї–∞ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П).
–Э–µ—Б–Ї–Њ–ї—М–Ї–Њ –±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Є–є –Ї—А—Г–≥ ¬Ђ–±–Њ–ї—М—И–Є—Е¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –њ—А–µ–і–ї–∞–≥–∞–µ—В—Б—П –∞–≤—В–Њ—А–∞–Љ–Є —И–Ї–∞–ї—Л REPLACE-2 [28]: –Є–љ—В—А–∞–Ї—А–∞–љ–Є–∞–ї—М–љ–Њ–µ, –њ—А–Є–≤–µ–і—И–µ–µ –Ї –њ–∞–і–µ–љ–Є—О –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –љ–∞ 30 –≥/–ї –Є –±–Њ–ї–µ–µ –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П, –ї—О–±–Њ–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ, –њ–Њ—В—А–µ–±–Њ–≤–∞–≤—И–µ–µ –њ–µ—А–µ–ї–Є–≤–∞–љ–Є—П 2 –Є –±–Њ–ї–µ–µ –µ–і–Є–љ–Є—Ж –і–Њ–љ–Њ—А—Б–Ї–Њ–є –Ї—А–Њ–≤–Є, –∞ —В–∞–Ї–ґ–µ –Ј–∞–±—А—О—И–Є–љ–љ—Л–µ –≥–µ–Љ–∞—В–Њ–Љ—Л.
–Х–і–Є–љ—Л–Љ–Є –њ—А–Є–љ—Ж–Є–њ–∞–Љ–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —В—П–ґ–µ—Б—В–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ–≤–∞–ї–Є—Б—М –Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е ACUTY [29] –Є HORIZONS-AMI [30]. –Ъ ¬Ђ–±–Њ–ї—М—И–Є–Љ¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П–Љ —Н—В–Є —И–Ї–∞–ї—Л –Њ—В–љ–Њ—Б—П—В –Є–љ—В—А–∞–Ї—А–∞–љ–Є–∞–ї—М–љ—Л–µ, –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ—Л–µ, –Ј–∞–±—А—О—И–Є–љ–љ—Л–µ, –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Є–Ј –Љ–µ—Б—В–∞ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –і–Њ—Б—В—Г–њ–∞, –њ–Њ—В—А–µ–±–Њ–≤–∞–≤—И–Є–µ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞, –њ–Њ—Б—В–њ—Г–љ–Ї—Ж–Є–Њ–љ–љ—Л–µ –≥–µ–Љ–∞—В–Њ–Љ—Л –і–Є–∞–Љ–µ—В—А–Њ–Љ 5 —Б–Љ –Є –±–Њ–ї–µ–µ, —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –љ–∞ 30 –≥/–ї –Є –±–Њ–ї–µ–µ –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П, –ї—О–±—Г—О –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –≥–µ–Љ–Њ—В—А–∞–љ—Б—Д—Г–Ј–Є–Є.
–Ф–ї—П –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є—П –≤–Њ–Ј–љ–Є–Ї—И–Є—Е —А–∞–Ј–љ–Њ–≥–ї–∞—Б–Є–є –њ—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ш—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Є–є –∞–Ї–∞–і–µ–Љ–Є—З–µ—Б–Ї–Є–є –Ї–Њ–љ—Б–Њ—А—Ж–Є—Г–Љ –њ–Њ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П–Љ (BARC) –њ—А–µ–і–ї–Њ–ґ–Є–ї —Б–≤–Њ—О —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Г—О –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—О –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є [31] –і–ї—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ—А–Њ–≤–µ–і–µ–љ–Є–µ–Љ —Н–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є —Н–Ї—Б—В—А–µ–љ–љ—Л—Е –І–Ъ–Т –њ—А–Є –≤—Б–µ—Е —В–Є–њ–∞—Е –Ю–Ъ–°. –Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Њ—Ж–µ–љ–Ї–Є —В—П–ґ–µ—Б—В–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є BARC –њ–Њ–і—А–∞–Ј—Г–Љ–µ–≤–∞–µ—В –Є—Е —А–∞–Ј–і–µ–ї–µ–љ–Є–µ –љ–∞ 5 —В–Є–њ–Њ–≤ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є, –∞ —В–∞–Ї–ґ–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є —Н—В–Њ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, –љ–∞—З–Є–љ–∞—П —Б —В–Є–њ–∞ 0 вАУ –Њ—В—Б—Г—В—Б—В–≤–Є—П –≤—Б—П–Ї–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Є –Ј–∞–Ї–∞–љ—З–Є–≤–∞—П —В–Є–њ–Њ–Љ 5 вАУ —Д–∞—В–∞–ї—М–љ—Л–Љ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ–Љ. –Т –Њ—Б–Њ–±—Л–є —В–Є–њ 4 –≤—Л–і–µ–ї—П—О—В—Б—П –≤—Б–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–µ —Б –Ї–Њ—А–Њ–љ–∞—А–љ—Л–Љ —И—Г–љ—В–Є—А–Њ–≤–∞–љ–Є–µ–Љ [32]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П BARC –њ—А–µ–і–ї–∞–≥–∞–µ—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ —Г–љ–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б—В–∞–љ–і–∞—А—В–∞ –і–ї—П –Њ—Ж–µ–љ–Ї–Є —В—П–ґ–µ—Б—В–Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–Є –і–Є–Ј–∞–є–љ–∞ –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° [33].
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П TRACER –Њ–њ—А–µ–і–µ–ї–µ–љ–Њ, —З—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –±–µ–Ј –њ–Њ–і—К–µ–Љ–∞ —Б–µ–≥–Љ–µ–љ—В–∞ ST —И–Ї–∞–ї—Л BARC –і–ї—П –Њ—Ж–µ–љ–Ї–Є —В—П–ґ–µ—Б—В–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞—В—М —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–Є, —З–∞—Б—В–Њ—В–∞ –Ї–Њ—В–Њ—А–Њ–є –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–∞ –Є—Б—Е–Њ–і–љ–Њ–є —В—П–ґ–µ—Б—В–Є –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П [34]. –†–µ–Ј—Г–ї—М—В–∞—В—Л —Н—В–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —И–Ї–∞–ї—Г BARC –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є –Љ–Њ–і–µ–ї–Є –Њ—Ж–µ–љ–Ї–Є —В—П–ґ–µ—Б—В–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–°, –љ–Њ –Є –і–ї—П –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –Њ—В–і–∞–ї–µ–љ–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –і–∞–ґ–µ —И–Ї–∞–ї–∞ BARC –љ–µ —Г—З–Є—В—Л–≤–∞–µ—В –≤–Њ–Ј—А–∞—Б—В–∞ –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Ю–Ъ–° –≤ –Ї–∞—З–µ—Б—В–≤–µ —Д–∞–Ї—В–Њ—А–∞, —Г—Б—Г–≥—Г–±–ї—П—О—Й–µ–≥–Њ —В—П–ґ–µ—Б—В—М —Б–Њ—Б—В–Њ—П–љ–Є—П –њ—А–Є —А–∞–Ј–≤–Є—В–Є–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є. –Т–Њ–њ—А–µ–Ї–Є —Н—В–Њ–Љ—Г –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–µ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–µ –њ–Њ —В—П–ґ–µ—Б—В–Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–µ —Б–Њ–±—Л—В–Є–µ –Љ–Њ–ґ–µ—В –Є–Љ–µ—В—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ–µ –љ–µ–≥–∞—В–Є–≤–љ—Л–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П —Г –њ–Њ–ґ–Є–ї—Л—Е –±–Њ–ї—М–љ—Л—Е, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞.
–Т–Њ–Ј—А–∞—Б—В –Ї–∞–Ї —Д–∞–Ї—В–Њ—А —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є –Є—Е —В—П–ґ–µ—Б—В–Є
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —А–∞–±–Њ—В, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –≤–µ–і–µ–љ–Є—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–°, —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –њ—А–Њ–±–ї–µ–Љ–µ –≤—Л—П–≤–ї–µ–љ–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–Њ—Б—П—В –µ–і–Є–љ–Є—З–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —Н—В–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞ –≤—Л—Б–Њ–Ї—Г—О —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М —Б—А–µ–і–Є –њ–Њ–ґ–Є–ї—Л—Е –Є–Ј–≤–µ—Б—В–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є: —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ–Њ—З–µ–Ї, –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–є –∞–љ–µ–Љ–Є–Є, –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ [35, 36].
–С–µ—Б—Б–њ–Њ—А–љ–Њ, —З—В–Њ –≤–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–∞ —П–≤–ї—П–µ—В—Б—П –Ј–љ–∞—З–Є–Љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –Ї–∞–Ї –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, —В–∞–Ї –Є —А–Є—Б–Ї–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є [37]. –Я–Њ –і–∞–љ–љ—Л–Љ M. Zielinska et al., —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° —Б—В–∞—А—И–µ 85 –ї–µ—В —З–∞—Б—В–Њ—В–∞ ¬Ђ–±–Њ–ї—М—И–Є—Е¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –Љ–µ—Б—В–Њ–Љ –і–Њ—Б—В—Г–њ–∞ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ї–Њ—А–Њ–љ–∞—А–Њ–≥—А–∞—Д–Є–Є, –і–Њ—Б—В–Є–≥–∞–ї–∞ 5,5%, —В–Њ–≥–і–∞ –Ї–∞–Ї —Г –±–Њ–ї—М–љ—Л—Е –і–Њ 85 –ї–µ—В вИТ —В–Њ–ї—М–Ї–Њ 2,3% [38]. –Я—А–Є —Н—В–Њ–Љ –њ–∞—Ж–Є–µ–љ—В—Л —Б –Ю–Ъ–° —Б—В–∞—А—И–µ 85 –ї–µ—В —З–∞—Й–µ –љ—Г–ґ–і–∞–ї–Є—Б—М –≤ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–Є–Є –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –≥–µ–Љ–Њ—В—А–∞–љ—Б—Д—Г–Ј–Є–Є. –Я—А–Є —Н—В–Њ–Љ –≥–Њ—Б–њ–Є—В–∞–ї—М–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј –Є—Е –±—Л–ї –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ —Е—Г–ґ–µ, —З–µ–Љ —Г –±–Њ–ї–µ–µ –Љ–Њ–ї–Њ–і—Л—Е –±–Њ–ї—М–љ—Л—Е.
–Т–Љ–µ—Б—В–µ —Б —В–µ–Љ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –±–Њ–ї—М—И—Г—О —З–∞—Б—В–Њ—В—Г —А–∞–Ј–≤–Є—В–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –њ–µ—А–≤–Є—З–љ—Л—Е –І–Ъ–Т —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–є –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –Є —Г–ї—Г—З—И–µ–љ–Є–µ –Њ—В–і–∞–ї–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Г –љ–Є—Е –Њ–њ—А–∞–≤–і—Л–≤–∞—О—В –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ —А–Є—Б–Ї–Є. –°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –Њ–і–љ–Њ–≥–Њ –Є–Ј –Њ–і–љ–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Ю–Ъ–° —Б –њ–Њ–і—К–µ–Љ–Њ–Љ —Б–µ–≥–Љ–µ–љ—В–∞ ST —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ, –Њ–і–љ–∞–Ї–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞—П —А–µ–њ–µ—А—Д—Г–Ј–Є—П –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ —Б–љ–Є–ґ–∞–µ—В —З–Є—Б–ї–Њ –ї–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –±–Њ–ї—М—И–µ, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±–Њ–ї–µ–µ –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ [20].
–§–∞–Ї—В —Б–Њ—Б—В–Њ—П–≤—И–µ–≥–Њ—Б—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П —Г –њ–Њ–ґ–Є–ї–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М —А–∞—Б—Б–Љ–Њ—В—А–µ–љ –Ї–∞–Ї —В—А–Є–≥–≥–µ—А –і–ї—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –њ—А–Њ—В—А–Њ–Љ–±–Њ–≥–µ–љ–љ–Њ–≥–Њ —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤–Њ–≥–Њ –Ї–∞—Б–Ї–∞–і–∞ —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞, —Б–њ–∞–Ј–Љ–∞ –∞—А—В–µ—А–Є–Њ–ї –Є —А–∞–Ј–≤–Є—В–Є—П –≥–µ–Љ–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–Њ–Ї—Б–Є–Є, —З—В–Њ –≤ —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є —Б–њ–Њ—Б–Њ–±–љ–Њ —Г—Б—Г–≥—Г–±–Є—В—М –Є—И–µ–Љ–Є—О –Љ–Є–Њ–Ї–∞—А–і–∞ –њ—А–Є –Ю–Ъ–° –Є —Г—Е—Г–і—И–Є—В—М –њ—А–Њ–≥–љ–Њ–Ј [39].
–Т—Л—И–µ–љ–∞–Ј–≤–∞–љ–љ—Л–µ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–∞ —Б–ї–µ–і—Г–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞—А–≥—Г–Љ–µ–љ—В–Њ–≤ –і–ї—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е —Г—Б–Є–ї–Є–є –≤ —Г–ї—Г—З—И–µ–љ–Є–Є –њ–Њ–і—Е–Њ–і–Њ–≤ –Ї —А–Є—Б–Ї-—Б—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є–Є –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –І–Ъ–Т —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б –Ю–Ъ–°.
–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ–Њ–і—Е–Њ–і—Л –Ї —А–Є—Б–Ї-—Б—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є–Є –Є –Љ–µ—В–Њ–і—Л —Б–љ–Є–ґ–µ–љ–Є—П —А–Є—Б–Ї–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є
–†–Є—Б–Ї-—Б—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є—П –њ–Њ–≤—В–Њ—А–љ—Л—Е –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Б–Њ–±—Л—В–Є–є –њ—А–Є –Ю–Ъ–° –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Ј–∞–љ—П–ї–∞ –і–Њ–≤–Њ–ї—М–љ–Њ –њ—А–Њ—З–љ—Л–µ –њ–Њ–Ј–Є—Ж–Є–Є –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Б—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є—П —А–Є—Б–Ї–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤—Л–Ј—Л–≤–∞–µ—В –Ј–∞—В—А—Г–і–љ–µ–љ–Є—П –Є —А–µ–і–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П ¬Ђ—Г –њ–Њ—Б—В–µ–ї–Є –±–Њ–ї—М–љ–Њ–≥–Њ¬ї. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Є–Ј–≤–µ—Б—В–љ–∞—П –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —И–Ї–∞–ї–∞ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є CRUSADE (Can Rapid Risk Stratification of Unstable Angina Patients Suppress Adverse Outcomes), —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ–∞—П –≤ —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤–Ї–ї—О—З–Є–≤—И–µ–≥–Њ 71 277 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –±–µ–Ј –њ–Њ–і—К–µ–Љ–∞ —Б–µ–≥–Љ–µ–љ—В–∞ ST, –Є–Љ–µ–µ—В —Б–µ—А—М–µ–Ј–љ—Г—О –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ—Г—О –±–∞–Ј—Г [18]. –Ф–ї—П –њ–Њ–і—Б—З–µ—В–∞ –±–∞–ї–ї–Њ–≤ –њ–Њ —Н—В–Њ–є —И–Ї–∞–ї–µ —Г—З–Є—В—Л–≤–∞—О—В —В–∞–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, –Ї–∞–Ї –Є—Б—Е–Њ–і–љ—Л–є —Г—А–Њ–≤–µ–љ—М –≥–µ–Љ–∞—В–Њ–Ї—А–Є—В–∞ –Љ–µ–љ–µ–µ 36%, –Ї–ї–Є—А–µ–љ—Б –Ї—А–µ–∞—В–Є–љ–Є–љ–∞, —З–∞—Б—В–Њ—В–∞ —Б–µ—А–і–µ—З–љ—Л—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є (–І–°–°), –ґ–µ–љ—Б–Ї–Є–є –њ–Њ–ї, –љ–∞–ї–Є—З–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Ј–∞—Б—В–Њ–є–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –њ—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є, —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ –Љ–µ–љ–µ–µ 110 –Љ–Љ —А—В.—Б—В. –Є–ї–Є –±–Њ–ї–µ–µ 180 –Љ–Љ —А—В.—Б—В., –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–Њ—Б—Г–і–Њ–≤ –Є —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В. –Я–Њ–ї—Г—З–µ–љ–љ—Л–є —Б—Г–Љ–Љ–∞—А–љ—Л–є –±–∞–ї–ї –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Њ—В 1 –і–Њ 100 –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞—В—М —А–Є—Б–Ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –≤ –≥–Њ—Б–њ–Є—В–∞–ї—М–љ—Л–є –њ–µ—А–Є–Њ–і –Ю–Ъ–°. –†–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –≤—Л—А–∞–ґ–∞–µ–Љ—Л–є –≤ –њ—А–Њ—Ж–µ–љ—В–∞—Е, –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –љ–∞–±–Є—А–∞–µ–Љ—Л—Е –±–∞–ї–ї–Њ–≤: –Њ—В 3,1% вИТ –Њ—З–µ–љ—М –љ–Є–Ј–Ї–Є–є —А–Є—Б–Ї (20 –±–∞–ї–ї–Њ–≤) –і–Њ 19,5% вИТ –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї (50 –±–∞–ї–ї–Њ–≤). –Т–∞–ї–Є–і–љ–Њ—Б—В—М –Љ–Њ–і–µ–ї–Є –њ—А–Њ–≤–µ—А–µ–љ–∞ –љ–∞ 17 857 –±–Њ–ї—М–љ—Л—Е, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ —А–µ–≥–Є—Б—В—А CRUSADE, –Є –Є–Љ–µ–µ—В —А–∞–≤–љ–Њ–Ј–љ–∞—З–љ—Г—О –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О —Ж–µ–љ–љ–Њ—Б—В—М –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—Л–±—А–∞–љ–љ–Њ–є —Б—В—А–∞—В–µ–≥–Є–Є –≤–µ–і–µ–љ–Є—П (–Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–є –Є–ї–Є –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–є) –Є –Њ–±—К–µ–Љ–∞ –њ–Њ–ї—Г—З–∞–µ–Љ–Њ–є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Я—А–Є–Љ–µ—А–Њ–Љ –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–µ–≥–Њ—Б—П –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –њ–Њ–Є—Б–Ї–∞ –љ–Њ–≤—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є —П–≤–ї—П–µ—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ R. Mehran et al., –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–≤—И–Є—Е –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б–Њ–±—Б—В–≤–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е —И–Ї–∞–ї—Г —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П ¬Ђ–±–Њ–ї—М—И–Є—Е¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –њ—А–Є –Ю–Ъ–° [40].
–Т –Њ—Б–љ–Њ–≤—Г —Н—В–Њ–є —И–Ї–∞–ї—Л –ї–µ–≥–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–Њ–≥–Є—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –і–∞–љ–љ—Л—Е 17 421 –њ–∞—Ж–Є–µ–љ—В–∞, –≤–Ї–ї—О—З–µ–љ–љ–Њ–≥–Њ –≤ –і–≤–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –њ—А—П–Љ–Њ–Љ—Г –Є–љ–≥–Є–±–Є—В–Њ—А—Г —В—А–Њ–Љ–±–Є–љ–∞ вАУ –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ—Г, –њ—А–Є–Љ–µ–љ—П–µ–Љ–Њ–Љ—Г –њ—А–Є –Ю–Ъ–° –±–µ–Ј –њ–Њ–і—К–µ–Љ–∞ —Б–µ–≥–Љ–µ–љ—В–∞ ST: ACUITY (Acute Catheterisation and Urgent Intervention Triage strategY) –Є HORIZONS-AMI (Harmonising Outcomes with RevascularIZatiON and Stents in Acute Myocardial Infarction). –Р–≤—В–Њ—А—Л –Њ–њ—А–µ–і–µ–ї–Є–ї–Є —Б–µ–Љ—М –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–≤ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П: –ґ–µ–љ—Б–Ї–Є–є –њ–Њ–ї, –≤–Њ–Ј—А–∞—Б—В, –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є, –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤, –љ–∞–ї–Є—З–Є–µ –Є—Б—Е–Њ–і–љ–Њ–є –∞–љ–µ–Љ–Є–Є, —В–Є–њ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, –∞ —В–∞–Ї–ґ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞ –Є –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–∞ –Є –Є—Е –≤–Є–і. –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—Г–Љ–Љ—Л –±–∞–ї–ї–Њ–≤, –љ–∞–±—А–∞–љ–љ–Њ–є –≤ –Ї–∞–ґ–і–Њ–Љ —Б–ї—Г—З–∞–µ, —А–Є—Б–Ї –Њ–њ—А–µ–і–µ–ї—П–ї—Б—П –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Њ—В 1 –і–Њ 40%.
–Х—Й–µ –Њ–і–љ–∞ –Є–Ј–≤–µ—Б—В–љ–∞—П —И–Ї–∞–ї–∞ –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є вИТ ACTION вИТ –±—Л–ї–∞ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–∞ –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б—Г–±–∞–љ–∞–ї–Є–Ј–∞ —А–µ–≥–Є—Б—В—А–∞ ACTION Registry¬Ѓ-GWTGTM, –Ї–Њ—В–Њ—А—Л–є –≤–Ї–ї—О—З–∞–ї –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ –≤—Б–µ–Љ–Є —В–Є–њ–∞–Љ–Є –Ю–Ъ–°. –≠—В–∞ —И–Ї–∞–ї–∞ –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞–µ—В –і–Њ–≤–Њ–ї—М–љ–Њ –±–Њ–ї—М—И–Њ–µ —З–Є—Б–ї–Њ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞: –І–°–° –њ—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є, –Є—Б—Е–Њ–і–љ—Л–є —Г—А–Њ–≤–µ–љ—М –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –Љ–µ–љ–µ–µ 120 –≥/–ї, –ґ–µ–љ—Б–Ї–Є–є –њ–Њ–ї, –Ј–љ–∞—З–µ–љ–Є–µ –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –Ї—А–Њ–≤–Є –њ—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞, –≤–Њ–Ј—А–∞—Б—В, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –љ–∞ –≠–Ъ–У, –њ—А–Є–Ј–љ–∞–Ї–Є –Њ—Б—В—А–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –њ—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В, –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј, –Љ–∞—Б—Б–∞ —В–µ–ї–∞, —Г—А–Њ–≤–µ–љ—М —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –њ—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є. –Ъ–∞–ґ–і–Њ–Љ—Г –Ї—А–Є—В–µ—А–Є—О –њ—А–Є—Б–≤–∞–Є–≤–∞–µ—В—Б—П –±–∞–ї–ї, –Њ—В—А–∞–ґ–∞—О—Й–Є–є –µ–≥–Њ –≤–Ї–ї–∞–і –≤ —А–Є—Б–Ї –њ–Њ—Б–ї–µ–і—Г—О—Й–Є—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є. –£—Б–ї–Њ–≤–љ–Њ –њ–∞—Ж–Є–µ–љ—В—Л, –љ–∞–±—А–∞–≤—И–Є–µ –љ–µ –±–Њ–ї–µ–µ 40 –±–∞–ї–ї–Њ–≤ –њ–Њ —И–Ї–∞–ї–µ ACTION, —Б—З–Є—В–∞—О—В—Б—П –±–Њ–ї—М–љ—Л–Љ–Є –љ–Є–Ј–Ї–Њ–≥–Њ –Є —Б—А–µ–і–љ–µ–≥–Њ —А–∞—Б—З–µ—В–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є, –љ–∞–±—А–∞–≤—И–Є–µ –±–Њ–ї–µ–µ 40 –±–∞–ї–ї–Њ–≤ вАУ –њ–∞—Ж–Є–µ–љ—В—Л –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–∞—Б—З–µ—В–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є [19].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–є —И–Ї–∞–ї—Л –Њ—Ж–µ–љ–Ї–Є —А–Є—Б–Ї–∞ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є. –Т–µ—А–Њ—П—В–љ–Њ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤–∞–ї–Є–і–Є–Ј–Є—А–Њ–≤–∞—В—М –Є–Ј–≤–µ—Б—В–љ—Л–µ —И–Ї–∞–ї—Л –і–ї—П –Ї–∞–ґ–і–Њ–є –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –≤ —Ж–µ–ї—П—Е –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –љ–∞–Є–±–Њ–ї–µ–µ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є –Є–Ј –љ–Є—Е –Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є —В–Њ—З–љ–Њ–є —И–Ї–∞–ї—Л.
–Ь–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–∞—П —В–µ—А–∞–њ–Є—П –Ї–∞–Ї —Д–∞–Ї—В–Њ—А —А–Є—Б–Ї–∞ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є –Љ–µ—В–Њ–і –Є—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є
–Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–≥—А–µ—Б—Б–Є–≤–љ—Л—Е —Б—Е–µ–Љ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ю–Ъ–° –Љ–Њ–ґ–µ—В –њ–Њ–≤—Л—И–∞—В—М —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є—Б—Е–Њ–і–љ–Њ –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —В–∞–Ї–Њ–≤—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ –∞–Ї—В—Г–∞–ї—М–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –≤—Л–±–Њ—А –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б –Є–Ј–≤–µ—Б—В–љ—Л–Љ –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є [41].
–Т –Ї–∞—З–µ—Б—В–≤–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –≤ –ї–µ—З–µ–љ–Є–Є –Ю–Ъ–° –і–Њ –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М —А–∞–Ј–ї–Є—З–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л вАУ –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –≥–µ–њ–∞—А–Є–љ –Є –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л вАУ —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ, –і–∞–ї—М—В–µ—А–∞–њ–Є–љ –Є –і—А. –У–µ–њ–∞—А–Є–љ –±—Л–ї –Њ—В–Ї—А—Л—В McLean –Є Howell –Њ–Ї–Њ–ї–Њ 100 –ї–µ—В –љ–∞–Ј–∞–і вАУ –≤ 1916 –≥. [42]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —И–Є—А–Њ–Ї–Њ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –≥–µ–њ–∞—А–Є–љ–∞ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–°, –Њ–љ –Є–Љ–µ–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П: –і–ї—П –µ–≥–Њ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Є —В—А–µ–±—Г–µ—В—Б—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ –њ–ї–∞–Ј–Љ–µ –∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ–∞ III, –љ–µ–і–Њ—Б—В–∞—В–Њ–Ї –Ї–Њ—В–Њ—А–Њ–≥–Њ –Љ–Њ–ґ–µ—В –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞—В—М —Н—Д—Д–µ–Ї—В—Л –≥–µ–њ–∞—А–Є–љ–∞. –Т—В–Њ—А—Л–Љ –≤–∞–ґ–љ—Л–Љ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≥–µ–њ–∞—А–Є–љ–∞ —П–≤–ї—П–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ —А–µ–і–Ї–Њ–≥–Њ, –љ–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —В—П–ґ–µ–ї–Њ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П вАУ –≥–µ–њ–∞—А–Є–љ-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є, –Ї–Њ—В–Њ—А–∞—П –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї —А–∞–Ј–≤–Є—В–Є—О –ґ–Є–Ј–љ–µ—Г–≥–Њ—А–Њ–ґ–∞—О—Й–Є—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є [43].
–Ф–ї—П —Б–љ–Є–ґ–µ–љ–Є—П —А–Є—Б–Ї–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≥–µ–њ–∞—А–Є–љ–∞ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П —А–∞—Б—З–µ—В –і–Њ–Ј–Є—А–Њ–≤–Ї–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Є—Б—Е–Њ–і—П –Є–Ј –≤–µ—Б–∞ –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Ю–Ъ–° (–њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ—Л–є –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–є –±–Њ–ї—О—Б 60вИТ100 –µ–і–Є–љ–Є—Ж –≥–µ–њ–∞—А–Є–љ–∞ –љ–∞ –Ї–Є–ї–Њ–≥—А–∞–Љ–Љ –≤–µ—Б–∞ –±–Њ–ї—М–љ–Њ–≥–Њ). –£ –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–µ –і–Њ–Ј–Є—А–Њ–≤–Ї–Є (60 –µ–і–Є–љ–Є—Ж). –Ф–∞–ї—М–љ–µ–є—И–µ–µ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–µ –Є–љ—Д—Г–Ј–Є–Њ–љ–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –≥–µ–њ–∞—А–Є–љ–∞ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П —В–Њ–ї—М–Ї–Њ –њ—А–Є –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї–µ –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –Ї–Њ–∞–≥—Г–ї–Њ–≥—А–∞–Љ–Љ—Л. –Р–±—Б–Њ–ї—О—В–љ–Њ –љ–µ–і–Њ–њ—Г—Б—В–Є–Љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≥–µ–њ–∞—А–Є–љ–∞ –≤ –≤–Є–і–µ –±–Њ–ї—О—Б–Њ–≤ –њ–Њ 5000 –Є–ї–Є 10 000 –µ–і–Є–љ–Є—Ж –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –≤–µ—Б–∞ –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Ю–Ъ–°, —З—В–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ.
–Ф—А—Г–≥–Њ–є —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В –≤ –ї–µ—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° вАУ –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ. –С–Є–≤–∞–ї–Є—А—Г–і–Є–љ вИТ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Њ–≥ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞ –≥–Є—А—Г–і–Є–љ–∞. –Х—Й–µ –≤ 1884 –≥. J.B. Haycraft –≤—Л–і–µ–ї–Є–ї –Є–Ј —Б–µ–Ї—А–µ—В–∞ —Б–ї—О–љ—Л –њ–Є—П–≤–Њ–Ї –Є –Њ–њ–Є—Б–∞–ї –≥–Є—А—Г–і–Є–љ –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ вАУ –њ—А—П–Љ–Њ–≥–Њ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ —В—А–Њ–Љ–±–Є–љ–∞ [44]. –У–Є—А—Г–і–Є–љ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–ї—Б—П –≤—Л—Б–Њ–Ї–Њ–є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –Њ–і–љ–∞–Ї–Њ –Є –≤—Л—Б–Њ–Ї–Є–Љ –ґ–µ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Х–≥–Њ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Њ–≥ вИТ –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ —Ж–µ–ї–µ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ –ї–Є—И–µ–љ —Н—Д—Д–µ–Ї—В–∞ –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є –Є –≤–њ–µ—А–≤—Л–µ –±—Л–ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ 20 –ї–µ—В –љ–∞–Ј–∞–і [45].
–Я–µ—А–≤–Њ–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≥–µ–њ–∞—А–Є–љ–∞ –Є –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –њ–Њ–Ї–∞–Ј–∞–ї–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —А–∞–Ј–ї–Є—З–Є–є –њ–Њ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Є —З–∞—Б—В–Њ—В–µ —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Є–љ—Д–∞—А–Ї—В–Њ–≤ –Љ–Є–Њ–Ї–∞—А–і–∞ –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї—М—И–µ–µ —З–Є—Б–ї–Њ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ –≥—А—Г–њ–њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≥–µ–њ–∞—А–Є–љ–∞ [46].
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є HORIZONS-AMI –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ –њ–Њ–Ї–∞–Ј–∞–ї –Ј–љ–∞—З–Є–Љ—Л–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–љ–Є–ґ–µ–љ–Є—П —А–Є—Б–Ї–∞ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Є (–Ъ–Ъ–Ґ) —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–њ–∞—А–Є–љ–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є IIb/IIIa-—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ (–∞–±—Ж–Є–Ї—Б–Є–Љ–∞–±) (—З–∞—Б—В–Њ—В–∞ 9,2% –≤ –≥—А—Г–њ–њ–µ –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ–∞ –Є 12,1% –≤ –≥—А—Г–њ–њ–µ –≥–µ–њ–∞—А–Є–љ–∞ –Є –∞–±—Ж–Є–Ї—Б–Є–Љ–∞–±–∞) [47]. –°—В—А—Г–Ї—В—Г—А–∞ –Ъ–Ъ–Ґ –≤ —Н—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤–Ї–ї—О—З–∞–ї–∞ –Є ¬Ђ–±–Њ–ї—М—И–Є–µ¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П (4,9% –≤ –≥—А—Г–њ–њ–µ –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ–∞ –Є 8,3% –≤ –≥—А—Г–њ–њ–µ –≥–µ–њ–∞—А–Є–љ–∞ –Є –∞–±—Ж–Є–Ї—Б–Є–Љ–∞–±–∞). –Я—А–Є —Н—В–Њ–Љ –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –њ–Њ —З–∞—Б—В–Њ—В–µ —А–∞–Ј–≤–Є—В–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Б–Њ–±—Л—В–Є–є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ, –∞ –њ–Њ —З–∞—Б—В–Њ—В–µ —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Б—В–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ–∞ –≥–µ–њ–∞—А–Є–љ–∞ –Є –∞–±—Ж–Є–Ї—Б–Є–Љ–∞–±–∞ –њ–Њ–Ї–∞–Ј–∞–ї–∞ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ (1,3% –≤ –≥—А—Г–њ–њ–µ –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ–∞ –Є 0,3% –≤ –≥—А—Г–њ–њ–µ –≥–µ–њ–∞—А–Є–љ–∞ –Є –∞–±—Ж–Є–Ї—Б–Є–Љ–∞–±–∞).
–Я–Њ–і–Њ–±–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є EUROMAX, –і–Є–Ј–∞–є–љ –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞–ї —А–∞–Ј–і–µ–ї–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –љ–∞ –≥—А—Г–њ–њ—Г –і–Њ–≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ–∞ –Є –≥—А—Г–њ–њ—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≥–µ–њ–∞—А–Є–љ–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Є–Ј–±–Є—А–∞—В–µ–ї—М–љ—Л–Љ–Є –±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є IIb/IIIa-—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ (63% –±–Њ–ї—М–љ—Л—Е). –Я–µ—А–≤–Є—З–љ–∞—П –Ї–Њ–љ–µ—З–љ–∞—П —В–Њ—З–Ї–∞ (—Б–Љ–µ—А—В—М –Є ¬Ђ–±–Њ–ї—М—И–Є–µ¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, –љ–µ —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Ї–Њ—А–Њ–љ–∞—А–љ—Л–Љ —И—Г–љ—В–Є—А–Њ–≤–∞–љ–Є–µ–Љ, –≤ —В–µ—З–µ–љ–Є–µ 30 –і–љ–µ–є –љ–∞–±–ї—О–і–µ–љ–Є—П) –±—Л–ї–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –љ–Є–ґ–µ –≤ –≥—А—Г–њ–њ–µ –і–Њ–≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ–∞ (5,1%), —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –≥–µ–њ–∞—А–Є–љ–∞ (8,5%) [48].
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є REPLACE-2 [49], –љ–∞–Њ–±–Њ—А–Њ—В, —З–∞—Б—В–Њ—В–∞ ¬Ђ–±–Њ–ї—М—И–Є—Е¬ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–ґ–∞–ї–∞—Б—М –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ–∞ (2,4%) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–Ї–Њ–≤–Њ–є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≥–µ–њ–∞—А–Є–љ–∞ (4,1%) –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞ —Б –Є–Ј–±–Є—А–∞—В–µ–ї—М–љ—Л–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ IIb/IIIa-—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ (p<0,001).
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ —А—П–і–∞ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–Њ–≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–ї—М—В–µ—А–љ–∞—В–Є–≤—Л –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ–Њ–Љ—Г –≥–µ–њ–∞—А–Є–љ—Г [50, 51] –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –Ј–љ–∞—З–Є–Љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ 30-–і–љ–µ–≤–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є. –Ю–і–љ–∞–Ї–Њ –≤ —Н—В–Њ–є –ґ–µ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ –Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П —З–∞—Б—В–Њ—В–∞ —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Б—В–µ–љ—В–Њ–≤ –Є –њ–Њ–≤—В–Њ—А–љ—Л—Е —Н–Ї—Б—В—А–µ–љ–љ—Л—Е —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–є [–Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї (–Ю–†) 1,73; 95% –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї (–Ф–Ш) 1,24вАУ2,40; p<0,001], –∞ —В–∞–Ї–ґ–µ –љ–µ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є 30вАУ–і–љ–µ–≤–љ–Њ–є –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –Ю–Ъ–°, —З—В–Њ –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ –≤—Л–Ј—Л–≤–∞–ї–Њ —Б–Њ–Љ–љ–µ–љ–Є—П –≤ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є —И–Є—А–Њ–Ї–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Н—В–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –і–ї—П –љ–∞–і–µ–ґ–љ–Њ–є –≥–Є–њ–Њ–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є –њ—А–Є –Ю–Ъ–°.
–Ю–і–љ–∞–Ї–Њ –љ–µ–і–∞–≤–љ–Є–є –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –±–Њ–ї–µ–µ 11 —В—Л—Б. –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –Є —Б—В–∞–±–Є–ї—М–љ–Њ–є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О —Б–µ—А–і—Ж–∞, –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л—Е –І–Ъ–Т [52], –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ–∞ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –±–Њ–ї—М—И–µ–є —З–∞—Б—В–Њ—В–Њ–є —Б—Г–±–Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ (–њ–Њ —И–Ї–∞–ї–µ TIMIвЙ§2) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–њ–∞—А–Є–љ–∞ –Є –∞–±—Ж–Є–Ї—Б–Є–Љ–∞–±–∞, —В–µ–Љ –љ–µ –Љ–µ–љ–µ–µ —Н—В–Њ –љ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О —А–Є—Б–Ї–∞ –Њ—Б—В—А—Л—Е –Є –њ–Њ–і–Њ—Б—В—А—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Б—В–µ–љ—В–Њ–≤ –Є –љ–µ –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –≤ —В–µ—З–µ–љ–Є–µ 12 –Љ–µ—Б. –љ–∞–±–ї—О–і–µ–љ–Є—П.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –±–Є–≤–∞–ї–Є—А—Г–і–Є–љ–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ъ–° –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–Љ –≤ —Ж–µ–ї—П—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —В–∞–Ї–Њ–≤—Л—Е.
–Я–Њ–і–≤–Њ–і—П –Є—В–Њ–≥, –Љ–Њ–ґ–љ–Њ –њ–Њ–і—В–≤–µ—А–і–Є—В—М, —З—В–Њ –њ–µ—А–µ–і –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–Љ –≤—А–∞—З–Њ–Љ, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–Љ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї—Г—О –њ–Њ–Љ–Њ—Й—М –њ–∞—Ж–Є–µ–љ—В—Г —Б –Ю–Ъ–°, —Б—В–Њ–Є—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л—Е –і–ї—П —А–µ—И–µ–љ–Є—П –Ј–∞–і–∞—З: –Њ–±—К–µ–Ї—В–Є–≤–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ —А–Є—Б–Ї–∞ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Б —Г—З–µ—В–Њ–Љ –Ї–Њ—В–Њ—А—Л—Е –њ–∞—Ж–Є–µ–љ—В—Г –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –њ–Њ–ї–љ—Л–є –Њ–±—К–µ–Љ –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–є –Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –≤—Б–µ—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л—Е –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е —Б —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –Є—Е —А–∞–Ј–≤–Є—В–Є—П.












