
Введение
Несмотря на прогресс современной медицины и новые возможности консервативной терапии, хирургические методы лечения остаются одними из основных в тактике ведения многих заболеваний. Ежегодно во всем мире проводятся миллионы оперативных вмешательств. По всему миру развитие осложнений при внесердечных операциях достигает от 7 до 11%, летальность составляетот 0,8 до 1,5% [1]. Ведущая роль принадлежит кардиальным осложнениям. На территории ЕС ежегодно регистрируются по меньшей мере 167 тыс. случаев кардиальных осложнений при выполнении внесердечных хирургических вмешательств, из которых 19 тыс. являются угрожающими для жизни пациента [2, 3]. Сердечно-сосудистые осложнения (ССО) в периоперационном периоде (т. е. на этапе подготовки к операции, непосредственно во время операции, а также в ближайшем и отсроченном послеоперационном периоде) являются основной междисциплинарной проблемой. В настоящее время отмечается прогрессивный рост продолжительности жизни населения и, следовательно, общего количества пожилых людей. Многие пациенты старше 60 лет продолжают активную трудовую и социальную деятельность, поэтому вопрос быстрой реабилитации после хирургического вмешательства также является актуальным. В течение последующих 20 лет старение населения будет одним из основных факторов, влияющих на ведение хирургических пациентов. Согласно существующим оценкам, оперативные вмешательства у пожилых проводятся в 4 раза чаще, чем у остальных больных. При этом в Европе, согласно предварительным оценкам, число пациентов, нуждающихся в хирургическом лечении, к 2020 г. возрастет на 25%, а популяция пожилых людей увеличится вдвое [1]. Следует полагать, что количество операций возрастет еще значительнее, т. к. у пожилых пациентов они проводятся относительно чаще. При этом в большинстве случаев у пациентов пожилого и старческого возраста имеются коморбидные заболевания. ССО могут возникнуть у больных с ранее не диагностированной или протекающей бессимптомно (например, при сахарном диабете) ишемической болезнью сердца (ИБС), дисфункцией левого желудочка (ЛЖ), клапанными пороками и нарушениями ритма. Дисфункция ЛЖ и аритмии могут возникать вследствие различных причин в любом возрасте. Однако в связи с тем, что распространенность как ИБС, так и поражений клапанов и аритмий с возрастом увеличивается, развитие кардиальных осложнений и связанный с ними риск смерти отмечаются главным образом среди пациентов, которым проводятся крупные внесердечные операции [2]. К сожалению, отягощенный кардиологический анамнез нередко является основной причиной отказа в проведении пациенту того или иного вида хирургического пособия. Но, как показывает практика и подтверждают результаты многих местных исследований, в настоящее время существует возможность проводить оперативное лечение тяжелых коморбидных пациентов с последующим благоприятным прогнозом. Имеющиеся единичные данные о медикаментозной коррекции факторов риска, параметрах интраоперационного мониторинга внутрисердечной гемодинамики и послеоперационной модификации терапии в зависимости от нозологии неоднозначны и требуют детального обсуждения и систематизации. Поэтому очень важной и актуальной является проблема стратификации и модификации факторов периоперационного риска, систематизации схем и методик пред- и интраоперационного кардиального мониторинга, на основании которого становится возможным прогнозировать вероятность послеоперационных осложнений и оптимизировать лечебные схемы послеоперационной кардиальной поддержки в стационаре, а в последующем — и на амбулаторном этапе.
Современные аспекты стратификации кардиальных осложнений при внесердечных операциях
Стратификация кардиального риска при внесердечных оперативных вмешательствах
Частота развития ССО во время экстракардиальных хирургических вмешательств, а также в послеоперационном периоде составляет от 0,5% до 30% [1–3]. Каждое хирургическое вмешательство сопровождается стрессовым ответом организма на повреждение тканей и может вызвать дисбаланс вегетативной нервной системы. Изменение объема внутрисосудистой жидкости в ходе операции также усиливает стресс, который, в свою очередь, повышает потребность миокарда в кислороде. Хирургическое вмешательство приводит к изменениям в системе свертывания крови, повышению тромбогенной активности, что потенциально может привести к развитию коронарного тромбоза. Степень и выраженность всех вышеуказанных изменений находятся в прямой зависимости от степени инвазивности и длительности операции [3, 4]. Такие изменения в совокупности с положением пациента, изменениями температуры тела, кровопотерей и особенностями анестезиологического пособия могут привести к нарушениям гемодинамики и развитию ишемии миокарда и сердечной недостаточности (СН) [4, 5].Первичными на этапе предоперационной подготовки являются тактические систематизирующие действия в отношении тех или иных групп пациентов. Это является важным аспектом как с медицинской, так и с экономической точки зрения. Как показывает практика, унифицированный перечень для планового предоперационного обследования является малоэффективным, а с экономической точки зрения — неоправданно затратным для пациентов и клиники. Поэтому (на основании имеющихся к настоящему моменту регламентирующих документов по стратификации риска ССО [5]) оптимальным представляется следующий алгоритм:
Определить, необходимо ли проводить у пациента оценку кардиального предоперационного риска?
Имеет ли пациент клинические факторы риска согласно модифицированному индексу кардиального риска (табл. 1)?

Влияют ли эти факторы риска на хирургическую тактику?
Требует ли состояние пациента смещения сроков или отмены экстракардиального хирургического вмешательства?
Какой будет медикаментозная кардиальная терапия на весь периоперационный период, включая интраоперационное и послеоперационное время?
Категории хирургических вмешательств
Согласно имеющимся к настоящему времени данным международных рекомендаций [4, 5], абсолютно не каждому пациенту показана оценка кардиального риска, и возраст в данном случае не является определяющим параметром. Прежде всего необходимо дифференцировать различные категории некардиальных процедур: от малоинвазивных вмешательств до больших хирургических пособий. То есть первым этапом необходимо провести оценку возможного объема оперативного вмешательства. При операциях малого объема, безусловно, масштабная оценка кардиальных рисков лишена практического смысла. Далее необходимо определиться по срокам реализации процедуры. Манипуляция с целью устранения непосредственной угрозы жизни называется экстренной операцией. При экстренной операции клиническая оценка кардиального риска не проводится, поскольку жизнеугрожающим является основное заболевание/состояние, по поводу которого планируется вмешательство (прежде всего кровотечения любой этиологии, асфиксия, наличие острой хирургической инфекции). Чем позже выполняется операция, тем хуже прогноз лечения. Обычно это оперативные пособия, которые должны быть выполнены в течение 6 ч. Неотложными процедурами являются те, при которых есть ограниченное время для клинической оценки до манипуляции. В этом случае пациент должен быть доставлен в операционный зал не позднее 24 ч. Срочные операции могут быть проведены в интервале от 1 до 6 нед., и именно у этой категории пациентов модификация схем медикаментозной и немедикаментозной терапии может влиять на ближайший и отдаленный прогноз. К этой категории относятся пациенты с онкологическими заболеваниями. Наконец, проводятся плановые, или элективные, процедуры, которые могут быть отложены на срок до 1 года. Следовательно, основная группа пациентов, которым требуется кардиальная оценка риска, — это пациенты, которым предстоит срочная операция.Относительно кардиального риска самого оперативного пособия существует разделение на вмешательства низкого, промежуточного и высокого риска [6–8]. Высокий риск осложнений составляет более 5% неблагоприятных исходов, промежуточный риск — от 1 до 5% значимых осложнений, низкий риск — менее 1% (табл. 1) [5–7].
Выбор предпочтительной хирургической манипуляции из перечня возможных серьезно затрудняет оценку риска кардиальных осложнений применительно к каждой конкретной процедуре [7–10]. При рассмотрении возможности выполнения менее инвазивного (эндоваскулярного или эндоскопического) хирургического вмешательства в качестве альтернативы открытой операции всегда следует принимать во внимание потенциальный компромисс между благоприятными краткосрочными исходами в связи с меньшим количеством осложнений и степенью эффективности результатов лечения в средне- и долгосрочной перспективе [6, 8].
Связь кардиальных факторов риска с методологией оперативного пособия
По сравнению с открытыми операциями лапароскопические вмешательства менее травматичны для тканей и реже вызывают парез кишечника, что уменьшает болевые ощущения, улучшает дыхательную функцию, значительно уменьшает количество осложнений со стороны брюшной стенки и минимизирует дисбаланс внутрисосудистой жидкости, связанный с нарушением моторики кишечника. Однако карбоксиперитонеум, неизбежный при данных операциях, вызывает увеличение внутрибрюшного давления и, как следствие, уменьшение венозного оттока. Повышение давления в брюшной полости и последующая абсорбция газа приводят к типичным физиологическим последствиям. В то время как сохранные пациенты, находящиеся на искусственной вентиляции легких, обычно хорошо переносят карбоксиперитонеум, у ослабленных больных с сердечно-сосудистой патологией либо пациентов с избыточным весом могут возникнуть серьезные проблемы. Результатом пневмоперитонеума и пребывания в положении Тренделенбурга является повышение среднего артериального давления (АД), центрального венозного давления (ЦВД), среднего давления в легочной артерии, давления заклинивания легочных капилляров и общего периферического сосудистого сопротивления, ухудшающих функцию сердца. Таким образом, риск кардиальных осложнений у пациентов с СН при проведении лапароскопических операций не меньше такового при проведении открытых операций, и оценка риска должна проводиться одинаково для обеих техник вмешательства [10–12]. Это особенно важно учитывать не только у больных, направленных на хирургическое лечение по поводу тяжелого ожирения, но и у других групп пациентов, всегда помня о том, что возможна ситуация, когда необходимо будет продолжить лапароскопическую операцию как открытую. В краткосрочной перспективе статистика исходов лапароскопических операций, как правило, более благоприятна по сравнению с таковой при открытых операциях, однако это зависит также от типа вмешательства, опыта хирурга и количества операций, выполняемых в конкретном лечебном учреждении. Сравнительный анализ кардиальных осложнений проводился лишь в нескольких исследованиях [9–11]. Преимущества лапароскопических операций, в т. ч. сокращение продолжительности пребывания в стационаре, уменьшение кровопотери, более быстрое восстановление функции кишечника, а также сниженный риск послеоперационных пневмоний, инфицирования раны и кардиальных осложнений, по-видимому, в большей степени проявляются у пожилых пациентов.Диагностическое и прогностическое значение дополнительных методов исследования с целью определения кардиального риска
Группы сердечно-сосудистого риска
В большинстве случаев при экстренной и неотложной хирургии оценка кардиального риска принципиального значения не имеет. А какие группы пациентов в случае срочной и плановой большой хирургии высокого риска обязательно подлежат стратификации сердечно-сосудистого риска? Это все пациенты старше 45 лет. У пациентов в возрасте 18–45 лет стратификация сердечно-сосудистого риска проводится в случае ранее диагностированных:клинически значимых клапанных пороков сердца;
систолической дисфункции ЛЖ;
ССО в анамнезе;
сложных, гемодинамически значимых нарушений ритма;
постоянного приема кардиальных медикаментозных препаратов;
тяжелого соматического коморбидного статуса.
В случае отсутствия вышеуказанных факторов пациенты, не достигшие 45-летнего возраста, не должны быть консультированы врачом-интернистом с целью оценки кардиального риска перед внесердечной операцией.
Функциональные и лабораторные предикторы осложнений
Далее, согласно представленному алгоритму, необходимо оценить кардиальные факторы риска. Для этогоиспользуются общепринятые клинические методы: опрос, осмотр и принятие решения о целесообразности и прогностической ценности дополнительных методов обследования. Последний пункт имеет важное и принципиальное значение. Важно помнить, что пациент пришел к врачу не с соматической жалобой, а с проблемой периоперационного терапевтического осмотра. В случае отсутствия жалоб выполнение «на всякий случай» дополнительных инструментальных обследований с возможным выявлением отклонений от нормы влечет за собой цепочку лишних, неоправданных и затратных действий [12]. Для того чтобы понять, нужны ли дополнительные инструментальные обследования, важно оценить, насколько пациент является «кардиологически симптомным» [9–12]. Частота периоперационных кардиальных нежелательных событий и даже долгосрочные результаты могут быть достоверно предсказаны с помощью функционального статуса пациента. Для оценки функционального состояния пациента очень удобно использовать шкалу активности человека в повседневной жизни [9, 11]. Выражается она в метаболических единицах (МЕТ). Низкая функциональная активность соответствует уровню ниже 4 МЕТ, средняя — от 4 до 7 МЕТ, более 8 МЕТ считается удовлетворительным показателем (рис. 1). Если функциональная способность человека более 4 МЕТ, то даже при наличии стабильного и контролируемого кардиологического заболевания прогноз при экстракардиальном хирургическом вмешательстве будет благоприятным.

Пациенты, имеющие функциональное состояние менее 4 МЕТ, находятся в группе повышенного риска периоперационных осложнений. Именно у этой категории пациентов может потребоваться дополнительное определение биомаркеров повреждения миокарда. В контексте периоперационного ведения больного основными группами биомаркеров являются маркеры ишемии миокарда и его повреждения, маркеры воспаления и показатели функции ЛЖ. Сердечные тропонины T и I (cTnT и cTnI соответственно) являются надежными биомаркерами развития ИМ, поскольку они характеризуются хорошей чувствительностью и тканевой избирательностью [13–15]. Прогностическая информация, полученная при их исследовании, независима от других известных кардиальных факторов риска (ФР) (таких как изменения сегмента ST и функция ЛЖ). По-видимому, cTnT и cTnI имеют одинаковое прогностическое значение при ОКС как при наличии, так и при отсутствии почечной недостаточности. Накопленные данные свидетельствуют о том, что даже незначительное повышение уровня cTnT в периоперационном периоде указывает на клинически значимые повреждения миокарда с ухудшением прогноза и исхода заболевания. Разработка новых биомаркеров, включая высокочувствительные тропонины, должна привести к дальнейшему улучшению качества оценки состояния миокарда. Таким образом, у пациентов высокого риска перед проведением обширных хирургических вмешательств, а также в течение 48–72 ч после окончания операции рекомендуется исследовать уровень тропонинов. Следует помнить, что повышение уровня так называемых маркеров некроза может наблюдаться и при многих других заболеваниях; диагноз ИМ без подъема сегмента ST не правомочен на основании одного лишь повышения уровня тропонинов. Исследование маркеров воспаления может использоваться перед оперативным вмешательством, в т. ч. и для выявления пациентов с нестабильными бляшками в коронарных артериях; тем не менее в хирургической практике на сегодняшний день отсутствуют данные о роли биомаркеров воспаления в снижении риска развития кардиальных осложнений. С нашей точки зрения, наиболее важным является мониторинг этих параметров в раннем послеоперационном периоде на фоне пролонгированного обезболивания пациента.
Мозговой натрийуретический пептид В-типа (BNP) и его N-терминальный фрагмент (NT-proBNP) образуются в кардиомиоцитах в ответ на напряжение стенки сердца и растяжение миокарда. Их выработка может происходить на любом этапе развития СН, независимо от наличия или отсутствия ишемии. Уровни BNP и NT-proBNP в плазме крови в настоящее время считаются важными прогностическими признаками при различных ССЗ. Кроме того, показатели BNP и NТ-proBNP имеют значение для прогнозирования отдаленной смертности и кардиальных осложнений в послеоперационном периоде обширных внесердечных вмешательств. К настоящему времени практически отсутствуют сведения о предоперационной прогностической ценности биомаркеров, полученные в результате проспективных контролируемых рандомизированных клинических исследований (РКИ) [13, 14]. На основе имеющихся данных исследование уровней биомаркеров в сыворотке крови перед проведением внесердечных хирургических вмешательств не может быть предложено для внедрения в рутинную практику. Однако у пациентов с симптомами СН в совокупности с определенными эхокардиографическими критериями, о которых речь пойдет далее, предоперационный тест на концентрацию BNP и NТ-proBNP может способствовать дальнейшей коррекции симптомов и снижению периоперационного риска.
Инструментальные методы диагностики:
цель оправдывает средства?
Выполнение стандартной 12-канальной электрокардиограммы (ЭКГ) стало действительным стандартом любого оперативного вмешательства практически в любом возрасте при любой операции. ЭКГ покоя является обычной традиционной частью предоперационного обследования и оценки риска ССО у пациентов перед внесердечными вмешательствами. К сожалению, в большинстве клинических исследований, посвященных этой проблеме, рутинная 12-канальная ЭКГ не показала диагностической и прогностической пользы перед хирургическим вмешательством [16]. Само по себе оперативное вмешательство показанием для регистрации ЭКГ не является. Целесообразно проанализировать в 12 отведениях ЭКГ в предоперационном периоде у пациентов с доказанной ИБС, заболеваниями периферических артерий, значимыми симптомными аритмиями, цереброваскулярными заболеваниями или другими структурными заболеваниями сердца, за исключением тех пациентов, которым предстоит операция низкого риска. Пациентам с перспективой операции низкого риска проведение ЭКГ нецелесообразно, даже в случаях отягощенного кардиального анамнеза, поскольку информационная прогностическая ценность этого метода низкая. Регулярное использование предоперационной ЭКГ в 12 отведениях не является полезным и не рекомендуется [17].У пациентов с впервые возникшей одышкой, прогрессирующей одышкой или у пациентов с СН и ухудшением самочувствия целесообразно оценить функцию ЛЖ в предоперационном периоде [18]. Но рутинная оценка функции ЛЖ не рекомендуется в предоперационном периоде. Для пациентов без симптомов СН использование трансторакальной эхокардиографии с целью стратификации кардиального риска не несет пользы, для пациентов с СН в анамнезе, особенно с низкой фракцией выброса, наоборот, является прогностически важным и информативным. Наибольший риск наблюдается у пациентов с фракцией выброса левого желудочка (ФВ ЛЖ) менее 35% в покое [18]. Существует очень мало данных по оценке диастолической функции и ее прогностического значения.
У пациентов с высоким риском хирургического вмешательства и/или с резервом функциональных возможностей менее 4 МЕТ целесообразно проведение стресс-
тестирования, но только в том случае, если этот тест изменит тактику ведения пациента [19–21]. У пациентов с отличной толерантностью к физической нагрузке (>10 МЕТ) или с промежуточным риском внесердечных хирургических вмешательств целесообразно приступить к операции без какого-либо дополнительного стресс-тестирования [21, 23]. Рутинный скрининг с помощью неинвазивного стресс-тестирования также не рекомендуется. Если рассматривать варианты стресс-теста, то оптимальным является кардиопульмональный стресс-тест [21–24]. У пациентов с неудовлетворительной толерантностью к нагрузкам методом выбора является добутамин-стресс-эхокардиография или фармакологическая стресс-визуализация перфузии
миокарда, но только если она меняет дальнейшую тактику ведения [23, 24].
Предоперационная реваскуляризация при внесердечных хирургических вмешательствах рекомендуется в случае развития острого коронарного синдрома (ОКС). Плановая коронарная реваскуляризация для уменьшения периоперационных сердечных осложнений внесердечных хирургических вмешательств не продемонстрировала свою эффективность. Нет проспективных рандомизированных исследований, поддерживающих аортокоронарное шунтирование (АКШ) или чрескожное коронарное вмешательство (ЧКВ) для уменьшения интраоперационных и послеоперационных кардиальных событий в рамках периоперационной подготовки пациентов для внесердечных хирургических вмешательств [25, 26].
Периоперационная модификация антикоагулянтной и антитромботической терапии
Современные аспекты периоперационной антитромботической терапии
Современные научные данные позволяют модернизировать текущие алгоритмы периоперационной терапии оральными антикоагулянтами и ингибиторами агрегации тромбоцитов [27, 28]. В зависимости от рисков (табл. 2 и 3) и проведенных вмешательств на коронарных артериях назначается антитромбоцитарная или антикоагулянтная терапия, представленная в соответствующих рекомендациях. Риск развития кровотечений может усугубляться на фоне лечения этими препаратами. Перед хирургическим вмешательством у пациентов, получающих антиагрегантную и/или антикоагулянтную терапию, должно быть оценено соотношение риска тромбоза к риску кровотечений. Эта проблема актуальна не только для терапевтов и кардиологов; врачи хирургического, эндоскопического, анестезиологического профиля также должны быть информированы о соотношении рисков и тактики ведения пациентов [29–31]. Международные клинические руководства по хирургии и эндоскопии выделили 2 группы вмешательств, согласно которым риск кровотечений классифицируется как низкий или высокий (табл. 4) [32]. Этот параметр в контексте лечения антикоагулянтами или ингибиторами агрегации тромбоцитов является определяющим в дальнейшей тактике ведения пациента.


При стентировании коронарной артерии и применении двойной антиагрегантной терапии плановая операция откладывается на 30 дней в случае установки голометаллического стента и на 90 дней — в случае стента с лекарственным покрытием. Это те минимальные сроки, в течение которых должна быть строго продолжена двойная антитромбоцитарная терапия (ДАТ). Экстракардиальная плановая операция должна быть отложена в течение 14 дней после баллонной ангиопластики. Оптимальным сроком приема ДАТ в случае стента с лекарственным покрытием является срок 6 мес. [4, 5, 30–32].
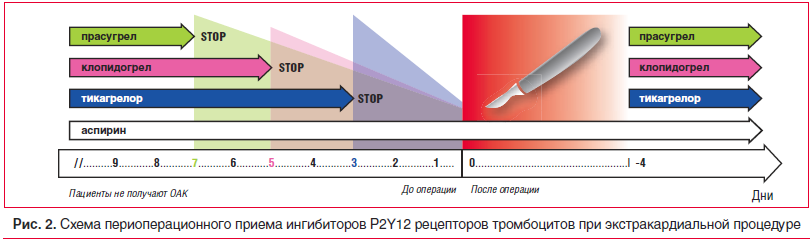
При хирургических процедурах с низким риском кровотечения следует приложить все усилия, чтобы не прерывать ДАТ на периоперационный период. При хирургических процедурах с высоким риском кровотечения пациенты должны принимать ацетилсалициловую кислоту (АСК), тогда как ингибитор P2Y12 следует отменить, когда это возможно (рис. 2). Более сложно принимать решение в группе пациентов, которым предстоят вмешательства на крупных сосудах, нейрохирургические операции и трансбронхиальные операции. В этих случаях особое внимание следует уделять своевременному прекращению терапии ингибитором P2Y12 для минимизации периода вне терапии перед хирургическим вмешательством [33]. В плановой хирургии для снижения риска кровотечения рекомендуется отложить оперативное вмешательство до завершения полного курса ДАТ. В большинстве клинических ситуаций АСК обеспечивает преимущество, которое перевешивает риск кровотечения, соответственно, монотерапия АСК должна быть продолжена. Возможные исключения из этой рекомендации включают внутричерепные процедуры, трансуретральную простатэктомию, внутриглазные процедуры и операции с чрезвычайно высоким риском кровотечения [34]. Экстракардиальная хирургия сама по себе, независимо от сроков прекращения приема ДАТ, связана с провоспалительными и протромботическими эффектами, тем самым увеличивая риск развития тромбоза коронарных артерий на уровне стентированного сосудистого сегмента, а также во всей коронарной сосудистой сети. Поэтому у пациентов, перенесших несердечное вмешательство после недавней имплантации стента, преимущества ранней операции должны быть четко сопоставлены с риском ОКС. У пациентов, нуждающихся в хирургической операции в течение нескольких дней, ранее было рекомендовано прекратить прием препаратов клопидогрел и тикагрелор в течение 5 дней и прасугрел в течение 7 дней до операции, если отсутствует высокий риск тромбоза [33, 35]. Однако новые данные свидетельствуют об отсутствии необходимости делать столь длительным период прекращения приема тикагрелора до хирургической манипуляции (рис. 2). Для пациентов с очень высоким риском тромбоза стента можно рассмотреть воз-
можность проведения мост-терапии внутривенны-ми обратимыми ингибиторами гликопротеиновых IIb/IIIа рецепторов тромбоцитов, такими как эптифибатид или тирофибан. Сопутствующая парентеральная антикоагулянтная терапия не рекомендуется для снижения риска кровотечения в периоперационном периоде [33, 34].
Современные аспекты периоперационной антикоагулянтной терапии
При обсуждении вопроса продолжения антикоагулянтной терапии на периоперационный период риск кровотечения должен быть взвешен до любой хирургической манипуляции [36]. Чтобы определить, может ли быть прервано лечение антикоагулянтами и является ли целесообразной мост-терапия, должна проводиться сопряженная оценка риска кровотечения, связанного с процедурой оценки риска тромбоэмболии, индивидуального для каждого пациента [37–41].При выполнении эндоскопических процедур, ассоциированных с низким риском кровотечения, лечение АВК следует продолжать, как обычно. В большинстве случаев это в равной степени относится к пациентам и с высоким, и с низким риском развития тромбоэмболии. Манипуляцию следует проводить при МНО в диапазоне 2,5–3,5. В случае эндоскопических процедур с высоким риском кровотечения лечение АВК, как правило, должно быть временно прекращено. Оценка индивидуального риска тромбоэмболии имеет важное значение при решении вопроса о необходимости и целесообразности мост-терапии. У пациентов с низким риском тромбоэмболии мост-терапия нецелесообразна. Переход с АВК на гепарины является обязательным у пациентов с высоким риском тромбоэмболии. Соотношение риск/польза «моста» для пациентов с умеренным риском тромбоэмболии до сих пор четко не установлено. Недавно опубликованные результаты исследований, однако, показывают, что в большинстве случаев оптимальным является отказ от терапии «моста» [41].
Даже при нерандомизированных проспективных исследованиях у хирургических пациентов было показано, что переход на гепаринотерапию приводит к увеличению скорости кровотечения (основного кровоизлияния — 4,2% против 0,9%), не снижая при этом риск развития тромбоэмболических осложнений. Перспективное рандомизированное исследование подтвердило эти результаты, показывая, что мост-терапия с низкомолекулярным гепарином по сравнению с продолжением лечения варфарином при имплантации кардиостимулятора или дефибриллятора ассоциирована со значительно более высокой частотой геморрагических осложнений (16% (n=56) по сравнению с 3,5% (n=12)). Результаты большого плацебо-контролируемого исследования BRIDGE у больных с мерцательной аритмией были опубликованы в 2015 г. [42]. За 5 дней до операции варфарин был заменен либо на дальтепарин, либо на плацебо. Пациенты без мост-терапии не продемонстрировали более высокую частоту тромбоэмболических осложнений (<0,5% в обеих группах), но в данной группе отмечен значительно более низкий уровень перипроцедурного кровотечения (1,3 по сравнению с 3,2%). Если кратковременное прекращение АВК необходимо, прерывание должно быть как можно более кратким — как правило, это 5 дней, максимальный срок отмены АВК — 8 дней. Назначение гепарина необходимо при мост-терапии примерно через 36 ч после последней дозы АВК. Перед операцией введение проводится за 4–6 ч (НФГ) или за 12–24 ч (низкомолекулярные гепарины). Как правило, возобновление терапии АВК возможно через 6–8 ч от момента вмешательства. Если риск кровотечения высок, возобновление терапии АВК возможно не ранее 48–72 ч после процедуры. Если антикоагуляция является приоритетом, например, в случае искусственного механического митрального клапана, лечение АВК может быть возобновлено ранее с учетом преимуществ и рисков [43]. Немедленный эффект и короткий период полураспада новых оральных антикоагулянтов или неантагонистов витамина К (НОАК) демонстрируют отсутствие необходимости мост-терапии. Схема отмены проста: препарат отменяется перед оперативным вмешательством, затем его прием возобновляется, как только адекватный гемостаз обеспечен. Возможные сложности заключаются в том, что НОАК накапливаются у пациента с почечной недостаточностью, поэтому у таких пациентов НОАК должны быть отменены на более длительный период. Поскольку приведенные данные в настоящее время исследуются, их следует рассматривать как ориентировочные [44, 45].
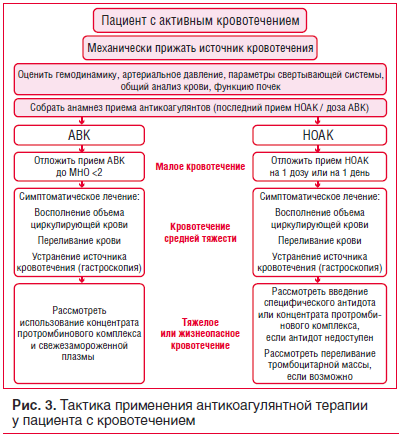
Тактика применения антикоагулянтной терапии у пациента с кровотечением представлена на рисунке 3.
Применение медикаментозной терапии в периоперационном периоде
Вопрос инициации и продолжения медикаментозной терапии, не оказывающей непосредственного влияния на гемостаз, также является важным, поскольку на этот счет нет единого мнения. Так, например, отсутствует однозначная позиция по поводу терапии β-блокаторами. Основной целью периоперационного назначения этих препаратов является уменьшение потребления кислорода миокардом в результате уменьшения ЧСС, приводящего к удлинению диастолы и снижению сократимости миокарда. Согласно данным последних исследований, пациенты, которые находятся на постоянной терапии β-блокаторами, не должны прекращать прием препаратов в периоперационном периоде. Изменения могут быть осуществлены до, в процессе или после операции в зависимости от клинических обстоятельств. Изменение или даже прекращение приема может потребоваться у больных с артериальной гипотензией, брадикардией, кровотечениями и т. д. Резкое и безосновательное прекращение терапии β-адреноблокаторами в периоперационном периоде продемонстрировало негативные кардиальные последствия. Если у пациента предоперационное обследование свидетельствует о средней и высокой степени риска ишемии миокарда, разумно начать в периоперационном периоде терапию β-адреноблокаторами как можно раньше, если нет противопоказаний к их применению [46].Терапия β-адреноблокаторами, начатая менее чем за 1 день до операции, имеет минимальный эффект. Начинать терапию предпочтительнее от 2 до 7 дней до операции, но некоторые данные показывают, что желательно инициировать назначение β-адреноблокаторов более чем за 30 дней до операции. Никогда лечение не следует начинать в день операции [47].
У больных из группы низкого риска невозможно обосновать назначение терапии с потенциально опасными побочными действиями при отсутствии доказанного полезного эффекта от ее применения. Этот вопрос в настоящее время остается открытым для пациентов из группы промежуточного риска, т. е. имеющих 1 или 2 клинических ФР. Увеличение уровня смертности после отмены β-блокаторов перед выполнением оперативного вмешательства было описано в 4 исследованиях. Подобная терапия для лечения аритмий и ИБС должна быть продолжена; это же касается и β-блокаторов для лечения гипертензии, т. к. в настоящее время отсутствует доказательная база по периоперационному кардиопротективному действию иных антигипертензивных препаратов. Нельзя прекращать лечение β-блокаторами у пациентов со стабильной СН, вызванной систолической дисфункцией ЛЖ. У пациентов с некомпенсированной СН терапия должна быть оптимизирована в соответствии с их клиническим состоянием [48, 49]. Если возможно, внесердечное вмешательство должно быть отложено и в дальнейшем выполнено при стабилизации состояния пациента и в условиях адекватной медикаментозной терапии. В отсутствие противопоказаний лечение β-блокаторами необходимо начинать с малых доз, использовать кардиоселективные препараты, постепенно увеличивать дозировку до достижения целевой ЧСС 60–70 ударов в минуту в покое.
Ингибиторы 3-гидрокси-3-метилглютарилкоэнзим А редуктазы (статины) широко применяются в лечении больных ИБС или с ФР ее развития. Пациенты с некоронарным атеросклерозом (с поражением аорты, сонных или периферических артерий) должны получать статины с целью вторичной профилактики, вне зависимости от того, предполагается внесердечное хирургическое вмешательство или нет. В связи с плейотропным действием статины также способствуют стабилизации коронарных бляшек, что может предотвратить их повреждение и последующее развитие ИМ в периоперационном периоде. Результаты многочисленных исследований свидетельствуют о том, что периоперационное использование гиполипидемической терапии снижает показатели смертности и частоты развития ИМ в течение 30 дней после операции, а также показатели долгосрочной смертности и частоты кардиальных осложнений. Статины могут снизить риск развития ФП после обширных внесердечных хирургических вмешательств. Прекращение приема препарата в течение 5 и более дней после операции на аорте ассоциировано с 3-кратным увеличением риска развития послеоперационной ишемии миокарда [50, 51].
Имеются ограниченные данные об эффективности блокаторов кальциевых каналов в периоперационной терапии пациентов, перенесших внесердечную операцию. Максимальные преимущества отмечены у дилтиазема. Не продемонстрировали снижения эпизодов ишемии миокарда препараты дигидропиридина и верапамила. Верапамил также продемонстрировал повышенную частоту наджелудочковой тахикардии. Следует помнить, что верапамил и дилтиазем могут ухудшить прогноз у пациентов со сниженной систолической функцией ЛЖ [52].
Периоперационное назначение ингибиторов ангиотензинпревращающего фермента и антагонистов рецепторов ангиотензина (иАПФ и АРА) связано с риском развития тяжелой гипотензии во время анестезии, в особенности при более раннем или одновременном назначении β-блокаторов. Важно оценить, по какой причине была назначена терапия этими препаратами: в качестве антигипертензивной терапии или терапии СН? Риск развития гипотензии снижается при прекращении приема иАПФ за 1 сут до операции. Хотя данный вопрос остается дискуссионным, иАПФ (в том случае, если они были ранее назначены для лечения артериальной гипертензии (АГ)) желательно отменить за 1 сут до предполагаемого хирургического вмешательства, а затем продолжить их прием в послеоперационном периоде, как только произойдет стабилизация АД и объема циркулирующей крови. При применении АРА риск возникновения гипотензии является столь же высоким, как и при использовании иАПФ; кроме того, возможно снижение ответной реакции на вазопрессоры. У клинически стабильных пациентов с систолической дисфункцией ЛЖ представляется разумным продолжать ранее назначенное лечение иАПФ при тщательном мониторинге основных параметров гемодинамики в периоперационном периоде. Пациентам, постоянно принимающим препараты по поводу СН, целесообразно продолжить прием иАПФ или АРА до операции и в послеоперационном периоде. Если по какой-либо причине допущен перерыв в приеме, разумно возобновить терапию после операции как можно скорее [53].
Использование внутривенного нитроглицерина с профилактической целью для предотвращения ишемии миокарда не продемонстрировало желаемого эффекта у пациентов при выполнении экстракардиальных хирургических вмешательств [54].












