–í–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ
–Ď–ĺ–Ľ–Ķ–∑–Ĺ—Ć –ź–Ľ—Ć—Ü–≥–Ķ–Ļ–ľ–Ķ—Ä–į (–Ď–ź) —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ—č–ľ, –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É—é—Č–ł–ľ –ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—ā–ł–≤–Ĺ—č–ľ —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤–ĺ–ľ, –ĺ—ā–Ľ–ł—á–į—é—Č–ł–ľ—Ā—Ź –Ī–ĺ–Ľ—Ć—ą–ĺ–Ļ —Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –∑–Ĺ–į—á–ł–ľ–ĺ—Ā—ā—Ć—é. –°–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ —Ā–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č–ľ –ī–į–Ĺ–Ĺ—č–ľ –ļ–į–∂–ī—č–Ļ –≥–ĺ–ī –≤ –ľ–ł—Ä–Ķ –Ņ–ĺ—á—ā–ł —É 8 –ľ–Ľ–Ĺ —á–Ķ–Ľ–ĺ–≤–Ķ–ļ —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä—É–Ķ—ā—Ā—Ź –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł—Ź [1]. –í–ĺ –≤—Ā–Ķ–ľ–ł—Ä–Ĺ–ĺ–ľ –ĺ—ā—á–Ķ—ā–Ķ –Ņ–ĺ –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ–Ķ –Ď–ź –∑–į 2015 –≥. –Ņ—Ä–ł–≤–ĺ–ī—Ź—ā—Ā—Ź –ī–į–Ĺ–Ĺ—č–Ķ –ĺ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–ł–ł –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł–ł –Ī–ĺ–Ľ–Ķ–Ķ —á–Ķ–ľ —É 47 –ľ–Ľ–Ĺ —á–Ķ–Ľ–ĺ–≤–Ķ–ļ –Ņ–ĺ –≤—Ā–Ķ–ľ—É –ľ–ł—Ä—É, –Ņ—Ä–ł—á–Ķ–ľ –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–ł—Ä—É—é—ā, —á—ā–ĺ –ļ 2030 –≥. —ć—ā–ĺ—ā –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć –≤—č—Ä–į—Ā—ā–Ķ—ā –ī–ĺ 76 –ľ–Ľ–Ĺ, –į –ļ 2050 –≥. ‚ÄĒ –ī–ĺ 145 –ľ–Ľ–Ĺ [1].
–ó–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź–Ķ—ā —Ā–ĺ–Ī–ĺ–Ļ –Ĺ–Ķ–ł–∑–ľ–Ķ–Ĺ–Ĺ–ĺ —Ą–į—ā–į–Ľ—Ć–Ĺ—É—é —Ā—ā–į—Ä—á–Ķ—Ā–ļ—É—é –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł—é, –ļ–ĺ—ā–ĺ—Ä–į—Ź –Ĺ–Ķ –ł–∑–Ľ–Ķ—á–ł–≤–į–Ķ—ā—Ā—Ź –ł –ł–ľ–Ķ–Ķ—ā –ĺ–≥—Ä–į–Ĺ–ł—á–Ķ–Ĺ–Ĺ—č–Ķ –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–ł –ī–Ľ—Ź —Ä–į–Ĺ–Ĺ–Ķ–Ļ –ĺ–ī–Ĺ–ĺ–∑–Ĺ–į—á–Ĺ–ĺ–Ļ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł. –Ē–Ľ—Ź –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ĺ–į—Ä—Ź–ī—É —Ā–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ–ľ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ą—É–Ĺ–ļ—Ü–ł–Ļ, —ā—Ź–∂–Ķ–Ľ—č–ľ–ł —Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ-–Ņ–ĺ–≤–Ķ–ī–Ķ–Ĺ—á–Ķ—Ā–ļ–ł–ľ–ł –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź–ľ–ł —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ—č —Ä–į–∑–Ľ–ł—á–Ĺ—č–Ķ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź –∑—Ä–Ķ–Ĺ–ł—Ź, –≤–ļ–Ľ—é—á–į—Ź —Ā—É–∂–Ķ–Ĺ–ł–Ķ –Ņ–ĺ–Ľ—Ź –∑—Ä–Ķ–Ĺ–ł—Ź, —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ļ–ĺ–Ĺ—ā—Ä–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł –ł —Ä–į—Ā–Ņ–ĺ–∑–Ĺ–į–≤–į–Ĺ–ł—Ź —Ü–≤–Ķ—ā–į, –į —ā–į–ļ–∂–Ķ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź —Ü–ł—Ä–ļ–į–ī–Ĺ–ĺ–≥–ĺ —Ä–ł—ā–ľ–į —Ā–Ĺ–į –ł –Ī–ĺ–ī—Ä—Ā—ā–≤–ĺ–≤–į–Ĺ–ł—Ź [2, 3].
–ü–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –≤ –≥–Ľ–į–∑–į—Ö —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –Ī—č–Ľ–ł –≤–Ņ–Ķ—Ä–≤—č–Ķ –∑–į–ī–ĺ–ļ—É–ľ–Ķ–Ĺ—ā–ł—Ä–ĺ–≤–į–Ĺ—č –≤ 1986 –≥., –ļ–ĺ–≥–ī–į D.R. Hinton et al. [4] —Ā–ĺ–ĺ–Ī—Č–ł–Ľ–ł –ĺ –ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—Ü–ł–ł –∑—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ĺ–Ķ—Ä–≤–į, —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–ł –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–į –≥–į–Ĺ–≥–Ľ–ł–ĺ–∑–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ –ł –ł—Ā—ā–ĺ–Ĺ—á–Ķ–Ĺ–ł–ł —Ā–Ľ–ĺ—Ź –Ĺ–Ķ—Ä–≤–Ĺ—č—Ö –≤–ĺ–Ľ–ĺ–ļ–ĺ–Ĺ —Ā–Ķ—ā—á–į—ā–ļ–ł (–°–Ě–í–°). –ü–Ķ—Ä–≤–ĺ–Ĺ–į—á–į–Ľ—Ć–Ĺ–ĺ —Ā—á–ł—ā–į–Ľ–ĺ—Ā—Ć, —á—ā–ĺ –∑—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź —Ā–≤—Ź–∑–į–Ĺ—č –ł—Ā–ļ–Ľ—é—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —Ā –Ĺ–Ķ–Ļ—Ä–ĺ–ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—Ü–ł–Ķ–Ļ –∑–į–ī–Ĺ–Ķ–≥–ĺ –∑—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ņ—É—ā–ł. –ě–ī–Ĺ–į–ļ–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł –≤ —ć–ļ—Ā–Ņ–Ķ—Ä–ł–ľ–Ķ–Ĺ—ā–į–Ľ—Ć–Ĺ—č—Ö –ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –ľ–ĺ–ī–Ķ–Ľ—Ź—Ö –Ņ–ĺ–ļ–į–∑–į–Ľ–ł, —á—ā–ĺ –Ĺ–Ķ–Ļ—Ä–ĺ–ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—Ü–ł—Ź —ā–į–ļ–∂–Ķ –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–ī–ł—ā –≤ –Ņ–Ķ—Ä–Ķ–ī–Ĺ–Ķ–ľ –∑—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–ľ –Ņ—É—ā–ł —Ā —É—á–į—Ā—ā–ł–Ķ–ľ –ī–Ķ–Ĺ–ī—Ä–ł—ā–ĺ–≤, —Ā–ĺ–ľ–į—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ –ł –į–ļ—Ā–ĺ–Ĺ–ĺ–≤ –≥–į–Ĺ–≥–Ľ–ł–ĺ–∑–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ —Ā–Ķ—ā—á–į—ā–ļ–ł –≤ –∑—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–ľ –Ĺ–Ķ—Ä–≤–Ķ. –≠—ā–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź —ā–į–ļ–∂–Ķ —Ā–ĺ–ĺ–Ī—Č–į–Ľ–ł, —á—ā–ĺ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –Ĺ–į–Ī–Ľ—é–ī–į—é—ā—Ā—Ź –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –≤ —Ā–Ķ—ā—á–į—ā–ļ–Ķ –ł —Ö–ĺ—Ä–ł–ĺ–ł–ī–į–Ľ—Ć–Ĺ–ĺ–ľ –ľ–ł–ļ—Ä–ĺ—Ü–ł—Ä–ļ—É–Ľ—Ź—ā–ĺ—Ä–Ĺ–ĺ–ľ —Ä—É—Ā–Ľ–Ķ [5]. –Ď–ĺ–Ľ–Ķ–Ķ –Ņ–ĺ–∑–ī–Ĺ–ł–Ķ –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ņ–ĺ–ļ–į–∑–į–Ľ–ł, —á—ā–ĺ –ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—Ü–ł—Ź –≥–į–Ĺ–≥–Ľ–ł–ĺ–∑–Ĺ–ĺ–≥–ĺ –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–≥–ĺ —Ā–Ľ–ĺ—Ź –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–ī–ł—ā –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –≤ –Ņ–Ķ—Ä–ł—Ą–Ķ—Ä–ł—á–Ķ—Ā–ļ–ĺ–Ļ –∑–ĺ–Ĺ–Ķ, –į —ā–į–ļ–∂–Ķ –≤ —Ü–Ķ–Ĺ—ā—Ä–į–Ľ—Ć–Ĺ–ĺ–Ļ –∑–ĺ–Ĺ–Ķ —Ā–Ķ—ā—á–į—ā–ļ–ł, —Ą–ĺ–≤–Ķ–į–Ľ—Ć–Ĺ–ĺ–Ļ –ĺ–Ī–Ľ–į—Ā—ā–ł [5, 6].
–ó–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź —Ü–Ķ–Ĺ—ā—Ä–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ĺ–Ķ—Ä–≤–Ĺ–ĺ–Ļ —Ā–ł—Ā—ā–Ķ–ľ—č (–¶–Ě–°) –ľ–ĺ–≥—É—ā –Ņ—Ä–ĺ—Ź–≤–Ľ—Ź—ā—Ć—Ā—Ź –≤ –≤–ł–ī–Ķ –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –≤ —Ā–Ķ—ā—á–į—ā–ļ–Ķ –≥–Ľ–į–∑–į.
–°–Ķ—ā—á–į—ā–ļ–į, —Ä–į–∑–≤–ł–≤–į—é—Č–į—Ź—Ā—Ź –≤ —ć–ľ–Ī—Ä–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ –ł–∑ –ĺ–ī–Ĺ–ĺ–≥–ĺ –∑–į—á–į—ā–ļ–į —Ā –≥–ĺ–Ľ–ĺ–≤–Ĺ—č–ľ –ľ–ĺ–∑–≥–ĺ–ľ, –ĺ–Ī–Ľ–į–ī–į–Ķ—ā –ľ–Ĺ–ĺ–∂–Ķ—Ā—ā–≤–ĺ–ľ –ĺ–Ī—Č–ł—Ö —Ā –ľ–ĺ–∑–≥–ĺ–ľ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ—č—Ö –ł –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ—č—Ö –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–Ķ–Ļ, –≤–ļ–Ľ—é—á–į—Ź –Ĺ–Ķ–Ļ—Ä–ĺ–Ĺ—č, –≥–Ľ–ł–į–Ľ—Ć–Ĺ—č–Ķ –ļ–Ľ–Ķ—ā–ļ–ł, —Ā–≤—Ź–∑–į–Ĺ–Ĺ—É—é —Ā–ĺ—Ā—É–ī–ł—Ā—ā—É—é —Ā–Ķ—ā—Ć –ł –Ĺ–į–Ľ–ł—á–ł–Ķ –≥–Ķ–ľ–į—ā–ĺ—ć–Ĺ—Ü–Ķ—Ą–į–Ľ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ī–į—Ä—Ć–Ķ—Ä–į [7]. –≠—ā–ĺ –ī–į–Ķ—ā –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–Ķ –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–į–≥–į—ā—Ć, —á—ā–ĺ —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł–Ķ —Ā–Ķ—ā—á–į—ā–ļ–ł –ľ–ĺ–∂–Ķ—ā –ĺ—ā—Ä–į–∂–į—ā—Ć —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł–Ķ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į –ļ–į–ļ —É –∑–ī–ĺ—Ä–ĺ–≤—č—Ö –Ľ—é–ī–Ķ–Ļ, —ā–į–ļ –ł —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ĺ–Ķ–Ļ—Ä–ĺ–ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—ā–ł–≤–Ĺ—č–ľ–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź–ľ–ł [8, 9].
–ú–Ķ—ā–ĺ–ī–ĺ–ľ –ĺ—Ü–Ķ–Ĺ–ļ–ł —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź —Ā–Ķ—ā—á–į—ā–ļ–ł in vivo —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ĺ–Ņ—ā–ł—á–Ķ—Ā–ļ–į—Ź –ļ–ĺ–≥–Ķ—Ä–Ķ–Ĺ—ā–Ĺ–į—Ź —ā–ĺ–ľ–ĺ–≥—Ä–į—Ą–ł—Ź (–ě–ö–Ę), –ļ–ĺ—ā–ĺ—Ä–į—Ź –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–ł–≤–į–Ķ—ā –ī–≤—É—Ö–ľ–Ķ—Ä–Ĺ–ĺ–Ķ –Ņ–ĺ–Ņ–Ķ—Ä–Ķ—á–Ĺ–ĺ–Ķ –ł–∑–ĺ–Ī—Ä–į–∂–Ķ–Ĺ–ł–Ķ –≤—č—Ā–ĺ–ļ–ĺ–≥–ĺ —Ä–į–∑—Ä–Ķ—ą–Ķ–Ĺ–ł—Ź (1‚Äď15 –ľ–ļ–ľ) –ł —ā—Ä–Ķ—Ö–ľ–Ķ—Ä–Ĺ—č–Ķ –ĺ–Ī—ä–Ķ–ľ–Ĺ—č–Ķ –ł–∑–ľ–Ķ—Ä–Ķ–Ĺ–ł—Ź [10]. –†—Ź–ī –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ —Ā –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł–Ķ–ľ —ā–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł –ě–ö–Ę –Ņ–ĺ–ļ–į–∑–į–Ľ–ł, —á—ā–ĺ –Ņ–į—Ä–į–ľ–Ķ—ā—Ä—č, –Ņ—Ä–Ķ–ī–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ–ľ—č–Ķ –ě–ö–Ę, —Ź–≤–Ľ—Ź—é—ā—Ā—Ź —ā–ĺ—á–Ĺ—č–ľ–ł –ī–Ľ—Ź –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–Ļ —Ā–Ķ—ā—á–į—ā–ļ–ł [11, 12]. –í–ľ–Ķ—Ā—ā–Ķ —Ā —ā–Ķ–ľ –ī–ĺ –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–≥–ĺ –≤—Ä–Ķ–ľ–Ķ–Ĺ–ł –Ĺ–Ķ—ā —á–Ķ—ā–ļ–ł—Ö —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł–Ļ –ĺ—ā–Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —ā–ĺ–≥–ĺ, –ľ–ĺ–≥—É—ā –Ľ–ł –ĺ–ī–ł–Ĺ, –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ĺ –ł–Ľ–ł –≤—Ā–Ķ –Ņ–į—Ä–į–ľ–Ķ—ā—Ä—č —Ā–Ķ—ā—á–į—ā–ļ–ł, –ł–∑–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ—č–Ķ —Ā –Ņ–ĺ–ľ–ĺ—Č—Ć—é –ě–ö–Ę, –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į—ā—Ć—Ā—Ź –ī–Ľ—Ź –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł –Ĺ–Ķ–Ļ—Ä–ĺ–ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—ā–ł–≤–Ĺ—č—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ, —ā–į–ļ–ł—Ö –ļ–į–ļ –Ď–ź.
–°–Ľ–Ķ–ī—É–Ķ—ā —ā–į–ļ–∂–Ķ –ĺ—ā–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ –Ņ–ĺ –ł–∑—É—á–Ķ–Ĺ–ł—é —Ā–Ķ—ā—á–į—ā–ļ–ł, –≤ —á–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł —ā–ĺ–Ľ—Č–ł–Ĺ—č –°–Ě–í–°, —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –≤ –†–Ķ—Ā–Ņ—É–Ī–Ľ–ł–ļ–Ķ –ź–∑–Ķ—Ä–Ī–į–Ļ–ī–∂–į–Ĺ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ.
–¶–Ķ–Ľ—Ć –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź ‚ÄĒ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ —ā–ĺ–Ľ—Č–ł–Ĺ—č –°–Ě–í–° –ł –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā–į –≥–į–Ĺ–≥–Ľ–ł–ĺ–∑–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ —Ā–Ķ—ā—á–į—ā–ļ–ł (–ö–ď–ö) —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź.
–ú–į—ā–Ķ—Ä–ł–į–Ľ –ł –ľ–Ķ—ā–ĺ–ī—č
–í –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –Ņ—Ä–ł–Ĺ—Ź–Ľ–ł —É—á–į—Ā—ā–ł–Ķ 45 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ (88 –≥–Ľ–į–∑) —Ā –Ď–ź, –ł–ľ–Ķ—é—Č–ł—Ö –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č–Ķ —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤–į –Ľ–Ķ–≥–ļ–ĺ–Ļ —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł —ā—Ź–∂–Ķ—Ā—ā–ł (—Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ĺ—Ü–Ķ–Ĺ–ļ–Ķ –Ņ–ĺ —ą–ļ–į–Ľ–Ķ MMSE (Mini-Mental State Examination ‚ÄĒ –ö—Ä–į—ā–ļ–į—Ź —ą–ļ–į–Ľ–į –ĺ—Ü–Ķ–Ĺ–ļ–ł –Ņ—Ā–ł—Ö–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ā—ā–į—ā—É—Ā–į) ‚ÄĒ –ĺ—ā 13 –ī–ĺ 24), –≤ –≤–ĺ–∑—Ä–į—Ā—ā–Ķ –ĺ—ā 58 –ī–ĺ 74 –Ľ–Ķ—ā, —Ā—Ä–Ķ–ī–Ĺ–ł–Ļ –≤–ĺ–∑—Ä–į—Ā—ā —Ā–ĺ—Ā—ā–į–≤–ł–Ľ 66,2¬Ī3,44 –≥–ĺ–ī–į. –ú—É–∂—á–ł–Ĺ –Ī—č–Ľ–ĺ 10 —á–Ķ–Ľ–ĺ–≤–Ķ–ļ (22,2%), –∂–Ķ–Ĺ—Č–ł–Ĺ ‚ÄĒ 35 (77,8%).
–ö—Ä–ł—ā–Ķ—Ä–ł—Ź–ľ–ł –≤–ļ–Ľ—é—á–Ķ–Ĺ–ł—Ź –Ī—č–Ľ–ł —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –í–ď–Ē –≤ –Ņ—Ä–Ķ–ī–Ķ–Ľ–į—Ö –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ—č—Ö –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ļ –ł —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā—Ć –Ņ–ĺ–Ĺ–ł–ľ–į—ā—Ć —Ü–Ķ–Ľ—Ć –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź. –ö—Ä–ł—ā–Ķ—Ä–ł—Ź–ľ–ł –ł—Ā–ļ–Ľ—é—á–Ķ–Ĺ–ł—Ź –Ī—č–Ľ–ł —Ä–Ķ—Ą—Ä–į–ļ—Ü–ł—Ź >5 –ī–Ņ—ā—Ä –ł/–ł–Ľ–ł –ĺ—Ā–Ķ–≤–į—Ź –ī–Ľ–ł–Ĺ–į >25 –ľ–ľ –≤ –ł—Ā—Ā–Ľ–Ķ–ī—É–Ķ–ľ–ĺ–ľ –≥–Ľ–į–∑—É, —ā—Ź–∂–Ķ–Ľ–į—Ź –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł—Ź, –ī—Ä—É–≥–ł–Ķ –≤–ł–ī—č –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł–ł, —Ü–Ķ—Ä–Ķ–Ī—Ä–ĺ–≤–į—Ā–ļ—É–Ľ—Ź—Ä–Ĺ—č–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź, –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ł–Ķ –ł –Ņ—Ā–ł—Ö–ł—á–Ķ—Ā–ļ–ł–Ķ —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤–į, —ā—Ź–∂–Ķ–Ľ–į—Ź –ĺ—Ą—ā–į–Ľ—Ć–ľ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–į—Ź –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—Ź (–≥–Ľ–į—É–ļ–ĺ–ľ–į, —É–≤–Ķ–ł—ā, –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź —Ā–Ķ—ā—á–į—ā–ļ–ł), —Ā–į—Ö–į—Ä–Ĺ—č–Ļ –ī–ł–į–Ī–Ķ—ā, –ł–Ĺ—Ā—É–Ľ—Ć—ā –≤ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ.
–í –ļ–į—á–Ķ—Ā—ā–≤–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ—č –ī–į–Ĺ–Ĺ—č–Ķ 60 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ (115 –≥–Ľ–į–∑) –Ī–Ķ–∑ –Ď–ź –≤ –≤–ĺ–∑—Ä–į—Ā—ā–Ķ –ĺ—ā 57 –ī–ĺ 68 –Ľ–Ķ—ā, —Ā—Ä–Ķ–ī–Ĺ–ł–Ļ –≤–ĺ–∑—Ä–į—Ā—ā ‚ÄĒ 59,6¬Ī2,03 –≥–ĺ–ī–į. –í —ć—ā–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ –ľ—É–∂—á–ł–Ĺ –Ī—č–Ľ–ĺ 17 (28,3%), –∂–Ķ–Ĺ—Č–ł–Ĺ ‚ÄĒ 43 (71,7%).
–ü–ĺ –ĺ—Ą—ā–į–Ľ—Ć–ľ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–ľ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ź–ľ —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö —Ä–į–∑–Ľ–ł—á–ł–Ļ –≤ –≥—Ä—É–Ņ–Ņ–į—Ö –Ĺ–Ķ –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ĺ. –ě—á–Ķ–≤–ł–ī–Ĺ–ĺ, —á—ā–ĺ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –Ņ–ĺ —ą–ļ–į–Ľ–Ķ –ú–úSE –Ī—É–ī—É—ā –Ĺ–ł–∑–ļ–ł–ľ–ł (—ā–į–Ī–Ľ. 1).
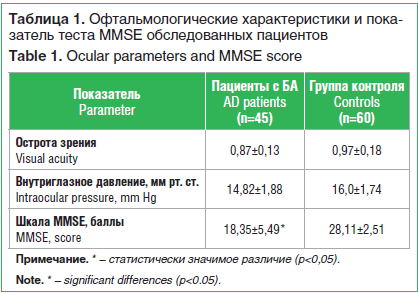
–ü–ĺ –ī–į–Ĺ–Ĺ—č–ľ —ā–į–Ī–Ľ–ł—Ü—č 1, –ĺ—Ā—ā—Ä–ĺ—ā–į –∑—Ä–Ķ–Ĺ–ł—Ź —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –Ī—č–Ľ–į —Ā–Ĺ–ł–∂–Ķ–Ĺ–į –≤ —Ā—Ä–Ķ–ī–Ĺ–Ķ–ľ –Ĺ–į 11,5%, –≤–Ĺ—É—ā—Ä–ł–≥–Ľ–į–∑–Ĺ–ĺ–Ķ –ī–į–≤–Ľ–Ķ–Ĺ–ł–Ķ ‚ÄĒ –Ĺ–į 8,0%, —Ā–ĺ–≤–ĺ–ļ—É–Ņ–Ĺ—č–Ļ –Ī–į–Ľ–Ľ –Ņ–ĺ —ą–ļ–į–Ľ–Ķ MMSE ‚ÄĒ –Ĺ–į 53,2%.
–ü—Ä–ĺ—ā–ĺ–ļ–ĺ–Ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ī—č–Ľ –ĺ–ī–ĺ–Ī—Ä–Ķ–Ĺ —É—á–Ķ–Ĺ—č–ľ —Ā–ĺ–≤–Ķ—ā–ĺ–ľ, —É –≤—Ā–Ķ—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ī—č–Ľ–ĺ –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–ĺ –ł–Ĺ—Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ķ —Ā–ĺ–≥–Ľ–į—Ā–ł–Ķ, –≤—Ā–Ķ –Ņ—Ä–ĺ—Ü–Ķ–ī—É—Ä—č –Ī—č–Ľ–ł –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ—č –≤ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–ł–ł —Ā –Ņ–Ķ—Ä–Ķ—Ā–ľ–ĺ—ā—Ä–Ķ–Ĺ–Ĺ–ĺ–Ļ —Ą–ĺ—Ä–ľ–ĺ–Ļ –•–Ķ–Ľ—Ć—Ā–ł–Ĺ–ļ—Ā–ļ–ĺ–Ļ –ī–Ķ–ļ–Ľ–į—Ä–į—Ü–ł–ł (2008) [14].
–í—Ā–Ķ–ľ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ĺ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ —ā—Ä–į–ī–ł—Ü–ł–ĺ–Ĺ–Ĺ—č–ľ–ł –ľ–Ķ—ā–ĺ–ī–į–ľ–ł: –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ –ĺ—Ā—ā—Ä–ĺ—ā—č –∑—Ä–Ķ–Ĺ–ł—Ź –ļ–į–∂–ī–ĺ–≥–ĺ –≥–Ľ–į–∑–į —Ā –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł–Ķ–ľ —ā–į–Ī–Ľ–ł—Ü—č –°–Ĺ–Ķ–Ľ–Ľ–Ķ–Ĺ–į, –ĺ—Ü–Ķ–Ĺ–ļ–į —É—Ä–ĺ–≤–Ĺ—Ź –≤–Ĺ—É—ā—Ä–ł–≥–Ľ–į–∑–Ĺ–ĺ–≥–ĺ –ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź –Ņ–ĺ –ď–ĺ–Ľ—Ć–ī–ľ–į–Ĺ—É. –ö–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–ĺ–Ķ —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł–Ķ –ļ–į–∂–ī–ĺ–≥–ĺ —É—á–į—Ā—ā–Ĺ–ł–ļ–į –Ī—č–Ľ–ĺ –ĺ—Ü–Ķ–Ĺ–Ķ–Ĺ–ĺ –Ņ–ĺ —ą–ļ–į–Ľ–Ķ MMSE [13]. –í—Ā–Ķ–ľ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–į –ě–ö–Ę –Ĺ–į –į–Ņ–Ņ–į—Ä–į—ā–Ķ Stratus OCT 3000 (Carl Zeiss Meditec, –°–®–ź). –ė—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ–ł —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č–Ļ –Ņ—Ä–ĺ—ā–ĺ–ļ–ĺ–Ľ Macular Cube 512√ó128 Combo. –í –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–į—Ā—Ć —Ä–Ķ–≥–ł—Ā—ā—Ä–į—Ü–ł—Ź –ł –į–Ĺ–į–Ľ–ł–∑ –ĺ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö —ā–ĺ–ľ–ĺ–≥—Ä–į–ľ–ľ –≤ —Ä–Ķ–∂–ł–ľ–Ķ –ļ–į—Ä—ā–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź, –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ—č –Ņ—Ä–ĺ—ā–ĺ–ļ–ĺ–Ľ—č RNFL (retinal nerve fiber layer ‚ÄĒ —Ā–Ľ–ĺ–Ļ –Ĺ–Ķ—Ä–≤–Ĺ—č—Ö –≤–ĺ–Ľ–ĺ–ļ–ĺ–Ĺ —Ā–Ķ—ā—á–į—ā–ļ–ł) –ł GCC (ganglion cell complex ‚ÄĒ –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā –≥–į–Ĺ–≥–Ľ–ł–ĺ–∑–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ, –ö–ď–ö).
–°—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–į—Ź –ĺ–Ī—Ä–į–Ī–ĺ—ā–ļ–į –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ—č—Ö —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–ĺ–≤ –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–į –≤ –Ņ—Ä–ĺ–≥—Ä–į–ľ–ľ–Ķ Microsoft Excel 2016. –°—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł–Ļ –į–Ĺ–į–Ľ–ł–∑ –ł –ĺ—Ü–Ķ–Ĺ–ļ–į –Ņ–ĺ–Ľ—É—á–į–Ķ–ľ—č—Ö —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–ĺ–≤ –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ł—Ā—Ć —Ā –Ņ–ĺ–ľ–ĺ—Č—Ć—é –Ņ—Ä–ĺ–≥—Ä–į–ľ–ľ—č Statistica 8.0. –Ē–į–Ĺ–Ĺ—č–Ķ –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ—č –≤ –≤–ł–ī–Ķ M¬ĪSD, –≥–ī–Ķ –ú ‚ÄĒ —Ā—Ä–Ķ–ī–Ĺ–Ķ–Ķ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ (average), SD ‚ÄĒ —Ā—ā–į–Ĺ–ī–į—Ä—ā–Ĺ–ĺ–Ķ –ĺ—ā–ļ–Ľ–ĺ–Ĺ–Ķ–Ĺ–ł–Ķ —Ā—Ä–Ķ–ī–Ĺ–Ķ–≥–ĺ (standard deviation), –ľ–ł–Ĺ–ł–ľ–į–Ľ—Ć–Ĺ—č—Ö –ł –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ—č—Ö –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ļ. –†–į–∑–Ľ–ł—á–ł—Ź —Ā—á–ł—ā–į–Ľ–ł –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ—č–ľ–ł –Ņ—Ä–ł –∑–Ĺ–į—á–Ķ–Ĺ–ł–ł p<0,05.
–†–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź
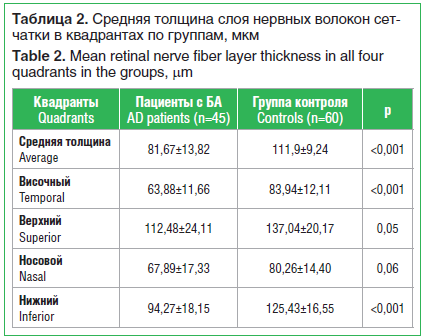
–ü—Ä–ł –į–Ĺ–į–Ľ–ł–∑–Ķ —ā–ĺ–Ľ—Č–ł–Ĺ—č –≤—Ā–Ķ–Ļ —Ā–Ķ—ā—á–į—ā–ļ–ł —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –ĺ—ā–ľ–Ķ—á–į–Ľ–ĺ—Ā—Ć —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ–ĺ–Ķ –Ķ–Ķ –ł—Ā—ā–ĺ–Ĺ—á–Ķ–Ĺ–ł–Ķ –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā —ā–į–ļ–ĺ–≤–ĺ–Ļ –≤ –≥—Ä—É–Ņ–Ņ–Ķ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź. –ė–∑ –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ—č—Ö –≤ —ā–į–Ī–Ľ–ł—Ü–Ķ 2 –ī–į–Ĺ–Ĺ—č—Ö —Ā–Ľ–Ķ–ī—É–Ķ—ā, —á—ā–ĺ –≤–Ķ–Ľ–ł—á–ł–Ĺ–į —Ā—Ä–Ķ–ī–Ĺ–Ķ–Ļ —ā–ĺ–Ľ—Č–ł–Ĺ—č –°–Ě–í–° –≤ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł–ł —Ā —ć—ā–ł–ľ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–ľ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –≤ –≥—Ä—É–Ņ–Ņ–Ķ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –Ī—č–Ľ–į —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–Ĺ–ĺ–Ļ. –í –≤–ł—Ā–ĺ—á–Ĺ–ĺ–ľ, –≤–Ķ—Ä—Ö–Ĺ–Ķ–ľ –ł –Ĺ–ł–∂–Ĺ–Ķ–ľ –ļ–≤–į–ī—Ä–į–Ĺ—ā–į—Ö –ł—Ā—ā–ĺ–Ĺ—á–Ķ–Ĺ–ł–Ķ –°–Ě–í–° —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –≤ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł–ł —Ā –≥—Ä—É–Ņ–Ņ–ĺ–Ļ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź —ā–į–ļ–∂–Ķ –ī–ĺ—Ā—ā–ł–≥–Ľ–ĺ —É—Ä–ĺ–≤–Ĺ—Ź —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ–ĺ–≥–ĺ. –°—Ä–Ķ–ī–Ĺ—Ź—Ź —ā–ĺ–Ľ—Č–ł–Ĺ–į –°–Ě–í–° —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –Ņ–ĺ –ĺ—ā–Ĺ–ĺ—ą–Ķ–Ĺ–ł—é –ļ —ā–į–ļ–ĺ–≤–ĺ–Ļ –≤ –≥—Ä—É–Ņ–Ņ–Ķ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –Ī—č–Ľ–į –Ĺ–ł–∂–Ķ –Ĺ–į 27,0%, –≤ –≤–ł—Ā–ĺ—á–Ĺ–ĺ–ľ, –Ĺ–ĺ—Ā–ĺ–≤–ĺ–ľ, –≤–Ķ—Ä—Ö–Ĺ–Ķ–ľ –ł –Ĺ–ł–∂–Ĺ–Ķ–ľ –ļ–≤–į–ī—Ä–į–Ĺ—ā–į—Ö —Ä–į–∑–Ĺ–ł—Ü–į —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–į 24,0, 15,4, 17,9 –ł 24,9% —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ.
–ü—Ä–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –ö–ď–ö –Ņ—Ä–ĺ–į–Ĺ–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ—č 5 –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ: —Ā—Ä–Ķ–ī–Ĺ—Ź—Ź —ā–ĺ–Ľ—Č–ł–Ĺ–į, —Ā—Ä–Ķ–ī–Ĺ—Ź—Ź —ā–ĺ–Ľ—Č–ł–Ĺ–į –≤ –≤–Ķ—Ä—Ö–Ĺ–Ķ–ľ –ł –≤ –Ĺ–ł–∂–Ĺ–Ķ–ľ —Ā–Ķ–≥–ľ–Ķ–Ĺ—ā–į—Ö, –ł–Ĺ–ī–Ķ–ļ—Ā —Ą–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ņ–ĺ—ā–Ķ—Ä–ł –ĺ–Ī—ä–Ķ–ľ–į –ł –ł–Ĺ–ī–Ķ–ļ—Ā –≥–Ľ–ĺ–Ī–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ņ–ĺ—ā–Ķ—Ä–ł –ĺ–Ī—ä–Ķ–ľ–į (—ā–į–Ī–Ľ. 3).
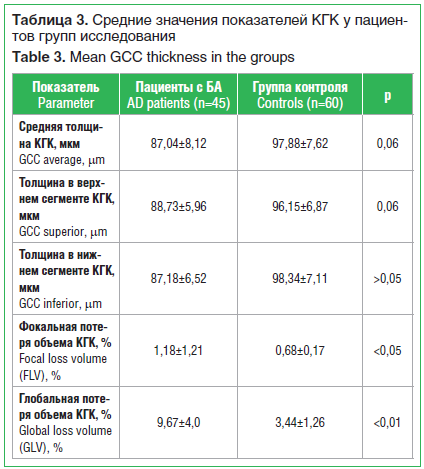
–°–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ –į–Ĺ–į–Ľ–ł–∑–į —ā–ĺ–Ľ—Č–ł–Ĺ—č –ö–ď–ö –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ —Ā—Ä–Ķ–ī–Ĺ–Ķ–Ļ —ā–ĺ–Ľ—Č–ł–Ĺ—č, —ā–ĺ–Ľ—Č–ł–Ĺ—č –≤ –≤–Ķ—Ä—Ö–Ĺ–Ķ–ľ –ł –Ĺ–ł–∂–Ĺ–Ķ–ľ —Ā–Ķ–≥–ľ–Ķ–Ĺ—ā–į—Ö –ö–ď–ö —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź, –ĺ–ī–Ĺ–į–ļ–ĺ —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ–ĺ–Ļ —Ä–į–∑–Ĺ–ł—Ü—č —Ā –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ź–ľ–ł –≥—Ä—É–Ņ–Ņ—č –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –Ĺ–Ķ –ĺ—ā–ľ–Ķ—á–į–Ľ–ĺ—Ā—Ć. –í—č—Ź–≤–Ľ–Ķ–Ĺ–ĺ —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ–ĺ–Ķ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ –ł–Ĺ–ī–Ķ–ļ—Ā–ĺ–≤ —Ą–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ–Ļ –ł –≥–Ľ–ĺ–Ī–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ņ–ĺ—ā–Ķ—Ä–ł –ĺ–Ī—ä–Ķ–ľ–į –ö–ď–ö. –ü–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć —Ą–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ņ–ĺ—ā–Ķ—Ä–ł –ĺ–Ī—ä–Ķ–ľ–į –ö–ď–ö –Ņ—Ä–ł –Ď–ź –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ć–Ĺ—č–ľ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–ľ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ –≤ 1,7 —Ä–į–∑–į (p<0,05), –≥–Ľ–ĺ–Ī–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ņ–ĺ—ā–Ķ—Ä–ł –ĺ–Ī—ä–Ķ–ľ–į –ö–ď–ö ‚ÄĒ –≤ 2,8 —Ä–į–∑–į (—Ä<0,01).
–ě–Ī—Ā—É–∂–ī–Ķ–Ĺ–ł–Ķ
–í –Ĺ–į—ą–Ķ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –Ņ—Ä–ł–Ĺ—Ź–Ľ–ł —É—á–į—Ā—ā–ł–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č–Ķ —Ā –Ď–ź –Ľ–Ķ–≥–ļ–ĺ–Ļ —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł, –Ņ—Ä–ł—á–Ķ–ľ –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–ĺ —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–ł –∂–Ķ–Ĺ—Č–ł–Ĺ—č ‚ÄĒ 77,8%, —á—ā–ĺ —Ā–ĺ–≥–Ľ–į—Ā—É–Ķ—ā—Ā—Ź —Ā –ī–į–Ĺ–Ĺ—č–ľ–ł –Ľ–ł—ā–Ķ—Ä–į—ā—É—Ä—č, —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ļ–ĺ—ā–ĺ—Ä—č–ľ –Ď–ź –≤ 1,5 —Ä–į–∑–į —á–į—Č–Ķ –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź —É –∂–Ķ–Ĺ—Č–ł–Ĺ [15].
–í –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –ľ—č –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ–ł –ě–ö–Ę –ī–Ľ—Ź —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź —ā–ĺ–Ľ—Č–ł–Ĺ—č –°–Ě–í–° –ł –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –ö–ď–ö —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ľ–Ķ–≥–ļ–ĺ–Ļ —Ą–ĺ—Ä–ľ–ĺ–Ļ –Ď–ź –ł –≥—Ä—É–Ņ–Ņ—č –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź. –°–Ķ—ā—á–į—ā–ļ–į –ł–ľ–Ķ–Ķ—ā –Ĺ–Ķ–ļ–ĺ—ā–ĺ—Ä—č–Ķ –ĺ–Ī—Č–ł–Ķ —á–Ķ—Ä—ā—č —Ā –ľ–ĺ–∑–≥–ĺ–ľ: –ĺ–Ī—Č–Ķ–Ķ —ć–ľ–Ī—Ä–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ķ –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–∂–ī–Ķ–Ĺ–ł–Ķ; —Ā—Ö–ĺ–ī–Ĺ—É—é –ľ–ł–ļ—Ä–ĺ—Ā–ĺ—Ā—É–ī–ł—Ā—ā—É—é –į–Ĺ–į—ā–ĺ–ľ–ł—é –ł –≥–ł—Ā—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ķ —Ā—ā—Ä–ĺ–Ķ–Ĺ–ł–Ķ. –ö—Ä–ĺ–ľ–Ķ —ā–ĺ–≥–ĺ, –Ĺ–Ķ–ļ–ĺ—ā–ĺ—Ä—č–Ķ –Ķ–Ķ —Ā—ā—Ä—É–ļ—ā—É—Ä–Ĺ–ĺ-—Ą–ł–∑–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —Ā—Ö–ĺ–∂–ł —Ā–ĺ —Ā—ā—Ä—É–ļ—ā—É—Ä–ĺ–Ļ –≥–Ķ–ľ–į—ā–ĺ—ć–Ĺ—Ü–Ķ—Ą–į–Ľ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ī–į—Ä—Ć–Ķ—Ä–į [7]. –≠—ā–ł –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –≤–ľ–Ķ—Ā—ā–Ķ –ī–Ķ–Ľ–į—é—ā –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ —Ā–Ķ—ā—á–į—ā–ļ–ł –Ĺ–Ķ–ł–Ĺ–≤–į–∑–ł–≤–Ĺ—č–ľ –ł –ī–ĺ—Ā—ā—É–Ņ–Ĺ—č–ľ —Ā—Ä–Ķ–ī—Ā—ā–≤–ĺ–ľ, –Ņ–ĺ–ľ–ĺ–≥–į—é—Č–ł–ľ –≤ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –Ņ–ĺ—Ä–į–∂–Ķ–Ĺ–ł–Ļ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į. –í —á–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł, –≤–ł–∑—É–į–Ľ–ł–∑–į—Ü–ł—Ź —Ā–Ķ—ā—á–į—ā–ļ–ł –Ņ—Ä–ł–≤–Ľ–Ķ–ļ–Ľ–į –≤–Ĺ–ł–ľ–į–Ĺ–ł–Ķ –ļ–į–ļ –Ĺ–Ķ–ł–Ĺ–≤–į–∑–ł–≤–Ĺ–ĺ–Ķ —Ā—Ä–Ķ–ī—Ā—ā–≤–ĺ –ī–Ľ—Ź –ĺ—Ü–Ķ–Ĺ–ļ–ł —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź –∑–ī–ĺ—Ä–ĺ–≤—Ć—Ź –į–ļ—Ā–ĺ–Ĺ–ĺ–≤ –ł –ł–∑–ľ–Ķ—Ä–Ķ–Ĺ–ł—Ź —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤ –Ĺ–Ķ–Ļ—Ä–ĺ–Ņ—Ä–ĺ—ā–Ķ–ļ—ā–ł–≤–Ĺ—č—Ö –į–≥–Ķ–Ĺ—ā–ĺ–≤ [16, 17].
–ü–ĺ –ī–į–Ĺ–Ĺ—č–ľ –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –Ĺ–į–ľ–ł —Ā—Ä–į–≤–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –į–Ĺ–į–Ľ–ł–∑–į, —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā –≥—Ä—É–Ņ–Ņ–ĺ–Ļ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –≤—č—Ź–≤–Ľ—Ź–Ľ–ĺ—Ā—Ć —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ķ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ —ā–ĺ–Ľ—Č–ł–Ĺ—č –°–Ě–í–° –ł –ö–ď–ö —Ā–Ķ—ā—á–į—ā–ļ–ł –ł —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ–ĺ–Ķ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –ł–Ĺ–ī–Ķ–ļ—Ā–ĺ–≤ —Ą–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ–Ļ –ł –≥–Ľ–ĺ–Ī–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ņ–ĺ—ā–Ķ—Ä–ł –ĺ–Ī—ä–Ķ–ľ–į –ö–ď–ö. –°—É—Č–Ķ—Ā—ā–≤—É–Ķ—ā –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ĺ —Ā–ĺ–ĺ–Ī—Č–Ķ–Ĺ–ł–Ļ –ĺ —ā–ĺ–ľ, —á—ā–ĺ —ā–ĺ–Ľ—Č–ł–Ĺ–į –°–Ě–í–° –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–į —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā —ā–į–ļ–ĺ–≤–ĺ–Ļ —É –Ľ–ł—Ü –Ī–Ķ–∑ —ć—ā–ĺ–Ļ –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł [16, 18]. X.F. He et al. [16] —ā–į–ļ–∂–Ķ —Ā–ĺ–ĺ–Ī—Č–ł–Ľ–ł, —á—ā–ĺ —ā–ĺ–Ľ—Č–ł–Ĺ–į –°–Ě–í–° –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —É–ľ–Ķ–Ĺ—Ć—ą–ł–Ľ–į—Ā—Ć –≤–ĺ –≤—Ā–Ķ—Ö –ļ–≤–į–ī—Ä–į–Ĺ—ā–į—Ö —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź. –Ē—Ä—É–≥–ł–Ķ —Ā–ĺ–ĺ–Ī—Č–Ķ–Ĺ–ł—Ź, –ĺ–ī–Ĺ–į–ļ–ĺ, —É–ļ–į–∑—č–≤–į—é—ā, —á—ā–ĺ —ā–ĺ–Ľ—Č–ł–Ĺ–į –°–Ě–í–° –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –ĺ—ā–Ľ–ł—á–į–Ķ—ā—Ā—Ź –≤ –≤–Ķ—Ä—Ö–Ĺ–Ķ–Ļ —á–į—Ā—ā–ł –ł –Ĺ–ł–∂–Ĺ–Ķ–ľ –ļ–≤–į–ī—Ä–į–Ĺ—ā–Ķ [9, 19]. –í –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –ľ—č –ĺ–Ī–Ĺ–į—Ä—É–∂–ł–Ľ–ł, —á—ā–ĺ —ā–ĺ–Ľ—Č–ł–Ĺ–į –°–Ě–í–° –Ī—č–Ľ–į —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ–ĺ —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–į –≤ –≤–ł—Ā–ĺ—á–Ĺ–ĺ–ľ, –≤–Ķ—Ä—Ö–Ĺ–Ķ–ľ –ł –Ĺ–ł–∂–Ĺ–Ķ–ľ –ļ–≤–į–ī—Ä–į–Ĺ—ā–į—Ö —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā —ā–į–ļ–ĺ–≤–ĺ–Ļ —É –Ľ–ł—Ü –≤ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ć–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ (—Ä<0,05). –°–Ľ–Ķ–ī—É–Ķ—ā –ĺ—ā–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ –ł—Ā—ā–ĺ–Ĺ—á–Ķ–Ĺ–ł–Ķ –°–Ě–í–° –ľ–ĺ–∂–Ķ—ā –Ī—č—ā—Ć —Ā–į–ľ—č–ľ —Ä–į–Ĺ–Ĺ–ł–ľ —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ĺ–ľ –Ď–ź, –Ķ—Č–Ķ –ī–ĺ —É—Ö—É–ī—ą–Ķ–Ĺ–ł—Ź –Ņ–į–ľ—Ź—ā–ł. –Ě–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ —Ā–ĺ–ĺ–Ī—Č–ł–Ľ–ł –ĺ –Ņ–ĺ—ā–Ķ—Ä–Ķ —ā–ĺ–Ľ—Č–ł–Ĺ—č –°–Ě–í–° –Ĺ–į —Ä–į–Ĺ–Ĺ–ł—Ö —Ā—ā–į–ī–ł—Ź—Ö –Ď–ź [16, 18]. –Ę–Ķ–ľ –Ĺ–Ķ –ľ–Ķ–Ĺ–Ķ–Ķ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā—č —ć—ā–ł—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ —Ā–Ņ–ĺ—Ä–Ĺ—č. –ü–ĺ–Ľ–į–≥–į—é—ā, —á—ā–ĺ –°–Ě–í–° –ľ–ĺ–∂–Ķ—ā —Ā–Ľ—É–∂–ł—ā—Ć –≤ –ļ–į—á–Ķ—Ā—ā–≤–Ķ –Ī–ł–ĺ–ľ–į—Ä–ļ–Ķ—Ä–į —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ—č—Ö –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ –ł –Ď–ź [15, 20].
–ü—Ä–ł—á–ł–Ĺ–ĺ–Ļ —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł—Ź —ā–ĺ–Ľ—Č–ł–Ĺ—č –°–Ě–í–° –Ņ—Ä–ł –Ď–ź, –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ, —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –≥–ł–Ī–Ķ–Ľ—Ć –į–ļ—Ā–ĺ–Ĺ–ĺ–≤ –≥–į–Ĺ–≥–Ľ–ł–ĺ–∑–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ —Ā–Ķ—ā—á–į—ā–ļ–ł –≤ –ī–ĺ–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ł–Ķ –ļ —Ä–Ķ—ā—Ä–ĺ–≥—Ä–į–ī–Ĺ–ĺ–Ļ –ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—Ü–ł–ł –≤ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ –Ņ–ĺ—ā–Ķ—Ä–ł –ļ–ĺ—Ä–ļ–ĺ–≤—č—Ö –Ĺ–Ķ–Ļ—Ä–ĺ–Ĺ–ĺ–≤ [3, 5, 21]. –í—č—Ź–≤–Ľ–Ķ–Ĺ–ł–Ķ –ī–Ķ—Ą–Ķ–ļ—ā–ĺ–≤ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł–Ķ–Ļ –Ľ–Ķ–≥–ļ–ĺ–Ļ —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł —Ā –Ņ–ĺ–ľ–ĺ—Č—Ć—é –ě–ö–Ę –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–į–Ķ—ā –ľ–Ĺ–Ķ–Ĺ–ł–Ķ –ĺ—ā–Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —ā–ĺ–≥–ĺ, —á—ā–ĺ —ć—ā–ł –ī–Ķ—Ą–Ķ–ļ—ā—č –ľ–ĺ–≥—É—ā –Ī—č—ā—Ć —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ—č –ī–Ľ—Ź –Ď–ź.
–í 1986 –≥. D.R. Hinton et al. [4] –≥–ł—Ā—ā–ĺ–Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł –≤—č—Ź–≤–ł–Ľ–ł –Ņ–ĺ—ā–Ķ—Ä–ł –ö–ď–ö –Ņ—Ä–ł –Ď–ź. –ü—Ä–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –ö–ď–ö –ľ—č –ĺ–Ī–Ĺ–į—Ä—É–∂–ł–Ľ–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ –≤—Ā–Ķ—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ, –Ĺ–ĺ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ –ł–∑–ľ–Ķ–Ĺ—Ź–Ľ–ł—Ā—Ć –ł–Ĺ–ī–Ķ–ļ—Ā—č —Ą–ĺ–ļ–į–Ľ—Ć–Ĺ—č—Ö –ł –≥–Ľ–ĺ–Ī–į–Ľ—Ć–Ĺ—č—Ö –Ņ–ĺ—ā–Ķ—Ä—Ć –ĺ–Ī—ä–Ķ–ľ–į —ć—ā–ĺ–≥–ĺ –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā–į. –Ě–į—ą–ł —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ĺ –ĺ—ā–Ľ–ł—á–į—é—ā—Ā—Ź –ĺ—ā –ī–į–Ĺ–Ĺ—č—Ö –í.–ü. –ē—Ä–ł—á–Ķ–≤–į –ł —Ā–ĺ–į–≤—ā. [21]. –ü–ĺ –ł—Ö –ī–į–Ĺ–Ĺ—č–ľ, —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –Ľ–ł—ą—Ć –ł–Ĺ–ī–Ķ–ļ—Ā –≥–Ľ–ĺ–Ī–į–Ľ—Ć–Ĺ—č—Ö –Ņ–ĺ—ā–Ķ—Ä—Ć —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ–ĺ –ĺ—ā–Ľ–ł—á–į–Ľ—Ā—Ź –ĺ—ā –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ź. –ź–≤—ā–ĺ—Ä—č –ĺ—ā–ľ–Ķ—á–į—é—ā, —á—ā–ĺ —ć—ā–ĺ—ā –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć —É –Ĺ–Ķ–ļ–ĺ—ā–ĺ—Ä—č—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –Ņ—Ä–ł –ě–ö–Ę –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ľ—Ā—Ź –ļ–į–ļ –Ņ–ĺ–≥—Ä–į–Ĺ–ł—á–Ĺ—č–Ļ. –ź–≤—ā–ĺ—Ä—č –Ņ–ĺ–Ľ–į–≥–į—é—ā, —á—ā–ĺ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ľ–Ķ–≥–ļ–ĺ–Ļ –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł–Ķ–Ļ –Ĺ–į —Ä–į–Ĺ–Ĺ–Ķ–Ļ —Ā—ā–į–ī–ł–ł –Ď–ź –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–ī–ł—ā –Ĺ–Ķ–∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –ī–ł—Ą—Ą—É–∑–Ĺ–ĺ–Ķ —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–Ķ –ĺ–Ī—ä–Ķ–ľ–į –ö–ď–ö –ł —ć—ā–ĺ –Ĺ–į—Ö–ĺ–ī–ł—ā —Ā–≤–ĺ–Ķ –ĺ—ā—Ä–į–∂–Ķ–Ĺ–ł–Ķ –≤ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–ł –ł–Ĺ–ī–Ķ–ļ—Ā–į –≥–Ľ–ĺ–Ī–į–Ľ—Ć–Ĺ—č—Ö –Ņ–ĺ—ā–Ķ—Ä—Ć –ĺ–Ī—ä–Ķ–ľ–į. –ź–≤—ā–ĺ—Ä—č —Ā—á–ł—ā–į—é—ā, —á—ā–ĺ —ć—ā–ĺ—ā –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć –ö–ď–ö —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —Ā–į–ľ—č–ľ —á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ—č–ľ –≤ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–Ķ –Ĺ–Ķ–Ļ—Ä–ĺ–ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—ā–ł–≤–Ĺ—č—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ —Ā–Ķ—ā—á–į—ā–ļ–ł –Ņ—Ä–ł –Ď–ź –ł –ľ–ĺ–∂–Ķ—ā –Ī—č—ā—Ć –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ –ī–Ľ—Ź —Ä–į–Ĺ–Ĺ–Ķ–Ļ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł —ć—ā–ĺ–≥–ĺ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź [21].
–í –∑–į–ļ–Ľ—é—á–Ķ–Ĺ–ł–Ķ —Ā–Ľ–Ķ–ī—É–Ķ—ā –ĺ—ā–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–į–Ķ—ā —ā–ĺ—ā —Ą–į–ļ—ā, —á—ā–ĺ –ł—Ā—ā–ĺ–Ĺ—á–Ķ–Ĺ–ł–Ķ –°–Ě–í–° –ľ–ĺ–∂–Ķ—ā –ĺ—ā—Ä–į–∂–į—ā—Ć –ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—Ü–ł—é –į–ļ—Ā–ĺ–Ĺ–ĺ–≤ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź.
–í—č–≤–ĺ–ī—č
–†–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –Ĺ–į—ą–Ķ–≥–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ņ–ĺ–ļ–į–∑—č–≤–į—é—ā, —á—ā–ĺ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź (MMSE 18,35¬Ī5,49) –Ĺ–Ķ–Ļ—Ä–ĺ–ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—Ü–ł—Ź –ľ–ĺ–∂–Ķ—ā –Ņ—Ä–ĺ—Ź–≤–Ľ—Ź—ā—Ć—Ā—Ź –≤ –≤–ł–ī–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –°–Ě–í–° –ł –ĺ–Ī—ä–Ķ–ľ–į –≥–į–Ĺ–≥–Ľ–ł–ĺ–∑–Ĺ–ĺ–≥–ĺ –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–≥–ĺ —Ā–Ľ–ĺ—Ź.
–Ę–ĺ–Ľ—Č–ł–Ĺ–į –°–Ě–í–° —Ā–Ĺ–ł–∂–į–Ķ—ā—Ā—Ź —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā —ā–į–ļ–ĺ–≤–ĺ–Ļ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ī–Ķ–∑ –Ď–ź –≤–ĺ –≤—Ā–Ķ—Ö –ļ–≤–į–ī—Ä–į–Ĺ—ā–į—Ö, –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ –≤ –≤–ł—Ā–ĺ—á–Ĺ–ĺ–ľ, –≤–Ķ—Ä—Ö–Ĺ–Ķ–ľ –ł –Ĺ–ł–∂–Ĺ–Ķ–ľ (—Ä<0,001). –£–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–Ĺ–į—Ź —ā–ĺ–Ľ—Č–ł–Ĺ–į –°–Ě–í–° –ľ–ĺ–∂–Ķ—ā –ĺ—ā—Ä–į–∂–į—ā—Ć –≥–ł–Ī–Ķ–Ľ—Ć –Ĺ–Ķ—Ä–≤–Ĺ—č—Ö –≥–į–Ĺ–≥–Ľ–ł–ĺ–∑–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ —Ā–Ķ—ā—á–į—ā–ļ–ł.
–£ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ď–ź –ł–∑–ľ–Ķ–Ĺ—Ź—é—ā—Ā—Ź –≤—Ā–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –ö–ď–ö —Ā–Ķ—ā—á–į—ā–ļ–ł, –Ņ—Ä–ł—á–Ķ–ľ —Ā—Ä–Ķ–ī–Ĺ—Ź—Ź —ā–ĺ–Ľ—Č–ł–Ĺ–į, —ā–ĺ–Ľ—Č–ł–Ĺ–į –≤ –Ĺ–ł–∂–Ĺ–Ķ–ľ –ł –≤–Ķ—Ä—Ö–Ĺ–Ķ–ľ —Ā–Ķ–≥–ľ–Ķ–Ĺ—ā–į—Ö —Ā–Ĺ–ł–∂–į–Ķ—ā—Ā—Ź, –į –ł–Ĺ–ī–Ķ–ļ—Ā—č —Ą–ĺ–ļ–į–Ľ—Ć–Ĺ—č—Ö –ł –≥–Ľ–ĺ–Ī–į–Ľ—Ć–Ĺ—č—Ö –Ņ–ĺ—ā–Ķ—Ä—Ć –ĺ–Ī—ä–Ķ–ľ–į –ö–ď–ö —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ–ĺ —É–≤–Ķ–Ľ–ł—á–ł–≤–į—é—ā—Ā—Ź (p<0,01).
–Ē–Ľ—Ź –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź –Ĺ–Ķ–Ļ—Ä–ĺ–ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—ā–ł–≤–Ĺ—č—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ —Ā–Ķ—ā—á–į—ā–ļ–ł —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ľ–Ķ–≥–ļ–ĺ–Ļ —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć—é –Ď–ź —Ü–Ķ–Ľ–Ķ—Ā–ĺ¬≠–ĺ–Ī—Ä–į–∑–Ĺ–ĺ –ł–∑–ľ–Ķ—Ä—Ź—ā—Ć —ā–ĺ–Ľ—Č–ł–Ĺ—É –°–Ě–í–° –ł –ĺ–Ī—ä–Ķ–ľ –ö–ď–ö.
–°–≤–Ķ–ī–Ķ–Ĺ–ł—Ź –ĺ–Ī –į–≤—ā–ĺ—Ä–Ķ:
–ď—É–Ľ–ł–Ķ–≤–į –†—É–Ī–į–Ī–į –Ě–į–∑–ł–ľ –ļ—č–∑—č ‚ÄĒ –ľ–Ľ–į–ī—ą–ł–Ļ –Ĺ–į—É—á–Ĺ—č–Ļ —Ā–ĺ—ā—Ä—É–ī–Ĺ–ł–ļ, ORCID iD 0000-0002-9206-8218.
–ė–Ĺ—Ā—ā–ł—ā—É—ā —Ą–ł–∑–ł–ĺ–Ľ–ĺ–≥–ł–ł –ł–ľ. –ź.–ė. –ö–į—Ä–į–Ķ–≤–į –Ě–į—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ –į–ļ–į–ī–Ķ–ľ–ł–ł –Ĺ–į—É–ļ –ź–∑–Ķ—Ä–Ī–į–Ļ–ī–∂–į–Ĺ–į. 1100, –ź–∑–Ķ—Ä–Ī–į–Ļ–ī–∂–į–Ĺ, –≥. –Ď–į–ļ—É, —É–Ľ. –ź.–ú. –®–į—Ä–ł—Ą–∑–į–ī–Ķ, –ī. 78.
–ö–ĺ–Ĺ—ā–į–ļ—ā–Ĺ–į—Ź –ł–Ĺ—Ą–ĺ—Ä–ľ–į—Ü–ł—Ź: –ď—É–Ľ–ł–Ķ–≤–į –†—É–Ī–į–Ī–į –Ě–į–∑–ł–ľ –ļ—č–∑—č, e-mail: ittihaf@yahoo.com.
–ü—Ä–ĺ–∑—Ä–į—á–Ĺ–ĺ—Ā—ā—Ć —Ą–ł–Ĺ–į–Ĺ—Ā–ĺ–≤–ĺ–Ļ –ī–Ķ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł: –į–≤—ā–ĺ—Ä –Ĺ–Ķ –ł–ľ–Ķ–Ķ—ā —Ą–ł–Ĺ–į–Ĺ—Ā–ĺ–≤–ĺ–Ļ –∑–į–ł–Ĺ—ā–Ķ—Ä–Ķ—Ā–ĺ–≤–į–Ĺ–Ĺ–ĺ—Ā—ā–ł –≤ –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ—č—Ö –ľ–į—ā–Ķ—Ä–ł–į–Ľ–į—Ö –ł–Ľ–ł –ľ–Ķ—ā–ĺ–ī–į—Ö. –ö–ĺ–Ĺ—Ą–Ľ–ł–ļ—ā –ł–Ĺ—ā–Ķ—Ä–Ķ—Ā–ĺ–≤ –ĺ—ā—Ā—É—ā—Ā—ā–≤—É–Ķ—ā. –°—ā–į—ā—Ć—Ź –Ņ–ĺ—Ā—ā—É–Ņ–ł–Ľ–į 08.04.2020.
About the author:
Rubaba N. Gulieva ‚ÄĒ MD, Junior Researcher, ORCID iD 0000-0002-9206-8218.
A.I. Karaev Institute of Physiology of Azerbaijan National Academy of Sciences. 78, A.M. Sharifadze str., Baku, 1100, Azerbaijan.
Contact information: Rubaba N. Gulieva, e-mail: ittihaf@yahoo.com.
Financial Disclosure: author has no a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 08.04.2020.








.gif)



