–Т–≤–µ–і–µ–љ–Є–µ
–Т—А–Њ–ґ–і–µ–љ–љ–∞—П –∞—В—А–µ–Ј–Є—П —Е–Њ–∞–љ (–Р–•) вАФ –∞–љ–Њ–Љ–∞–ї–Є—П —А–∞–Ј–≤–Є—В–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –Ј–∞–і–љ–Є–µ –Њ—В–і–µ–ї—Л –њ–Њ–ї–Њ—Б—В–Є –љ–Њ—Б–∞ –њ–Њ–ї–љ–Њ—Б—В—М—О –Є–ї–Є —З–∞—Б—В–Є—З–љ–Њ –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ—Л –Ї–Њ—Б—В–љ–Њ–є –Є–ї–Є –Ї–Њ—Б—В–љ–Њ-–Љ–µ–Љ–±—А–∞–љ–Њ–Ј–љ–Њ–є –њ–ї–∞—Б—В–Є–љ–Њ–є –Є –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В —Б–Њ–Њ–±—Й–µ–љ–Є–µ –Љ–µ–ґ–і—Г –љ–Њ—Б–Њ–Љ –Є –љ–Њ—Б–Њ–≥–ї–Њ—В–Ї–Њ–є. –Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М —А–∞–Ј—А–∞–±–Њ—В–∞–љ–Њ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤–∞—А–Є–∞–љ—В–Њ–≤ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Є –Є —В–∞–Ї—В–Є–Ї–Є –≤–µ–і–µ–љ–Є—П –і–µ—В–µ–є –њ–µ—А–≤—Л—Е –і–љ–µ–є –ґ–Є–Ј–љ–Є —Б –њ–Њ–ї–љ–Њ–є –і–≤—Г—Б—В–Њ—А–Њ–љ–љ–µ–є –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –Р–•. –Ю–і–љ–∞–Ї–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–є —В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ–≥—А–µ—Б—Б –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 10 –ї–µ—В, –Р–• –≤—Б–µ –µ—Й–µ –Њ—Б—В–∞–µ—В—Б—П –Њ–і–љ–Њ–є –Є–Ј –∞–Ї—В—Г–∞–ї—М–љ—Л—Е –њ—А–Њ–±–ї–µ–Љ –≤ –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ.
–Р—В—А–µ–Ј–Є—П —Е–Њ–∞–љ: –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П, —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—П, –њ–∞—В–Њ–≥–µ–љ–µ–Ј –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞
–Т—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В—М –Р–• –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В –Њ–і–љ–Њ–≥–Њ —Б–ї—Г—З–∞—П –љ–∞ 5вАУ8 —В—Л—Б. —А–Њ–і–Є–≤—И–Є—Е—Б—П. –°–∞–Љ–∞—П —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–∞—П —Д–Њ—А–Љ–∞ –Р–• вАФ –Ї–Њ—Б—В–љ–∞—П, –Ї–Њ—В–Њ—А–∞—П –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ 85вАУ90% –љ–∞–±–ї—О–і–µ–љ–Є–є. –Ь–µ–Љ–±—А–∞–љ–Њ–Ј–љ—Л–є –Є–ї–Є —Б–Љ–µ—И–∞–љ–љ—Л–є —В–Є–њ—Л –Р–• (—Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–ї–∞—Б—В–Є–љ–Ї–Є –Ї–Њ—Б—В–љ–Њ-–Љ–µ–Љ–±—А–∞–љ–Њ–Ј–љ–Њ–≥–Њ –≤–Є–і–∞) –љ–∞–±–ї—О–і–∞—О—В—Б—П –љ–∞–Љ–љ–Њ–≥–Њ —А–µ–ґ–µ, —Б–Њ—Б—В–∞–≤–ї—П—П –і–Њ 10% –љ–∞–±–ї—О–і–µ–љ–Є–є. –Э–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л–µ –і–µ–≤–Њ—З–Ї–Є —Б—В—А–∞–і–∞—О—В –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є –≤ 2 —А–∞–Ј–∞ —З–∞—Й–µ, —З–µ–Љ –Љ–∞–ї—М—З–Є–Ї–Є. –Ґ–∞–Ї–ґ–µ –≤ 2 —А–∞–Ј–∞ —З–∞—Й–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ —Б –Њ–±–µ–Є—Е —Б—В–Њ—А–Њ–љ –љ–Њ—Б–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є, –љ–µ–ґ–µ–ї–Є –Њ–і–љ–Њ—Б—В–Њ—А–Њ–љ–љ–µ–µ [1].
–Я–µ—А–µ–Ї—А—Л—В–Є—О —Е–Њ–∞–љ —Б –і–≤—Г—Е —Б—В–Њ—А–Њ–љ –Ј–∞—З–∞—Б—В—Г—О —Б–Њ–њ—Г—В—Б—В–≤—Г—О—В –Є–љ—Л–µ –њ–∞—В–Њ–ї–Њ–≥–Є–Є: CHARGE-—Б–Є–љ–і—А–Њ–Љ (–Ї–Њ–ї–Њ–±–Њ–Љ–∞ (Coloboma), —Б–µ—А–і–µ—З–љ—Л–µ –і–µ—Д–µ–Ї—В—Л (Heart defects), –Р–• (Atresia choanae), –Ј–∞–і–µ—А–ґ–Ї–∞ —А–Њ—Б—В–∞ –Є —А–∞–Ј–≤–Є—В–Є—П (growth Retardation), –∞–љ–Њ–Љ–∞–ї–Є–Є –≥–µ–љ–Є—В–∞–ї–Є–є (Genital abnormalities), –∞–љ–Њ–Љ–∞–ї–Є–Є —Г—Е–∞ (Ear abnormalities)), —Б–Є–љ–і—А–Њ–Љ –Р–њ–µ—А—В–∞, —Б–Є–љ–і—А–Њ–Љ –Ъ—А—Г–Ј–Њ–љ–∞, —Б–Є–љ–і—А–Њ–Љ –Ф–∞—Г–љ–∞, –∞ —В–∞–Ї–ґ–µ –і—А—Г–≥–Є–µ –≤–∞—А–Є–∞–љ—В—Л –Ї—А–∞–љ–Є–Њ—Д–∞—Ж–Є–∞–ї—М–љ—Л—Е –∞–љ–Њ–Љ–∞–ї–Є–є [2].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Р–• –Љ–Њ–≥—Г—В –≤–∞—А—М–Є—А–Њ–≤–∞—В—М –Њ—В –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–є –Њ–±—Б—В—А—Г–Ї—Ж–Є–Є –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–µ–є—Б—П —Г–≥—А–Њ–Ј–Њ–є –ґ–Є–Ј–љ–Є –≤–≤–Є–і—Г –∞—Б—Д–Є–Ї—Б–Є–Є, –і–Њ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–љ–Њ–є–љ–Њ–≥–Њ —А–Є–љ–Є—В–∞, —Б–≤—П–Ј–∞–љ–љ–Њ–≥–Њ —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Ї–ї–Є—А–µ–љ—Б–∞ —Б–ї–Є–Ј–Є –Є –Ј–∞—Б—В–Њ–є–љ—Л–Љ–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –≤ –њ–Њ–ї–Њ—Б—В–Є –љ–Њ—Б–∞ –Є –Њ–Ї–Њ–ї–Њ–љ–Њ—Б–Њ–≤—Л—Е –њ–∞–Ј—Г—Е–∞—Е, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –∞—Н—А–∞—Ж–Є–Є.
–Ю–і–љ–Є–Љ –Є–Ј —Б–∞–Љ—Л—Е –≤–∞–ґ–љ—Л—Е –∞—Б–њ–µ–Ї—В–Њ–≤ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П —А–µ–±–µ–љ–Ї–∞ –≤ –њ–µ—А–≤—Л–µ –і–љ–Є –ґ–Є–Ј–љ–Є —П–≤–ї—П–µ—В—Б—П —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–∞—П —Д—Г–љ–Ї—Ж–Є—П, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ —Г—З–Є—В—Л–≤–∞—В—М —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –њ—А–Є —А–Њ–ґ–і–µ–љ–Є–Є —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –і–µ—В–µ–є –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —А–Њ—В–Њ–≤–Њ–≥–Њ –і—Л—Е–∞–љ–Є—П, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —А—П–і–Њ–Љ –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є—Е –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є. –Ґ–∞–Ї, –љ–∞–і–≥–Њ—А—В–∞–љ–љ–Є–Ї –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ –≤—Л—И–µ, —З–µ–Љ —Г –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ. –Ъ–Њ–≥–і–∞ –Љ–ї–∞–і–µ–љ–µ—Ж –≥–ї–Њ—В–∞–µ—В, –≥–Њ—А—В–∞–љ—М –њ–Њ–і–љ–Є–Љ–∞–µ—В—Б—П –≤—Л—И–µ –љ–∞–і–≥–Њ—А—В–∞–љ–љ–Є–Ї–∞ –Є –Ї–∞—Б–∞–µ—В—Б—П –љ–Њ—Б–Њ–≥–ї–Њ—В–Ї–Є, —В–µ–Љ —Б–∞–Љ—Л–Љ –≥–Њ—А—В–∞–љ—М –Ј–∞–Љ—Л–Ї–∞–µ—В—Б—П –Љ–µ–ґ–і—Г –Љ—П–≥–Ї–Є–Љ –љ–µ–±–Њ–Љ –Є —Б—В–µ–љ–Ї–Њ–є –љ–Њ—Б–Њ–≥–ї–Њ—В–Ї–Є. –Т–Њ –≤—А–µ–Љ—П –≤–і–Њ—Е–∞ —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ —Б–Њ–Ј–і–∞–µ—В—Б—П –≤–∞–Ї—Г—Г–Љ, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –Љ—П–≥–Ї–Є–µ —В–Ї–∞–љ–Є –і–љ–∞ –њ–Њ–ї–Њ—Б—В–Є —А—В–∞ –њ–µ—А–µ–Љ–µ—Й–∞—О—В—Б—П –≤–≤–µ—А—Е –Є –љ–∞–Ј–∞–і –Ї –Љ—П–≥–Ї–Њ–Љ—Г –љ–µ–±—Г. –Т–Њ –≤—А–µ–Љ—П –≤—Л–і–Њ—Е–∞ –і–∞–≤–ї–µ–љ–Є–µ –≤ –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В—П—Е –Ј–∞—Б—В–∞–≤–ї—П–µ—В –Љ—П–≥–Ї–Њ–µ –љ–µ–±–Њ –≤—Л–і–≤–Є–≥–∞—В—М—Б—П –≤–њ–µ—А–µ–і –Ї –Љ—П–≥–Ї–Є–Љ —В–Ї–∞–љ—П–Љ –Є —П–Ј—Л–Ї—Г, —В–∞–Ї–ґ–µ –Њ–±—В—Г—А–Є—А—Г—П –і—Л—Е–∞—В–µ–ї—М–љ—Л–µ –њ—Г—В–Є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і—Л—Е–∞—В–µ–ї—М–љ—Л–є –њ—А–Њ—Б–≤–µ—В —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ –љ–µ–Є–Ј–Љ–µ–љ–љ–Њ –±–ї–Њ–Ї–Є—А—Г–µ—В—Б—П –њ—А–Є –љ–Њ—Б–Њ–≤–Њ–Љ –і—Л—Е–∞–љ–Є–Є. –Ф—Л—Е–∞–љ–Є–µ –Љ–ї–∞–і–µ–љ—Ж–∞ —З–µ—А–µ–Ј —А–Њ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —В–Њ–ї—М–Ї–Њ –≤–Њ –≤—А–µ–Љ—П –њ–ї–∞—З–∞. –£–Љ–µ–љ—М—И–µ–љ–Є–µ –њ—А–Њ—Б–≤–µ—В–∞ –і—Л—Е–∞—В–µ–ї—М–љ–Њ–≥–Њ –њ—Г—В–Є —З–µ—А–µ–Ј –љ–Њ—Б –љ–∞ –Њ–і–љ—Г —В—А–µ—В—М —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ –љ–Њ—Б–Њ–≤—Л—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –≤ 8 —А–∞–Ј, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–µ—А—М–µ–Ј–љ—Л–Љ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–Љ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞–Љ —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е [3].
–Я—А–Є –і–≤—Г—Б—В–Њ—А–Њ–љ–љ–µ–є –Р–• –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л–є –љ—Г–ґ–і–∞–µ—В—Б—П –≤ —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Њ–љ–љ—Л—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П—Е (–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–∞—П –≤–µ–љ—В–Є–ї—П—Ж–Є—П –ї–µ–≥–Ї–Є—Е, —В—А–∞—Е–µ–Њ—Б—В–Њ–Љ–Є—П, —Н–Ї—Б—В—А–µ–љ–љ–∞—П —Е–Њ–∞–љ–Њ—В–Њ–Љ–Є—П), –њ—А–Є –Њ—В—Б—А–Њ—З–Ї–µ –Ї–Њ—В–Њ—А—Л—Е –Ј–і–Њ—А–Њ–≤—Л–µ –і–Њ–љ–Њ—И–µ–љ–љ—Л–µ –і–µ—В–Є –Љ–Њ–≥—Г—В –њ–Њ–ї—Г—З–Є—В—М —Б–µ—А—М–µ–Ј–љ—Л–µ –≥–Є–њ–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –≤–Њ–Ј–Љ–Њ–ґ–µ–љ –Є –ї–µ—В–∞–ї—М–љ—Л–є –Є—Б—Е–Њ–і. –Т —А—П–і–µ —Б–ї—Г—З–∞–µ–≤, –Ї–∞–Ї –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ—А–∞–Ї—В–Є–Ї–∞, –≤—Б—В—А–µ—З–∞—О—В—Б—П –Є—Б–Ї–ї—О—З–µ–љ–Є—П, –Ї–Њ–≥–і–∞ —А–µ–±–µ–љ–Њ–Ї —Б —А–Њ–ґ–і–µ–љ–Є—П –Љ–Њ–ґ–µ—В –і—Л—И–∞—В—М —А—В–Њ–Љ, –љ–Њ –њ—А–Є —Н—В–Њ–Љ –њ–Є—В–∞–љ–Є–µ –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ. –Ф–ї—П –Є—Б–Ї–ї—О—З–µ–љ–Є—П –∞–њ–љ–Њ—Н —А–Њ–і–Є—В–µ–ї–Є —З–∞—Б—В–Њ —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Б–њ–Њ—Б–Њ–±–∞–Љ–Є —Д–Є–Ї—Б–Є—А—Г—О—В –љ–Є–ґ–љ—О—О —З–µ–ї—О—Б—В—М –њ–ї–∞—Б—В—Л—А–µ–Љ, —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В –≤–Њ–Ј–і—Г—Е–Њ–≤–Њ–і—Л (—А–Є—Б. 1), —А–∞–Ј–ї–Є—З–љ—Л–µ –њ—А–Є—Б–њ–Њ—Б–Њ–±–ї–µ–љ–Є—П –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П –Ј–∞–њ–∞–і–µ–љ–Є—П —П–Ј—Л–Ї–∞. –Ф–∞–љ–љ—Л–µ –Љ–µ—А—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В –Є–Ј–±–µ–ґ–∞—В—М –∞—Б—Д–Є–Ї—Б–Є–Є, –љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –љ–∞—А—Г—И–∞—О—В –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є —А–µ–±–µ–љ–Ї–∞ –Є –Є–Љ–µ—О—В –≤—Л—Б–Њ–Ї–Є–µ —А–Є—Б–Ї–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –њ–Њ—Н—В–Њ–Љ—Г –Љ–Њ–≥—Г—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –ї–Є—И—М –Ї–∞–Ї –≤—А–µ–Љ–µ–љ–љ–∞—П –Љ–µ—А–∞.

–Я—А–Є –Њ–і–љ–Њ—Б—В–Њ—А–Њ–љ–љ–µ–є –Р–• —В–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –Ј–∞—В—А—Г–і–љ–µ–љ–Є–µ –љ–Њ—Б–Њ–≤–Њ–≥–Њ –і—Л—Е–∞–љ–Є—П, –Њ–і–љ–∞–Ї–Њ –њ—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є—Е –≤–∞—А–Є–∞–љ—В–∞—Е –љ–Њ—Б–Њ–≤–Њ–µ –і—Л—Е–∞–љ–Є–µ –Љ–Њ–ґ–µ—В —Б–Њ—Е—А–∞–љ—П—В—М—Б—П –Ї–∞–Ї–Њ–µ-—В–Њ –≤—А–µ–Љ—П. –Ъ–Њ–≥–і–∞ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л–є –Ј–∞—Б—Л–њ–∞–µ—В, —А–Њ—В–Њ–≤–Њ–µ –Њ—В–≤–µ—А—Б—В–Є–µ —Б–Љ—Л–Ї–∞–µ—В—Б—П. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Б—В—А–Є–і–Њ—А вАФ –Ј–∞—В—А—Г–і–љ–µ–љ–љ–Њ–µ —Г—З–∞—Й–µ–љ–љ–Њ–µ –і—Л—Е–∞–љ–Є–µ, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–µ–µ—Б—П —Ж–Є–∞–љ–Њ–Ј–Њ–Љ –Ї–Њ–ґ–љ—Л—Е –њ–Њ–Ї—А–Њ–≤–Њ–≤. –Э–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л–є –љ–µ–Ј–∞–Љ–µ–і–ї–Є—В–µ–ї—М–љ–Њ –њ—А–Њ—Б—Л–њ–∞–µ—В—Б—П, –њ–Њ—П–≤–ї—П–µ—В—Б—П –њ–ї–∞—З, –і—Л—Е–∞–љ–Є–µ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –±–Њ–ї–µ–µ —Б–≤–Њ–±–Њ–і–љ—Л–Љ, —Ж–Є–∞–љ–Њ—В–Є—З–љ–∞—П –Њ–Ї—А–∞—Б–Ї–∞ –Ї–Њ–ґ–Є –Є—Б—З–µ–Ј–∞–µ—В. –Ґ–∞–Ї–Њ–є —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –Љ–Њ–ґ–µ—В –њ—А–Њ–і–Њ–ї–ґ–∞—В—М—Б—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —З–∞—Б–Њ–≤. –Р–• —В–∞–Ї–ґ–µ –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ—Г –≥—А—Г–і–љ–Њ–Љ—Г –≤—Б–Ї–∞—А–Љ–ї–Є–≤–∞–љ–Є—О –≤–≤–Є–і—Г –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –і—Л—Е–∞–љ–Є—П, —Б–Њ—Б–∞–љ–Є—П –Є –≥–ї–Њ—В–∞–љ–Є—П. –Я–Њ—П–≤–ї—П—О—В—Б—П —Б–Є–Љ–њ—В–Њ–Љ—Л: –Њ—В—А—Л–ґ–Ї–∞, —Б–Ї–ї–Њ–љ–љ–Њ—Б—В—М –Ї –њ–Њ–њ–µ—А—Е–Є–≤–∞–љ–Є—О. –°—А–µ–і–Є –і—А—Г–≥–Є—Е –≤–∞–ґ–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Р–• –Љ–Њ–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М —В–∞–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л, –Ї–∞–Ї: –Њ—В—Б—В–∞–≤–∞–љ–Є–µ –≤ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є–Є; —Ж–Є–∞–љ–Њ–Ј –ї–Є—Ж–µ–≤–Њ–є –Ј–Њ–љ—Л, –Ї–Њ–љ—З–Є–Ї–Њ–≤ –њ–∞–ї—М—Ж–µ–≤, –љ–Њ—Б–∞, —Г—И–µ–є; –Њ–±—Й–∞—П –±–ї–µ–і–љ–Њ—Б—В—М –Ї–Њ–ґ–Є; –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є–µ –≤—Л–і–µ–ї–µ–љ–Є—П –Є–Ј –љ–Њ—Б–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є —Б–ї–Є–Ј–Є—Б—В–Њ–≥–Њ –Є–ї–Є –≥–љ–Њ–є–љ–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞; –њ–µ—А–Є–Њ–і—Л –≤—Л—Б–Њ–Ї–Њ–≥–Њ –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є—П, —Б–Љ–µ–љ—П–µ–Љ—Л–µ –њ–µ—А–Є–Њ–і–∞–Љ–Є –≤—П–ї–Њ—Б—В–Є; –Њ—В—Б—В–∞–≤–∞–љ–Є–µ –≤ –њ—Б–Є—Е–Є—З–µ—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є–Є; –∞–љ–µ–Љ–Є—П. –Х—Б–ї–Є –Ї –Р–• –њ—А–Є—Б–Њ–µ–і–Є–љ—П–µ—В—Б—П –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–∞—П —Б–Њ—Б—В–∞–≤–ї—П—О—Й–∞—П, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —А–∞–Ј–≤–Є—В–Є–µ —В–µ—Е –Є–ї–Є –Є–љ—Л—Е —Д–Њ—А–Љ —А–Є–љ–Є—В–∞, –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—В–і–µ–ї–∞—Е —Г—Е–∞. –Х—Б–ї–Є –∞—В—А–µ–Ј–Є—П —Е–Њ–∞–љ –љ–Њ—Б–Є—В –Њ–і–љ–Њ—Б—В–Њ—А–Њ–љ–љ–Є–є —Е–∞—А–∞–Ї—В–µ—А, —В–Њ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –і—Л—Е–∞—В–µ–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –љ–µ —В–∞–Ї –Ј–∞–Љ–µ—В–љ–∞. –Ю–љ–∞ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –ї–Є—И—М –њ—А–Є –љ–∞–≥—А—Г–Ј–Ї–∞—Е –Є –≤–Њ –≤—А–µ–Љ—П —Б–љ–∞. –Ю–і–љ–Њ—Б—В–Њ—А–Њ–љ–љ—П—П –Р–• —З–∞—Б—В–Њ –і–∞–µ—В –Њ —Б–µ–±–µ –Ј–љ–∞—В—М –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –љ–Њ—Б–Њ–≥–ї–Њ—В–Ї–Є, –±—А–Њ–љ—Е–Є—В–∞–Љ–Є, —Б–Є–љ—Г—Б–Є—В–∞–Љ–Є. –Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ–Њ–њ—Л—В–Ї–Є –ї–µ—З–µ–љ–Є—П —В–∞–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –љ–µ –њ—А–Є–љ–Њ—Б—П—В —А–µ–Ј—Г–ї—М—В–∞—В–∞ [4].
–Ы–µ—З–µ–љ–Є–µ –Р–•
–Ю—Б–љ–Њ–≤–љ–Њ–є —Б–њ–Њ—Б–Њ–± –ї–µ—З–µ–љ–Є—П –Р–• —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–є, –µ–≥–Њ —Ж–µ–ї—М—О —П–≤–ї—П–µ—В—Б—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Б–Њ–Њ–±—Й–µ–љ–Є—П –ї–µ–≤–Њ–є, –њ—А–∞–≤–Њ–є –Є–ї–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Њ–±–µ–Є—Е –њ–Њ–ї–Њ–≤–Є–љ –љ–Њ—Б–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є —Б –љ–Њ—Б–Њ–≥–ї–Њ—В–Ї–Њ–є. –Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –љ–µ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–њ–Њ—Б–Њ–±–∞ –ї–µ—З–µ–љ–Є—П –Р–•, –≥–∞—А–∞–љ—В–Є—А—Г—О—Й–µ–≥–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —А–µ—Ж–Є–і–Є–≤–∞ [5]. –Ю—Б–љ–Њ–≤–љ–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –≤ –љ–∞—И–µ–є —А–∞–±–Њ—В–µ –±—Г–і–µ—В —Г–і–µ–ї–µ–љ–Њ —Н–љ–і–Њ–љ–∞–Ј–∞–ї—М–љ–Њ–Љ—Г –і–Њ—Б—В—Г–њ—Г, —В–∞–Ї –Ї–∞–Ї –і–∞–љ–љ—Л–є –Љ–µ—В–Њ–і —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–Љ–µ–љ–µ–µ —В—А–∞–≤–Љ–∞—В–Є—З–љ—Л–Љ, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–µ–є –Є, –љ–∞ –љ–∞—И –≤–Ј–≥–ї—П–і, –њ–Њ–ї–љ–Њ—Б—В—М—О –Ј–∞–Љ–µ–љ—П–µ—В —В—А–∞–≤–Љ–∞—В–Є—З–љ—Л–µ –і–Њ—Б—В—Г–њ—Л (—В—А–∞–љ—Б–њ–∞–ї–∞—В–Є–љ–љ—Л–є, —В—А–∞–љ—Б–Љ–∞–Ї—Б–Є–ї–ї—П—А–љ—Л–є) [6].
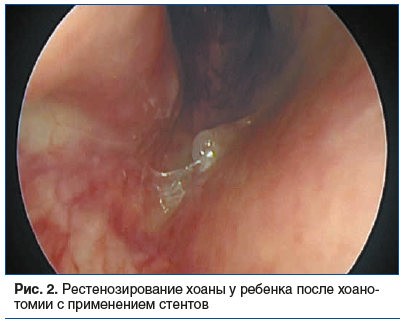
–•–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ –Р–• –Є–Ј–≤–µ—Б—В–љ–Њ –±–Њ–ї–µ–µ 200 –ї–µ—В, –њ–µ—А–≤–Њ–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ –Њ–њ–Є—Б–∞–љ–Є–µ —Е–Њ–∞–љ–Њ–њ–ї–∞—Б—В–Є–Ї–Є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Б—В–µ–љ—В–Њ–≤ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї 1930 –≥. –Ф–∞–ї–µ–µ —А—П–і–Њ–Љ –∞–≤—В–Њ—А–Њ–≤ –±—Л–ї–Є –њ—А–µ–і–ї–Њ–ґ–µ–љ—Л —А–∞–Ј–ї–Є—З–љ—Л–µ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –і–∞–љ–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–Є, –∞ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є–є –њ–Њ–і—Е–Њ–і –≤–њ–µ—А–≤—Л–µ –±—Л–ї –њ—А–µ–і–ї–Њ–ґ–µ–љ –≤ 1990 –≥. –Я–Њ–Ј–ґ–µ –±—Л–ї–Є –њ—А–µ–і–ї–Њ–ґ–µ–љ—Л —А–∞–Ј–ї–Є—З–љ—Л–µ –≤–∞—А–Є–∞–љ—В—Л —Б—В–µ–љ—В–Њ–≤, —Г—Б—В–∞–љ–Њ–≤–Ї—Г –Ї–Њ—В–Њ—А—Л—Е –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—О—В –≤—Б–µ –Њ–њ–Є—Б–∞–љ–љ—Л–µ –Љ–µ—В–Њ–і–Є–Ї–Є [6]. –Ъ—А–∞—В–Ї–∞—П —Б—Г—В—М –Љ–µ—В–Њ–і–∞: —Г–і–∞–ї—П—О—В—Б—П –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б—В—А—Г–Ї—В—Г—А—Л –Љ–µ–Љ–±—А–∞–љ–Њ–Ј–љ–Њ–≥–Њ –Є–ї–Є –Ї–Њ—Б—В–љ–Њ–≥–Њ —В–Є–њ–Њ–≤; –і–ї—П –Є—Б–Ї–ї—О—З–µ–љ–Є—П –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ —Б—В–µ–љ–Њ–Ј–∞ –≤ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Г—О —А–∞–љ—Г –њ–Њ–Љ–µ—Й–∞–µ—В—Б—П —Б—В–µ–љ—В. –Я–Њ—Б–ї–µ–і–љ–Є–є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –Њ—Б–Њ–±—Г—О —В—А—Г–±–Ї—Г, –љ–µ –њ–Њ–Ј–≤–Њ–ї—П—О—Й—Г—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—П–Љ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є —А–∞–љ—Л –Ї–Њ–љ—В–∞–Ї—В–Є—А–Њ–≤–∞—В—М, —В–µ–Љ —Б–∞–Љ—Л–Љ –Є—Б–Ї–ї—О—З–∞–µ—В—Б—П –њ–Њ—П–≤–ї–µ–љ–Є–µ —А—Г–±—Ж–Њ–≤1. –Э–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–µ –љ–∞—Е–Њ–ґ–і–µ–љ–Є–µ —Б—В–µ–љ—В–∞ –≤ –љ–Њ—Б–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є (—З–∞—Б—В–Њ —Б–≤—Л—И–µ 5вАУ6 –Љ–µ—Б.) –≤—Л–Ј—Л–≤–∞–µ—В –і–Є—Б–Ї–Њ–Љ—Д–Њ—А—В —Г —А–µ–±–µ–љ–Ї–∞, —В—А–∞–≤–Љ–Є—А—Г–µ—В –њ–Њ–і–ї–µ–ґ–∞—Й—Г—О —Б–ї–Є–Ј–Є—Б—В—Г—О –њ–Њ–ї–Њ—Б—В–Є –љ–Њ—Б–∞, –≤—Л–Ј—Л–≤–∞—П –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ, –њ–Њ–≤—Л—И–µ–љ–љ–Њ–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –≥—А–∞–љ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–є —В–Ї–∞–љ–Є, –њ—А–Њ–ї–µ–ґ–љ–µ–є. –Ґ–∞–Ї–∞—П —Б–Є—В—Г–∞—Ж–Є—П –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї —А–µ—Б—В–µ–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П (—А–Є—Б. 2) –њ–Њ—Б–ї–µ –Є–Ј–≤–ї–µ—З–µ–љ–Є—П —Б—В–µ–љ—В–∞ [7]. –Э–µ—А–µ–і–Ї–Њ –њ–Њ—Б–ї–µ —Г–і–∞–ї–µ–љ–Є—П —В—А—Г–±–Ї–Є-—Б—В–µ–љ—В–∞ —Е–Њ–∞–љ–∞ –≤–љ–Њ–≤—М —Б—А–∞—Б—В–∞–µ—В—Б—П –Є —В—А–µ–±—Г–µ—В—Б—П –њ–Њ–≤—В–Њ—А–љ–Њ–µ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ.
–Ф–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –≤ –Њ—В–Њ—А–Є–љ–Њ–ї–∞—А–Є–љ–≥–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ —Б–Њ–Њ–±—Й–µ—Б—В–≤–µ –≤–µ–і–µ—В—Б—П –і–Є—Б–Ї—Г—Б—Б–Є—П –њ–Њ –њ–Њ–≤–Њ–і—Г –Њ—В–Ї–∞–Ј–∞ –Њ—В —Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є—П —Б —Ж–µ–ї—М—О —Г–ї—Г—З—И–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є —А–µ–±–µ–љ–Ї–∞ –Є –Љ–Є–љ–Є–Љ–Є–Ј–∞—Ж–Є–Є —А–Є—Б–Ї–Њ–≤ —А–µ—Б—В–µ–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П, —А–∞–љ–µ–µ –љ–∞–Љ–Є –±—Л–ї –њ—А–µ–і–ї–Њ–ґ–µ–љ –Є —Г—Б–њ–µ—И–љ–Њ –∞–њ—А–Њ–±–Є—А–Њ–≤–∞–љ –Љ–µ—В–Њ–і —Е–Њ–∞–љ–Њ–њ–ї–∞—Б—В–Є–Ї–Є —Б —Д–Є–Ї—Б–∞—Ж–Є–µ–є –ї–Њ—Б–Ї—Г—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –±–∞–ї–ї–Њ–љ–Њ–Љ –ѓ–Ь–Ш–Ъ –±–µ–Ј –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Б—В–µ–љ—В–Њ–≤ (—А–Є—Б. 3) [8].
![–†–Є—Б. 3. –§–Є–Ї—Б–∞—Ж–Є—П –≤–µ—А—Е–љ–µ–≥–Њ –Є –љ–Є–ґ–љ–µ–≥–Њ —Б–µ–њ—В–∞–ї—М–љ—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤ –±–∞–ї–ї–Њ–љ–Њ–Љ –≤ —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –∞–њ–µ—А—В—Г—А–µ —Е–Њ–∞–љ—Л [8] –†–Є—Б. 3. –§–Є–Ї—Б–∞—Ж–Є—П –≤–µ—А—Е–љ–µ–≥–Њ –Є –љ–Є–ґ–љ–µ–≥–Њ —Б–µ–њ—В–∞–ї—М–љ—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤ –±–∞–ї–ї–Њ–љ–Њ–Љ –≤ —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –∞–њ–µ—А—В—Г—А–µ —Е–Њ–∞–љ—Л [8]](/upload/medialibrary/871/ukqux7n1vey4wdsx8lo3tb4go5m7hf3j/52-3.png)
–° —Ж–µ–ї—М—О –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –∞–љ–∞—В–Њ–Љ–Є–Є —Е–Њ–∞–љ —Г–і–∞–ї—П–µ—В—Б—П –і–Є—Б—В–∞–ї—М–љ—Л–є –Ї–Њ–љ–µ—Ж —Б–Њ—И–љ–Є–Ї–∞, —В–µ–Љ —Б–∞–Љ—Л–Љ –њ–Њ–і–≥–Њ—В–∞–≤–ї–Є–≤–∞—О—В—Б—П —Б–ї–Є–Ј–Є—Б—В—Л–µ –ї–Њ—Б–Ї—Г—В—Л —Б –Ј–∞–і–љ–µ–є —З–∞—Б—В–Є –љ–Њ—Б–Њ–≤–Њ–є –њ–µ—А–µ–≥–Њ—А–Њ–і–Ї–Є. –≠—В–Є –ї–Њ—Б–Ї—Г—В—Л —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –њ–Њ–Љ–µ—Й–∞—О—В—Б—П –љ–∞ –љ–Є–ґ–љ—О—О –Є –≤–µ—А—Е–љ—О—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –љ–Њ—Б–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є (–љ–Є–ґ–љ–Є–є –Є –≤–µ—А—Е–љ–Є–є –ї–Њ—Б–Ї—Г—В—Л —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –Т –њ–Њ–ї—Г—З–Є–≤—И—Г—О—Б—П –љ–µ–Њ—Е–Њ–∞–љ—Г –њ–Њ–Љ–µ—Й–∞–µ—В—Б—П –±–∞–ї–ї–Њ–љ-–Ї–∞—В–µ—В–µ—А –ѓ–Ь–Ш–Ъ, –Љ–Њ–ґ–µ—В —В–∞–Ї–ґ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –Ї–∞—В–µ—В–µ—А –§–Њ–ї–µ—П. –С–∞–ї–ї–Њ–љ —А–∞–Ј–і—Г–≤–∞—О—В —Б –њ–Њ–Љ–Њ—Й—М—О —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞, –љ–∞—А—Г–ґ–љ–∞—П —З–∞—Б—В—М –±–∞–ї–ї–Њ–љ–∞ —Д–Є–Ї—Б–Є—А—Г–µ—В—Б—П –њ–ї–∞—Б—В—Л—А–µ–Љ –Ї —Й–µ–Ї–µ. –Т –љ–Њ—Б–Њ–≤—Л–µ —Е–Њ–і—Л —В–∞–Ї–ґ–µ —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В—Б—П —Б–≤–Њ–±–Њ–і–љ–Њ —А–∞—Б—И–Є—А—П—О—Й–Є–µ—Б—П –Ї—А–Њ–≤–Њ–Њ—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—Й–Є–µ —В–∞–Љ–њ–Њ–љ—Л (–њ–∞—В–µ–љ—В –љ–∞ –Є–Ј–Њ–±—А–µ—В–µ–љ–Є–µ вДЦ 2674876) [9]. –С–∞–ї–ї–Њ–љ-–Ї–∞—В–µ—В–µ—А –ѓ–Ь–Ш–Ъ –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –љ–µ–Њ—Е–Њ–∞–љ–µ –≤ —В–µ—З–µ–љ–Є–µ 4вАУ5 —Б—Г—В, –Ј–∞—В–µ–Љ –Њ–љ –њ–Њ–і–ї–µ–ґ–Є—В —Г–і–∞–ї–µ–љ–Є—О. –Ф–∞–љ–љ–∞—П –Љ–µ—В–Њ–і–Є–Ї–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ–±–µ—Б–њ–µ—З–Є—В—М —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є—О —А–µ–±–µ–љ–Ї–∞ –±–µ–Ј –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Б—В–µ–љ—В–Њ–≤, –±–ї–∞–≥–Њ–і–∞—А—П —З–µ–Љ—Г —А–µ–±–µ–љ–Њ–Ї –Љ–Њ–ґ–µ—В —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –і—Л—И–∞—В—М –љ–Њ—Б–Њ–Љ —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ —Г–і–∞–ї–µ–љ–Є—П –±–∞–ї–ї–Њ–љ–∞.
–Х–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ –і–∞–љ–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–Є —П–≤–ї—П–µ—В—Б—П —В–Њ, —З—В–Њ –љ–∞ –≤—А–µ–Љ—П –љ–Њ—И–µ–љ–Є—П –±–∞–ї–ї–Њ–љ–∞ –Є —В–∞–Љ–њ–Њ–љ–Њ–≤ –њ–∞—Ж–Є–µ–љ—В –љ–µ –Љ–Њ–ґ–µ—В –і—Л—И–∞—В—М –љ–Њ—Б–Њ–Љ, —В–∞–Ї –Ї–∞–Ї –њ–Њ–ї–Њ—Б—В—М –љ–Њ—Б–∞ –њ–Њ–ї–љ–Њ—Б—В—М—О –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–∞. –Т–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–≥–Њ –і—Л—Е–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –њ–µ—А–≤—Л–µ –і–љ–Є –њ–Њ—Б–ї–µ —А–Њ–ґ–і–µ–љ–Є—П, —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ –∞—Б–њ–µ–Ї—В–Њ–Љ –Ј–і–Њ—А–Њ–≤—М—П —А–µ–±–µ–љ–Ї–∞.
–Э–∞–Љ–Є –±—Л–ї –њ—А–µ–і–ї–Њ–ґ–µ–љ –Є –∞–њ—А–Њ–±–Є—А–Њ–≤–∞–љ –±–µ—Б—Б—В–µ–љ—В–Њ–≤—Л–є –Љ–µ—В–Њ–і —Е–Њ–∞–љ–Њ–њ–ї–∞—Б—В–Є–Ї–Є, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –ї–Њ—Б–Ї—Г—В—Л —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–Є—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —Д–Є–±—А–Є–љ–Њ–≤–Њ–≥–Њ –Ї–ї–µ—П. –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –і–∞–љ–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ —П–≤–ї—П–µ—В—Б—П –Ї–ї–µ–µ–≤–∞—П —Д–Є–Ї—Б–∞—Ж–Є—П —Б–ї–Є–Ј–Є—Б—В—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤, –њ—А–Є —Н—В–Њ–Љ –љ–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –≤ —Г—Б—В–∞–љ–Њ–≤–Ї–µ —Б—В–µ–љ—В–∞ –Є–ї–Є —В–∞–Љ–њ–Њ–љ–Њ–≤ –≤ –њ–Њ–ї–Њ—Б—В—М –љ–Њ—Б–∞. –°—А–∞–Ј—Г –ґ–µ –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є —А–µ–±–µ–љ–Њ–Ї –Љ–Њ–ґ–µ—В –і—Л—И–∞—В—М –љ–Њ—Б–Њ–Љ, —З—В–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ –і–ї—П –і–µ—В–µ–є –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ –ґ–Є–Ј–љ–Є.
–Ю–њ–Є—Б–∞–љ–љ—Л–є —Б–њ–Њ—Б–Њ–± —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –Р–• —А–∞–Ј—А–∞–±–Њ—В–∞–љ –і–ї—П —В–Њ–≥–Њ, —З—В–Њ–±—Л –Є—Б–Ї–ї—О—З–Є—В—М –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –љ–Њ—И–µ–љ–Є—П —Б—В–µ–љ—В–∞/—В—А—Г–±–Ї–Є –Є –Ї–∞–Ї–Є—Е-–ї–Є–±–Њ —В–∞–Љ–њ–Њ–љ–Њ–≤ –≤ –њ–Њ–ї–Њ—Б—В–Є –љ–Њ—Б–∞ –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є, –Њ–љ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л–њ–Њ–ї–љ—П—В—М —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –≤ –љ–µ–Њ–љ–∞—В–∞–ї—М–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ, –Є —А–µ–±–µ–љ–Њ–Ї –Љ–Њ–ґ–µ—В –і—Л—И–∞—В—М –љ–Њ—Б–Њ–Љ —Г–ґ–µ –≤ –њ–µ—А–≤—Л–µ —З–∞—Б—Л –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є.
–°–Њ–±—Б—В–≤–µ–љ–љ—Л–є –Њ–њ—Л—В –≤–µ–і–µ–љ–Є—П –і–µ—В–µ–є —Б –Р–•
–Ч–∞ –њ–µ—А–Є–Њ–і —Б 2018 –њ–Њ 2023 –≥. –Ї–Њ–ї–ї–µ–Ї—В–Є–≤–Њ–Љ –∞–≤—В–Њ—А–Њ–≤ –≤ –Ы–Ю–†-–Њ—В–і–µ–ї–µ–љ–Є–Є –Ш–љ—Б—В–Є—В—Г—В–∞ –Т–µ–ї—М—В–Є—Й–µ–≤–∞ –±—Л–ї–Њ –њ—А–Њ–Ї–Њ–љ—Б—Г–ї—М—В–Є—А–Њ–≤–∞–љ–Њ —Б–≤—Л—И–µ 60 –і–µ—В–µ–є —Б –Р–• (–Є–Ј –љ–Є—Е 17 –і–µ—В–µ–є —Б –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ—Л–Љ CHARGE-—Б–Є–љ–і—А–Њ–Љ–Њ–Љ), –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Њ 55 —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤. –Ш—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–∞—П —А–∞–±–Њ—В–∞ [11] –≤–µ–ї–∞—Б—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є 31 —А–µ–±–µ–љ–Ї–∞ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ 1 –≥–Њ–і–∞ (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 7,5 –Љ–µ—Б.): 19 (61,3%) –і–µ–≤–Њ—З–µ–Ї –Є 12 (38,7%) –Љ–∞–ї—М—З–Є–Ї–Њ–≤, –Њ–њ–µ—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤ –њ–µ—А–Є–Њ–і —Б 2019 –њ–Њ 2023 –≥. (–Ј–∞–Ї–Њ–љ–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–Є –≤—Б–µ—Е –і–µ—В–µ–є –њ–Њ–і–њ–Є—Б–∞–ї–Є –і–Њ–±—А–Њ–≤–Њ–ї—М–љ–Њ–µ –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ –љ–∞ –њ—Г–±–ї–Є–Ї–∞—Ж–Є—О —Д–Њ—В–Њ–≥—А–∞—Д–Є–є –≤ –Њ–±–µ–Ј–ї–Є—З–µ–љ–љ–Њ–Љ –≤–Є–і–µ). –Ю–і–љ–Њ—Б—В–Њ—А–Њ–љ–љ—П—П –Р–• –±—Л–ї–∞ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–∞ —Г 16 (51,6%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (–Є–Ј –љ–Є—Е –њ—А–∞–≤–Њ—Б—В–Њ—А–Њ–љ–љ—П—П вАФ —Г 13, –ї–µ–≤–Њ—Б—В–Њ—А–Њ–љ–љ—П—П вАФ —Г 3 –і–µ—В–µ–є), –і–≤—Г—Б—В–Њ—А–Њ–љ–љ—П—П –Р–• вАФ —Г 15 (48,4%) –і–µ—В–µ–є.
–Ш–Ј 31 —А–µ–±–µ–љ–Ї–∞ 9 (29,1%) –і–µ—В—П–Љ, –њ–Њ—Б—В—Г–њ–Є–≤—И–Є–Љ –њ–µ—А–≤–Є—З–љ–Њ –Є–ї–Є —Б —А–µ—Ж–Є–і–Є–≤–Њ–Љ –њ–Њ—Б–ї–µ –њ–µ—А–≤–Є—З–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є, –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–∞—П –±–µ—Б—Б—В–µ–љ—В–Њ–≤–∞—П —Е–Њ–∞–љ–Њ–њ–ї–∞—Б—В–Є–Ї–∞ —Б —Д–Є–Ї—Б–∞—Ж–Є–µ–є –ї–Њ—Б–Ї—Г—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –±–∞–ї–ї–Њ–љ–Њ–Љ, 22 (70,9%) –і–µ—В—П–Љ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–∞—П –±–µ—Б—Б—В–µ–љ—В–Њ–≤–∞—П —Е–Њ–∞–љ–Њ–њ–ї–∞—Б—В–Є–Ї–∞ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–µ—В–Њ–і–∞ —Д–Є–Ї—Б–∞—Ж–Є–Є –ї–Њ—Б–Ї—Г—В–Њ–≤ –≤ —Е–Њ–∞–љ–µ —Д–Є–±—А–Є–љ–Њ–≤—Л–Љ –Ї–ї–µ–µ–Љ. –Ф–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Р–• –Ї–∞–ґ–і—Л–є –њ–∞—Ж–Є–µ–љ—В –њ–Њ–і–≤–µ—А–≥—Б—П —Б—В–∞–љ–і–∞—А—В–љ–Њ–Љ—Г –Ы–Ю–†-–Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—О, –≤–Ї–ї—О—З–∞–≤—И–µ–Љ—Г —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—О –њ–Њ–ї–Њ—Б—В–Є –љ–Њ—Б–∞, –Ъ–Ґ –љ–Њ—Б–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є —Б–Є–љ—Г—Б–Њ–≤. –Т —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є–Є –љ–µ–≤—А–Њ–ї–Њ–≥–∞, –љ–µ–Њ–љ–∞—В–Њ–ї–Њ–≥–∞, –Њ–Ї—Г–ї–Є—Б—В–∞, –≥–µ–љ–µ—В–Є–Ї–∞.
–Т 2023 –≥. –∞–≤—В–Њ—А—Л –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–∞—В–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –±–Њ–ї—М—И–µ–є —З–∞—Б—В–Є –і–µ—В–µ–є, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ [10]. –Я–Њ –і–∞–љ–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—Б–Љ–Њ—В—А–∞, —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –і–µ—В–µ–є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є–ї–∞—Б—М —Д—Г–љ–Ї—Ж–Є—П –љ–Њ—Б–Њ–≤–Њ–≥–Њ –і—Л—Е–∞–љ–Є—П, –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є —Б–Є–Љ–њ—В–Њ–Љ—Л –љ–∞–Ј–∞–ї—М–љ–Њ–є –Њ–±—Б—В—А—Г–Ї—Ж–Є–Є.
–Ю–і–љ–∞–Ї–Њ –і–ї—П –Њ–±—К–µ–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Є —Б—А–∞–≤–љ–µ–љ–Є—П –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Є–Ї –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Є—Б–Ї–ї—О—З–∞—О—Й–Є—Е —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л. –Т —Б–≤—П–Ј–Є —Б —В–µ–Љ, —З—В–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –і–µ—В–µ–є, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –њ–Њ –≤–Њ–Ј—А–∞—Б—В—Г –љ–µ –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ—Л –Љ–µ—В–Њ–і–∞–Љ–Є —А–Є–љ–Њ–Љ–∞–љ–Њ–Љ–µ—В—А–Є–Є, –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –Њ—Ж–µ–љ–Ї–Є —А–∞–Ј–Љ–µ—А–Њ–≤ —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —Е–Њ–∞–љ—Л —Б—В–∞–ї–∞ –Ъ–Ґ.
–Ъ–Њ–Љ–њ—М—О—В–µ—А–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П –њ–Њ–ї–Њ—Б—В–Є –љ–Њ—Б–∞, –Њ–Ї–Њ–ї–Њ–љ–Њ—Б–Њ–≤—Л—Е –њ–∞–Ј—Г—Е –Є –љ–Њ—Б–Њ–≥–ї–Њ—В–Ї–Є –њ—А–Њ–≤–µ–і–µ–љ–∞ –≤ –ї–µ—З–µ–±–љ–Њ-–њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е —Г—З—А–µ–ґ–і–µ–љ–Є—П—Е –њ–Њ –Љ–µ—Б—В—Г –ґ–Є—В–µ–ї—М—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–Њ –і–∞–љ–љ—Л–µ –±—Л–ї–Є —А–∞–Ј–ї–Є—З–љ—Л –њ–Њ –Ї–∞—З–µ—Б—В–≤—Г –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П. –Э–µ–Ї–Њ—В–Њ—А—Л–µ —А–Њ–і–Є—В–µ–ї–Є –Њ—В–Ї–∞–Ј—Л–≤–∞–ї–Є—Б—М –Њ—В –њ—А–Њ–≤–µ–і–µ–љ–Є—П —А–µ–±–µ–љ–Ї—Г –Ъ–Ґ –њ–Њ–і –Њ–±—Й–µ–є –∞–љ–µ—Б—В–µ–Ј–Є–µ–є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –±—Л–ї–Є –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л –і–∞–љ–љ—Л–µ –Ъ–Ґ 44 (86,3%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т –≥—А—Г–њ–њ–µ –њ–µ—А–≤–Є—З–љ–Њ–є –Р–• –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л –і–∞–љ–љ—Л–µ –Ъ–Ґ 24 (88,8%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ –≥—А—Г–њ–њ–µ —А–µ—Ж–Є–і–Є–≤–∞ –Р–• вАФ 20 (83,3%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Я–µ—А–≤—Л–Љ —Н—В–∞–њ–Њ–Љ –∞–љ–∞–ї–Є–Ј–∞ –Ъ–Ґ –Љ—Л –Њ–њ—А–µ–і–µ–ї—П–ї–Є –Љ–∞—А–Ї–Є—А–Њ–≤–Ї—Г –њ—А–∞–≤–Њ–є –Є –ї–µ–≤–Њ–є —Б—В–Њ—А–Њ–љ—Л –Є —Б–Њ–њ–Њ—Б—В–∞–≤–ї—П–ї–Є —Б —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є —А–Є–љ–Њ—Б–Ї–Њ–њ–Є–Є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—Б–Љ–Њ—В—А–∞. –Ф–∞–ї–µ–µ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –Њ—Ж–µ–љ–Ї–∞ –≤ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є, –∞–Ї—Б–Є–∞–ї—М–љ–Њ–є –Є —Б–∞–≥–Є—В—В–∞–ї—М–љ–Њ–є –њ—А–Њ–µ–Ї—Ж–Є—П—Е –Ъ–Ґ —Б –і–≤—Г—Е —Б—В–Њ—А–Њ–љ. –Я—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –љ–∞—Б –Є–љ—В–µ—А–µ—Б–Њ–≤–∞–ї–Є —А–∞–Ј–Љ–µ—А –≤–Њ–Ј–і—Г—И–љ–Њ–≥–Њ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–∞ —Е–Њ–∞–љ—Л —Б –Ї–∞–ґ–і–Њ–є —Б—В–Њ—А–Њ–љ—Л –Є —Б–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ–Є–µ –і–∞–љ–љ—Л—Е –Ъ–Ґ —Б –і–∞–љ–љ—Л–Љ–Є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—Б–Љ–Њ—В—А–∞. –†–∞–Ј–Љ–µ—А (—И–Є—А–Є–љ–∞) —Б–Њ—И–љ–Є–Ї–∞ –њ—А–Є –±–µ—Б—Б—В–µ–љ—В–Њ–≤–Њ–Љ –Љ–µ—В–Њ–і–µ –Њ–њ–µ—А–∞—Ж–Є–Є –љ–µ –Є–Љ–µ–ї –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П, —В–∞–Ї –Ї–∞–Ї —В–µ—Е–љ–Є–Ї–∞ –Њ–њ–µ—А–∞—Ж–Є–Є –Њ—Б–љ–Њ–≤–∞–љ–∞ –љ–∞ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –љ–Њ–≤–Њ–є –µ–і–Є–љ–Њ–є –љ–µ–Њ—Е–Њ–∞–љ—Л. –†–∞–Ј–Љ–µ—А—Л —Е–Њ–∞–љ –њ–Њ –і–∞–љ–љ—Л–Љ –Ъ–Ґ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ. –Ф–Є–∞–Љ–µ—В—А —Е–Њ–∞–љ—Л –±–Њ–ї–µ–µ 0,6 —Б–Љ —Б—З–Є—В–∞–ї–Є –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ (100%), –і–Є–∞–Љ–µ—В—А 0,3вАУ0,6 —Б–Љ вАФ –±–Њ–ї–µ–µ 50% –Њ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ, –і–Є–∞–Љ–µ—В—А –Љ–µ–љ–µ–µ 0,3 —Б–Љ вАФ –Љ–µ–љ–µ–µ 50% –Њ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ, –≤—Л–і–µ–ї—П–ї–Є —В–∞–Ї–ґ–µ —В–Њ—В–∞–ї—М–љ–Њ–µ –Ј–∞–Ї—А—Л—В–Є–µ —Е–Њ–∞–љ—Л.
–Э–Њ—А–Љ–∞–ї—М–љ—Л–µ —А–∞–Ј–Љ–µ—А—Л —Е–Њ–∞–љ—Л —Б–ї–µ–≤–∞ (–±–Њ–ї–µ–µ 0,6 —Б–Љ) —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–ї–Є—Б—М –≤ –≥—А—Г–њ–њ–µ –њ–µ—А–≤–Є—З–љ–Њ–є –Р–•, –≤ –≥—А—Г–њ–њ–µ —А–µ—Ж–Є–і–Є–≤–∞ вАФ –ї–Є—И—М –≤ 2 (10,0%) —Б–ї—Г—З–∞—П—Е. –Ґ–Њ—В–∞–ї—М–љ–Њ–µ –Ј–∞–Ї—А—Л—В–Є–µ —Е–Њ–∞–љ—Л —Б–ї–µ–≤–∞ —В–∞–Ї–ґ–µ —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–ї–Њ—Б—М –≤ –≥—А—Г–њ–њ–µ –њ–µ—А–≤–Є—З–љ–Њ–є –Р–•. –†–∞–Ј–Љ–µ—А—Л —Е–Њ–∞–љ –±–Њ–ї–µ–µ 50% –Њ—В –љ–Њ—А–Љ—Л –Є–ї–Є –Љ–µ–љ–µ–µ 50% –Њ—В –љ–Њ—А–Љ—Л —Б–ї–µ–≤–∞ —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–ї–Є—Б—М –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ—Ж–Є–і–Є–≤–Њ–Љ.
–Э–Њ—А–Љ–∞–ї—М–љ—Л–µ —А–∞–Ј–Љ–µ—А—Л (–±–Њ–ї–µ–µ 0,6 —Б–Љ) —Е–Њ–∞–љ—Л —Б–њ—А–∞–≤–∞ —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–ї–Є—Б—М –≤ –≥—А—Г–њ–њ–µ –њ–µ—А–≤–Є—З–љ–Њ–є –Р–•, –Ї–∞–Ї –Є —В–Њ—В–∞–ї—М–љ–Њ–µ –Ј–∞–Ї—А—Л—В–Є–µ —Е–Њ–∞–љ—Л —Б–њ—А–∞–≤–∞. –†–∞–Ј–Љ–µ—А—Л —Е–Њ–∞–љ –±–Њ–ї–µ–µ 50% –Њ—В –љ–Њ—А–Љ—Л –Є–ї–Є –Љ–µ–љ–µ–µ 50% –Њ—В –љ–Њ—А–Љ—Л —Б–њ—А–∞–≤–∞ —В–∞–Ї–ґ–µ —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–ї–Є—Б—М –≤ –≥—А—Г–њ–њ–µ —Б —А–µ—Ж–Є–і–Є–≤–Њ–Љ.
–≠–љ–і–Њ—Б–Ї–Њ–њ–Є—П –љ–Њ—Б–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –љ–∞ 4, 10 –Є 30-–µ —Б—Г—В–Ї–Є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –Ї–∞–ґ–і–Њ–Љ—Г —А–µ–±–µ–љ–Ї—Г. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –њ—А–Њ–Њ–њ–µ—А–Є—А–Њ–≤–∞–љ–љ—Л–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–і–≤–µ—А–≥–∞–ї–Є—Б—М (–Є–ї–Є –±—Г–і—Г—В –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л) –Њ—Б–Љ–Њ—В—А–∞–Љ —Б–њ—Г—Б—В—П –њ–Њ–ї–≥–Њ–і–∞, –≥–Њ–і –Є —З–µ—А–µ–Ј 2 –≥–Њ–і–∞. –Т —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е —В—А–µ—Е –і–љ–µ–є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Є —Е–Њ–∞–љ–Њ–њ–ї–∞—Б—В–Є–Ї—Г —Б —Д–Є–Ї—Б–∞—Ж–Є–µ–є –ї–Њ—Б–Ї—Г—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –±–∞–ї–ї–Њ–љ–Њ–Љ, –љ–Њ—Б–Њ–≤—Л–µ —Е–Њ–і—Л –±—Л–ї–Є –њ–Њ–ї–љ–Њ—Б—В—М—О –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ—Л, –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —А–∞–Ј–і—Г–≤–∞–љ–Є–µ –Є —Б–і—Г–≤–∞–љ–Є–µ –±–∞–ї–ї–Њ–љ–Њ–≤, –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ —Г–і–∞–ї—П–ї–Є—Б—М —В–∞–Љ–њ–Њ–љ—Л. –Ф–µ—В–Є –Њ—Б—В–∞–≤–∞–ї–Є—Б—М –љ–∞ —Н–љ—В–µ—А–∞–ї—М–љ–Њ–Љ –њ–Є—В–∞–љ–Є–Є –і–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –љ–Њ—Б–Њ–≤–Њ–≥–Њ –і—Л—Е–∞–љ–Є—П. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Г –і–µ—В–µ–є, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –±–µ—Б—Б—В–µ–љ—В–Њ–≤–∞—П —Е–Њ–∞–љ–Њ–њ–ї–∞—Б—В–Є–Ї–∞ —Б —Д–Є–Ї—Б–∞—Ж–Є–µ–є –ї–Њ—Б–Ї—Г—В–Њ–≤ –≤ —Е–Њ–∞–љ–µ —Д–Є–±—А–Є–љ–Њ–≤—Л–Љ –Ї–ї–µ–µ–Љ, –љ–Њ—Б–Њ–≤–Њ–µ –і—Л—Е–∞–љ–Є–µ –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї–Њ—Б—М —Г–ґ–µ –≤ –њ–∞–ї–∞—В–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є. –Т–Њ—Б–µ–Љ—М (36,4%) –і–µ—В–µ–є –љ–∞ –≥—А—Г–і–љ–Њ–Љ –≤—Б–Ї–∞—А–Љ–ї–Є–≤–∞–љ–Є–Є –њ—А–Є–Ї–ї–∞–і—Л–≤–∞–ї–Є –Ї –≥—А—Г–і–Є –≤ –њ–µ—А–≤—Л–µ —З–∞—Б—Л –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є, 12 (54,5%) –і–µ—В–µ–є –њ–µ—А–µ–≤–µ–і–µ–љ—Л —Б –Ј–Њ–љ–і–Њ–≤–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П –љ–∞ –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–µ –≤ –њ–µ—А–≤—Л–µ –і–љ–Є, 2 (9%) —А–µ–±–µ–љ–Ї–∞ –≤—Л–њ–Є—Б–∞–љ—Л –Є–Ј —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞ –љ–∞ –Ј–Њ–љ–і–Њ–≤–Њ–Љ –њ–Є—В–∞–љ–Є–Є —Б —В—А–∞—Е–µ–Њ—Б—В–Њ–Љ–Њ–є –≤ —Б–≤—П–Ј–Є —Б —В—П–ґ–µ–ї—Л–Љ —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ —Б—В–∞—В—Г—Б–Њ–Љ.
–С–∞–ї–ї–Њ–љ—Л –њ–Њ—Б–ї–µ —Е–Њ–∞–љ–Њ–њ–ї–∞—Б—В–Є–Ї–Є –±—Л–ї–Є —Г–і–∞–ї–µ–љ—Л –љ–∞ 4вАУ5-–µ —Б—Г—В–Ї–Є. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Є —Е–Њ–∞–љ–Њ–њ–ї–∞—Б—В–Є–Ї—Г –Љ–µ—В–Њ–і–Њ–Љ —Д–Є–Ї—Б–∞—Ж–Є–Є –ї–Њ—Б–Ї—Г—В–Њ–≤ –≤ —Е–Њ–∞–љ–µ —Д–Є–±—А–Є–љ–Њ–≤—Л–Љ –Ї–ї–µ–µ–Љ, –≤ –њ–µ—А–≤—Л–µ —Б—Г—В–Ї–Є –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –Ј–∞—В—А—Г–і–љ–µ–љ–љ–Њ–µ –љ–Њ—Б–Њ–≤–Њ–µ –і—Л—Е–∞–љ–Є–µ, –љ–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –і–ї—П –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П, —Б–ї–Є–Ј–Є—Б—В–Њ-—Б—Г–Ї—А–Њ–≤–Є—З–љ–Њ–µ –Њ—В–і–µ–ї—П–µ–Љ–Њ–µ –Є–Ј –љ–Њ—Б–Њ–≤—Л—Е —Е–Њ–і–Њ–≤, –Ј–∞—В–µ–Љ –љ–∞ 3вАУ4-–µ —Б—Г—В–Ї–Є –љ–Њ—Б–Њ–≤–Њ–µ –і—Л—Е–∞–љ–Є–µ –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї–Њ—Б—М –≤ –њ–Њ–ї–љ–Њ–Љ –Њ–±—К–µ–Љ–µ –њ–Њ –Љ–µ—А–µ —А–µ–≥—А–µ—Б—Б–∞ —А–µ–∞–Ї—В–Є–≤–љ—Л—Е —П–≤–ї–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –љ–Њ—Б–∞.
–Я–Њ—Б–ї–µ —Е–Њ–∞–љ–Њ–њ–ї–∞—Б—В–Є–Ї–Є —Б —Д–Є–Ї—Б–∞—Ж–Є–µ–є –ї–Њ—Б–Ї—Г—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –±–∞–ї–ї–Њ–љ–Њ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤—Л–њ–Є—Б—Л–≤–∞–ї–Є –љ–∞ 10-–µ —Б—Г—В–Ї–Є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є, —В–Њ–≥–і–∞ –Ї–∞–Ї –њ–Њ—Б–ї–µ —Е–Њ–∞–љ–Њ–њ–ї–∞—Б—В–Є–Ї–Є –Љ–µ—В–Њ–і–Њ–Љ —Д–Є–Ї—Б–∞—Ж–Є–Є –ї–Њ—Б–Ї—Г—В–Њ–≤ –≤ —Е–Њ–∞–љ–µ —Д–Є–±—А–Є–љ–Њ–≤—Л–Љ –Ї–ї–µ–µ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤—Л–њ–Є—Б—Л–≤–∞–ї–Є –љ–∞ 4-–µ —Б—Г—В–Ї–Є. –Я—А–Є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —З–µ—А–µ–Ј 1 –Љ–µ—Б. —Г –≤—Б–µ—Е –і–µ—В–µ–є –Њ—В–Љ–µ—З–∞–ї–Є –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Н–њ–Є—В–µ–ї–Є—П –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є —А–∞–љ—Л. –°–Њ–Ј–і–∞–љ–љ—Л–µ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Њ–њ–µ—А–∞—Ж–Є–Є —Б–ї–Є–Ј–Є—Б—В—Л–µ –ї–Њ—Б–Ї—Г—В—Л –њ–Њ–ї–љ–Њ—Б—В—М—О –Ј–∞–Ї—А—Л–≤–∞–ї–Є –Ї–Њ—Б—В–љ—Л–µ —Б—В–µ–љ–Ї–Є –љ–Њ—Б–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –ї–µ—З–µ–љ–Є—П —Е–Њ–∞–љ—Л. –£ –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Б–≤–Њ–±–Њ–і–љ–Њ–µ –і—Л—Е–∞–љ–Є–µ –±–µ–Ј –Ј–∞—В—А—Г–і–љ–µ–љ–Є–є, –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –љ–Є –Њ–і–љ–Њ–≥–Њ —А–µ—Ж–Є–і–Є–≤–∞.
–Т –і–∞–ї—М–љ–µ–є—И–µ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ–ї–∞–љ–Є—А—Г–µ—В—Б—П –Њ—Ж–µ–љ–Є–≤–∞—В—М –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –њ–Њ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї–∞—А—В–Є–љ–µ –Є –і–∞–љ–љ—Л–Љ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Ъ–Ґ —З–µ—А–µ–Ј 12 –Љ–µ—Б. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –Њ–±—К–µ–Ї—В–Є–≤–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–Њ—Б–Њ–≤–Њ–≥–Њ –і—Л—Е–∞–љ–Є—П (—А–Є–љ–Њ–Љ–∞–љ–Њ–Љ–µ—В—А–Є—П), –њ—А–Є–љ—П—В–∞—П –і–ї—П –і–µ—В–µ–є –±–Њ–ї–µ–µ —Б—В–∞—А—И–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, —Г –і–µ—В–µ–є –і–Њ –≥–Њ–і–∞ —В–µ—Е–љ–Є—З–µ—Б–Ї–Є –љ–µ–≤—Л–њ–Њ–ї–љ–Є–Љ–∞.
–Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є —А–Њ–і–Є—В–µ–ї—П–Љ –±—Л–ї –њ—А–µ–і–ї–Њ–ґ–µ–љ –≤–∞–ї–Є–і–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ–њ—А–Њ—Б–љ–Є–Ї, —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ—В–Њ—А–Њ–≥–Њ —А–Њ–і–Є—В–µ–ї–Є –≤ –±–∞–ї–ї–∞—Е –Њ—В 1 –і–Њ 10 –Њ—В–Љ–µ—З–∞–ї–Є, –Ї–∞–Ї —А–µ–±–µ–љ–Њ–Ї —Б–њ–Є—В, –µ—Б—В, –і—Л—И–Є—В, –µ–≥–Њ –љ–∞—Б—В—А–Њ–µ–љ–Є–µ, —Б—В–µ–њ–µ–љ—М –±–µ—Б–њ–Њ–Ї–Њ–є—Б—В–≤–∞. –°–њ–Њ—Б–Њ–± –њ–ї–∞—Б—В–Є–Ї–Є —Е–Њ–∞–љ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Д–Є–±—А–Є–љ–Њ–≤–Њ–≥–Њ –Ї–ї–µ—П —Б —Ж–µ–ї—М—О –Ї—А–µ–њ–ї–µ–љ–Є—П –ї–Њ—Б–Ї—Г—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Ї –Ї–Њ—Б—В–љ—Л–Љ —Б—В—А—Г–Ї—В—Г—А–∞–Љ –љ–Њ—Б–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є —Б–Њ–Ї—А–∞—Й–∞–ї —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Њ–љ–љ—Л–є –њ–µ—А–Є–Њ–і —Б 4вАУ8 –Љ–µ—Б. –і–Њ 2вАУ3 —Б—Г—В –Є —Г–ї—Г—З—И–∞–ї –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Ю–њ–µ—А–∞—В–Є–≤–љ–Њ–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ —Г –і–µ—В–µ–є –і–Њ –≥–Њ–і–∞ —Б –Р–• –і–Њ–ї–ґ–љ–Њ –±—Л—В—М: –Љ–∞–ї–Њ–Є–љ–≤–∞–Ј–Є–≤–љ—Л–Љ, –Њ–і–љ–Њ–Љ–Њ–Љ–µ–љ—В–љ—Л–Љ, —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ, —Б –љ–Є–Ј–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Б –Ї–Њ—А–Њ—В–Ї–Є–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л–Љ –њ–µ—А–Є–Њ–і–Њ–Љ, –±–µ–Ј –±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Г—Е–Њ–і–∞, –љ–µ —В—А–µ–±—Г—О—Й–Є–Љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –∞–љ–µ—Б—В–µ–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—Б–Њ–±–Є—П. –° —А–∞–Ј–≤–Є—В–Є–µ–Љ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є —В–µ—Е–љ–Є–Ї–Є –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е 30 –ї–µ—В –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ –њ—А–Є —Е–Є—А—Г—А–≥–Є–Є –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –Р–• –Њ—В–і–∞–µ—В—Б—П —В—А–∞–љ—Б–љ–∞–Ј–∞–ї—М–љ–Њ–Љ—Г —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–Љ—Г –і–Њ—Б—В—Г–њ—Г, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–∞—П –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—П –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–Њ–ї—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Г–і–∞–ї–Є—В—М –∞—В—А–µ—В–Є—З–µ—Б–Ї—Г—О –њ–ї–∞—Б—В–Є–љ–Ї—Г –Є –Ј–∞–і–љ–Є–µ –Њ—В–і–µ–ї—Л —Б–Њ—И–љ–Є–Ї–∞ –і–ї—П —Г–≤–µ–ї–Є—З–µ–љ–Є—П —Е–Њ–∞–љ. –Т–∞–ґ–љ–µ–є—И–Є–Љ–Є –∞—Б–њ–µ–Ї—В–∞–Љ–Є –≤—Л–±–Њ—А–∞ —В–∞–Ї—В–Є–Ї–Є –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Р–• —Г –і–µ—В–µ–є —П–≤–ї—П—О—В—Б—П, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ, –Є—Б–Ї–ї—О—З–µ–љ–Є–µ –Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ —Б—В–µ–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ–ї–Њ—Б—В–Є –љ–Њ—Б–∞, —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –ї–µ—З–µ–љ–Є—П, —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ —Б—А–Њ–Ї–∞ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П, —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ. –Я–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–є —А–µ—Б—В–µ–љ–Њ–Ј –Њ—Б—В–∞–µ—В—Б—П —Б–∞–Љ—Л–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ–Љ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є —В—А–∞–љ—Б–љ–∞–Ј–∞–ї—М–љ–Њ–є —В–µ—Е–љ–Є–Ї–Є –њ—А–Є –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –Р–•. –§–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ —А–µ—Б—В–µ–љ–Њ–Ј–∞ –≤–Ї–ї—О—З–∞—О—В –≤–Њ–Ј—А–∞—Б—В, –Љ–∞—Б—Б—Г —В–µ–ї–∞, –і–≤—Г—Б—В–Њ—А–Њ–љ–љ–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–∞, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Г—О –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В—М –љ–Њ—Б–∞ –Є —З—А–µ–Ј–Љ–µ—А–љ—Л–є —А–Њ—Б—В –≥—А–∞–љ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–є —В–Ї–∞–љ–Є –љ–∞ –Њ–≥–Њ–ї–µ–љ–љ–Њ–є –Ї–Њ—Б—В–Є. –Ю—Б—В–∞–µ—В—Б—П —Б–њ–Њ—А–љ—Л–Љ –≤–Њ–њ—А–Њ—Б –Њ —В–Њ–Љ, –Ї–∞–Ї —Б–љ–Є–Ј–Є—В—М —З–∞—Б—В–Њ—В—Г –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ —А–µ—Б—В–µ–љ–Њ–Ј–∞ —Г —Н—В–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Ф–≤—Г–Љ—П –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ–Є –њ—А–µ–і–Љ–µ—В–∞–Љ–Є —А–∞–Ј–љ–Њ–≥–ї–∞—Б–Є–є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Е–Њ–∞–љ—Л —П–≤–ї—П—О—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є –Є —Б–Њ–Ј–і–∞–љ–Є–µ –ї–Њ—Б–Ї—Г—В–Њ–≤ –і–ї—П –њ–Њ–Ї—А—Л—В–Є—П –Њ–≥–Њ–ї–µ–љ–љ–Њ–є –Ї–Њ—Б—В–Є. –Ф–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —А–µ—Б—В–µ–љ–Њ–Ј–∞ –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –њ–Њ–≤—В–Њ—А–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є –Љ–љ–Њ–≥–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –≤—Л—Б—В—Г–њ–∞—О—В –Ј–∞ —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –і–ї—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –ї–Њ—Б–Ї—Г—В–Њ–≤, —З—В–Њ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Б–Њ—З–µ—В–∞–µ—В—Б—П —Б –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–Љ —Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є–µ–Љ [11]. –Ю–і–љ–∞–Ї–Њ —Б–ї–µ–і—Г–µ—В —В—Й–∞—В–µ–ї—М–љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –љ–µ–і–Њ—Б—В–∞—В–Ї–Є, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б–Њ —Б—В–µ–љ—В–Њ–Љ, –≤–Ї–ї—О—З–∞—П —В—А–∞–≤–Љ—Л –Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –Њ–Ї—А—Г–ґ–∞—О—Й–Є—Е —В–Ї–∞–љ–µ–є, –Ї–Њ—В–Њ—А—Л–µ –Њ—В–Љ–µ—З–∞—О—В—Б—П –≤ —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 31вАУ33 –і–љ—П –њ–Њ—Б–ї–µ –њ–µ—А–≤–Є—З–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є. –Ь–µ–ґ–і—Г —В–µ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —А–µ–≤–Є–Ј–Є–Є —А–µ—Б—В–µ–љ–Њ–Ј–∞ –њ–Њ—Б–ї–µ —Г–і–∞–ї–µ–љ–Є—П —Б—В–µ–љ—В–∞ –Њ—Б—В–∞–µ—В—Б—П –µ—Й–µ –Њ–і–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є –і–ї—П —Е–Є—А—Г—А–≥–∞ –Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [12]. –Ґ–∞–Ї–ґ–µ –Љ–љ–Њ–≥–Є–µ –∞–≤—В–Њ—А—Л –Є—Б–њ–Њ–ї—М–Ј—Г—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ —Д–Њ—А–Љ—Л –ї–Њ—Б–Ї—Г—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є (–Ј–≤–µ–Ј–і–Њ–Њ–±—А–∞–Ј–љ—Л–є —А–∞–Ј—А–µ–Ј, –У-–Њ–±—А–∞–Ј–љ—Л–є —А–∞–Ј—А–µ–Ј –Є –і—А.) [3, 7]. –≠—В–Њ—В –Љ–µ—В–Њ–і –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б–µ–њ—В–Њ–љ–∞–Ј–∞–ї—М–љ–Њ–≥–Њ –ї–Њ—Б–Ї—Г—В–∞ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –Њ—В–ї–Є—З–љ—Г—О –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—О —Б–Њ—И–љ–Є–Ї–∞ –Є –±–Њ–Ї–Њ–≤–Њ–є –љ–Њ—Б–Њ–≤–Њ–є –Ї–Њ—Б—В–Є –і–ї—П —Б–Њ–Ј–і–∞–љ–Є—П –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є –љ–µ–Њ—Е–Њ–∞–љ—Л –Є –њ–Њ–Ї—А—Л—В–Є—П –Ї–Њ—Б—В–љ–Њ–є –њ–Њ—Б–ї–µ-–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –≤—Б—П –Њ–Ї—А—Г–ґ–љ–Њ—Б—В—М –љ–µ–Њ—Е–Њ–∞–љ—Л –њ–Њ–Ї—А—Л–≤–∞–µ—В—Б—П —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є. –Т –і–≤—Г—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б–Њ–Њ–±—Й–∞–ї–Њ—Б—М –Њ–± –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –љ–Њ–≤—Л—Е –±–Є–Њ–∞–±—Б–Њ—А–±–Є—А—Г–µ–Љ—Л—Е —Б—В–µ–љ—В–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е —Б—В–µ—А–Њ–Є–і—Л –Є –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є –њ—А–Є –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –Р–•, –∞ —В–∞–Ї–ґ–µ –Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—В–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ [13, 14]. –°—В–µ–љ—В —Б–Њ—Б—В–Њ–Є—В –Є–Ј –±–Є–Њ–∞–±—Б–Њ—А–±–Є—А—Г–µ–Љ–Њ–≥–Њ –њ–Њ–ї–Є–ї–∞–Ї—В–Є–і-–≥–ї–Є–Ї–Њ–ї–Є–і–љ–Њ–≥–Њ –њ–Њ–ї–Є–Љ–µ—А–∞, –њ–Њ–Ї—А—Л—В–Њ–≥–Њ 652 –Љ–Ї–≥ –Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–∞ (–Љ–Њ–Љ–µ—В–∞–Ј–Њ–љ–∞ —Д—Г—А–Њ–∞—В). –Ю–љ –Є–Љ–µ–µ—В —Ж–Є–ї–Є–љ–і—А–Є—З–µ—Б–Ї—Г—О –∞–ґ—Г—А–љ—Г—О —Д–Њ—А–Љ—Г –Є —Б–Њ–і–µ—А–ґ–Є—В –њ—А—Г–ґ–Є–љ–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є–є –µ–Љ—Г —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞—В—М —Д–Њ—А–Љ–µ –њ–Њ–ї–Њ—Б—В–Є, –≤ –Ї–Њ—В–Њ—А—Г—О –Њ–љ —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П. –Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ —Н—В–Њ–≥–Њ —В–Є–њ–∞ —Б—В–µ–љ—В–∞ –≤–Ї–ї—О—З–∞—О—В —Г–і–µ—А–ґ–∞–љ–Є–µ –ї–Њ—Б–Ї—Г—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –≤ –љ—Г–ґ–љ–Њ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є –љ–µ–Њ—Е–Њ–∞–љ—Л. –Ъ–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞–µ—В—Б—П –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –њ—А–Є–Љ–µ—А–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 30 –і–љ–µ–є –≤ –Њ–Ї—А—Г–ґ–∞—О—Й—Г—О —Б–ї–Є–Ј–Є—Б—В—Г—О –Њ–±–Њ–ї–Њ—З–Ї—Г [15], –њ–Њ—Н—В–Њ–Љ—Г –љ–µ —В—А–µ–±—Г–µ—В—Б—П —А–µ–≤–Є–Ј–Є–Њ–љ–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є –і–ї—П —Г–і–∞–ї–µ–љ–Є—П. –Ґ–∞–Ї–∞—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —В–µ—Е–љ–Є–Ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б–µ–њ—В–Њ–љ–∞–Ј–∞–ї—М–љ–Њ–≥–Њ –ї–Њ—Б–Ї—Г—В–∞ –Є —Б—В–µ–љ—В–Њ–≤ —Б–Њ —Б—В–µ—А–Њ–Є–і–љ—Л–Љ –њ–Њ–Ї—А—Л—В–Є–µ–Љ –≤ –Љ–µ—Б—В–µ –∞—В—А–µ–Ј–Є–Є –њ–Њ–Ј–≤–Њ–ї—П–ї–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –Љ–Є–љ–Є–Љ–Є–Ј–Є—А–Њ–≤–∞—В—М —В—А–∞–≤–Љ—Г –Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, –љ–Њ –Є –і–Њ–±–Є—В—М—Б—П –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Ј–∞ –Њ–і–Є–љ —Н—В–∞–њ –Њ–њ–µ—А–∞—Ж–Є–Є. –Ю–і–љ–∞–Ї–Њ –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –њ–Њ—П–≤–Є–ї–Є—Б—М —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П—Е, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –њ—А–µ–≤—А–∞—Й–µ–љ–Є–µ–Љ —Н—В–Є—Е —Б—В–µ–љ—В–Њ–≤ –≤ –Є–љ–Њ—А–Њ–і–љ—Л–µ —В–µ–ї–∞ –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –Є–ї–Є –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є [12]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤–Њ–њ—А–Њ—Б –Њ —Д–Є–Ї—Б–∞—Ж–Є–Є —Б—В–µ–љ—В–∞ –≤ –љ–Њ—Б–Њ–≥–ї–Њ—В–Ї–µ, —В–∞–Ї –Ї–∞–Ї —А–Є—Б–Ї –∞—Б–њ–Є—А–∞—Ж–Є–Є –Є —Б–Љ–µ—Й–µ–љ–Є—П —Б—В–µ–љ—В–∞ –і–Њ –њ–µ—А–Є–Њ–і–∞ —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є—П –Њ—Б—В–∞–µ—В—Б—П –Ї—А–∞–є–љ–µ –≤—Л—Б–Њ–Ї–Є–Љ.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Э–∞–Љ–Є —Г—Б–њ–µ—И–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ —Б–њ–Њ—Б–Њ–± –њ–ї–∞—Б—В–Є–Ї–Є —Е–Њ–∞–љ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Д–Є–±—А–Є–љ–Њ–≤–Њ–≥–Њ –Ї–ї–µ—П –і–ї—П –Ї—А–µ–њ–ї–µ–љ–Є—П –ї–Њ—Б–Ї—Г—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Ї –Ї–Њ—Б—В–љ—Л–Љ —Б—В—А—Г–Ї—В—Г—А–∞–Љ –љ–Њ—Б–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є. –≠—В–Њ—В –Љ–∞–ї–Њ–Є–љ–≤–∞–Ј–Є–≤–љ—Л–є —Б–њ–Њ—Б–Њ–± –њ—А–µ–і–µ–ї—М–љ–Њ —Б–Њ–Ї—А–∞—Й–∞–µ—В —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Њ–љ–љ—Л–є –њ–µ—А–Є–Њ–і, —Г–ї—Г—З—И–∞–µ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–∞ –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є, –µ–≥–Њ –Љ–Њ–ґ–љ–Њ —Б—З–Є—В–∞—В—М ¬Ђ–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Р–•. –Ю–љ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤ –Ї—А–∞—В—З–∞–є—И–Є–µ —Б—А–Њ–Ї–Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В—М –њ—А–Њ—Б–≤–µ—В —Е–Њ–∞–љ—Л –±–µ–Ј –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —В—А–∞–≤–Љ–∞—В–Є—З–љ—Л—Е —Б—В–µ–љ—В–Њ–≤, —Б –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ–Є —А–Є—Б–Ї–∞–Љ–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Є —А–µ—Б—В–µ–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–Њ–Ї—А–∞—В–Є—В—М —Б—А–Њ–Ї–Є –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ. –†–Њ–і–Є—В–µ–ї–Є –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Љ–Њ–≥—Г—В —Г—Е–∞–ґ–Є–≤–∞—В—М –Ј–∞ —А–µ–±–µ–љ–Ї–Њ–Љ –і–Њ–Љ–∞, –њ—А–Є —Н—В–Њ–Љ –љ–µ —В—А–µ–±—Г–µ—В—Б—П —А–µ–≥—Г–ї—П—А–љ–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ы–Ю–†-–≤—А–∞—З–∞. –Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–∞—П –Љ–µ—В–Њ–і–Є–Ї–∞ –ї–µ—З–µ–љ–Є—П –Р–• –љ–µ –љ–µ—Б–µ—В —А–Є—Б–Ї–∞ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ —Б—В–µ–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –≤ –Њ—В–і–∞–ї–µ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ.
1–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є. –Р—В—А–µ–Ј–Є—П —Е–Њ–∞–љ —Г –і–µ—В–µ–ЄћЖ. 2016. (–≠–ї–µ–Ї—В—А–Њ–љ–љ—Л–ЄћЖ —А–µ—Б—Г—А—Б.) URL: http://glav-otolar .ru/assets/images/docs/clinical-recomendations/KR%20310%20 Atrezija_hoan .pdf?ysclid=ltgxqzssbe825566043 (–і–∞—В–∞ –Њ–±—А–∞—Й–µ–љ–Є—П: 22.02.2024).












