–Р–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М –њ—А–Њ–±–ї–µ–Љ—Л
–Ь–∞—Б—И—В–∞–±—Л –Љ–µ–і–Є–Ї–Њ-—Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ—Л –±–Њ–ї–Є –≤ —Б–њ–Є–љ–µ –њ–Њ—В—А—П—Б–∞—О—В –љ–µ —В–Њ–ї—М–Ї–Њ –≤–Њ–Њ–±—А–∞–ґ–µ–љ–Є–µ –≤—А–∞—З–µ–є –≤—Б–µ—Е —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ—Б—В–µ–є, –љ–Њ –Є –≥—А–Њ–Ј—П—В –Њ–±—Й–µ–њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–є –њ–∞–љ–і–µ–Љ–Є–µ–є. –Т–Њ –≤—В–Њ—А–Њ–Љ –і–µ—Б—П—В–Є–ї–µ—В–Є–Є XXI –≤. –±–Њ–ї–µ–µ 90% —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –љ–∞ –Ч–µ–Љ–ї–µ –њ–Њ–і–≤–µ—А–ґ–µ–љ—Л –±–Њ–ї–µ–≤—Л–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ –≤ —Б–њ–Є–љ–µ, –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—О—Й–Є–Љ –њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ—Г—О –і–µ—П—В–µ–ї—М–љ–Њ—Б—В—М, –≤—Л–њ–Њ–ї–љ–µ–љ–Є–µ –±—Л—В–Њ–≤—Л—Е –Ј–∞–і–∞—З –Є –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–є —Г—А–Њ–≤–µ–љ—М —Б–Њ—Ж–Є–∞–ї–Є–Ј–∞—Ж–Є–Є [1].–•—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М –≤ —Б–њ–Є–љ–µ —П–≤–ї—П–µ—В—Б—П –≥–ї–∞–≤–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є –љ–µ—В—А—Г–і–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є [2]. –С–Њ–ї–µ–≤—Л–µ —Б–Є–љ–і—А–Њ–Љ—Л –≤ —Б—В—А—Г–Ї—В—Г—А–µ –≥–ї–Њ–±–∞–ї—М–љ–Њ–≥–Њ –±—А–µ–Љ–µ–љ–Є –±–Њ–ї–µ–Ј–љ–µ–є –Ј–∞–љ–Є–Љ–∞—О—В –≤–µ–і—Г—Й–µ–µ –Љ–µ—Б—В–Њ –≤–Њ –≤—Б–µ—Е —Б—В—А–∞–љ–∞—Е –Љ–Є—А–∞, –њ—А–Є–≤–Њ–і—П –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –њ–Њ—Б–ї–µ–і–љ–Є—Е –і–≤—Г—Е –і–µ—Б—П—В–Є–ї–µ—В–Є–є –Ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ї–µ—В, –њ—А–Њ–ґ–Є—В—Л—Е —Б –љ–∞—А—Г—И–µ–љ–љ—Л–Љ –Ј–і–Њ—А–Њ–≤—М–µ–Љ, –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Г—Е—Г–і—И–µ–љ–Є—О –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –љ–∞—Б–µ–ї–µ–љ–Є—П.
–Т –°–®–Р –Њ—В–Љ–µ—З–∞–µ—В—Б—П –µ–ґ–µ–≥–Њ–і–љ–Њ–µ (—Б 1992 –≥.) —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –±–Њ–ї–Є –≤ –љ–Є–ґ–љ–µ–є —З–∞—Б—В–Є —Б–њ–Є–љ—Л (–С–Э–°) –љ–∞ 11,6% –≤–Њ –≤—Б–µ—Е –і–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –≥—А—Г–њ–њ–∞—Е [3].
–≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Є–Ј—Г—З–∞–≤—И–Є–µ —Б—В—А—Г–Ї—В—Г—А—Г –њ—А–Є—З–Є–љ –С–Э–°, –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —Г—Б—В–∞–љ–Њ–≤–Є—В—М: 80вАУ85% –±–Њ–ї–µ–≤—Л—Е —Б–Є–љ–і—А–Њ–Љ–Њ–≤ —Б–≤—П–Ј–∞–љ—Л —Б –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї—М—О –≤ —Б–њ–Є–љ–µ, 10вАУ15% вАФ —Б —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є—П–Љ–Є, 1вАУ5% вАФ —Б–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є –±–Њ–ї—П–Љ–Є –≤ —Б–њ–Є–љ–µ, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–Љ–Є —Б–µ—А—М–µ–Ј–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є [4].
–Я—А–Њ–≤–µ–і–µ–љ–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б –њ–Њ—Б—В–∞–љ–∞–ї–Є–Ј–Њ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –±–Њ–ї–Є –≤—Л—П–≤–Є–ї–Є –Ї—А–∞–є–љ–µ –љ–Є–Ј–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є –С–Э–°. –Т —Б—А–µ–і–љ–µ–Љ –ї–Є—И—М 20% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–µ–љ—Л –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–µ–є [5].
–Р–љ–∞–ї–Є–Ј –њ—А–Є—З–Є–љ –љ–Є–Ј–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–µ—В–Њ–і–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ–Њ–і—Е–Њ–і–Њ–≤ –Ї —В–µ—А–∞–њ–Є–Є –С–Э–° –≤—Л—П–≤–ї—П–µ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Д–∞–Ї—В–Њ—А–Њ–≤:
–Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤ —А—Г—В–Є–љ–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –µ–і–Є–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Ї –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —Б—В—А—Г–Ї—В—Г—А–∞—Е –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞;
–љ–Є–Ј–Ї–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –Ї ¬Ђ–Ї—А–∞—Б–љ—Л–Љ —Д–ї–∞–≥–∞–Љ¬ї –њ—А–Є –±–Њ–ї–Є –≤ —Б–њ–Є–љ–µ (–љ–Њ—З–љ—Л–µ –±–Њ–ї–Є –Є –і—А—Г–≥–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –±–Њ–ї–Є, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –∞–ї–≥–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ј –Є –њ—А–Є–µ–Љ–Њ–≤, –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –њ–Њ—Б–ї–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–Њ–ї—М–Ї–Њ –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –љ–∞—В—А–Є—П, —Б–Є–Љ–њ—В–Њ–Љ—Л, —Г–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ –љ–∞ –∞–љ–µ–≤—А–Є–Ј–Љ—Г –±—А—О—И–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –∞–Њ—А—В—Л, –Є –њ—А.);
–Є–≥–љ–Њ—А–Є—А–Њ–≤–∞–љ–Є–µ –≤ –ї–µ—З–µ–±–љ–Њ–є —В–∞–Ї—В–Є–Ї–µ –С–Э–° –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –Њ—В–і–µ–ї—М–љ—Л—Е –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ—Б—В–Є (–≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—П, –≥–Є–њ–µ—А—Г—А–Є–Ї–µ–Љ–Є—П, –∞–љ–µ–Љ–Є—П, –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є—П —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, –≥–Є–њ–Њ—В–Є—А–µ–Њ–Ј, –Њ–±–Њ—Б—В—А–µ–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –ї–µ–≥–Ї–Є—Е, –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–Ј—Л, –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞);
—Б–≤–µ–і–µ–љ–Є–µ –ї–µ—З–µ–±–љ–Њ–є —В–∞–Ї—В–Є–Ї–Є —В–Њ–ї—М–Ї–Њ –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Э–Я–Т–Я) –Є –Љ–Є–Њ—А–µ–ї–∞–Ї—Б–∞–љ—В–Њ–≤;
–Њ—В—Б—Г—В—Б—В–≤–Є–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –њ—Б–Є—Е–Њ–≥–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞;
–љ–Є–Ј–Ї–∞—П –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –Є –љ–Є–Ј–Ї–∞—П –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ—Л–Љ —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Њ–љ–љ—Л–Љ –њ—А–Њ–≥—А–∞–Љ–Љ–∞–Љ;
–љ–µ–і–Њ–Њ—Ж–µ–љ–Ї–∞ —А–Њ–ї–Є —В—А–∞–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є, –≤ —В. —З. —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ—Л–Љ —Б–њ–Њ—А—В–Њ–Љ.
–Э–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –С–Э–°
–Э–∞–Є–±–Њ–ї–µ–µ –Њ—З–µ–≤–Є–і–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є —А—Г—В–Є–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є —П–≤–ї—П–µ—В—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ –љ–∞ —В–µ—А—А–Є—В–Њ—А–Є–Є –†–§ –µ–і–Є–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Ї –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–µ –њ—А–Є—З–Є–љ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≤ —Б–њ–Є–љ–µ. –Ю–њ—В–Є–Љ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Њ–є –С–Э–° –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П, –Њ–±–Њ–Ј–љ–∞—З–µ–љ–љ–∞—П –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –Р—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –≤—А–∞—З–µ–є –Њ–±—Й–µ–є –њ—А–∞–Ї—В–Є–Ї–Є (—Б–µ–Љ–µ–є–љ—Л—Е –≤—А–∞—З–µ–є) –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є ¬Ђ–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –≤ —Б–њ–Є–љ–µ –≤ –Њ–±—Й–µ–є –≤—А–∞—З–µ–±–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ¬ї (2014).–Я–Њ–і—Е–Њ–і—Л –Ї –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–µ –С–Э–°
–≠—В–Є–Њ–њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–є –њ–Њ–і—Е–Њ–і
–Я–µ—А–≤–Є—З–љ–∞—П –С–Э–° –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ–Є –Є/–Є–ї–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –≤ —В–Ї–∞–љ—П—Е –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞ (–Љ–µ–ґ–њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤—Л–µ —Б—Г—Б—В–∞–≤—Л, –Љ–µ–ґ–њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤—Л–µ –і–Є—Б–Ї–Є (–Ь–Я–Ф), —Д–∞—Б—Ж–Є–Є, –Љ—Л—И—Ж—Л, —Б—Г—Е–Њ–ґ–Є–ї–Є—П) —Б –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –≤–Њ–≤–ї–µ—З–µ–љ–Є–µ–Љ —Б–Љ–µ–ґ–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А (–Ї–Њ—А–µ—И–Њ–Ї, –љ–µ—А–≤).–Т—В–Њ—А–Є—З–љ–∞—П –С–Э–° –≤ –Њ—Б–љ–Њ–≤–µ —Б–≤–Њ–µ–є –Є–Љ–µ–µ—В –њ—А–Є—З–Є–љ—Л: –≤—А–Њ–ґ–і–µ–љ–љ—Л–µ –∞–љ–Њ–Љ–∞–ї–Є–Є (–ї—О–Љ–±–∞–ї–Є–Ј–∞—Ж–Є—П, spina bifida, –Є —В.–і.), —В—А–∞–≤–Љ—Л (–њ–µ—А–µ–ї–Њ–Љ—Л –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤, –њ—А–Њ—В—А—Г–Ј–Є–Є –Ь–Я–Ф –Є –і—А.), –∞—А—В—А–Є—В—Л (–∞–љ–Ї–Є–ї–Њ–Ј–Є—А—Г—О—Й–Є–є —Б–њ–Њ–љ–і–Є–ї–Є—В, —А–µ–∞–Ї—В–Є–≤–љ—Л–є –∞—А—В—А–Є—В, —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В –Є –і—А.), –і—А—Г–≥–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞ (–Њ–њ—Г—Е–Њ–ї–Є, –Є–љ—Д–µ–Ї—Ж–Є–Є, –љ–∞—А—Г—И–µ–љ–Є—П –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Є –і—А.), –њ—А–Њ–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –±–Њ–ї–Є –њ—А–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤ (–ґ–µ–ї—Г–і–Ї–∞, –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –Ї–Є—И–µ—З–љ–Є–Ї–∞, –±—А—О—И–љ–Њ–є –∞–Њ—А—В—Л –Є –і—А.), –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Љ–Њ—З–µ–њ–Њ–ї–Њ–≤—Л—Е –Њ—А–≥–∞–љ–Њ–≤.
–≠—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ–Њ–і—Е–Њ–і
–Т–µ—А—В–µ–±—А–Њ–≥–µ–љ–љ—Л–µ –њ—А–Є—З–Є–љ—Л –С–Э–°: –≥—А—Л–ґ–∞ (–њ—А–Њ–ї–∞–њ—Б) –Є–ї–Є –њ—А–Њ—В—А—Г–Ј–Є—П –Ь–Я–Ф; —Б–њ–Њ–љ–і–Є–ї–µ–Ј; –Њ—Б—В–µ–Њ—Д–Є—В—Л; —Б–∞–Ї—А–∞–ї–Є–Ј–∞—Ж–Є—П –Є–ї–Є –ї—О–Љ–±–∞–ї–Є–Ј–∞—Ж–Є—П; —Б–њ–Њ–љ–і–Є–ї–Њ–∞—А—В—А–Њ–Ј (—Д–∞—Б–µ—В–Њ—З–љ—Л–є —Б–Є–љ–і—А–Њ–Љ); –∞–љ–Ї–Є–ї–Њ–Ј–Є—А—Г—О—Й–Є–є —Б–њ–Њ–љ–і–Є–ї–Є—В (–±–Њ–ї–µ–Ј–љ—М –С–µ—Е—В–µ—А–µ–≤–∞); —Б–њ–Є–љ–∞–ї—М–љ—Л–є —Б—В–µ–љ–Њ–Ј (–≤—В–Њ—А–Є—З–љ—Л–є —Б—В–µ–љ–Њ–Ј –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Њ–≥–Њ –Ї–∞–љ–∞–ї–∞, –Њ—В–Љ–µ—З–∞—О—Й–Є–є—Б—П —З–∞—Б—В–Њ –љ–∞ —Д–Њ–љ–µ –µ–≥–Њ –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є —Г–Ј–Њ—Б—В–Є); –љ–µ—Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Њ-–і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ (–Њ—Б–Њ–±–µ–љ–љ–Њ —А–µ—В—А–Њ—Б–њ–Њ–љ–і–Є–ї–Њ–ї–Є—Б—В–µ–Ј); –њ–µ—А–µ–ї–Њ–Љ—Л –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤ (–≤ —В. —З. –Ї–Њ–Љ–њ—А–µ—Б—Б–Є–Њ–љ–љ—Л–µ –љ–∞ —Д–Њ–љ–µ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞); –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј; –њ–µ—А–≤–Є—З–љ—Л–µ/–≤—В–Њ—А–Є—З–љ—Л–µ –Њ–њ—Г—Е–Њ–ї–Є –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞, —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є –Ї–Њ—А–µ—И–Ї–Њ–≤; –≤—А–Њ–ґ–і–µ–љ–љ—Л–µ –Є–ї–Є –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ—Л–µ –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞ (–Ї–Є—Д–Њ—Б–Ї–Њ–ї–Є–Њ–Ј, —Б–Ї–Њ–ї–Є–Њ–Ј, –≥–Є–њ–µ—А–ї–Њ—А–і–Њ–Ј); —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –±–Є–Њ–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П –≤ –Љ–µ–ґ–њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤—Л—Е –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е —Б–µ–≥–Љ–µ–љ—В–∞—Е —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ —Б—В–µ—А–µ–Њ—В–Є–њ–∞.
–Э–µ–≤–µ—А—В–µ–±—А–Њ–≥–µ–љ–љ—Л–µ –њ—А–Є—З–Є–љ—Л –С–Э–°: –Љ–Є–Њ—Д–∞—Б—Ж–Є–∞–ї—М–љ—Л–є –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ; –њ—Б–Є—Е–Њ–≥–µ–љ–љ—Л–µ –±–Њ–ї–Є; –Њ—В—А–∞–ґ–µ–љ–љ—Л–µ –±–Њ–ї–Є –≤ —Б–њ–Є–љ–µ –њ—А–Є –±–Њ–ї–µ–Ј–љ—П—Е –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤ (—Б–µ—А–і—Ж–∞, –ї–µ–≥–Ї–Є—Е, –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, –Љ–Њ—З–µ–њ–Њ–ї–Њ–≤—Л—Е –Њ—А–≥–∞–љ–Њ–≤); —Н–њ–Є–і—Г—А–∞–ї—М–љ—Л–є –∞–±—Б—Ж–µ—Б—Б; —Б–Є—А–Є–љ–≥–Њ–Љ–Є–µ–ї–Є—П.
–Т—А–µ–Љ–µ–љ–љ–Њ–є –њ–Њ–і—Е–Њ–і:
–Њ—Б—В—А–∞—П –С–Э–° вАФ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П –і–Њ 6 –љ–µ–і., –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ –Њ—В–≤–µ—В –љ–∞ –љ–Њ–≤–Њ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –Є –љ–µ—А–∞–Ј—А—Л–≤–љ–Њ —Б –љ–Є–Љ —Б–≤—П–Ј–∞–љ–∞;–њ–Њ–і–Њ—Б—В—А–∞—П –С–Э–° вАФ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П –Њ—В 6 –і–Њ 12 –љ–µ–і.;
—Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –С–Э–° вАФ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П —Б–≤—Л—И–µ 12 –љ–µ–і., —В. –µ. —Б–≤–µ—А—Е –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П –њ–Њ–≤—А–µ–ґ–і–µ–љ–љ—Л—Е —В–Ї–∞–љ–µ–є;
—А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–∞—П –С–Э–° вАФ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ –љ–µ –Љ–µ–љ–µ–µ 6 –Љ–µ—Б. —Б –Љ–Њ–Љ–µ–љ—В–∞ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –њ—А–µ–і—Л–і—Г—Й–µ–≥–Њ –Њ–±–Њ—Б—В—А–µ–љ–Є—П, —В. –µ. –њ–Њ—Б–ї–µ –њ–Њ–ї–љ–Њ—Б—В—М—О –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞;
–Њ–±–Њ—Б—В—А–µ–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –С–Э–° вАФ –µ—Б–ї–Є –±–Њ–ї—М –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –Љ–µ–љ–µ–µ —З–µ–Љ —З–µ—А–µ–Ј 6 –Љ–µ—Б. –ї–Є–±–Њ –µ—Б–ї–Є –±–Њ–ї—М –і–Њ –Ї–Њ–љ—Ж–∞ –љ–µ –Ї—Г–њ–Є—А–Њ–≤–∞–ї–∞—Б—М.
–Я–Њ–і—Е–Њ–і –Ь–Ъ–С-10
–Я–Њ –Ь–Ъ–С-10, –і–Њ—А—Б–Њ–њ–∞—В–Є–Є –і–µ–ї—П—В—Б—П –љ–∞ 3 –Њ—Б–љ–Њ–≤–љ—Л–µ –≥—А—Г–њ–њ—Л: –і–µ—Д–Њ—А–Љ–Є—А—Г—О—Й–Є–µ –і–Њ—А—Б–Њ–њ–∞—В–Є–Є, —Б–њ–Њ–љ–і–Є–ї–Њ–њ–∞—В–Є–Є, –і–Њ—А—Б–∞–ї–≥–Є–Є. –Т —А–∞–Ј–і–µ–ї–µ ¬Ђ–°–њ–Њ–љ–і–Є–ї–Њ–њ–∞—В–Є–Є¬ї –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ —П–≤–ї—П–µ—В—Б—П —Б–њ–Њ–љ–і–Є–ї–µ–Ј, –≤ –Ї–Њ—В–Њ—А—Л–є –≤–Ї–ї—О—З–µ–љ—Л –∞—А—В—А–Њ–Ј –Є –і–µ–≥–µ–љ–µ—А–∞—Ж–Є—П —Д–∞—Б–µ—В–Њ—З–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ (—Б–њ–Њ–љ–і–Є–ї–Њ–∞—А—В—А–Њ–Ј).–°–њ–Њ–љ–і–Є–ї–Њ–∞—А—В—А–Њ–Ј
–°–њ–Њ–љ–і–Є–ї–Њ–∞—А—В—А–Њ–Ј, –Ї–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б, –ї–Њ–Ї–∞–ї–Є–Ј—Г—О—Й–Є–є—Б—П –≤ –Љ–µ–ґ–њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤—Л—Е —Б—Г—Б—В–∞–≤–∞—Е, —П–≤–ї—П—О—Й–Є—Е—Б—П –Њ–±—Л—З–љ—Л–Љ–Є —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ—Л–Љ–Є —Б—Г—Б—В–∞–≤–∞–Љ–Є —Б –і–≤—Г–Љ—П –њ–Њ–Ї—А—Л—В—Л–Љ–Є –≥–Є–∞–ї–Є–љ–Њ–≤—Л–Љ —Е—А—П—Й–Њ–Љ —Б—Г—Б—В–∞–≤–љ—Л–Љ–Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—П–Љ–Є [6]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Ь–Я–Ф вАФ —Н—В–Њ —А–∞–Ј–љ–Њ–≤–Є–і–љ–Њ—Б—В—М —Е—А—П—Й–µ–≤–Њ–є —В–Ї–∞–љ–Є, –±–Њ–≥–∞—В–Њ–є –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ–∞–Љ–Є, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–Љ–Є —Б—Г–ї—М—Д–∞—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –≥–ї–Є–Њ–Ј–∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–∞–љ–∞–Љ–Є –Є –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–Љ I –Є II —В–Є–њ–Њ–≤. –Я—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ—Л –і–Є—Б–Ї–∞ (–њ—Г–ї—М–њ–Њ–Ј–љ–Њ–≥–Њ —П–і—А–∞ –Є —Д–Є–±—А–Њ–Ј–љ–Њ–≥–Њ –Ї–Њ–ї—М—Ж–∞) –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л —Е–Њ–љ–і—А–Њ–Є—В–Є–љ—Б—Г–ї—М—Д–∞—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –≥–Њ–Љ–Њ–ї–Њ–≥–Є—З–љ—Л –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ–∞–Љ —Б—Г—Б—В–∞–≤–љ—Л—Е —Е—А—П—Й–µ–є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —Б—Г—Б—В–∞–≤–Њ–≤. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Њ—Ж–µ—Б—Б—Л –і–µ–≥–µ–љ–µ—А–∞—Ж–Є–Є –≤ –Љ–µ–ґ–њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤—Л—Е –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —Б—Г—Б—В–∞–≤–∞—Е –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ –љ–µ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П [7].–Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Њ—Ж–µ—Б—Б—Л –њ–Њ—А–∞–ґ–µ–љ–Є—П —Е—А—П—Й–∞ –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —Б—Г—Б—В–∞–≤–∞—Е –Є —Б—Г—Б—В–∞–≤–∞—Е –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞ –њ—А–Є –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–µ (–Ю–Р) –њ—А–Њ—В–µ–Ї–∞—О—В –њ–Њ –Њ–і–љ–Њ—В–Є–њ–љ–Њ–Љ—Г –Љ–µ—Е–∞–љ–Є–Ј–Љ—Г. –Т –Њ—Б–љ–Њ–≤–µ –ї–µ–ґ–Є—В –і–Є—Б–±–∞–ї–∞–љ—Б —Б–Є–љ—В–µ–Ј–∞ –Є –і–µ–≥—А–∞–і–∞—Ж–Є–Є –Љ–∞—В—А–Є–Ї—Б–∞ (—Б–љ–Є–ґ–µ–љ–Є–µ –≤—Л—А–∞–±–Њ—В–Ї–Є –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤, –њ–Њ–≤—Л—И–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Њ—В–µ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ –Є –і—А.) –Є —А–∞–Ј–≤–Є—В–Є–µ –∞—Б–µ–њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (–њ—А–Њ–і—Г–Ї—Ж–Є—П –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–Њ–≤ (–Ш–Ы) вАФ –Ш–Ы-1, –Ш–Ы-6, –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤, —Д–∞–Ї—В–Њ—А–∞ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є ќ± вАФ –§–Э–Ю-ќ± –Є –і—А.).
–°–њ–Њ–љ–і–Є–ї–Њ–∞—А—В—А–Њ–Ј вАФ —Б–∞–Љ–∞—П —З–∞—Б—В–∞—П –њ—А–Є—З–Є–љ–∞ –±–Њ–ї–µ–є –≤ –њ–Њ—П—Б–љ–Є—Ж–µ —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞. –Я—А–Є –∞—А—В—А–Њ–Ј–µ —Д–∞—Б–µ—В–Њ—З–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –±–Њ–ї—М –Њ–±—Л—З–љ–Њ –і–≤—Г—Б—В–Њ—А–Њ–љ–љ—П—П, –ї–Њ–Ї–∞–ї–Є–Ј—Г–µ—В—Б—П, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –і–Є—Б–Ї–Њ–≥–µ–љ–љ–Њ–є, –њ–∞—А–∞–≤–µ—А—В–µ–±—А–∞–ї—М–љ–Њ, –∞ –љ–µ –њ–Њ —Б—А–µ–і–љ–µ–є –ї–Є–љ–Є–Є, —Г—Б–Є–ї–Є–≤–∞–µ—В—Б—П –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ —Б—В–Њ—П–љ–Є–Є –Є —А–∞–Ј–≥–Є–±–∞–љ–Є–Є –Є —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –њ—А–Є —Е–Њ–і—М–±–µ –Є —Б–Є–і–µ–љ–Є–Є.
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –Ь–Я–Ф, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–µ —Б—В–∞—А–µ–љ–Є–µ–Љ, –њ–Њ—П–≤–ї—П—О—В—Б—П —Г –ї–Є—Ж —Б—В–∞—А—И–µ 30 –ї–µ—В –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –≤ –Љ–∞—В—А–Є–Ї—Б–µ –њ—Г–ї—М–њ–Њ–Ј–љ–Њ–≥–Њ —П–і—А–∞ —Б –њ–Њ—П–≤–ї–µ–љ–Є—П –Њ—З–∞–≥–Њ–≤ –Ј–µ—А–љ–Є—Б—В–Њ–≥–Њ —А–∞—Б–њ–∞–і–∞, –≥–Є–±–µ–ї–Є —З–∞—Б—В–Є –Ї–ї–µ—В–Њ–Ї. –≠—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –љ–∞—А—Г—И–∞—О—В –Њ–і–љ–Њ—А–Њ–і–љ–Њ—Б—В—М –Є —Г–њ–Њ—А—П–і–Њ—З–µ–љ–љ–Њ—Б—В—М —Б—В—А—Г–Ї—В—Г—А—Л, –≤–µ–і—Г—В –Ї –њ–Њ—В–µ—А–µ –≤–Њ–і—Л, —Б–љ–Є–ґ–µ–љ–Є—О –≤–љ—Г—В—А–Є–і–Є—Б–Ї–Њ–≤–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Є —Г—Е—Г–і—И–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —Б–≤–Њ–є—Б—В–≤ –і–Є—Б–Ї–∞. –Ф–µ–≥–µ–љ–µ—А–∞—Ж–Є—П –Ь–Я–Ф вАФ –Љ–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б. –Т –Њ—Б–љ–Њ–≤–µ –≤—Л—А–Њ–ґ–і–µ–љ–Є—П –і–Є—Б–Ї–∞ –ї–µ–ґ–Є—В –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–є –і–µ—Д–µ–Ї—В. –Ш–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≥–µ–љ–Њ–≤, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞ –њ—А–Њ—З–љ–Њ—Б—В—М –Є –Ї–∞—З–µ—Б—В–≤–Њ –Ї–Њ—Б—В–љ–Њ-—Е—А—П—Й–µ–≤—Л—Е —Б—В—А—Г–Ї—В—Г—А, вАФ –≥–µ–љ—Л —Б–Є–љ—В–µ–Ј–∞ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ IX —В–Є–њ–∞, —А–µ—Ж–µ–њ—В–Њ—А–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D, –∞–≥–≥—А–µ–Ї–∞–љ–∞, –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј—Л. –У–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П ¬Ђ–њ–Њ–ї–Њ–Љ–Ї–∞¬ї –љ–Њ—Б–Є—В —Б–Є—Б—В–µ–Љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А, —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М—О –і–µ–≥–µ–љ–µ—А–∞—Ж–Є–Є –Ь–Я–Ф —Г –±–Њ–ї—М–љ—Л—Е –Ю–Р –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —Б—Г—Б—В–∞–≤–Њ–≤. –Ґ—А–Є–≥–≥–µ—А–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –і–Є—Б–Ї–µ —Б–ї—Г–ґ–Є—В —Б—В—А—Г–Ї—В—Г—А–љ–Њ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ —Д–Є–±—А–Њ–Ј–љ–Њ–≥–Њ –Ї–Њ–ї—М—Ж–∞, –њ—А–Є–≤–Њ–і—П—Й–µ–µ –Ї –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ –≤ –њ—Г–ї—М–њ–Њ–Ј–љ–Њ–Љ —П–і—А–µ –Є –Ј–∞–Љ—Л–Ї–∞—В–µ–ї—М–љ—Л—Е –њ–ї–∞—Б—В–Є–љ–∞—Е. –°—В—А—Г–Ї—В—Г—А–љ–Њ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ —Н–ї–µ–Љ–µ–љ—В–Њ–≤ –і–Є—Б–Ї–∞ –њ—А–Є–≤–Њ–і–Є—В –≤ –Њ–±—Й–µ–Љ —Б–ї—Г—З–∞–µ –Ї —А–∞–Ј–≤–Є—В–Є—О –Ї–∞—Б–Ї–∞–і–∞ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є вАФ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П. C –≤–Њ–Ј—А–∞—Б—В–Њ–Љ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є —А–µ–њ–∞—А–∞—Ж–Є–Є –Њ—Б–ї–∞–±–µ–≤–∞–µ—В, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ [8].
–Ґ—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ —В–µ—А–∞–њ–Є—П –С–Э–° –≤–Ї–ї—О—З–∞–µ—В –Љ–µ—Б—В–љ—Л–µ –Є —Б–Є—Б—В–µ–Љ–љ—Л–µ –Э–Я–Т–Я, —А–µ–ґ–µ вАФ –Љ–Є–Њ—А–µ–ї–∞–Ї—Б–∞–љ—В—Л (–њ–Њ–ї—М–Ј–∞ –Њ—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –љ–µ –і–Њ–Ї–∞–Ј–∞–љ–∞) [9].
–£—З–Є—В—Л–≤–∞—П —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В—М –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Є –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –Ь–Я–Ф, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є—Е—Б—П –∞–њ–Њ–њ—В–Њ–Ј–Њ–Љ –Ї–ї–µ—В–Њ—З–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А, –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Ь–Я–Ф —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Њ–є –Є–Ј –љ–Њ–≤—Л—Е –Є —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –Ј–∞–і–∞—З –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –±–Њ–ї–Є.
–Ъ–∞–Ї –љ–∞–Є–±–Њ–ї–µ–µ –њ—А–Є–µ–Љ–ї–µ–Љ—Л–µ —Б—А–µ–і—Б—В–≤–∞, —Б–њ–Њ—Б–Њ–±–љ—Л–µ –≤–ї–Є—П—В—М –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤ —Е—А—П—Й–µ–≤–Њ–є, —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –њ–Њ–і–∞–≤–ї—П—П —Б–Є–љ—В–µ–Ј –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤, –і–ї—П —В–µ—А–∞–њ–Є–Є –С–Э–° –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–∞ —Б—Г–ї—М—Д–∞—В (–•–°, –•–Њ–љ–і—А–Њ–≥–∞—А–і) –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞ —Б—Г–ї—М—Д–∞—В (–У–°, –°—Г—Б—В–∞–≥–∞—А–і –Р—А—В—А–Њ).
–Я–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–µ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Є–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –•–° –Є –У–° –њ—А–Є –С–Э–° –њ–Њ–љ—П—В–љ–Њ –Є –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —Б–ї–µ–і—Г—О—Й–µ–Љ: —Н—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –њ–Њ–і–∞–≤–ї—П—О—В —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –Љ–∞—В—А–Є—З–љ—Л—Е –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј, –Ш–Ы-1b –Є –Ш–Ы-8, —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л-2, –§–Э–Ю-ќ±, –Њ–Ї–∞–Ј—Л–≤–∞—О—В –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –Ј–∞ —Б—З–µ—В –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –Ї–∞—Б–Ї–∞–і–∞ –∞—Б–µ–њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П; –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, —П–≤–ї—П—П—Б—М –љ—Г—В—А–Є–µ–љ—В–∞–Љ–Є, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–Љ–Є —Б–Њ–±–Њ–є –≥–ї–Є–Ї–Њ–Ј–∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–∞–љ—Л, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–µ –≤ —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–Љ –Љ–∞—В—А–Є–Ї—Б–µ —Е—А—П—Й–∞ –Ь–Я–Ф, –•–° –Є –У–° –Є–љ–≥–Є–±–Є—А—Г—О—В —Б–≤–Њ–±–Њ–і–љ—Л–µ —А–∞–і–Є–Ї–∞–ї—Л, —Б–њ–Њ—Б–Њ–±–љ—Л–µ –≤—Л–Ј—Л–≤–∞—В—М —А–∞–Ј—А—Г—И–µ–љ–Є–µ —Е—А—П—Й–∞ –Є –Ї–Њ–ї–ї–∞–≥–µ–љ–∞, —Г–≥–љ–µ—В–∞—О—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Д–µ—А–Љ–µ–љ—В–Њ–≤, –≤—Л–Ј—Л–≤–∞—О—Й–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є–µ —Е—А—П—Й–µ–≤–Њ–є —В–Ї–∞–љ–Є, —Г—З–∞—Б—В–≤—Г—О—В –≤ —Б–Є–љ—В–µ–Ј–µ –≥–ї–Є–Ї–Њ–Ј–∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤ –Є —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –≤–љ—Г—В—А–Є—Б—Г—Б—В–∞–≤–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є; –Ї —В–Њ–Љ—Г –ґ–µ –У–° —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–Љ –≥–ї–Є–Ї–Њ–Ј–∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤ –Є –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤ —Ж–µ–ї–Њ–Љ —А—П–і–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –і–∞–љ–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –Ј–∞–Љ–µ–і–ї–µ–љ–Є—О –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О —Б—В—А—Г–Ї—В—Г—А—Л —Е—А—П—Й–µ–≤–Њ–є —В–Ї–∞–љ–Є [10].
–Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –љ–∞–Ї–Њ–њ–ї–µ–љ–∞ –Њ–±—И–Є—А–љ–∞—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–∞—П –±–∞–Ј–∞ –і–ї—П –•–° –Є –У–° –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Ю–Р, –±–Њ–ї—М—И–µ –≤—Б–µ–≥–Њ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ [11вАУ15]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ —А—П–і –Њ–±–љ–∞–і–µ–ґ–Є–≤–∞—О—Й–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–∞ –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞ –њ—А–Є –С–Э–° –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –±–Њ–ї–Є [16].
–Т –љ–∞—Б—В–Њ—П—Й–µ–є —А–∞–±–Њ—В–µ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ—Л—Е —Д–Њ—А–Љ –•–° –Є –У–°.
–Т–њ–µ—А–≤—Л–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Е–Њ–љ–і—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–Њ–≤ (–•–°) –њ—А–Є
—Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –≤ —Б–њ–Є–љ–µ –њ—А–µ–і–њ—А–Є–љ—П—В–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є
K.D. Christensen, L.R. Bucci (1989), –≥–і–µ –±—Л–ї–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М [17].
–Ю—В–і–µ–ї—М–љ–Њ–≥–Њ –≤–љ–Є–Љ–∞–љ–Є—П –Ј–∞—Б–ї—Г–ґ–Є–≤–∞–µ—В —А–∞–±–Њ—В–∞ –Р.–Х. –С–∞—А—Г–ї–Є–љ–∞ –Є –Ю.–Т. –Ъ—Г—А—Г—И–Є–љ–Њ–є (2014) [18], –≤ –Ї–Њ—В–Њ—А–Њ–є –∞–≤—В–Њ—А—Л —Б–Њ—З–µ—В–∞–ї–Є –њ–∞—А–∞–≤–µ—А—В–µ–±—А–∞–ї—М–љ–Њ–µ –Є –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –•–°. –Р–≤—В–Њ—А—Л –і–µ–ї–∞—О—В –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ, —З—В–Њ –•–° —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –≤–≤–Њ–і–Є—В—М –њ–∞—А–∞–≤–µ—А—В–µ–±—А–∞–ї—М–љ–Њ –Є/–Є–ї–Є –ї–Њ–Ї–∞–ї—М–љ–Њ –≤–Њ–Ј–ї–µ –Ї—А—Г–њ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞ (–≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ), —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –±—Л—Б—В—А–µ–µ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–µ–µ –і–Њ—Б—В–Є–≥–∞—В—М –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є –•–° –≤ —А–µ–≥–Є–Њ–љ–∞—А–љ–Њ–Љ –Ї—А–Њ–≤–Њ—В–Њ–Ї–µ –њ–Њ—А–∞–ґ–µ–љ–љ—Л—Е —Г—З–∞—Б—В–Ї–Њ–≤ –Њ–њ–Њ—А–љ–Њ-–і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –њ–Њ–≤—Л—И–∞—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –Є —Б–Њ–Ї—А–∞—Й–∞—В—М —Б—А–Њ–Ї–Є –љ–µ—В—А—Г–і–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є.
–Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ –њ—Г–±–ї–Є–Ї–∞—Ж–Є—П—Е –њ–Њ—Б–ї–µ–і–љ–Є—Е –ї–µ—В –Њ—В–Љ–µ—З–∞–µ—В—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –•–° –Є –У–° –≤ —В–µ—А–∞–њ–Є–Є –±–Њ–ї–Є –њ—А–Є –Ю–Р [10]. –Т–∞–ґ–љ—Л–Љ –і–Њ–≤–Њ–і–Њ–Љ –≤ –њ–Њ–ї—М–Ј—Г —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –•–° –Є –У–° —Б–ї—Г–ґ–∞—В —А–µ–Ј—Г–ї—М—В–∞—В—Л —Д–∞—А–Љ–∞–Ї–Њ–њ—А–Њ—В–µ–Њ–Љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [19], —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є–µ –Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ —Е–Њ–љ–і—А–Њ—Ж–Є—В–µ (—Б–Є–љ—В–µ–Ј –±–µ–ї–Ї–∞ –Є —Б—В—А–µ—Б—Б–Њ—Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М) –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Н—В–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є.
–Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ—Л–µ —Д–Њ—А–Љ—Л –•–° –Є –У–° –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –Њ–њ—В–Є–Љ–∞–ї—М–љ—Г—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ —Е—А—П—Й–µ–≤–Њ–є —В–Ї–∞–љ–Є —Г–ґ–µ —Б –њ–µ—А–≤–Њ–є –Є–љ—К–µ–Ї—Ж–Є–Є, —З—В–Њ –Љ–Њ–ґ–µ—В –≤–ї–Є—П—В—М –Є –љ–∞ —Б–Ї–Њ—А–Њ—Б—В—М –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–µ–≥–Њ —Н—Д—Д–µ–Ї—В–∞. –Ш–Љ–µ–љ–љ–Њ –њ–Њ—Н—В–Њ–Љ—Г –Љ—Л —А–µ—И–Є–ї–Є –њ—А–Њ–≤–µ—Б—В–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–є –Є–љ—В–µ—А–Љ–Є—В—В–Є—А—Г—О—Й–µ–є —Б—Е–µ–Љ—Л –≤–≤–µ–і–µ–љ–Є—П –•–° –Є –У–°.
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П вАФ –Њ—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є–љ—В–µ—А–Љ–Є—В—В–Є—А—Г—О—Й–µ–є —Б—Е–µ–Љ—Л –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –•–° –Є –У–° –≤ —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є —Б –µ–ґ–µ–і–љ–µ–≤–љ–Њ–є —Е–Њ–і—М–±–Њ–є –Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –њ–Њ–і–Њ–±—А–∞–љ–љ—Л–Љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–Љ —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е —Г–њ—А–∞–ґ–љ–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ—Ж–Є–і–Є–≤–Њ–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –С–Э–°.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
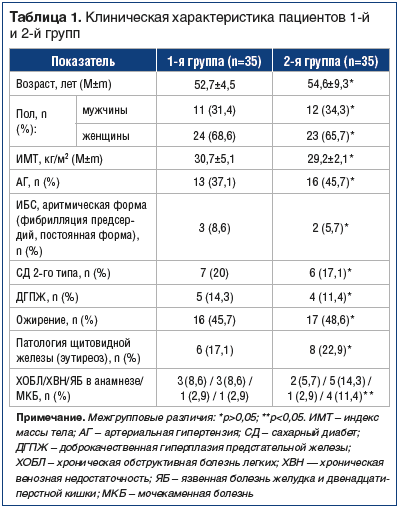
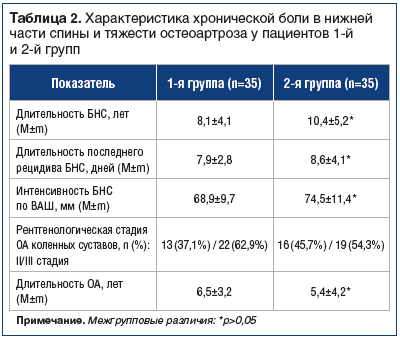
–Я—А–Њ–≤–µ–і–µ–љ–Њ –Њ—В–Ї—А—Л—В–Њ–µ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б–Ї—А–Є–љ–Є–љ–≥–∞ 118 –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї—М—О –≤ —Б–њ–Є–љ–µ –Њ—В–Њ–±—А–∞–љ–Њ 70 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –љ–∞ 2 —А–∞–≤–љ—Л–µ –≥—А—Г–њ–њ—Л –Љ–µ—В–Њ–і–Њ–Љ —Б–ї—Г—З–∞–є–љ—Л—Е —З–Є—Б–µ–ї.–Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ: –С–Э–° (–Њ–њ–Є—Б—Л–≤–∞–µ–Љ–∞—П —В–µ—А–Љ–Є–љ–∞–Љ–Є: ¬Ђ–і–Њ—А—Б–Њ–њ–∞—В–Є—П¬ї, ¬Ђ—Б–њ–Њ–љ–і–Є–ї–Њ–∞—А—В—А–Є—В¬ї, ¬Ђ—Б–њ–Њ–љ–і–Є–ї–Њ–њ–∞—В–Є—П¬ї, ¬Ђ–њ—А–Њ—В—А—Г–Ј–Є—П –і–Є—Б–Ї–∞¬ї, ¬Ђ–≥—А—Л–ґ–∞ –і–Є—Б–Ї–∞ –±–µ–Ј –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞¬ї) >40 –Љ–Љ –њ–Њ –≤–Є–Ј—Г–∞–ї—М–љ–Њ–є –∞–љ–∞–ї–Њ–≥–Њ–≤–Њ–є —И–Ї–∞–ї–µ –±–Њ–ї–Є (–Т–Р–®); –Ю–Р –Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞ IIвАУIII —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б—В–∞–і–Є–Є –њ–Њ Kellgren вАФ Lowrence; –≥–Њ—В–Њ–≤–љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–∞ –Њ—В–Ї–∞–Ј–∞—В—М—Б—П –Њ—В –њ—А–Є–µ–Љ–∞ –Є–љ—Л—Е –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї—А–Њ–Љ–µ –љ–∞–Ј–љ–∞—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є; —Б–Њ–≥–ї–∞—Б–Є–µ —Б–ї–µ–і–Њ–≤–∞—В—М —В—А–µ–±–Њ–≤–∞–љ–Є—П–Љ –њ—А–Њ—В–Њ–Ї–Њ–ї–∞ –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П; –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–∞ –і–ї—П –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є–є –Є –љ–∞–±–ї—О–і–µ–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞—З–Є–љ–∞—П —Б –Љ–Њ–Љ–µ–љ—В–∞ –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –љ–µ–≥–Њ; –≥–Њ—В–Њ–≤–љ–Њ—Б—В—М –Њ—В–Ї–∞–Ј–∞—В—М—Б—П –Њ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –Э–Я–Т–Я (–≤ 1-–є –≥—А—Г–њ–њ–µ) –љ–∞ –≤–µ—Б—М –њ–µ—А–Є–Њ–і –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П; –њ–Њ–і–њ–Є—Б–∞–љ–Є–µ –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Њ–≥–ї–∞—Б–Є—П –љ–∞ —Г—З–∞—Б—В–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є.
–Ъ—А–Є—В–µ—А–Є–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П: –Њ—В—З–µ—В–ї–Є–≤—Л–є –љ–µ–≤—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–є –Є/–Є–ї–Є –њ—Б–Є—Е–Њ–≥–µ–љ–љ—Л–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞; –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –ї—О–±–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є; —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В 1-–≥–Њ —В–Є–њ–∞; —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї–µ–Ј–љ—М –њ–Њ—З–µ–Ї —Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О (—Г—А–Њ–≤–µ–љ—М –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ вЙ•180 –Љ–Љ–Њ–ї—М/–ї, —Б–Ї–Њ—А–Њ—Б—В—М –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є <30 –Љ–ї/–Љ–Є–љ); –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–µ—З–µ–љ–Є —Б –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О (–∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–є –≥–µ–њ–∞—В–Є—В, –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–∞—П –±–Њ–ї–µ–Ј–љ—М –њ–µ—З–µ–љ–Є); –±–Њ–ї–µ–Ј–љ–Є –Ї—А–Њ–≤–Є; –Ј–ї–Њ—Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –∞–ї–Ї–Њ–≥–Њ–ї–µ–Љ (–≤ —Б—А–µ–і–љ–µ–Љ вЙ•20 –≥ —З–Є—Б—В–Њ–≥–Њ —Н—В–∞–љ–Њ–ї–∞ –≤ –і–µ–љ—М); –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П; –≤—В–Њ—А–Є—З–љ—Л–є –∞—А—В—А–Њ–Ј (–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–є, –њ–Њ–і–∞–≥—А–∞); –≥–Є–њ–µ—А—Г—А–Є–Ї–µ–Љ–Є—П, –Ї–Њ—В–Њ—А–∞—П –љ–µ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ; –∞—Б–µ–њ—В–Є—З–µ—Б–Ї–Є–є –љ–µ–Ї—А–Њ–Ј –Љ—Л—Й–µ–ї–Ї–Њ–≤ –±–µ–і—А–µ–љ–љ–Њ–є –Є –±–Њ–ї—М—И–µ–±–µ—А—Ж–Њ–≤–Њ–є –Ї–Њ—Б—В–µ–є; –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ –Ї–Њ–ї–µ–љ–љ–Њ–Љ —Б—Г—Б—В–∞–≤–µ –Є–ї–Є –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–µ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ; –≤–љ—Г—В—А–Є—Б—Г—Б—В–∞–≤–љ–Њ–µ –Є/–Є–ї–Є –њ–∞—А–∞–≤–µ—А—В–µ–±—А–∞–ї—М–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –ї—О–±—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ 6 –љ–µ–і. –і–Њ –љ–∞—З–∞–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Ф–ї—П –Є–Ј—Г—З–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є–љ—В–µ—А–Љ–Є—В—В–Є—А—Г—О—Й–µ–є —Б—Е–µ–Љ—Л –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –•–° –Є –У–° –≤ —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є —Б –µ–ґ–µ–і–љ–µ–≤–љ–Њ–є —Е–Њ–і—М–±–Њ–є –Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –њ–Њ–і–Њ–±—А–∞–љ–љ—Л–Љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–Љ —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е —Г–њ—А–∞–ґ–љ–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ—Ж–Є–і–Є–≤–Њ–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –С–Э–° –±—Л–ї–Є –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –њ–µ—А–≤–Є—З–љ—Л–µ –Є –≤—В–Њ—А–Є—З–љ—Л–µ —В–Њ—З–Ї–Є –Њ—Ж–µ–љ–Ї–Є.
–Я–µ—А–≤–Є—З–љ—Л–µ —В–Њ—З–Ї–Є: –њ—А–Њ—Ж–µ–љ—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Њ—В–≤–µ—В–Є–≤—И–Є—Е –љ–∞ —В–µ—А–∞–њ–Є—О, –Њ—Ж–µ–љ–µ–љ–љ—Л–є –њ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є—О –±–Њ–ї–Є, —Б–Њ–≥–ї–∞—Б–љ–Њ –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–∞–Љ (—Г–Љ–µ–љ—М—И–µ–љ–Є–µ –±–Њ–ї–Є –њ–Њ –Т–Р–® –љ–∞ вЙ•50%); –Њ—Ж–µ–љ–Ї–∞ –і–Є–љ–∞–Љ–Є–Ї–Є –±–Њ–ї–Є –њ–Њ –Т–Р–®; —Б—А–Њ–Ї–Є –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є—П, —Г–і–Њ–≤–ї–µ—В–≤–Њ—А—П—О—Й–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞.
–Т—В–Њ—А–Є—З–љ—Л–µ —В–Њ—З–Ї–Є: –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є; –Њ—Ж–µ–љ–Ї–∞ –і–Є–љ–∞–Љ–Є–Ї–Є –±–Њ–ї–Є –≤ —Б—Г—Б—В–∞–≤–∞—Е –њ–Њ –Т–Р–®; –≤–ї–Є—П–љ–Є–µ –љ–∞ –Њ—Б–љ–Њ–≤–љ—Л–µ –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л (–∞–ї–∞–љ–Є–љ–∞–Љ–Є–љ–Њ—В—А–∞–љ—Б—Д–µ—А–∞–Ј–∞ вАФ –Р–Ы–Ґ, –∞—Б–њ–∞—А—В–∞—В–∞–Љ–Є–љ–Њ—В—А–∞–љ—Б—Д–µ—А–∞–Ј–∞ вАФ –Р–°–Ґ, –≥–ї—О–Ї–Њ–Ј–∞ –Ї—А–Њ–≤–Є, –Ї—А–µ–∞—В–Є–љ–Є–љ –Ї—А–Њ–≤–Є), –і–Є–љ–∞–Љ–Є–Ї–∞ —Г—А–Њ–≤–љ—П –°-—А–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ (–°–†–С) –≤ 1-–є –≥—А—Г–њ–њ–µ, —З–∞—Б—В–Њ—В–∞ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є.
–Т–Ї–ї—О—З–µ–љ–љ—Л–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 2 –≥—А—Г–њ–њ—Л –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В—А–∞—В–µ–≥–Є–Є —В–µ—А–∞–њ–Є–Є –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –Я–∞—Ж–Є–µ–љ—В–∞–Љ 1-–є –≥—А—Г–њ–њ—Л (n=35) –±—Л–ї–∞ –љ–∞–Ј–љ–∞—З–µ–љ–∞ –Є–љ—В–µ—А–Љ–Є—В—В–Є—А—Г—О—Й–∞—П —Б—Е–µ–Љ–∞ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –•–Њ–љ–і—А–Њ–≥–∞—А–і–∞ –њ–Њ 2,0 –Љ–ї (200 –Љ–≥) –≤/–Љ —З–µ—А–µ–Ј –і–µ–љ—М вДЦ 20 –Є –°—Г—Б—В–∞–≥–∞—А–і–∞ –Р—А—В—А–Њ –њ–Њ 3,0 –Љ–ї –≤/–Љ (2,0 –Љ–ї вАФ 200 –Љ–≥ –і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Є 1,0 –Љ–ї —А–∞—Б—В–≤–Њ—А–Є—В–µ–ї—П) —З–µ—А–µ–Ј –і–µ–љ—М вДЦ 20 [20, 21]. –Я—А–µ–њ–∞—А–∞—В—Л –≤–≤–Њ–і–Є–ї–Є –≤ —А–µ–ґ–Є–Љ–µ —З–µ—А–µ–і–Њ–≤–∞–љ–Є—П: 1-–є, 3-–є, 5-–є, 7-–є –і–µ–љ—М –Є —В. –і. вАФ –•–°; 2-–є, 4-–є, 6-–є –і–µ–љ—М —В–µ—А–∞–њ–Є–Є –Є —В. –і. вАФ –У–°. –Ъ–∞–ґ–і—Л–є –њ–∞—Ж–Є–µ–љ—В –±—Л–ї –Њ—Б–Љ–Њ—В—А–µ–љ —В–µ—А–∞–њ–µ–≤—В–Њ–Љ –Є –љ–µ–≤—А–Њ–ї–Њ–≥–Њ–Љ –і–ї—П –Є—Б–Ї–ї—О—З–µ–љ–Є—П —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –њ—А–Є—З–Є–љ –±–Њ–ї–Є –≤ —Б–њ–Є–љ–µ. –Ъ–Њ–љ—Б–Є–ї–Є—Г–Љ–Њ–Љ —В–µ—А–∞–њ–µ–≤—В–∞, –љ–µ–≤—А–Њ–ї–Њ–≥–∞ –Є —А–µ–∞–±–Є–ї–Є—В–Њ–ї–Њ–≥–∞ –±—Л–ї —А–∞–Ј—А–∞–±–Њ—В–∞–љ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б —Г–њ—А–∞–ґ–љ–µ–љ–Є–є –і–ї—П –Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞ –Є –љ–Є–ґ–љ–µ–є —З–∞—Б—В–Є —Б–њ–Є–љ—Л. –Я–µ—А–≤—Л–µ 10 –Ј–∞–љ—П—В–Є–є –њ—А–Њ—Е–Њ–і–Є–ї–Є –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е, –і–∞–ї–µ–µ –і–Њ –Ї–Њ–љ—Ж–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є–љ—Б—В—А—Г–Ї—В–Њ—А –Ы–§–Ъ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї –µ–ґ–µ–і–љ–µ–≤–љ—Л–є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П —Г–њ—А–∞–ґ–љ–µ–љ–Є–є. –Т—Б–µ –±–Њ–ї—М–љ—Л–µ 1-–є –≥—А—Г–њ–њ—Л –≤—Л–њ–Њ–ї–љ—П–ї–Є –µ–ґ–µ–і–љ–µ–≤–љ—Г—О –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Г—О –љ–Њ—А–Љ—Г —Е–Њ–і—М–±—Л (5000вАУ12 000 —И–∞–≥–Њ–≤ –≤ —Б—Г—В–Ї–Є), —Б–Њ–≥–ї–∞—Б–Њ–≤–∞–љ–љ—Г—О –Ї–Њ–љ—Б–Є–ї–Є—Г–Љ–Њ–Љ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤. –£ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Н—В—Г –љ–Њ—А–Љ—Г –Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞–ї–Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є, –љ–Њ –љ–µ –Љ–µ–љ–µ–µ 10 000 —И–∞–≥–Њ–≤ –Ї –Ї–Њ–љ—Ж—Г 3-–є –љ–µ–і–µ–ї–Є —В–µ—А–∞–њ–Є–Є.
–Я–∞—Ж–Є–µ–љ—В–∞–Љ 2-–є –≥—А—Г–њ–њ—Л (n=35, –Ї–Њ–љ—В—А–Њ–ї—М) —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ —Б—В–∞–љ–і–∞—А—В–љ–∞—П —В–µ—А–∞–њ–Є—П, –≤–Ї–ї—О—З–∞–≤—И–∞—П –Э–Я–Т–Я, –њ–Њ–і–Њ–±—А–∞–љ–љ—Л–µ —Б —Г—З–µ—В–Њ–Љ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞ —В–µ—А–∞–њ–Є–Є –±–Њ–ї–Є. –Ш–Ј –љ–Є—Е 2 (5,7%) –њ–∞—Ж–Є–µ–љ—В–∞, –Є–Љ–µ–≤—И–Є—Е –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –Э–Я–Т–Я (–њ—А–Є–µ–Љ –Њ—А–∞–ї—М–љ—Л—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –≤ —Б–≤—П–Ј–Є —Б –љ–∞–ї–Є—З–Є–µ–Љ –љ–µ–Ї–ї–∞–њ–∞–љ–љ–Њ–є —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є) –њ–Њ–ї—Г—З–∞–ї–Є –њ–∞—А–∞—Ж–µ—В–∞–Љ–Њ–ї –≤ –і–Њ–Ј–µ 2,0вАУ3,0 –≥/—Б—Г—В.
–С—Л–ї–Є –љ–∞–Ј–љ–∞—З–µ–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ –Э–Я–Т–Я: –Ї–µ—В–Њ–њ—А–Њ—Д–µ–љ (7 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, 35%); –ї–Њ—А–љ–Њ–Ї—Б–Є–Ї–∞–Љ (8, 22,9%), –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї (10, 28,6%), –Є–±—Г–њ—А–Њ—Д–µ–љ (8, 22,9%). –Ф–Њ–Ј—Л –Њ–њ—А–µ–і–µ–ї—П–ї–Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –Є —В–Є—В—А–Њ–≤–∞–ї–Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є. –Ґ–µ—А–∞–њ–Є—О –Э–Я–Т–Я –Є –њ–∞—А–∞—Ж–µ—В–∞–Љ–Њ–ї–Њ–Љ –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–µ–≥–Њ —Н—Д—Д–µ–Ї—В–∞, —Г–і–Њ–≤–ї–µ—В–≤–Њ—А—П—О—Й–µ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л–Љ —Б—В—А–∞—В–µ–≥–Є—П–Љ –ї–µ—З–µ–љ–Є—П –Њ–±–Њ—Б—В—А–µ–љ–Є–є –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –Я–∞—Ж–Є–µ–љ—В–∞–Љ, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–љ–Є–Љ–∞–ї–Є –Э–Я–Т–Я, –±—Л–ї —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ –њ—А–Є–µ–Љ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ –≤ –і–Њ–Ј–µ 20 –Љ–≥ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Э–Я–Т–Я-–≥–∞—Б—В—А–Њ–њ–∞—В–Є–Є.
–Ф–ї—П –∞–љ–∞–ї–Є–Ј–∞ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –≤ –љ–∞—З–∞–ї–µ –Є –≤ –Ї–Њ–љ—Ж–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є –Є–Ј—Г—З–µ–љ—Л —Г—А–Њ–≤–љ–Є –≥–ї—О–Ї–Њ–Ј—Л –≤ –Ї—А–Њ–≤–Є –љ–∞—В–Њ—Й–∞–Ї, –Р–Ы–Ґ, –Р–°–Ґ, –Ї—А–µ–∞—В–Є–љ–Є–љ–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–Є —З–∞—Б—В–Њ—В—Г –ї—О–±—Л—Е –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 1-–є –≥—А—Г–њ–њ—Л –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Є–Ј—Г—З–∞–ї–Є —Г—А–Њ–≤–µ–љ—М –°–†–С –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є.
–С–∞–Ј–∞ –і–∞–љ–љ—Л—Е —Б–Њ–Ј–і–∞–љ–∞ –≤ –њ—А–Њ–≥—А–∞–Љ–Љ–µ Microsoft Exel 2011 –і–ї—П MacOS. –Т—Л—З–Є—Б–ї—П–ї–Є —Б—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –Є —Б—В–∞–љ–і–∞—А—В–љ—Л–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П. –Ф–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–Є–є –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –њ–Њ –Ї—А–Є—В–µ—А–Є—О –°—В—М—О–і–µ–љ—В–∞ (–і–≤—Г—Е–њ–∞—А–љ—Л–є —Б –љ–µ—А–∞–≤–љ—Л–Љ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–µ–Љ). –Р–љ–∞–ї–Є–Ј –і–∞–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Є –≤ –њ—А–Њ–≥—А–∞–Љ–Љ–∞—Е Microsoft Exel.
–†–µ–Ј—Г–ї—М—В–∞—В—Л
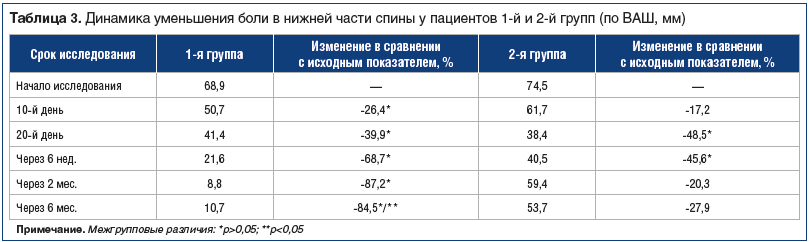
–Т—Б–µ –≤–Ї–ї—О—З–µ–љ–љ—Л–µ –њ–∞—Ж–Є–µ–љ—В—Л –Ј–∞–Ї–Њ–љ—З–Є–ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ.–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 1-–є –≥—А—Г–њ–њ—Л –Ї –Ї–Њ–љ—Ж—Г –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є (6 –љ–µ–і.) –≤ 32 (91,4%) —Б–ї—Г—З–∞—П—Е —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –С–Э–° —Б–Њ—Б—В–∞–≤–Є–ї–Њ >50%, –≤ —Б—А–µ–і–љ–µ–Љ вАФ –љ–∞ 68,7% (p<0,05).
–Ъ –Ї–Њ–љ—Ж—Г –њ—А–Є–µ–Љ–∞ –Э–Я–Т–Я –≤–Њ 2-–є –≥—А—Г–њ–њ–µ —Г–і–∞–ї–Њ—Б—М —Г–Љ–µ–љ—М—И–Є—В—М –±–Њ–ї—М –≤ —Б–њ–Є–љ–µ –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 48,5% (p<0,05). –Я—А–Є —Н—В–Њ–Љ —Г 22 (62,9%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–µ–љ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –±–Њ–ї–Є –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 56,4%, –∞ —Г 13 вАФ –ї–Є—И—М –љ–∞ 39,2%. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–Њ–±–Є—В—М—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є—П —Г–і–∞–ї–Њ—Б—М —Г 62,9% –њ–∞—Ж–Є–µ–љ—В–Њ–≤.


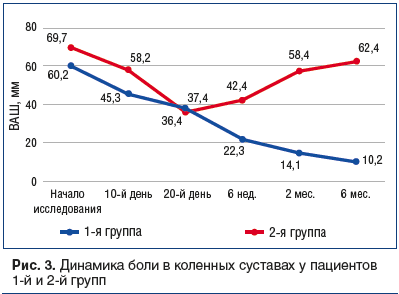
–Ь–µ–ґ–≥—А—Г–њ–њ–Њ–≤–∞—П —А–∞–Ј–љ–Є—Ж–∞ –њ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є—О –±–Њ–ї–Є –≤ –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–∞—Е –Ї –Ї–Њ–љ—Ж—Г –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є —Б–Њ—Б—В–∞–≤–Є–ї–∞ 22,7% (p<0,05). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–∞—П –Љ–µ—В–Њ–і–Є–Ї–∞ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –С–Э–° –Њ–Ї–∞–Ј–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≤ –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–∞—Е, —Б–≤—П–Ј–∞–љ–љ–Њ–≥–Њ —Б –Ю–Р.
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –љ–Є –≤–Њ –≤—А–µ–Љ—П –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –љ–Є –≤–Њ –≤—А–µ–Љ—П –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П.

–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –°–†–С —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 1-–є –≥—А—Г–њ–њ—Л –љ–∞ 25% c 5,1 –Љ–≥/–ї –і–Њ 3,8 –Љ–≥/–ї (p<0,05). –£ 11 (31,4%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Н—В–Њ–є –≥—А—Г–њ–њ—Л —Г—А–Њ–≤–µ–љ—М –°–†–С –њ—А–µ–≤—Л—И–∞–ї —А–µ—Д–µ—А–µ–љ—Б–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П, –Є –≤ —Б—А–µ–і–љ–µ–Љ –µ–≥–Њ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ 12,6¬±2,3 –Љ–≥/–ї. –Ч–∞ 6 –љ–µ–і. —В–µ—А–∞–њ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –°–†–С —Г –љ–Є—Е —Б–љ–Є–Ј–Є–ї–∞—Б—М –≤ —Б—А–µ–і–љ–µ–Љ –і–Њ 4,8¬±3,1 –Љ–≥/–ї (–љ–∞ 38,1% –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Є—Б—Е–Њ–і–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ). –≠—В–Њ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ —П–≤–ї—П–µ—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–Љ –≤–ї–Є—П–љ–Є—П –•–° –Є –У–° –љ–∞ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є —Б–Њ–≥–ї–∞—Б—Г–µ—В—Б—П —Б –і–∞–љ–љ—Л–Љ–Є –ї–Є—В–µ—А–∞—В—Г—А—Л.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, 6-–љ–µ–і–µ–ї—М–љ–∞—П –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–∞—П –Є–љ—В–µ—А–Љ–Є—В—В–Є—А—Г—О—Й–∞—П —В–µ—А–∞–њ–Є—П –•–° –Є –У–° –≤ —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є —Б –µ–ґ–µ–і–љ–µ–≤–љ–Њ–є —Е–Њ–і—М–±–Њ–є –Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–Љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–Љ —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е —Г–њ—А–∞–ґ–љ–µ–љ–Є–є –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ–є, —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б–Є–ї–∞—Б—М –±–Њ–ї—М–љ—Л–Љ–Є, –љ–µ –≤—Л–Ј—Л–≤–∞–ї–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –њ–Њ—З–µ—З–љ—Л—Е –Є –њ–µ—З–µ–љ–Њ—З–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є, –љ–µ –≤–ї–Є—П–ї–∞ –љ–∞ —Г–≥–ї–µ–≤–Њ–і–љ—Л–є –Њ–±–Љ–µ–љ. –Ч–∞ 6 –љ–µ–і. —В–µ—А–∞–њ–Є–Є —Г—А–Њ–≤–µ–љ—М –°–†–С —Г–Љ–µ–љ—М—И–Є–ї—Б—П –љ–∞ 25% –≤ —Б—А–µ–і–љ–µ–Љ –њ–Њ –≥—А—Г–њ–њ–µ –Є –љ–∞ 38,1% —Г –±–Њ–ї—М–љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –±—Л–ї –њ–Њ–≤—Л—И–µ–љ.
–Т—Л–≤–Њ–і—Л
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–є –Є–љ—В–µ—А–Љ–Є—В—В–Є—А—Г—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –•–° –Є –У–° –≤ —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є —Б –µ–ґ–µ–і–љ–µ–≤–љ–Њ–є —Е–Њ–і—М–±–Њ–є –Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –њ–Њ–і–Њ–±—А–∞–љ–љ—Л–Љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–Љ —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е —Г–њ—А–∞–ґ–љ–µ–љ–Є–є –≤ —В–µ—З–µ–љ–Є–µ 6 –љ–µ–і. –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ–±–Є—В—М—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є—П —Г 91,4% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —В–µ—А–∞–њ–Є—П –Э–Я–Т–Я вАФ –ї–Є—И—М —Г 62,9%.–Я–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–∞—П –Є–љ—В–µ—А–Љ–Є—В—В–Є—А—Г—О—Й–∞—П —В–µ—А–∞–њ–Є—П –•–° –Є –У–° –≤ —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є —Б –µ–ґ–µ–і–љ–µ–≤–љ–Њ–є —Е–Њ–і—М–±–Њ–є –Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –њ–Њ–і–Њ–±—А–∞–љ–љ—Л–Љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–Љ —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е —Г–њ—А–∞–ґ–љ–µ–љ–Є–є –≤ —В–µ—З–µ–љ–Є–µ 6 –љ–µ–і. –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Ї—Г–њ–Є—А–Њ–≤–∞—В—М –±–Њ–ї—М –≤ –љ–Є–ґ–љ–µ–є —З–∞—Б—В–Є —Б–њ–Є–љ—Л –љ–∞ 69% –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Є—Б—Е–Њ–і–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ, –њ—А–µ–≤–Њ—Б—Е–Њ–і—П —Н—Д—Д–µ–Ї—В —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є (–∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–є) —В–µ—А–∞–њ–Є–Є –Э–Я–Т–Я –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 23%.
–Т 1-–є –≥—А—Г–њ–њ–µ –Њ—В–Љ–µ—З–µ–љ–∞ —Г—Б—В–Њ–є—З–Є–≤–∞—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –±–Њ–ї–Є –љ–∞ 2-–Љ –Є 6-–Љ –Љ–µ—Б—П—Ж–∞—Е –љ–∞–±–ї—О–і–µ–љ–Є—П, —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –і–ї–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –ї–µ—З–µ–љ–Є—П –њ–Њ –і–∞–љ–љ–Њ–є –ї–µ—З–µ–±–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–µ.
–Т 1-–є –≥—А—Г–њ–њ–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –Ј–∞ 6 –Љ–µ—Б. —Г–≤–µ–ї–Є—З–Є–ї—Б—П –љ–∞ 56,6%, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –ї–Є—И—М –љ–∞1%.
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 1-–є –≥—А—Г–њ–њ—Л —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –°–†–С —Б–љ–Є–Ј–Є–ї–Њ—Б—М –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 25% –Є –љ–∞ 38,1% —Г –±–Њ–ї—М–љ—Л—Е —Б –Є—Б—Е–Њ–і–љ–Њ
–њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –°–†–С.
–Э–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є —В–µ—А–∞–њ–Є–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ.












