–Т–≤–µ–і–µ–љ–Є–µ
–Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –і–Њ –љ–µ–і–∞–≤–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–ї—Б—П –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –Ї–∞–Ї –њ—А–Њ–±–ї–µ–Љ–∞ —Б—В–∞—А–µ—О—Й–Є—Е –ґ–µ–љ—Й–Є–љ –≤ –Љ–µ–љ–Њ–њ–∞—Г–Ј–µ [1вАУ3]. –Ю–і–љ–∞–Ї–Њ —Б–µ–≥–Њ–і–љ—П —Н—В–∞ –≥–ї–Њ–±–∞–ї—М–љ–∞—П –Љ–µ–і–Є–Ї–Њ-—Б–Њ—Ж–Є–∞–ї—М–љ–∞—П –њ—А–Њ–±–ї–µ–Љ–∞ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –Ї—А–∞–є–љ–µ –∞–Ї—В—Г–∞–ї—М–љ–Њ–є –Є –і–ї—П –Љ—Г–ґ—Б–Ї–Њ–є —З–∞—Б—В–Є –љ–∞—Б–µ–ї–µ–љ–Є—П, –∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –≤ –Њ–±—Й–µ–є —Б—В—А—Г–Ї—В—Г—А–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є —З–µ–ї–Њ–≤–µ–Ї–∞ –≤ XXI –≤. —Г–ґ–µ –Ј–∞–љ–Є–Љ–∞–µ—В 4вАУ–µ –Љ–µ—Б—В–Њ –њ–Њ—Б–ї–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е, –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ (–°–Ф) 2-–≥–Њ —В–Є–њ–∞, –Ї–Њ—В–Њ—А—Л–µ, —П–≤–ї—П—П—Б—М –≤–Њ–Ј—А–∞—Б—В-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є —В–µ–љ–і–µ–љ—Ж–Є–µ–є –Ї –Њ–Љ–Њ–ї–Њ–ґ–µ–љ–Є—О [4вАУ6]. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Љ–Њ–ґ–љ–Њ –≤ –њ–Њ–ї–љ–Њ–є –Љ–µ—А–µ –≥–Њ–≤–Њ—А–Є—В—М –Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Љ–Є—А–Њ–≤–Њ–є —Н–њ–Є–і–µ–Љ–Є–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, –Ї–Њ—В–Њ—А—Л–є –њ–ї–Њ—Е–Њ –≤—Л—П–≤–ї—П–µ—В—Б—П –≤ –Њ–±—Й–µ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Є –≤—А–∞—З–∞–Љ–Є-—Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–∞–Љ–Є, –љ–Њ –љ–µ –њ–Њ—В–Њ–Љ—Г, —З—В–Њ –љ–µ—В –Њ–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –µ–≥–Њ —А–∞–љ–љ–µ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –∞ –њ–Њ—В–Њ–Љ—Г, —З—В–Њ —Г –≤—А–∞—З–µ–є –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В –љ–∞—Б—В–Њ—А–Њ–ґ–µ–љ–љ–Њ—Б—В—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ –Ї–Њ–≥–і–∞ —А–µ—З—М –Є–і–µ—В –Њ –њ—А–Њ–±–ї–µ–Љ–∞—Е –Љ—Г–ґ—Б–Ї–Њ–≥–Њ –Ј–і–Њ—А–Њ–≤—М—П. –≠—В–Њ–Љ—Г –љ–µ–Љ–∞–ї–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –±—Л—В—Г—О—Й–µ–µ –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ–≤–µ—А–љ–Њ–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–µ –Њ –і–∞–љ–љ–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є –Ї–∞–Ї –Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –ґ–µ–љ—Б–Ї–Њ–є –њ—А–Њ–±–ї–µ–Љ–µ.
–°–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞
–°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Њ–і–љ–Њ–≥–Њ –Є–Ј –љ–Њ–≤–µ–є—И–Є—Е –Ї—А—Г–њ–љ–Њ–Љ–∞—Б—И—В–∞–±–љ—Л—Е –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є NOREPOS, –≤–Ї–ї—О—З–∞–≤—И–µ–≥–Њ –њ–Њ—З—В–Є 85 —В—Л—Б. –Є–Ј–Љ–µ—А–µ–љ–Є–є –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–µ–є (–Ь–Я–Ъ) –Є –і–∞–љ–љ—Л–µ –Њ 140 —В—Л—Б. –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –±–µ–і—А–∞ –≤ –Э–Њ—А–≤–µ–≥–Є–Є –≤ 1994вАУ2008 –≥–≥., –Ї–∞–ґ–і—Л–є —З–∞—Б –≤ —Н—В–Њ–є —Б—В—А–∞–љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –љ–Њ–≤—Л–є –њ–µ—А–µ–ї–Њ–Љ —И–µ–є–Ї–Є –±–µ–і—А–∞; –Њ–Ї–Њ–ї–Њ 25% –±–Њ–ї—М–љ—Л—Е —Г–Љ–Є—А–∞–µ—В –≤ —В–µ—З–µ–љ–Є–µ 1 –≥–Њ–і–∞ –њ–Њ—Б–ї–µ –њ–µ—А–µ–ї–Њ–Љ–∞; –±–Њ–ї–µ–µ 12% –±–Њ–ї—М–љ—Л—Е –њ–µ—А–µ–љ–Њ—Б—П—В –њ–Њ–≤—В–Њ—А–љ—Л–є –њ–µ—А–µ–ї–Њ–Љ –±–µ–і—А–∞ –≤ —В–µ—З–µ–љ–Є–µ 10 –ї–µ—В –њ–Њ—Б–ї–µ –њ–µ—А–≤–Њ–≥–Њ –њ–µ—А–µ–ї–Њ–Љ–∞, –Є —В–Њ–ї—М–Ї–Њ 16% –±–Њ–ї—М–љ—Л—Е –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –њ—А–µ–њ–∞—А–∞—В—Л –і–ї—П –ї–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –≤ —В–µ—З–µ–љ–Є–µ 1 –≥–Њ–і–∞ –њ–Њ—Б–ї–µ –њ–µ—А–µ–ї–Њ–Љ–∞ —И–µ–є–Ї–Є –±–µ–і—А–∞ [7]. –І–∞—Б—В–Њ—В–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –≤ –У–µ—А–Љ–∞–љ–Є–Є —Г –ї–Є—Ж —Б—В–∞—А—И–µ 50 –ї–µ—В —Б–Њ—Б—В–∞–≤–ї—П–µ—В –љ–µ –Љ–µ–љ–µ–µ 14%: –Є–Љ —Б—В—А–∞–і–∞—О—В –Њ–Ї–Њ–ї–Њ 24% –ґ–µ–љ—Й–Є–љ –Є 6% –Љ—Г–ґ—З–Є–љ –≤ —Н—В–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ [8]. –Ю–±—Й–µ–µ —З–Є—Б–ї–Њ –±–Њ–ї—М–љ—Л—Е –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–Њ–Љ –≤ –У–µ—А–Љ–∞–љ–Є–Є –њ—А–Є–±–ї–Є–ґ–∞–µ—В—Б—П –Ї 6,3 –Љ–ї–љ —З–µ–ї–Њ–≤–µ–Ї, –њ—А–Є —Н—В–Њ–Љ –µ–ґ–µ–≥–Њ–і–љ–Њ –≤—Л—П–≤–ї—П–µ—В—Б—П –µ—Й–µ 885 —В—Л—Б. –љ–Њ–≤—Л—Е —Б–ї—Г—З–∞–µ–≤ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞. –Ю–±—Й–∞—П —З–∞—Б—В–Њ—В–∞ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –≤ —Б–≤—П–Ј–Є —Б –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–Њ–Љ –≤ –Њ–±—Й–µ–є —Б—В—А—Г–Ї—В—Г—А–µ —В—А–∞–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В —Б–µ–≥–Њ–і–љ—П –≤ –У–µ—А–Љ–∞–љ–Є–Є –љ–µ –Љ–µ–љ–µ–µ 52% [8]. –Т –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–Љ –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є NIIANES III —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —И–µ–є–Ї–Є –±–µ–і—А–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 18%, –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є вАУ 47,5% [9].
–Т –†–Њ—Б—Б–Є–Є –і–µ–ї–∞ –Њ–±—Б—В–Њ—П—В –≥–Њ—А–∞–Ј–і–Њ —Е—Г–ґ–µ. –°–Њ–≥–ї–∞—Б–љ–Њ —В–Њ–ї—М–Ї–Њ –Њ—Д–Є—Ж–Є–∞–ї—М–љ—Л–Љ –і–∞–љ–љ—Л–Љ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –њ–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј—Г, –≤ –≥—А—Г–њ–њ–µ —А–Є—Б–Ї–∞ –њ–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј—Г –≤ –†–§ —Б–Њ—Б—В–Њ–Є—В 34 –Љ–ї–љ —З–µ–ї–Њ–≤–µ–Ї, —В. –µ. –њ—А–Є–Љ–µ—А–љ–Њ 24% –љ–∞—Б–µ–ї–µ–љ–Є—П —Б—В—А–∞–љ—Л. –Я—А–Є —Н—В–Њ–Љ –Њ–Ї–Њ–ї–Њ 14 –Љ–ї–љ –ґ–Є—В–µ–ї–µ–є —Б—В—А–∞–љ—Л —Г–ґ–µ —Б—В—А–∞–і–∞—О—В —Н—В–Є–Љ –Њ–њ–∞—Б–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ, –Є –µ—Й–µ —Г 9 –Љ–ї–љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –≤—Л—А–∞–ґ–µ–љ–љ—Л–µ –њ–µ—А–µ–ї–Њ–Љ—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–Њ–Љ [10]. –Т –†–Њ—Б—Б–Є–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –Є–Љ–µ—О—В 33,8% –ґ–µ–љ—Й–Є–љ –Є 26,9% –Љ—Г–ґ—З–Є–љ —Б—В–∞—А—И–µ 50 –ї–µ—В, –∞ –µ—Й–µ —Г 43,3% –ґ–µ–љ—Й–Є–љ –Є 44,1% –Љ—Г–ґ—З–Є–љ –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –њ—А–Є–Ј–љ–∞–Ї–Є –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є [11]. –Ъ–∞–ґ–і—Л–µ 5 –Љ–Є–љ –≤ –†–Њ—Б—Б–Є–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ–µ—А–µ–ї–Њ–Љ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –±–µ–і—А–∞, –∞ —Н—В–Њ –±–Њ–ї–µ–µ 100 —В—Л—Б. –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –µ–ґ–µ–≥–Њ–і–љ–Њ. –Ъ–∞–ґ–і—Г—О –Љ–Є–љ—Г—В—Г —Б—А–µ–і–Є –ї—О–і–µ–є —Б—В–∞—А—И–µ 50 –ї–µ—В —Б–ї—Г—З–∞—О—В—Б—П 7 –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤ [10, 11]. –Я–Њ—Б–ї–µ –њ–µ—А–≤–Њ–≥–Њ –њ–µ—А–µ–ї–Њ–Љ–∞ —А–Є—Б–Ї –њ–Њ—Б–ї–µ–і—Г—О—Й–Є—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –ї—О–±–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 86%, –њ—А–Є —Н—В–Њ–Љ –њ–Њ–ї—Г—З–µ–љ–Є–µ –њ–µ—А–≤–Њ–≥–Њ –њ–µ—А–µ–ї–Њ–Љ–∞ –њ–Њ–Ј–≤–Њ–љ–Ї–∞ –≤ 5 —А–∞–Ј —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–Є—Б–Ї –њ–Њ–≤—В–Њ—А–љ—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤ –Є –≤ 2 —А–∞–Ј–∞ вАУ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –±–µ–і—А–∞, –Ј–∞–њ—Г—Б–Ї–∞–µ—В—Б—П —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–є ¬Ђ–Ї–∞—Б–Ї–∞–і –њ–µ—А–µ–ї–Њ–Љ–Њ–≤¬ї. –Т —Б—А–µ–і–љ–µ–Љ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј —Г–Љ–µ–љ—М—И–∞–µ—В –Њ–ґ–Є–і–∞–µ–Љ—Г—О –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ґ–Є–Ј–љ–Є –љ–∞ 12вАУ20% [10]. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е —А–µ–≥–Є–Њ–љ–∞—Е –†–Њ—Б—Б–Є–Є –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ –њ–Њ—Б–ї–µ –њ–µ—А–µ–ї–Њ–Љ–∞ —И–µ–є–Ї–Є –±–µ–і—А–µ–љ–љ–Њ–є –Ї–Њ—Б—В–Є –і–Њ—Б—В–Є–≥–∞–µ—В 50вАУ90%. –Ф–Њ 100% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–µ—А–µ–ї–Њ–Љ–Њ–Љ —И–µ–є–Ї–Є –±–µ–і—А–∞ –љ–µ –≤—Л–Ј–і–Њ—А–∞–≤–ї–Є–≤–∞—О—В –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ [10, 11]. –Ю—Б–Њ–±–µ–љ–љ–Њ –њ–ї–Њ—Е–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –≤—Л—П–≤–ї—П–µ—В—Б—П –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Љ—Г–ґ—З–Є–љ, —З–µ–Љ—Г –љ–µ–Љ–∞–ї–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –і–Њ —Б–Є—Е –њ–Њ—А –±—Л—В—Г—О—Й–Є–є –љ–µ–≤–µ—А–љ—Л–є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–є –≤–Ј–≥–ї—П–і –љ–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –Ї–∞–Ї –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –ґ–µ–љ—Б–Ї—Г—О –њ—А–Њ–±–ї–µ–Љ—Г. –Т –Є—В–Њ–≥–µ –і–Њ–ї–≥–Є–µ –≥–Њ–і—Л –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –њ—А–Њ—В–µ–Ї–∞–µ—В –ї–∞—В–µ–љ—В–љ–Њ, –∞ —Б–∞–Љ—Л–Љ —Б—В—А–∞—И–љ—Л–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ ¬Ђ–Љ–Њ–ї—З–∞–ї–Є–≤–Њ–≥–Њ¬ї, —В. –µ. –≤–Њ–≤—А–µ–Љ—П –љ–µ –≤—Л—П–≤–ї–µ–љ–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, —П–≤–ї—П—О—В—Б—П –Њ—Б—В–µ–Њ–њ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є–µ –њ–µ—А–µ–ї–Њ–Љ—Л —И–µ–є–Ї–Є –±–µ–і—А–∞, –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞, –њ—А–µ–і–њ–ї–µ—З—М—П, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б —Е—А—Г–њ–Ї–Њ—Б—В—М—О –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –≠—В–Є –њ–µ—А–µ–ї–Њ–Љ—Л –і–ї—П –Љ—Г–ґ—З–Є–љ –±–Њ–ї–µ–µ –Њ–њ–∞—Б–љ—Л, —З–µ–Љ –і–ї—П –ґ–µ–љ—Й–Є–љ, —В. –Ї. —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П –≤ 2 —А–∞–Ј–∞ –±–Њ–ї—М—И–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О –Є –≤–Њ–Ј–љ–Є–Ї–∞—О—В –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 7 –ї–µ—В —А–∞–љ—М—И–µ, —З–µ–Љ —Г –ґ–µ–љ—Й–Є–љ, —В. –µ. –≤ –µ—Й–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —В—А—Г–і–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ [12]. –Т —А–∞–Љ–Ї–∞—Е –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е –њ—А–Њ–≥—А–∞–Љ–Љ –Є–Ј—Г—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ (EVOS –Є EPOS) –Ш–љ—Б—В–Є—В—Г—В–Њ–Љ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є –†–Р–Э –±—Л–ї–Є —Б–Њ–±—А–∞–љ—Л —Б–≤–µ–і–µ–љ–Є—П –Њ —З–∞—Б—В–Њ—В–µ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є –≤ –†–Њ—Б—Б–Є–Є. –£ –ґ–µ–љ—Й–Є–љ —З–∞—Б—В–Њ—В–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –њ–Њ—П—Б–љ–Є—З–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 33,8%, —И–µ–є–Ї–Є –±–µ–і—А–∞ вАФ 43,3%; —Г –Љ—Г–ґ—З–Є–љ —Н—В–Є –≤–µ–ї–Є—З–Є–љ—Л —Б–Њ—Б—В–∞–≤–Є–ї–Є 26,9% –Є 44,1% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Т —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і—Г—О—Й–Є—Е 5 –ї–µ—В –Њ—В–Љ–µ—З–µ–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –≤ —Н—В–Њ–є –ґ–µ –≤—Л–±–Њ—А–Ї–µ вАУ –і–Њ 40% —Г –ґ–µ–љ—Й–Є–љ –Є –і–Њ 35,5% —Г –Љ—Г–ґ—З–Є–љ [10вАУ12]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –љ–∞–≥–ї—П–і–љ–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –≤–Њ –Љ–љ–Њ–≥–Є—Е —Б—В—А–∞–љ–∞—Е –Љ–Є—А–∞, –≤ —В. —З. –Є –≤ –†–Њ—Б—Б–Є–Є, –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ ¬Ђ–±–µ–Ј–Љ–Њ–ї–≤–љ–∞—П –њ–∞–љ–і–µ–Љ–Є—П –±–µ–Ј–Љ–Њ–ї–≤–љ–Њ–≥–Њ —Г–±–Є–є—Ж—Л¬ї –њ–Њ–і –љ–∞–Ј–≤–∞–љ–Є–µ–Љ ¬Ђ–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј¬ї [7вАУ12].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Є—П –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є —Г –Љ—Г–ґ—З–Є–љ
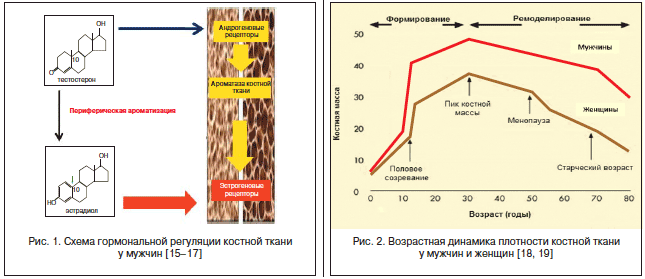
–°–Њ–≥–ї–∞—Б–љ–Њ –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–є —В–Њ—З–Ї–µ –Ј—А–µ–љ–Є—П, –љ–∞–Є–±–Њ–ї–µ–µ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є–Љ–Є –≥–Њ—А–Љ–Њ–љ–∞–Љ–Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ —Г –Њ–±–Њ–Є—Е –њ–Њ–ї–Њ–≤ —П–≤–ї—П—О—В—Б—П —Н—Б—В—А–Њ–≥–µ–љ—Л [13, 14]. –≠—В–Є–Љ —Д–∞–Ї—В–Њ–Љ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –њ—А–µ–≤–∞–ї–Є—А–Њ–≤–∞–љ–Є–µ —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–Њ–Љ –ґ–µ–љ—Й–Є–љ, —В. –Ї. —Н—Б—В—А–Њ–≥–µ–љ—Л —П–≤–ї—П—О—В—Б—П —Г –љ–Є—Е –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –њ–Њ–ї–Њ–≤—Л–Љ–Є —Б—В–µ—А–Њ–Є–і–љ—Л–Љ–Є –≥–Њ—А–Љ–Њ–љ–∞–Љ–Є. –Ш–Љ–µ–љ–љ–Њ –њ–Њ—Н—В–Њ–Љ—Г –љ–∞–Є–±–Њ–ї—М—И—Г—О –Њ–њ–∞—Б–љ–Њ—Б—В—М –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –і–ї—П –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ вАУ –њ—А–Є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–Љ –і–µ—Д–Є—Ж–Є—В–µ –њ–Њ–ї–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, –Ї–Њ–≥–і–∞ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –њ–µ—А–µ–ї–Њ–Љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б—В–∞—А—И–µ 50 –ї–µ—В –і–Њ—Б—В–Є–≥–∞–µ—В 53% [10, 12]. –Ю–і–љ–∞–Ї–Њ —Г –Љ—Г–ґ—З–Є–љ, –Ї–∞–Ї –Є —Г –ґ–µ–љ—Й–Є–љ, —Н—Б—В—А–Њ–≥–µ–љ—Л —В–∞–Ї–ґ–µ —П–≤–ї—П—О—В—Б—П –Ї–ї—О—З–µ–≤—Л–Љ–Є –≥–Њ—А–Љ–Њ–љ–∞–Љ–Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞, —Е–Њ—В—П –µ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П —А–µ–≥—Г–ї—П—Ж–Є—П —Г –Љ—Г–ґ—З–Є–љ –Є–Љ–µ–µ—В —Б–≤–Њ–Є —Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Є—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є —Б–Є–љ—В–µ–Ј–∞ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –≤ –Љ—Г–ґ—Б–Ї–Њ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ [15]. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Г –≤–Ј—А–Њ—Б–ї—Л—Е –Љ—Г–ґ—З–Є–љ —Г—А–Њ–≤–µ–љ—М —Н—Б—В—А–∞–і–Є–Њ–ї–∞ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б –њ–ї–Њ—В–љ–Њ—Б—В—М—О –Є –њ–Њ—В–µ—А–µ–є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, —З–µ–Љ —Г—А–Њ–≤–µ–љ—М —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞. –Ю–± —Н—В–Њ–Љ –≥–Њ–≤–Њ—А—П—В –і–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Љ–Њ–ї–Њ–і—Л—Е –Љ—Г–ґ—З–Є–љ —Б —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О –Ї —Н—Б—В—А–Њ–≥–µ–љ–∞–Љ –Є–ї–Є –і–µ—Д–Є—Ж–Є—В–Њ–Љ –∞—А–Њ–Љ–∞—В–∞–Ј—Л. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, —Г—А–Њ–≤–µ–љ—М –Є —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤, –Є –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤ —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ–Њ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б —А–Є—Б–Ї–Њ–Љ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —Г –њ–Њ–ґ–Є–ї—Л—Е –Љ—Г–ґ—З–Є–љ. –£—А–Њ–≤–µ–љ—М —Н—Б—В—А–∞–і–Є–Њ–ї–∞ –Ї—А–Њ–≤–Є —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Г—А–Њ–≤–љ—П —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ [16]. –£ –Љ—Г–ґ—З–Є–љ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –њ—А—П–Љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л, –Њ–±–Є–ї—М–љ–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –≤ –Ї–ї–µ—В–Ї–∞—Е –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –Ґ–∞–Ї–Њ–є ¬Ђ–Љ–µ—Б—В–љ—Л–є¬ї —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ –і–∞–ї–µ–µ –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –∞—А–Њ–Љ–∞—В–Є–Ј–∞—Ж–Є–Є –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –±–Њ–≥–∞—В–Њ–є —Д–µ—А–Љ–µ–љ—В–Њ–Љ –∞—А–Њ–Љ–∞—В–∞–Ј–Њ–є, –Є –Њ–±—А–∞–Ј–Њ–≤–∞–≤—И–Є–є—Б—П –≤ –Ї–Њ—Б—В–Є ¬Ђ–Љ–µ—Б—В–љ—Л–є¬ї —Н—Б—В—А–∞–і–Є–Њ–ї –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Б–≤–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–Њ–≤ –Є –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ [17]. –Ю–і–љ–∞–Ї–Њ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Љ—Г–ґ—Б–Ї–Є—Е —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ (–і–Њ 80%), –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є—Е —Б–≤–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞, –Њ–±—А–∞–Ј—Г–µ—В—Б—П –Є–Ј —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –≤–љ–µ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –∞—А–Њ–Љ–∞—В–Є–Ј–∞—Ж–Є–Є –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –Њ—А–≥–∞–љ–∞—Е –Є —В–Ї–∞–љ—П—Е (–њ–µ—З–µ–љ—М, –Ї–Њ–ґ–∞, –ґ–Є—А–Њ–≤–∞—П —В–Ї–∞–љ—М). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –Њ—Б—В–µ–Њ–Љ–Њ–і–µ–ї–Є—А—Г—О—Й–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ —Г –Љ—Г–ґ—З–Є–љ, –Ї–∞–Ї –Є —Г –ґ–µ–љ—Й–Є–љ, –Њ–±–ї–∞–і–∞—О—В —Н—Б—В—А–Њ–≥–µ–љ—Л, —Г –Љ—Г–ґ—З–Є–љ –Њ–љ–Є –Њ–±—А–∞–Ј—Г—О—В—Б—П –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –Є–Ј —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞. –Я–Њ—Н—В–Њ–Љ—Г –і–ї—П –Ј–і–Њ—А–Њ–≤—М—П –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є —Г –Љ—Г–ґ—З–Є–љ –Ї—А–∞–є–љ–µ –≤–∞–ґ–µ–љ –љ–Њ—А–Љ–∞–ї—М–љ—Л–є —Г—А–Њ–≤–µ–љ—М —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ [15]. –Т —Ж–µ–ї–Њ–Љ –ґ–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ –Є —Н—Б—В—А–Њ–≥–µ–љ—Л —Г –Љ—Г–ґ—З–Є–љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є —А–∞–±–Њ—В–∞—О—В –Ї–∞–Ї —Б–Є–љ–µ—А–≥–Є—Б—В—Л [15вАУ17] (—А–Є—Б. 1).
–Ы—О–±–Њ–є –і–µ—Д–Є—Ж–Є—В —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ —Г –Љ—Г–ґ—З–Є–љ —Б–њ–Њ—Б–Њ–±–µ–љ –њ—А–Є–≤–Њ–і–Є—В—М –Ї –і–µ—Д–Є—Ж–Є—В—Г —Н–љ–і–Њ–≥–µ–љ–љ—Л—Е —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Є —А–∞–Ј–≤–Є—В–Є—О –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є/–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, –Є –і–∞–љ–љ—Л–µ –ї–Є—В–µ—А–∞—В—Г—А—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В, —З—В–Њ —З–∞—Б—В–Њ—В–∞ –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є, –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Г –Љ–Њ–ї–Њ–і—Л—Е –Є –њ–Њ–ґ–Є–ї—Л—Е –Љ—Г–ґ—З–Є–љ —Б –≥–Є–њ–Њ–≥–Њ–љ–∞–і–Є–Ј–Љ–Њ–Љ [18]. –Ъ–∞–Ї –љ–Є –њ–∞—А–∞–і–Њ–Ї—Б–∞–ї—М–љ–Њ, –љ–Њ —З–∞—Б—В–Њ—В–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ 40 –ї–µ—В –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Љ—Г–ґ—З–Є–љ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤—Л—И–µ, —З–µ–Љ —Г –ґ–µ–љ—Й–Є–љ –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞. –Ю—Б–љ–Њ–≤–љ—Г—О –Љ–∞—Б—Б—Г –Љ—Г–ґ—З–Є–љ —Б –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–Њ–Љ –≤ —Н—В–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ —Б–Њ—Б—В–∞–≤–ї—П—О—В –Љ—Г–ґ—З–Є–љ—Л —Б –≤—А–Њ–ґ–і–µ–љ–љ—Л–Љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Б–∞–Љ–Њ–є —З–∞—Б—В–Њ–є –њ—А–Є—З–Є–љ–Њ–є –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є/–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –љ–Є–Љ–Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —Г –Љ–Њ–ї–Њ–і—Л—Е –Љ—Г–ґ—З–Є–љ –і–Њ 30 –ї–µ—В —П–≤–ї—П–µ—В—Б—П —Б–Є–љ–і—А–Њ–Љ –Ъ–ї–∞–є–љ—Д–µ–ї—М—В–µ—А–∞), –≤—Л—П–≤–ї–µ–љ–Є–µ, –∞ —В–µ–Љ –±–Њ–ї–µ–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П –Ї–Њ—А—А–µ–Ї—Ж–Є—П –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Ї—А–∞–є–љ–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ [14, 17]. –Я–Њ –Љ–µ—А–µ —Б—В–∞—А–µ–љ–Є—П –Љ—Г–ґ—З–Є–љ—Л –і–µ—Д–Є—Ж–Є—В —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ —Г—Б—Г–≥—Г–±–ї—П–µ—В—Б—П, –њ–Њ—Н—В–Њ–Љ—Г —Г –њ–Њ–ґ–Є–ї—Л—Е –Љ—Г–ґ—З–Є–љ —З–∞—Б—В–Њ—В–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –љ–Є–Љ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –њ—А–Є–Љ–µ—А–љ–Њ –Ї 50вАУ60 –≥–Њ–і–∞–Љ —Б—А–∞–≤–љ–Є–≤–∞–µ—В—Б—П —Б —В–∞–Ї–Њ–≤–Њ–є —Г –ґ–µ–љ—Й–Є–љ, –Њ–і–љ–∞–Ї–Њ –Є—Е –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П –і–ї—П –Љ—Г–ґ—З–Є–љ –Њ–Ї–∞–Ј—Л–≤–∞—О—В—Б—П –±–Њ–ї–µ–µ —В—П–ґ–µ–ї—Л–Љ–Є, —З–µ–Љ –і–ї—П –ґ–µ–љ—Й–Є–љ. –Ґ–∞–Ї, —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –≤—Л—П–≤–ї—П–µ—В—Б—П –њ—А–Є–Љ–µ—А–љ–Њ —Г 30% –њ–Њ–ґ–Є–ї—Л—Е –Љ—Г–ґ—З–Є–љ —Б –њ–µ—А–µ–ї–Њ–Љ–∞–Љ–Є –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞ –Є –і–Њ 50% –њ–Њ–ґ–Є–ї—Л—Е –Љ—Г–ґ—З–Є–љ —Б –њ–µ—А–µ–ї–Њ–Љ–∞–Љ–Є —И–µ–є–Ї–Є –±–µ–і—А–∞, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е –Њ–±—Й–∞—П –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ –њ–Њ—Б–ї–µ –њ–µ—А–µ–ї–Њ–Љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 30вАУ50%, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Г –ґ–µ–љ—Й–Є–љ –Њ–Ї–Њ–ї–Њ 20% [18, 19] (—А–Є—Б. 2).
–Т –љ–µ–і–∞–≤–љ–Є—Е –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞—Е –і–µ—Д–Є—Ж–Є—В —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ (–≥–Є–њ–Њ–≥–Њ–љ–∞–і–Є–Ј–Љ) —Г –Љ—Г–ґ—З–Є–љ –±—Л–ї –Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ –Ї–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–Њ, –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ –≤—В–Њ—А–Є—З–љ—Л–Љ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–Њ–Љ [20, 21]. –°–Њ–≥–ї–∞—Б–љ–Њ –њ–Њ—Б–ї–µ–і–љ–µ–Љ—Г —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤—Г –њ–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј—Г –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ (EES), –њ—А–µ–і–ї–∞–≥–∞–µ—В—Б—П –њ—А–Њ–≤–Њ–і–Є—В—М –Є–Ј–Љ–µ—А–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ —Г –≤—Б–µ—Е –Љ—Г–ґ—З–Є–љ, –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л—Е –њ–Њ –њ–Њ–≤–Њ–і—Г –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є–ї–Є –њ—А–Є –Њ—Ж–µ–љ–Ї–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Љ –ї–µ—З–µ–љ–Є—П –Ї–Њ—Б—В–љ–Њ-–∞–Ї—В–Є–≤–љ—Л–Љ–Є –≤–µ—Й–µ—Б—В–≤–∞–Љ–Є [22]. –°–Њ–≥–ї–∞—Б–љ–Њ –њ–Њ—Б–ї–µ–і–љ–µ–Љ—Г —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤—Г –њ–Њ –Љ—Г–ґ—Б–Ї–Њ–Љ—Г –≥–Є–њ–Њ–≥–Њ–љ–∞–і–Є–Ј–Љ—Г –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –≤–Њ–њ—А–Њ—Б–Њ–≤ —Б—В–∞—А–µ–љ–Є—П –Љ—Г–ґ—З–Є–љ (ISSAM), —Г –Љ—Г–ґ—З–Є–љ —Б—В–∞—А—И–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ –њ–∞–і–µ–љ–Є–є [23]. –Ґ–µ—А–∞–њ–Є—П —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–Њ–Љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ –Љ—Л—И–µ—З–љ—Г—О –Љ–∞—Б—Б—Г –Є —Б–Є–ї—Г, —З—В–Њ –Љ–Њ–ґ–µ—В —Г–Љ–µ–љ—М—И–∞—В—М —Б–Ї–ї–Њ–љ–љ–Њ—Б—В—М –Ї –њ–∞–і–µ–љ–Є—П–Љ –Є, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–љ–Є–ґ–∞—В—М —А–Є—Б–Ї –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [24, 25]. –Я–Њ—Н—В–Њ–Љ—Г –і–∞–љ–љ—Л–Љ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ–Љ —Г —Б—В–∞—А–µ—О—Й–Є—Е –Љ—Г–ґ—З–Є–љ —Б –≥–Є–њ–Њ–≥–Њ–љ–∞–і–Є–Ј–Љ–Њ–Љ –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–µ–є —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ –Њ—Ж–µ–љ–Ї–∞ –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–µ–є —Б 2-–ї–µ—В–љ–Є–Љ –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ [23]. –£ –Љ—Г–ґ—З–Є–љ —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В—М—О –Ї–Њ—Б—В–µ–є (–Ь–Я–Ъ), –њ–Њ–ї—Г—З–∞—О—Й–Є—Е —В–µ—А–∞–њ–Є—О —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–Њ–Љ, —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—П –Є–ї–Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Љ–Њ–≥—Г—В –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞—В—М—Б—П –µ–ґ–µ–≥–Њ–і–љ–Њ –Љ–µ—В–Њ–і–Њ–Љ –і–≤—Г—Е—Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–є —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–Њ–Љ–µ—В—А–Є–Є. –Ф–∞–љ–љ—Л–є –Љ–µ—В–Њ–і —П–≤–ї—П–µ—В—Б—П ¬Ђ–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї, –Ї–Њ—В–Њ—А—Л–є –њ—А–µ–і–Њ—Б—В–∞–≤–ї—П–µ—В –љ–∞–Є–±–Њ–ї–µ–µ –љ–∞–і–µ–ґ–љ—Г—О –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О [23]. –Ґ–∞–Ї–ґ–µ –Љ–Њ–ґ–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Г—О –Ї–Њ–Љ–њ—М—О—В–µ—А–љ—Г—О —В–Њ–Љ–Њ–≥—А–∞—Д–Є—О (–Ї–Ъ–Ґ), –Њ–і–љ–∞–Ї–Њ –њ—А–Є —Н—В–Њ–Љ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞—О—В –±–Њ–ї—М—И—Г—О –і–Њ–Ј—Г –Њ–±–ї—Г—З–µ–љ–Є—П. –Ф–ї—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Њ—Ж–µ–љ–Њ–Ї —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤—Л–µ –Љ–µ—В–Њ–і—Л –Є–Ј–Љ–µ—А–µ–љ–Є—П –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–µ–є –Њ—В—А–∞–ґ–∞—О—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –Њ—В–≤–µ—В –љ–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –Є –Љ–Њ–≥—Г—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і—А—Г–≥–Є—Е –Љ–µ—В–Њ–і–Њ–≤ [26]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–Њ—Б—В–љ–∞—П —В–Ї–∞–љ—М вАУ —Н—В–Њ —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ –∞–Ї—В–Є–≤–љ—Л–є –Њ—А–≥–∞–љ, –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є —Д—Г–љ–Ї—Ж–Є–є –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ—А–Є–љ–Є–Љ–∞—О—В –∞–Ї—В–Є–≤–љ–Њ–µ —Г—З–∞—Б—В–Є–µ –њ–Њ–ї–Њ–≤—Л–µ –≥–Њ—А–Љ–Њ–љ—Л (—Г –Љ—Г–ґ—З–Є–љ вАУ —Н—Б—В—А–Њ–≥–µ–љ—Л –Є –Њ—В—З–∞—Б—В–Є —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ) –Є –≥–Њ—А–Љ–Њ–љ—Л, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Ї–∞–ї—М—Ж–Є—П, –≤–Ї–ї—О—З–∞—П –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ—Л–є –≥–Њ—А–Љ–Њ–љ, 1,25(–Ю–Э)-–≤–Є—В–∞–Љ–Є–љ D –Є –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ, –Ї–Њ—В–Њ—А—Л–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–Њ—Б—В–љ—Г—О —А–µ–Ј–Њ—А–±—Ж–Є—О –Є –Ї–Њ—Б—В–љ—Г—О —А–µ–≥–µ–љ–µ—А–∞—Ж–Є—О. –Т—Б–µ —Н—В–Є –≥–Њ—А–Љ–Њ–љ—Л –≤–ї–Є—П—О—В –Ї–∞–Ї –љ–∞ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ, —В–∞–Ї –Є –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –≠—Б—В—А–Њ–≥–µ–љ—Л –Є–љ–≥–Є–±–Є—А—Г—О—В –Ї–Њ—Б—В–љ—Г—О —А–µ–Ј–Њ—А–±—Ж–Є—О, –њ–Њ—Н—В–Њ–Љ—Г —Н—Б—В—А–Њ–≥–µ–љ–Њ—В–µ—А–∞–њ–Є—П –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є–є –Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞. –Р–љ–і—А–Њ–≥–µ–љ—Л —П–≤–ї—П—О—В—Б—П –≤–∞–ґ–љ–µ–є—И–Є–Љ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤, –≤ –Ї–Њ—В–Њ—А—Л–µ –Њ–љ–Є —Б–њ–Њ—Б–Њ–±–љ—Л —В—А–∞–љ—Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞—В—М—Б—П –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ —Д–µ—А–Љ–µ–љ—В–∞ –∞—А–Њ–Љ–∞—В–∞–Ј—Л, –љ–Њ –њ—А–Є —Н—В–Њ–Љ –∞–љ–і—А–Њ–≥–µ–љ—Л —Б–њ–Њ—Б–Њ–±–љ—Л –Њ–Ї–∞–Ј—Л–≤–∞—В—М –Є —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ—Л–µ —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є–µ —Н—Д—Д–µ–Ї—В—Л –љ–∞ –Ї–Њ—Б—В–љ—Г—О —В–Ї–∞–љ—М [27]. –Я–Њ—Н—В–Њ–Љ—Г –ї—О–±–Њ–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–µ –≤–љ–µ–і—А–µ–љ–Є–µ –≤ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Є —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ —Г –Љ—Г–ґ—З–Є–љ —З—А–µ–≤–∞—В–Њ —А–∞–Ј–≤–Є—В–Є–µ–Љ –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є –Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ [28].
–Ь–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј: –Ї—В–Њ –≤–Є–љ–Њ–≤–∞—В?
–°–љ–Є–ґ–µ–љ–Є–µ –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Є —А–∞–Ј–≤–Є—В–Є–µ –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є, –∞ –Ј–∞—В–µ–Љ –Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —В–µ—Е –Є–ї–Є –Є–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, —Г–ґ–µ –і–∞–≤–љ–Њ –љ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –≤ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Ї–∞–Ї –љ–µ–Ї–Є–є –љ–µ–Њ–±—Л—З–љ—Л–є –Є–ї–Є —А–µ–і–Ї–Є–є —Д–∞–Ї—В, –Њ —З–µ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Є–Љ–µ—О—Й–Є–є—Б—П —В–µ—А–Љ–Є–љ ¬Ђ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј¬ї, –Њ—В—А–∞–ґ–∞—О—Й–Є–є –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –љ–µ–Ї–Њ—В–Њ—А—Л—Е –≤–Є–і–Њ–≤ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –љ–∞ –Ј–і–Њ—А–Њ–≤—М–µ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –≠—В–∞ –њ—А–Њ–±–ї–µ–Љ–∞ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –≤—Б–µ –∞–Ї—В—Г–∞–ї—М–љ–µ–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Љ–љ–Њ–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞—В—М—Б—П –њ–Њ–ї–Є–њ—А–∞–≥–Љ–∞–Ј–Є—П вАУ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –±–Њ–ї–µ–µ 5 –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –±–µ–Ј —Г—З–µ—В–∞ –Є—Е –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Є –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є –і–ї—П –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–∞, –≤ —В. —З. –і–ї—П –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞. –Ґ—А–∞–≥–Є–Ј–Љ —Б–Є—В—Г–∞—Ж–Є–Є —Г—Б—Г–≥—Г–±–ї—П–µ—В—Б—П –µ—Й–µ –Є —В–µ–Љ, —З—В–Њ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј —Г —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П —Б–ї–Є—И–Ї–Њ–Љ –њ–Њ–Ј–і–љ–Њ, —З–∞—Й–µ –≤—Б–µ–≥–Њ, –Ї–Њ–≥–і–∞ –Њ–љ —Г–ґ–µ –Љ–∞–љ–Є—Д–µ—Б—В–Є—А—Г–µ—В –њ–µ—А–≤—Л–Љ —Б–њ–Њ–љ—В–∞–љ–љ—Л–Љ –њ–µ—А–µ–ї–Њ–Љ–Њ–Љ.
–Ґ—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –љ–µ–≥–∞—В–Є–≤–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –њ—А–Є–њ–Є—Б—Л–≤–∞—О—В—Б—П –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–∞–Љ, –љ–∞—Е–Њ–і—П—Й–Є–Љ —Б–≤–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—В—А–∞—Б–ї—П—Е –Љ–µ–і–Є—Ж–Є–љ—Л, –≤ —В. —З. –њ—А–Є –ї–µ—З–µ–љ–Є–Є –≥–Њ—А–Љ–Њ–љ–Њ—А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–≥–Њ —А–∞–Ї–∞ –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (–†–Я–Ц) [29, 30]. –≠—В–Є –≥–Њ—А–Љ–Њ–љ—Л –љ–∞—А—Г—И–∞—О—В –Њ—Б—В–µ–Њ–≥–µ–љ–µ–Ј (–Є–љ–≥–Є–±–Є—А—Г—О—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї—Г –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–Њ–≤ –Є –Є—Е —Д—Г–љ–Ї—Ж–Є–Є, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –∞–Ї—В–Є–≤–Є—А—Г—П –Ї–Њ—Б—В–љ—Г—О —А–µ–Ј–Њ—А–±—Ж–Є—О). –°–≤–Њ–Є –љ–µ–≥–∞—В–Є–≤–љ—Л–µ –Њ—Б—В–µ–Њ–≥–µ–љ–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і—Л –Њ–Ї–∞–Ј—Л–≤–∞—О—В –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –≤–ї–Є—П–љ–Є—П –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —А–µ—Ж–µ–њ—В–Њ—А–∞ –∞–Ї—В–Є–≤–∞—Ж–Є–Є –ї–Є–≥–∞–љ–і–∞ —П–і–µ—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ kappa-B (RANKL вАУ Receptor activator of nuclear factor kappa-B ligand) вАУ –Љ–µ–Љ–±—А–∞–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞-—Ж–Є—В–Њ–Ї–Є–љ–∞ —Б–µ–Љ–µ–є—Б—В–≤–∞ —Д–∞–Ї—В–Њ—А–Њ–≤ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є, –њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–µ–≥–Њ—Б—П –≥–µ–љ–Њ–Љ —З–µ–ї–Њ–≤–µ–Ї–∞ TNFSF11 –Є –Є–≥—А–∞—О—Й–µ–≥–Њ –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –∞–Ї—В–Є–≤–Є—А—Г—О—Й–µ–≥–Њ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В—Л [31]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і—Л –Є–љ–≥–Є–±–Є—А—Г—О—В –∞–±—Б–Њ—А–±—Ж–Є—О –Ї–∞–ї—М—Ж–Є—П –Є–Ј –Ї–Є—И–µ—З–љ–Є–Ї–∞, –њ—А–Є–≤–Њ–і—П –Ї –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–Њ–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є, –∞ —А–∞–Ј–≤–Є–≤–∞—О—Й–Є–є—Б—П –≤ –Њ—В–≤–µ—В –љ–∞ —Н—В–Њ –≤—В–Њ—А–Є—З–љ—Л–є –≥–Є–њ–µ—А–њ–∞—А–∞—В–Є—А–µ–Њ–Ј —Г—Б–Ї–Њ—А—П–µ—В –њ—А–Њ—Ж–µ—Б—Б—Л –Ї–Њ—Б—В–љ–Њ–є —А–µ–Ј–Њ—А–±—Ж–Є–Є. –Я–Њ—В–µ—А—П –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –љ–∞ —Д–Њ–љ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–Њ–≤ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Њ—З–µ–љ—М —А–∞–љ–Њ (–њ–Њ—В–µ—А—П 3вАУ5% –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –≤ —В–µ—З–µ–љ–Є–µ 1вАУ–≥–Њ –≥–Њ–і–∞ —В–µ—А–∞–њ–Є–Є –Є –і–∞–ї–µ–µ –њ–Њ 1% –µ–ґ–µ–≥–Њ–і–љ–Њ) [31]. –Ю—Б—В–µ–Њ–њ–µ–љ–Є—П/–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –љ–µ—А–µ–і–Ї–Њ –Њ—Б–ї–Њ–ґ–љ—П–µ—В —В–∞–Ї–ґ–µ –і–ї–Є—В–µ–ї—М–љ—Г—О –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О —Б—Г–њ—А–µ—Б—Б–Є–≤–љ—Л–Љ–Є –і–Њ–Ј–∞–Љ–Є —В–Є—А–µ–Њ–Є–і–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, –љ–∞–њ—А–Є–Љ–µ—А, —Г –ґ–µ–љ—Й–Є–љ —Б –≥–Є–њ–Њ—Н—Б—В—А–Њ–≥–µ–љ–Є–Ј–Љ–Њ–Љ: L-—В–Є—А–Њ–Ї—Б–Є–љ –≤ –і–Њ–Ј–∞—Е >0,093 –Љ–≥/—Б—Г—В –≤–µ–і–µ—В –Ї –Ї–Њ—Б—В–љ–Њ–є —А–µ–Ј–Њ—А–±—Ж–Є–Є, –Њ–і–љ–Њ–є –Є–Ј –њ—А–Є—З–Є–љ –Ї–Њ—В–Њ—А–Њ–є –Љ–Њ–ґ–µ—В –±—Л—В—М —Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Ґ–Ґ–У [31]. –Ъ —А–∞–Ј–≤–Є—В–Є—О –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Љ–Њ–≥—Г—В –њ—А–Є–≤–µ—Б—В–Є –Є –љ–µ–Ї–Њ—В–Њ—А—Л–µ –њ–µ—А–Њ—А–∞–ї—М–љ—Л–µ –∞–љ—В–Є–і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л (–љ–∞–њ—А–Є–Љ–µ—А, —В–Є–∞–Ј–Њ–ї–Є–і–Є–љ–і–Є–Њ–љ—Л), –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є —Г—Б–Є–ї–Є–≤–∞—О—Й–Є–µ –∞–і–Є–њ–Њ–≥–µ–љ–µ–Ј, –∞ –љ–µ –Њ—Б—В–µ–Њ–≥–µ–љ–µ–Ј, —З—В–Њ –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –≤ —Б–≤—П–Ј–Є —Б –њ–Њ—В–µ—А–µ–є –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л [31]. –Я–µ—А–µ–ї–Њ–Љ—Л —В–∞–Ї–ґ–µ —З–∞—Б—В–Њ –љ–∞–±–ї—О–і–∞—О—В—Б—П –њ—А–Є –ї–µ—З–µ–љ–Є–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ–Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Њ–±—А–∞—В–љ–Њ–≥–Њ –Ј–∞—Е–≤–∞—В–∞ —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ (–°–Ш–Ю–Ч–°), –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–∞–Љ–Є, –і–Є—Г—А–µ—В–Є–Ї–∞–Љ–Є, –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞–Љ–Є –Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л [31]. –Т —В–Њ –ґ–µ —Б–∞–Љ–Њ–µ –≤—А–µ–Љ—П –µ—Б—В—М –і–∞–љ–љ—Л–µ, —З—В–Њ —Б—В–∞—В–Є–љ—Л, ќ≤вАУ–±–ї–Њ–Ї–∞—В–Њ—А—Л –Є –љ–Є—В—А–∞—В—Л –Љ–Њ–≥—Г—В –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞—В—М—Б—П —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [32].
–Ы–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –Ї–Њ—В–Њ—А—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –њ—А–Є–≤–Њ–і—П—В –Ї –Є–љ–і—Г–Ї—Ж–Є–Є –≥–Є–њ–Њ—Н—Б—В—А–Њ–≥–µ–љ–Є–Ј–Љ–∞ вАУ –і–µ—Д–Є—Ж–Є—В—Г —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —П–≤–ї—П—О—В—Б—П —Б–∞–Љ—Л–Љ–Є –Ї—А–Є—В–Є—З–µ—Б–Ї–Є–Љ–Є –≥–Њ—А–Љ–Њ–љ–∞–Љ–Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Ї–∞–Ї —Г –ґ–µ–љ—Й–Є–љ, —В–∞–Ї –Є —Г –Љ—Г–ґ—З–Є–љ. –Я–Њ—Н—В–Њ–Љ—Г —Б–µ–≥–Њ–і–љ—П —Б—В–∞–љ–Њ–≤–Є—В—Б—П –њ–Њ–љ—П—В–љ–Њ, —З—В–Њ –ї—О–±–∞—П –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–∞—П —Б—Г–њ—А–µ—Б—Б–Є—П –њ–Њ–ї–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ —Г –Љ—Г–ґ—З–Є–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –љ–µ–≥–∞—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ј–і–Њ—А–Њ–≤—М–µ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, —Б–љ–Є–ґ–∞—П –µ–µ –њ–ї–Њ—В–љ–Њ—Б—В—М –Є –њ–Њ–≤—Л—И–∞—П —А–Є—Б–Ї –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [33].
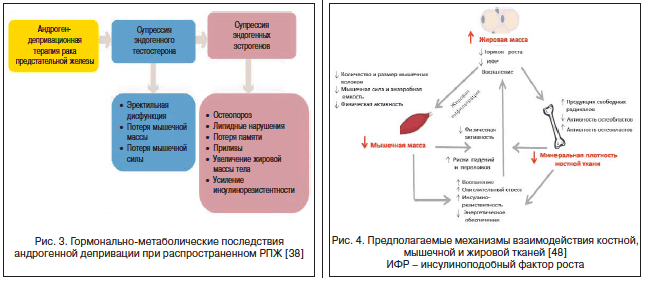
–†–Я–Ц вАУ —В–Є–њ–Є—З–љ—Л–є –њ—А–Є–Љ–µ—А –≥–Њ—А–Љ–Њ–љ–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ —А–∞–Ї–∞, –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤ —Б—В–∞–і–Є–Є –Љ–µ—Б—В–љ–Њ–≥–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—П –Є–ї–Є –і–Є—Б—Б–µ–Љ–Є–љ–∞—Ж–Є–Є (–Ґ3-4) –њ—А–Є—Е–Њ–і–Є—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –∞–љ—В–Є–∞–љ–і—А–Њ–≥–µ–љ—Л –Є –∞–≥–Њ–љ–Є—Б—В—Л/–∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –≥–Њ–љ–∞–і–Њ—В—А–Њ–њ–Є–љ-—А–Є–ї–Є–Ј–Є–љ–≥-–≥–Њ—А–Љ–Њ–љ–∞ (–У–љ-–†–У), –љ–∞—А—Г—И–∞—О—Й–Є–µ –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–є –±–∞–ї–∞–љ—Б —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Є –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ—А–µ–і–Ї–Њ –њ—А–Є–Љ–µ–љ—П–µ–Љ–∞—П —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П –Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –∞–і—К—О–≤–∞–љ—В–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Љ–Њ–≥—Г—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –њ—А–Є–≤–Њ–і–Є—В—М –Ї –љ–∞—А—Г—И–µ–љ–Є—П–Љ –≤ —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я–Њ—Н—В–Њ–Љ—Г —Б–µ–≥–Њ–і–љ—П –Љ–Њ–ґ–љ–Њ –≥–Њ–≤–Њ—А–Є—В—М –Њ —В–∞–Ї–Њ–Љ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ —Д–µ–љ–Њ–Љ–µ–љ–µ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Д–Њ—А–Љ –†–Я–Ц, –Ї–∞–Ї ¬Ђ–Њ—Б—В–µ–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –њ—А–Њ—В–Є–≤–Њ—А–∞–Ї–Њ–≤–Њ–є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є¬ї, –Ї–Њ—В–Њ—А—Г—О –±–Њ–ї—М—И–µ –љ–µ–ї—М–Ј—П –Є–≥–љ–Њ—А–Є—А–Њ–≤–∞—В—М [34вАУ38] (—А–Є—Б. 3).
–Ъ–ї–Є–љ–Є–Ї–Њ-—Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Г –Љ—Г–ґ—З–Є–љ, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –∞–љ–і—А–Њ–≥–µ–љ-–і–µ–њ—А–Є–≤–∞—Ж–Є–Њ–љ–љ—Г—О —В–µ—А–∞–њ–Є—О (–Р–Ф–Ґ) –†–Я–Ц
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –∞–љ–і—А–Њ–≥–µ–љ–љ—Л–є —Б–Є–≥–љ–∞–ї —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї –Ї–ї—О—З–µ–≤–Њ–є —Д–∞–Ї—В–Њ—А —А–µ–≥—Г–ї—П—Ж–Є–Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є –Њ–і–Є–љ –Є–Ј –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –µ–µ —А–∞–Ї–Њ–≤–Њ–є —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ –љ–∞—Г—З–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ –≤—Б–µ —З–∞—Й–µ –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В—Б—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Р–Ф–Ґ –љ–∞ –Ї–Њ—Б—В–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –†–Я–Ц [39]. –°–Њ–≥–ї–∞—Б–љ–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –Р–Ф–Ґ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —В—П–ґ–µ–ї–Њ–≥–Њ –≥–Є–њ–Њ–≥–Њ–љ–∞–і–Є–Ј–Љ–∞, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Љ—Г–ґ—З–Є–љ, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е —В–∞–Ї—Г—О —В–µ—А–∞–њ–Є—О, –Ї–∞–Ї —Г–љ–Є–Ї–∞–ї—М–љ—Г—О –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї—Г—О –Љ–Њ–і–µ–ї—М —В—П–ґ–µ–ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ –њ–Њ–ї–Њ–≤—Л—Е —Б—В–µ—А–Њ–Є–і–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, —А–∞–Ј–≤–Є–≤–∞—О—Й—Г—О—Б—П –≤ —А–∞–Ј–љ—Л–µ —Б—А–Њ–Ї–Є —Б –Љ–Њ–Љ–µ–љ—В–∞ –ї–Є—И–µ–љ–Є—П –Љ—Г–ґ—З–Є–љ—Л —Н—Д—Д–µ–Ї—В–Њ–≤ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞, —Б—А–µ–і–Є –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є –Ї–Њ—В–Њ—А–Њ–≥–Њ –Љ–Њ–ґ–љ–Њ —Б–Љ–µ–ї–Њ –љ–∞–Ј—Л–≤–∞—В—М –Ї–∞—А–і–Є–Њ–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –Є –Ї–Њ—Б—В–љ–Њ-–Љ—Л—И–µ—З–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤–Ї–ї—О—З–∞—П –Њ—Б—В–µ–Њ–њ–µ–љ–Є—О/–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј [39]. –°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ H. Rhee et al. (2015), –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ–≤–µ–ї–Є –∞–љ–∞–ї–Є–Ј –≤—Б–µ—Е –і–Њ—Б—В—Г–њ–љ—Л—Е –њ—Г–±–ї–Є–Ї–∞—Ж–Є–є –њ–Њ –Р–Ф–Ґ –†–Я–Ц –Ј–∞ –њ–µ—А–Є–Њ–і —Б 2005 –њ–Њ 2014 –≥., –і–∞–љ–љ—Л–є –≤–Є–і —В–µ—А–∞–њ–Є–Є –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б —Ж–µ–ї—Л–Љ —Б–њ–µ–Ї—В—А–Њ–Љ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –љ–∞—З–Є–љ–∞—П —Б –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –°–Ф 2-–≥–Њ —В–Є–њ–∞ –Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є –Ј–∞–Ї–∞–љ—З–Є–≤–∞—П –і–µ–њ—А–µ—Б—Б–Є–µ–є, –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –Є —Б–µ–Ї—Б—Г–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є, –њ–Њ—Н—В–Њ–Љ—Г —Б–µ–≥–Њ–і–љ—П –њ—А–Є—И–ї–Њ –≤—А–µ–Љ—П –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М –∞–Ї—В–Є–≤–љ—Л–є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ —Б–Њ—Б—В–Њ—П–љ–Є—П –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Р–Ф–Ґ —Г –±–Њ–ї—М–љ—Л—Е –†–Я–Ц (–≤–Ї–ї—О—З–∞—П –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А–Є—О) –Є –Ї–Њ—А—А–µ–Ї—Ж–Є—О –µ–µ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –≤ —А–∞–Љ–Ї–∞—Е –Љ–µ–ґ–і–Є—Б—Ж–Є–њ–ї–Є–љ–∞—А–љ–Њ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –≤—А–∞—З–µ–є —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ—Б—В–µ–є [40]. –Я–Њ–Ї–∞ –ґ–µ —З–∞—Б—В–Њ—В–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А–Є–Є –≤ –Њ–љ–Ї–Њ—Г—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–Є –≤–µ–і–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –†–Я–Ц –љ–∞ —Д–Њ–љ–µ –Р–Ф–Ґ —Б —Ж–µ–ї—М—О —А–∞–љ–љ–µ–≥–Њ –≤—Л—П–≤–ї–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є/–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 8,8%, –∞ 87,3% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–µ–Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –†–Я–Ц –љ–Є–Ї–Њ–≥–і–∞ –љ–µ –њ–Њ–і–≤–µ—А–≥–∞—О—В—Б—П –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А–Є–Є –Є –љ–µ –њ–Њ–ї—Г—З–∞—О—В —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –∞–љ—В–Є–Њ—Б—В–µ–Њ–њ–µ–љ–Є—З–µ—Б–Ї–Њ–є –Є–ї–Є –∞–љ—В–Є–Њ—Б—В–µ–Њ–њ–Њ—А–µ—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Р–Ф–Ґ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Њ—Б—В–∞–µ—В—Б—П –љ–µ–Њ—Ж–µ–љ–µ–љ–љ—Л–Љ, –∞ –Њ—Б—В–µ–Њ–њ–µ–љ–Є—П/–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, вАУ –љ–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Є –љ–µ –ї–µ—З–µ–љ–љ—Л–Љ–Є [41вАУ43]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В—Л –Њ–±–Њ—Б–љ–Њ–≤—Л–≤–∞—О—В —В–Њ—З–Ї—Г –Ј—А–µ–љ–Є—П, —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї–Њ—В–Њ—А–Њ–є –Є–Љ–µ—О—В—Б—П –≤—Б–µ –Њ—Б–љ–Њ–≤–∞–љ–Є—П —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Љ—Г–ґ—З–Є–љ —Б –†–Я–Ц, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –Р–Ф–Ґ, –Ї–∞–Ї –≥—А—Г–њ–њ—Г –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –њ—Б–Є—Е–Њ—Б–µ–Ї—Б—Г–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, –њ–µ—А–µ–ї–Њ–Љ–Њ–≤, –°–Ф –Є –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –±–Њ–ї—М—И–Њ–є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Р–Ф–Ґ, –Ї–Њ—В–Њ—А–∞—П –њ—А–Њ–ї–Њ–љ–≥–Є—А—Г–µ—В –Є —Г—Б—Г–≥—Г–±–ї—П–µ—В —Б–Њ—Б—В–Њ—П–љ–Є–µ –≥–Є–њ–Њ–∞–љ–і—А–Њ–≥–µ–љ–Є–Ј–Љ–∞ —Г –Љ—Г–ґ—З–Є–љ [44]. –Я–Њ—Н—В–Њ–Љ—Г —Б–µ–≥–Њ–і–љ—П –≤—Л–і–≤–Є–≥–∞–µ—В—Б—П –љ–Њ–≤–∞—П –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П вАУ –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П ¬Ђ–Ї–Њ—Б—В–љ–Њ–≥–Њ –Є –Љ—Л—И–µ—З–љ–Њ–≥–Њ –Ј–і–Њ—А–Њ–≤—М—П¬ї, –Ї–Њ—В–Њ—А–∞—П –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є–µ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –ї—О–±—Л—Е –њ–Њ—В–µ—А—М –Ї–Њ—Б—В–љ–Њ–є (–Њ—Б—В–µ–Њ–њ–µ–љ–Є—П/–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј) –Є –Љ—Л—И–µ—З–љ–Њ–є (—Б–∞—А–Ї–Њ–њ–µ–љ–Є—П) –Љ–∞—Б—Б—Л –љ–∞ —Д–Њ–љ–µ –ї—О–±–Њ–є –њ—А–Њ—В–Є–≤–Њ—А–∞–Ї–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є (–≤–Ї–ї—О—З–∞—П –Р–Ф–Ґ), —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є—В –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–µ —Г–њ—А–∞–≤–ї–µ–љ–Є–µ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–Њ–Љ, –Њ—Б—В–µ–Њ–њ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ–µ—А–µ–ї–Њ–Љ–∞–Љ–Є –Є —Б–∞—А–Ї–Њ–њ–µ–љ–Є–µ–є, –љ–∞—Е–Њ–і—П—Й–Є–Љ–Є—Б—П –≤ —В–µ—Б–љ–µ–є—И–Є—Е –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Б–≤—П–Ј—П—Е –Ї–∞–Ї –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є, —В–∞–Ї –Є —Б –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ—М—О [45вАУ48] (—А–Є—Б. 4).
–Ш–љ—В–µ—А–µ—Б –Ї –і–∞–љ–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–µ –≤–Њ–Ј–љ–Є–Ї —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –љ–µ–і–∞–≤–љ–Њ, –Њ–і–љ–∞–Ї–Њ –µ–µ –Њ–≥—А–Њ–Љ–љ–∞—П –∞–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М —Г–ґ–µ –љ–∞—И–ї–∞ —Б–≤–Њ–µ –Њ—В—А–∞–ґ–µ–љ–Є–µ –≤ –Њ–≥—А–Њ–Љ–љ–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –њ—Г–±–ї–Є–Ї–∞—Ж–Є–є –њ–Њ—Б–ї–µ–і–љ–Є—Е –ї–µ—В, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Р–Ф–Ґ –≤ —А–∞–Љ–Ї–∞—Е –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –∞–љ–і—А–Њ–≥–µ–љ–љ–Њ–є –±–ї–Њ–Ї–∞–і—Л (–Ь–Р–С) –Њ—Б—В–∞–µ—В—Б—П ¬Ђ–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї —В–µ—А–∞–њ–Є–Є –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–≥–Њ –Є –і–Є—Б—Б–µ–Љ–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ (–Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ) –†–Я–Ц, –∞–ї—М—В–µ—А–љ–∞—В–Є–≤—Л –Ї–Њ—В–Њ—А–Њ–є –њ–Њ–Ї–∞ –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В, –∞ —Б –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –†–Я–Ц –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Љ—Г–ґ—З–Є–љ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В –Ј–∞–љ–Є–Љ–∞—В—М 3-–µ –Љ–µ—Б—В–Њ –≤ —Б—В—А—Г–Ї—В—Г—А–µ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є, —Г—Б—В—Г–њ–∞—П –ї–Є—И—М —А–∞–Ї—Г –ї–µ–≥–Ї–Є—Е –Є –ґ–µ–ї—Г–і–Ї–∞ [49, 50]. –°–Њ–≥–ї–∞—Б–љ–Њ –Є–Љ–µ—О—Й–Є–Љ—Б—П –і–∞–љ–љ—Л–Љ, –љ–µ–і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј —Б–Њ–њ—Г—В—Б—В–≤—Г–µ—В –Љ–љ–Њ–≥–Є–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ –†–Я–Ц –µ—Й–µ –і–Њ –љ–∞—З–∞–ї–∞ –Р–Ф–Ґ, –∞ –Ј–∞—В–µ–Љ –љ–∞ –µ–µ —Д–Њ–љ–µ –µ–≥–Њ —З–∞—Б—В–Њ—В–∞ –љ–µ—Г–Ї–ї–Њ–љ–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П. –Ґ–∞–Ї, –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –і–≤–Њ–є–љ–Њ–є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–є –•-–∞–±—Б–Њ—А–±—Ж–Є–Њ–Љ–µ—В—А–Є–Є (–Ф–≠–•–Р), —Г 105 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –Є –і–Є—Б—Б–µ–Љ–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ –†–Я–Ц –≤ –≤–Њ–Ј—А–∞—Б—В–µ 53вАУ91 –≥–Њ–і–∞, –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –Р–Ф–Ґ, –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –і–∞—В—Б–Ї–Є—Е –Љ—Г–ґ—З–Є–љ —З–∞—Б—В–Њ—В–∞ –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є —Б–Њ—Б—В–∞–≤–Є–ї–∞ 58%, –∞ —З–∞—Б—В–Њ—В–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ вАУ 10% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [51]. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –≥–Њ–≤–Њ—А—П—В –Њ —В–Њ–Љ, —З—В–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є 2/3 –Љ—Г–ґ—З–Є–љ —Б –†–Я–Ц, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–µ–і—Б—В–Њ–Є—В –Р–Ф–Ґ, —Г–ґ–µ –Є–Љ–µ—О—В –љ–µ–≤—Л—П–≤–ї–µ–љ–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –њ–Њ—Н—В–Њ–Љ—Г –Є—Б—Е–Њ–і–љ—Л–є —Б–Ї—А–Є–љ–Є–љ–≥ –Ь–Я–Ъ —Б–µ–≥–Њ–і–љ—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤—Л–њ–Њ–ї–љ—П—В—М –Ї–∞–ґ–і–Њ–Љ—Г –њ–∞—Ж–Є–µ–љ—В—Г —Б –†–Я–Ц, –Ї–Њ—В–Њ—А–Њ–Љ—Г –њ—А–µ–і—Б—В–Њ–Є—В –Р–Ф–Ґ [51]. –Т —Е–Њ–і–µ –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Р–Ф–Ґ —З–∞—Б—В–Њ—В–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Г –Љ—Г–ґ—З–Є–љ —Б –†–Я–Ц –њ–Њ–≤—Л—И–∞–µ—В—Б—П –µ—Й–µ –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —Б–Њ—Б—В–∞–≤–ї—П—П, —Б–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –љ–Њ–≤–µ–є—И–µ–≥–Њ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞ (2014), –Њ—В 9 –і–Њ 53% –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Р–Ф–Ґ, —Б—В–∞–і–Є–Є –†–Я–Ц, —Н—В–љ–Є—З–µ—Б–Ї–Є—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [52]. –Ю–і–љ–∞–Ї–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–Є–µ –Ф–≠–•–Р –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –†–Я–Ц –љ–µ –≤—Е–Њ–і–Є—В –≤ —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–µ —Б—В–∞–љ–і–∞—А—В—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–Њ—Н—В–Њ–Љ—Г –≤—Л—П–≤–ї—П–µ–Љ–Њ—Б—В—М –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є/–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –≤ –Њ–љ–Ї–Њ—Г—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Ї—А–∞–є–љ–µ –љ–Є–Ј–Ї–∞ [53]. –Ґ–Њ–ї—М–Ї–Њ 38% –Љ—Г–ґ—З–Є–љ, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –Р–Ф–Ґ, –њ–Њ–і–≤–µ—А–≥–∞—О—В—Б—П –і–≤–Њ–є–љ–Њ–є —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–Њ–Љ–µ—В—А–Є–Є –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 2 –ї–µ—В –њ—А–Њ—В–Є–≤–Њ—А–∞–Ї–Њ–≤–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П [54]. –Я–Њ –і–∞–љ–љ—Л–Љ –Ь.–Х. Suarez-Almazor. et al. (2014), –Њ–±—А–∞–±–Њ—В–∞–≤—И–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П 2290 –Љ—Г–ґ—З–Є–љ —Б –†–Я–Ц –љ–∞ —Д–Њ–љ–µ –Р–Ф–Ґ, —В–Њ–ї—М–Ї–Њ 8,6% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–і–≤–µ—А–≥–∞–ї–Є—Б—М –Ф–≠–•–Р –Ј–∞ 1 –≥–Њ–і –і–Њ –Є –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –Р–Ф–Ґ, —В–Њ–ї—М–Ї–Њ 5,6% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –њ–Њ–ї—Г—З–∞–ї–Є –Њ—Б—В–µ–Њ—В—А–Њ–њ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –љ–∞ —Д–Њ–љ–µ –Р–Ф–Ґ, –Є —В–Њ–ї—М–Ї–Њ 12,6% –±—Л–ї–Є –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ—Л –њ–µ—А–µ–і –Р–Ф–Ґ –Є –њ–Њ–ї—Г—З–∞–ї–Є –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —В–µ—А–∞–њ–Є–Є –Њ—Б—В–µ–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л [55]. –Я—А–Њ–±–ї–µ–Љ–∞ –Њ—Б–ї–Њ–ґ–љ—П–µ—В—Б—П –љ–µ –њ—А–Њ—Б—В–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ —А–Њ—Б—В–Њ–Љ —З–∞—Б—В–Њ—В—Л –љ–µ–і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Є –њ–Њ—В–Њ–Љ—Г –љ–µ –ї–µ—З–µ–љ–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Г –Љ—Г–ґ—З–Є–љ —Б –†–Я–Ц, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –Р–Ф–Ґ. –У–ї–∞–≤–љ–Њ–µ –љ–µ–≥–∞—В–Є–≤–љ–Њ–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–µ –ї—О–±–Њ–є –∞–љ–і—А–Њ–≥–µ–љ–љ–Њ–є –і–µ–њ—А–Є–≤–∞—Ж–Є–Є —Г –Љ—Г–ґ—З–Є–љ —Б –†–Я–Ц —Б–Њ—Б—В–Њ–Є—В –≤–Њ –≤–Ј–∞–Є–Љ–љ–Њ–Љ –Њ—В—П–≥–Њ—Й–µ–љ–Є–Є –≤—Б–µ—Е –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤–Ї–ї—О—З–∞—П –Њ—Б—В–µ–Њ–њ–µ–љ–Є—О/–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј, –≤ —Г—Б–ї–Њ–≤–Є—П—Е –њ–Њ–ї–љ–Њ–є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є –Є/–Є–ї–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є –Ї–∞—Б—В—А–∞—Ж–Є–Є –Љ—Г–ґ—З–Є–љ—Л [56]. C–Њ–≥–ї–∞—Б–љ–Њ –љ–Њ–≤–µ–є—И–Є–Љ –і–∞–љ–љ—Л–Љ, –љ–∞ —Д–Њ–љ–µ –Р–Ф–Ґ –љ–µ –њ—А–Њ—Б—В–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —З–∞—Б—В–Њ—В–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, –љ–Њ –љ–µ—Г–Ї–ї–Њ–љ–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –і—А—Г–≥–Є—Е —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤ –Њ—Б–љ–Њ–≤–µ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Ї–Њ—В–Њ—А—Л—Е –њ—А—П–Љ–Њ –Є–ї–Є –Ї–Њ—Б–≤–µ–љ–љ–Њ –ї–µ–ґ–Є—В –≥–Є–њ–Њ–≥–Њ–љ–∞–і–Є–Ј–Љ вАУ –і–µ—Д–Є—Ж–Є—В –Љ—Г–ґ—Б–Ї–Є—Е –њ–Њ–ї–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ (—В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞) [35, 57]. –Т–Њ—В –њ–Њ—З–µ–Љ—Г —Г–ґ–µ –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 2 –ї–µ—В —Б –Љ–Њ–Љ–µ–љ—В–∞ –љ–∞—З–∞–ї–∞ –Р–Ф–Ґ 87% –Љ—Г–ґ—З–Є–љ —Б –†–Я–Ц –Є–Љ–µ—О—В –Є–Ј–±—Л—В–Њ—З–љ—Л–є –≤–µ—Б –Є–ї–Є –Њ–ґ–Є—А–µ–љ–Є–µ, 61% —Б—В—А–∞–і–∞—О—В –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–µ–є, —Г 56% –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Њ–ї–µ–Љ–Є—П, 27% —Г–ґ–µ –Є–Љ–µ—О—В –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, 11% —Б—В—А–∞–і–∞—О—В –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–Њ–Љ, –∞ –µ—Й–µ —Г 40% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–µ—В—Б—П –Њ—Б—В–µ–Њ–њ–µ–љ–Є—П. –І–µ—А–µ–Ј 2 –≥–Њ–і–∞ –Р–Ф–Ґ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –і–∞–ї—М–љ–µ–є—И–µ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Њ–Ї—А—Г–ґ–љ–Њ—Б—В–Є —В–∞–ї–Є–Є (–љ–∞ 2,6вАУ6,3 —Б–Љ), —Г –Љ—Г–ґ—З–Є–љ –±–µ–Ј –°–Ф 2-–≥–Њ —В–Є–њ–∞ –љ–∞ 13вАУ34% –њ–Њ–≤—Л—И–∞–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –≥–ї–Є–Ї–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ HbA1c –≤ –Ї—А–Њ–≤–Є, –∞ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –∞–љ–µ–Љ–Є–Є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Б 13,8% –і–Њ 32,5%. –Я—А–Є —Н—В–Њ–Љ —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—П –Ь–Я–Ъ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Р–Ф–Ґ –Њ—В–Љ–µ—З–∞–ї–∞—Б—М —В–Њ–ї—М–Ї–Њ —Г –Љ—Г–ґ—З–Є–љ, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б –Р–Ф–Ґ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–љ—В–Є—А–µ–Ј–Њ—А–±—В–Є–≤–љ—Г—О —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї—Г—О —В–µ—А–∞–њ–Є—О (–±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В—Л) [57].
–Ш—В–∞–Ї, —Б–µ–≥–Њ–і–љ—П –Р–Ф–Ґ –≤ —А–∞–Љ–Ї–∞—Е –Ь–Р–С (–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –∞–љ–і—А–Њ–≥–µ–љ–љ–Њ–є –±–ї–Њ–Ї–∞–і—Л), –±–µ—Б—Б–њ–Њ—А–љ–Њ, —П–≤–ї—П–µ—В—Б—П ¬Ђ–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї –ї–µ—З–µ–љ–Є—П –Љ—Г–ґ—З–Є–љ —Б –†–Я–Ц –≤ —Б—В–∞–і–Є–Є –Ґ3-4 [58вАУ60]. –Ю–і–љ–∞–Ї–Њ –њ—А–Є —Н—В–Њ–Љ –і–Њ—Б—В—Г–њ–љ—Л–µ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј—Л —Г–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –љ–µ–±–Њ–ї—М—И–Њ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Њ–±—Й–µ–є –Є —А–∞–Ї–Њ–≤–Њ-—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ 5 –ї–µ—В –љ–∞ —Д–Њ–љ–µ –Ь–Р–С –Є–Љ–µ–µ—В —Б–Њ–Љ–љ–Є—В–µ–ї—М–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Б–Њ–њ—А—П–ґ–µ–љ–Њ —Б –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О –Є –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є –њ–Њ–±–Њ—З–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є, —З—В–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–ґ–∞–µ—В –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ь–Р–С [61, 62]. –Т—Л—Е–Њ–і –Є–Ј —Н—В–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –Љ–Њ–ґ–µ—В –±—Л—В—М —В–Њ–ї—М–Ї–Њ –Њ–і–Є–љ вАУ —З—В–Њ–±—Л —Г–Љ–µ–љ—М—И–Є—В—М —З–∞—Б—В–Њ—В—Г –љ–∞–Ј–љ–∞—З–∞–µ–Љ–Њ—Б—В–Є –Р–Ф–Ґ –±–Њ–ї—М–љ—Л–Љ —Б –†–Я–Ц –Є —Б–≤–µ—Б—В–Є –Ї –Љ–Є–љ–Є–Љ—Г–Љ—Г –µ–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л (–≤ —В. —З. –≤ –≤–Є–і–µ –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є/–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞), –љ—Г–ґ–љ–Њ —Г–Љ–µ–љ—М—И–Є—В—М —З–Є—Б–ї–Њ —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е, —В. –µ. —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–ї—Г—З—И–Є—В—М —Б–Ї—А–Є–љ–Є–љ–≥ –Є –≤—Л—П–≤–ї–µ–љ–Є–µ –†–Я–Ц –љ–∞ —Б–∞–Љ—Л—Е —А–∞–љ–љ–Є—Е –ї–Њ–Ї–∞–ї—М–љ—Л—Е —Б—В–∞–і–Є—П—Е –Ґ1-2, –Ї–Њ–≥–і–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ–Њ–ї–љ–Њ–µ –Є–Ј–ї–µ—З–µ–љ–Є–µ –Њ—В –†–Я–Ц. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–і–љ–Њ–є –Є–Ј –њ–Њ—Б–ї–µ–і–љ–Є—Е –і–Є—Б–њ–∞–љ—Б–µ—А–Є–Ј–∞—Ж–Є–є –љ–∞—Б–µ–ї–µ–љ–Є—П –†–Њ—Б—Б–Є–Є –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –≤ 2013 –≥. –≤ –†–§ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ 535 887 —Б–ї—Г—З–∞–µ–≤ –≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ—Л—Е –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є. –Т —Б—В—А—Г–Ї—В—Г—А–µ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Љ—Г–ґ—З–Є–љ –±–Њ–ї—М—И–Њ–є —Г–і–µ–ї—М–љ—Л–є –≤–µ—Б –Є–Љ–µ—О—В –Њ–њ—Г—Е–Њ–ї–Є —В—А–∞—Е–µ–Є, –±—А–Њ–љ—Е–Њ–≤, –ї–µ–≥–Ї–Њ–≥–Њ (18,4%), –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (12,9%), –Ї–Њ–ґ–Є (11,4%), –ґ–µ–ї—Г–і–Ї–∞ (8,6%). –Я–µ—А–≤–Њ–µ —А–µ–є—В–Є–љ–≥–Њ–≤–Њ–µ –Љ–µ—Б—В–Њ –њ–Њ –≤—Л—П–≤–ї—П–µ–Љ–Њ—Б—В–Є –Ј–∞–љ—П–ї —А–∞–Ї –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —Г –ґ–µ–љ—Й–Є–љ (28,1%), –≤—В–Њ—А–Њ–µ вАУ —А–∞–Ї –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —Г –Љ—Г–ґ—З–Є–љ (16,5%). –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –і–Є—Б–њ–∞–љ—Б–µ—А–Є–Ј–∞—Ж–Є–Є –Ї–∞–ґ–і—Л–є –≤—В–Њ—А–Њ–є —А–Њ—Б—Б–Є–є—Б–Ї–Є–є –Љ—Г–ґ—З–Є–љ–∞ —Б –≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ—Л–Љ –†–Я–Ц —Г–ґ–µ –Є–Љ–µ–ї —Б—В–∞–і–Є—О –Ґ3-4 –Є —Б—В–∞–љ–Њ–≤–Є–ї—Б—П –Ї–∞–љ–і–Є–і–∞—В–Њ–Љ –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Р–Ф–Ґ (–Ь–Р–С) [63]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —Г–ї—Г—З—И–µ–љ–Є–µ –≤—Л—П–≤–ї—П–µ–Љ–Њ—Б—В–Є –†–Я–Ц –≤ —Ж–µ–ї–Њ–Љ, –Њ–љ —В–µ–Љ –љ–µ –Љ–µ–љ–µ–µ —З–∞—Б—В–Њ –≤—Л—П–≤–ї—П–µ—В—Б—П –≤ –†–Њ—Б—Б–Є–Є —Г–ґ–µ –љ–∞ –њ–Њ–Ј–і–љ–µ–є —Б—В–∞–і–Є–Є –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–≥–Њ –Є–ї–Є –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞–Ї–∞, –Ї–Њ–≥–і–∞ —А–∞–і–Є–Ї–∞–ї—М–љ–Њ–µ –Є–Ј–ї–µ—З–µ–љ–Є–µ –Њ—В –љ–µ–≥–Њ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ –Љ–Њ–ґ–љ–Њ –Њ–ґ–Є–і–∞—В—М –Ї–∞–Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Р–Ф–Ґ –њ—А–Є –†–Я–Ц, —В–∞–Ї –Є –њ–Њ–≤—Л—И–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –≤ —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–†–Я–Ц —П–≤–ї—П–µ—В—Б—П –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–Љ –њ—А–Є–Љ–µ—А–Њ–Љ ¬Ђ–Њ–Ї–Ї—Г–ї—М—В–љ–Њ–≥–Њ¬ї —А–∞–Ї–∞, –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –њ—А–Њ—В–µ–Ї–∞—О—Й–µ–≥–Њ –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ, –њ–Њ—Н—В–Њ–Љ—Г, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ—А–Њ–≥—А–µ—Б—Б –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є–Є –ї–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ –†–Я–Ц, –Љ–Њ–ґ–љ–Њ –Њ–ґ–Є–і–∞—В—М, —З—В–Њ —З–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ј–∞–њ—Г—Й–µ–љ–љ—Л–Љ–Є —Б—В–∞–і–Є—П–Љ–Є –†–Я–Ц –±—Г–і–µ—В –Њ—Б—В–∞–≤–∞—В—М—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±–Њ–ї—М—И–Є–Љ, –Є –≤—Б–µ —Н—В–Є –њ–∞—Ж–Є–µ–љ—В—Л –±—Г–і—Г—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М—Б—П –Ї–∞–Ї –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л–µ –Ї–∞–љ–і–Є–і–∞—В—Л –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Р–Ф–Ґ. –Э–∞–Ј–љ–∞—З–µ–љ–Є–µ —В–µ—А–∞–њ–Є–Є, –њ—А–Є–≤–Њ–і—П—Й–µ–є –Ї —В—П–ґ–µ–ї–Њ–Љ—Г –і–µ—Д–Є—Ж–Є—В—Г —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞, –љ–µ–њ—А–µ–Љ–µ–љ–љ–Њ –±—Г–і–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —Ж–µ–ї–Њ–Љ—Г —А—П–і—Г –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ-–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є, –≤–Ї–ї—О—З–∞—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Г —Н—В–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —В—П–ґ–µ–ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤, –Њ–±—А–∞–Ј—Г—О—Й–Є—Е—Б—П —Г –Љ—Г–ґ—З–Є–љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Ј–∞ —Б—З–µ—В –∞—А–Њ–Љ–∞—В–Є–Ј–∞—Ж–Є–Є —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞. –≠—Б—В—А–Њ–≥–µ–љ—Л —Г –Њ–±–Њ–Є—Е –њ–Њ–ї–Њ–≤ вАУ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є–µ –≥–Њ—А–Љ–Њ–љ—Л –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞, –њ–Њ—Н—В–Њ–Љ—Г —А–∞–Ј–≤–Є—В–Є–µ –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є/–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –љ–∞ —Д–Њ–љ–µ –Р–Ф–Ґ —П–≤–ї—П–µ—В—Б—П –љ–µ–Є–Ј–±–µ–ґ–љ—Л–Љ –Є –Ї—А–∞–є–љ–µ –і—А–∞–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ —Б–Њ–±—Л—В–Є–µ–Љ. –Ф–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Є —А–µ–њ–∞—А–∞—Ж–Є–Є –Є–Љ–µ–µ—В—Б—П –±–Њ–ї—М—И–Њ–є –∞—А—Б–µ–љ–∞–ї –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б –Ї–Њ—В–Њ—А—Л–Љ–Є, –Њ—З–µ–≤–Є–і–љ–Њ, —Г–ґ–µ —Б–µ–≥–Њ–і–љ—П –љ—Г–ґ–љ–Њ –Њ–Ј–љ–∞–Ї–Њ–Љ–Є—В—М—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–∞–Љ –њ–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј—Г, –љ–Њ –Є –Њ–љ–Ї–Њ–ї–Њ–≥–∞–Љ –Є –Њ–љ–Ї–Њ—Г—А–Њ–ї–Њ–≥–∞–Љ, —З—В–Њ–±—Л —Е–Њ—В—М –Ї–∞–Ї-—В–Њ –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞—В—М –љ–µ–≥–∞—В–Є–≤–љ—Л–µ –Њ—Б—В–µ–Њ—В—А–Њ–њ–љ—Л–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П –њ–Њ–ї–љ–Њ–є –∞–љ–і—А–Њ–≥–µ–љ–љ–Њ–є –і–µ–њ—А–Є–≤–∞—Ж–Є–Є —Г –Љ—Г–ґ—З–Є–љ —Б —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є –†–Я–Ц —Б —Ж–µ–ї—М—О —Е–Њ—В—П –±—Л –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –Є –±–µ–Ј —В–Њ–≥–Њ –љ–Є–Ј–Ї–Њ–≥–Њ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є —Г —Н—В–Њ–є —В—П–ґ–µ–ї–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤.












