Достаточный уровень биосинтеза коллагена является одним из важнейших показателей нормофизиологического метаболизма соединительной ткани. Фундаментальные и клинические исследования показали, что уровни кальция во внеклеточной среде стимулируют синтез/секрецию коллагена клетками внеклеточного матрикса соединительной ткани.
В эксперименте недостаточное потребление кальция негативно сказывается на состоянии биосинтеза коллагена в костной ткани [1]. Известно, в частности, что так называемые блокаторы кальциевых каналов ингибируют синтез коллагена-I и его секрецию фибробластами, а аскорбат-анион противодействует эффектам блокаторов кальция [2] (рис. 1). Исследования с использованием изотопных меток показали, что блокаторы кальциевых каналов снижают преимущественно биосинтез коллагена, а не биосинтез неколлагеновых белков соединительной ткани [3].
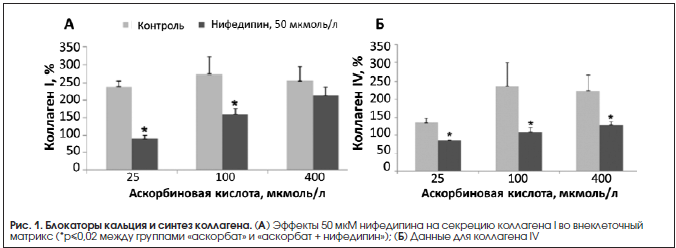
Показано также, что использование препаратов кальция стимулирует синтез коллагена, ускоряя заживление ран и переломов. Например, альгинат кальция улучшает заживление ран в эксперименте, повышая синтез коллагена I типа и соотношение количеств фибриллярного коллагена-I и ретикулярного коллагена-III. Скорость закрытия раны при использовании альгината увеличивалась по сравнению с таковой в контрольной группе [4].
В проведенном нами экспериментальном исследовании были изучены эффекты синергидной комбинации кальция с цинком, медью, марганцем, бором, магнием и витамином D (препарат Кальцемин Адванс) на модели резаной раны. Введение препарата в виде водной суспензии в течение 21 сут приводило к снижению среднего времени до полного заживления раны на 6 сут по сравнению с контролем (вода, p<0,05). При этом средняя площадь раны достоверно отличалась между группами уже с 9-го дня эксперимента (значения р в интервале 0,00013–0,047) [5].
Повышенная скорость заживления раны при приеме синергидной комбинации кальция сопровождалась повышением содержания волокон коллагена I в области раны (рис. 2А). В контрольной группе процент окрашивания коллагена составил 62±11%, а при приеме препарата Кальцемин Адванс – 82±8% (т. е. на 20% выше по сравнению с контролем, р=0,00056) [5]. Гистоморфологический анализ подтвердил ускорение процесса созревания рубцовой ткани и указал на снижение воспалительной реакции в созревающей соединительной ткани и улучшение эпителизации раны. В контрольной группе кожный дефект замещен рыхло-волокнистой соединительной тканью. В опытной группе (Кальцемин Адванс) практически во всех наблюдениях в зоне кожной раны сформировалась зрелая соединительная (рубцовая) ткань из мономорфных ориентированных коллагеновых волокон, и лишь в одном наблюдении кожный дефект был замещен рыхло-волокнистой соединительной тканью (рис. 2Б, В) [5].
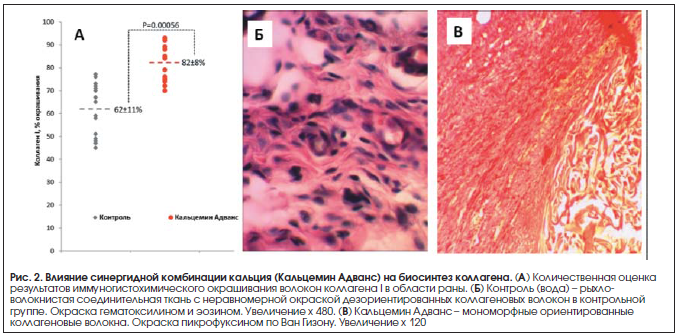
Описываемый эффект воздействия кальция на уровни коллагена был также подтвержден в клинических исследованиях. Например, дотации кальция (1200 мг/сут, 2 мес.) женщинам в постменопаузе с низким потреблением кальция снижали коллагеновые маркеры деградации: гидроксипролин, пиридинолин, дезоксипиридинолин [6].
Таким образом, экспериментальные и клинические исследования показывают, что препараты кальция стимулируют синтез/секрецию коллагенов. В настоящей работе представлены результаты системно-биологического анализа белков протеома человека, проведенного с целью установления наиболее вероятных молекулярных механизмов осуществления данного эффекта воздействия кальция на метаболизм коллагена.
Материал и методы
В настоящей работе использован метод анализа функциональных взаимосвязей [7] – одна из информационных технологий современной биоинформатики. Соединяя данные различных уровней (данные о моногенных заболеваниях, кофакторах белков, клеточных ролях белков, симптоматику и критерии диагностики заболеваний и т. д.), данный метод позволяет систематически рассмотреть все возможные области применения препаратов кальция. В целом при использовании метода анализа функциональных взаимосвязей для каждого белка протеома человека составляется последовательная цепь описаний:
– аминокислотная последовательность белка;
– список биохимически необходимых эссенциальных кофакторов белка (в т. ч. с указанием потребности ионов кальция для активности рассматриваемого белка);
– список моногенных заболеваний, связанных с полной или частичной потерей активности этого белка;
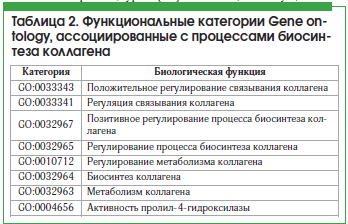
– список клеточных функций белка (по БД Gene Ontology, GO и др.);
– список отдельных симптомов заболеваний, список диагнозов по МКБ-10 и другая информация из баз данных.
Далее в полученном списке описаний белков выделяются Са-зависимые белки, проводится последующий анализ их функций на основании статистических критериев. Для статистической обработки результатов исследования использовались методы математической статистики, включающие расчет числовых характеристик случайных величин, проверки статистических гипотез с использованием параметрических и непараметрических критериев, корреляционного и дисперсионного анализа. Сравнение прогнозируемых и наблюдаемых частот встречаемости исследуемых признаков проводилось с помощью критерия -квадрат, T-критерия Вилкоксона – Манна – Уитни и теста Стьюдента. Для статистической обработки материала использовались прикладная программа Statistica 6.0 и электронные таблицы Microsoft Excel.
Результаты
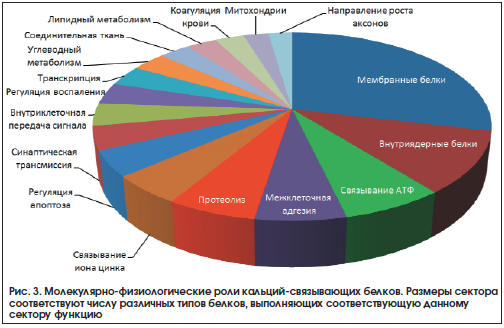
В ходе исследования была проанализирована информация о 23 500 белках протеома человека, для которых установлены биологические роли. Функции 2145 из 23 500 белков в той или иной мере зависят от уровней кальция (например, изменяются уровни экспрессии белка), а 625 из 2145 белков непосредственно связывают ион кальция как кофактор [8]. В целом ионы кальция необходимы для функционирования многочисленных мембранных белков (как правило, белков-рецепторов) и внутриядерных белков (белки транскрипции и метаболизма ДНК). Также ионы кальция принимают значительное участие в процессах межклеточной адгезии и формирования структуры соединительной ткани, регуляции клеточного апоптоза и воспаления, синаптической трансмиссии и роста аксонов (рис. 3).
Результаты проведенного системно-биологического анализа кальций-зависимых белков [8] указали на диагнозы по МКБ-10, специфически ассоциированные с генетическими дефектами в кальций-зависимых белках. Наиболее кальций-специфичными группами патологий являются нарушения гемостаза и состава крови, пороки развития различных органов, нарушения функции щитовидной и паращитовидной желез и патологии соединительной ткани. Для целей настоящего исследования интересно отметить, что многие из этих диагнозов были ассоциированы с нарушениями структуры соединительной ткани, в т. ч. ее коллагеновых сетей (табл. 1).
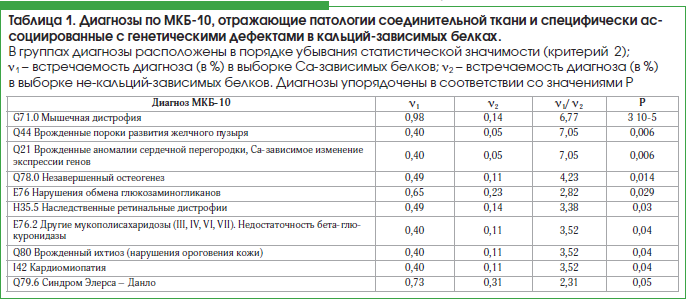
В целом перечисленные в таблице 1 диагнозы, ассоциированные с нарушениями структуры соединительной ткани и коллагена, зависят от нарушений активности более 58 Са-зависимых белков. Для уточнения молекулярных механизмов воздействия кальция на метаболизм коллагена рассмотрим молекулярные механизмы биосинтеза коллагена и затем оценим соответствие между результатами системно-биологического анализа Са-зависимых белков и этими механизмами.
Молекулярные механизмы биосинтеза коллагена
Коллагеновые фибриллы являются механической основой соединительной ткани всех органов и, в частности, кости. Коллаген I типа образует наиважнейший компонент коллагеновой сети – протяженные фибриллы. В костях фибриллы коллагена минерализуются гидроксиапатитом кальция и связывают ион кальция аминокислотными остатками № 1277....1285 [9]. В костной ткани фибриллы коллагена взаимодействуют с ионами кальция на поверхности кристаллов гидроксиапатита [10] (рис. 4).

Однако взаимодействия между кальцием и коллагеном вовсе не ограничены непосредственными взаимодействиями между гидроксиапатитом и коллагеновыми фибриллами в костной ткани. Например, взаимодействия между клетками, синтезирующими коллаген, и самими коллагеновыми молекулами зависят от активности магний- и инозитол-зависимого фермента фосфатидилинозитол-3-киназы (PI3K), который участвует в регуляции уровней внутриклеточного Ca2+ [11]. Рассмотрим и другие потенциальнык возможности участия препаратов кальция в процессе биосинтеза коллагена, основные стадии которого представлены на рисунке 5.
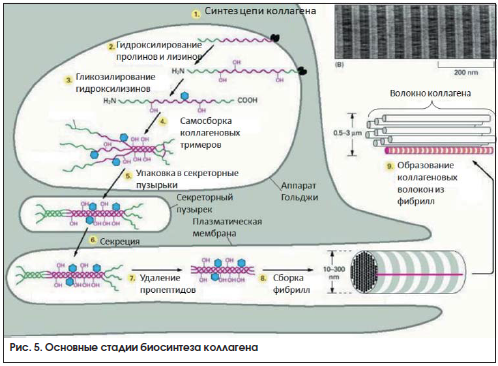
Осуществляемый фибробластами или другими типами клеток соединительной ткани биосинтез коллагена включает в себя следующие стадии [12]:
• Синтез мРНК (транскрипция генов, кодирующих коллагены, 34 гена) – участвуют десятки магний- и кальций-зависимых белков.
• Синтез аминокислотной цепи пре-проколлагена на рибосоме из мРНК (трансляция) поддерживается магний- и кальций-зависимыми белками, магний-зависимыми тРНК и рибосомной РНК.
• Транспорт цепи пре-проколлагена в эндоплазматический ретикулум посредством «адреса» (сигнального пептида) на N-концевом участке аминокислотной цепи.
• Удаление сигнального пептида в последовательности пре-проколлагена посредством фермента пептидазы сигнальных пептидов SPP (нет кофакторов).
• Гидроксилирование аминокислотных остатков пролина и лизина в пре-проколлагене с участием ферментов пролил-3-гидроксилазы, пролил-4-гидроксилазы и лизил-гидроксилаз 1, 2, 3. Все перечисленные ферменты требуют Fe2+ и аскорбат-анион в качестве кофакторов, O2 в качестве субстрата. Гиповитаминоз С и, особенно, авитаминоз С (цинга) ассоциированы с резким падением активности именно этих ферментов.
• Гликозилирование моносахаридами аминокислотных остатков лизина в пре-проколлагене посредством проколлаген-галактозилтрансфераз, гидроксилизил-галактозилтрансферазы (УДФ-галактозы-5-гидроксилизин-коллаген-галактозилтрансферазы) и галактозил-гидроксилизил-глюкозилтрансферазы (УДФ-глюкоза-5-гидроксилизин-коллаген глюкозилтрансферазы). Данные ферменты содержат ионы марганца (и, возможно, ионы Са2+) в качестве кофакторов.
• Сборка тройной спирали проколлагена из 3 аминокислотных цепей пре-проколлагена.
• Внесение необходимых конформационных изменений в проколлаген посредством изомеризации остатков цистеина и пролина ферментами протеиндисульфид изомеразы и пролил-цис-транс-изомеразы. Данные ферменты не содержат кофакторов.
• Упаковка проколлагена в транспортный везикул, перенос во внеклеточный матрикс.
• Вне клетки проколлаген-протеиназы модифицируют молекулу проколлагена с образованием тропоколлагена. Дефекты генов проколлаген-протеиназы ассоциированы с известным синдромом Элерса – Данло. Проколлаген-N-протеиназа и проколлаген-С-протеиназа нуждаются в ионах Zn2+ в качестве кофактора.
• Формирование коллагеновых фибрилл из тропоколлагена посредством лизилоксидазы, образующей ковалентные связки между отдельными сегментами тропоколлагена. Кофакторами лизилоксидазы являются ионы Cu+ и тирозил-хинон.
Таким образом, процесс биосинтеза коллагена нуждается в определенных кофакторах: ионах Са2+, Mg2+, Fe2+, Mn2+, Zn2+, Cu+, тирозил-хиноне и аскорбат-анионе. Следует отметить, что воздействие иона кальция собственно на биохимический процесс синтеза коллагена достаточно низкоспецифично – ведь ионы Са2+ влияют в основном на фундаментальные клеточные процессы транскрипции генов и трансляции всех видов белков. Для установления более специфичных механизмов воздействия ионов Са2+ на синтез коллагена рассмотрим результаты системно-биологического анализа Са-зависимых белков.
Системно-биологический анализ Са-зависимых белков, которые могут воздействовать на биосинтез коллагена
Для установления Са-зависимых белков протеома, которые могут воздействовать на синтез коллагена, был проведен поиск с использованием перечисленных в таблице 2 биологических ролей. В результате был получен список из 15 белков (табл. 3).
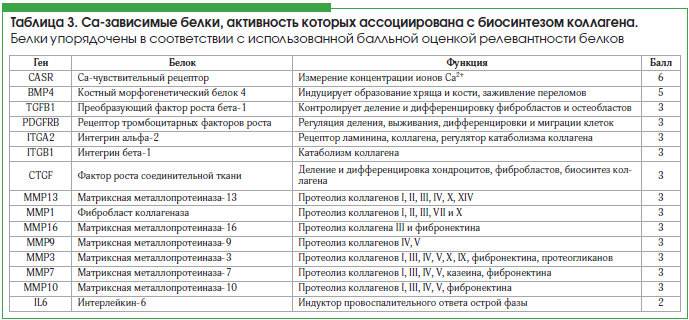
Для оценки вклада каждого из анализируемых 15 белков во взаимосвязь между уровнями кальция и коллагена была разработана балльная шкала оценки релевантности биологических функций белков, содержащая следующие пункты:
• Белок влияет, прямо или косвенно, на биосинтез коллагена – 1 балл.
• Белок влияет на биодеградацию коллагена – 1 балл.
• Имеются экспериментальные данные о том, что на активность белка влияют уровни кальция, – 1 балл.
• Белок содержит хотя бы 1 Са-связывающий сайт – 1 балл.
• Воздействие кальция на данный белок состоит в повышении активности коллаген-синтезирующих ферментов или в снижении активности коллаген-деградирующих ферментов – 1 балл.
• Биологические роли белка осуществляются посредством изменения внутриклеточных концентраций ионов Са2+ – 1 балл.
• Имеются экспериментальные данные, подтверждающие воздействие ионов кальция на биосинтез коллагена при участии данного белка, – 1 балл.
В таблице 3 приведены результаты оценки релевантности различных Са-зависимых белков по отношению к воздействию ионов Са2+ на биосинтез коллагена. Очевидно, что наиболее интересными «таргетными белками» являются Са-чувствительный рецептор (CASR) и костный морфогенетический белок 4 (BMP4). Далее представлен более подробный анализ перечисленных в таблице 3 белков.
Са-чувствительный рецептор CASR
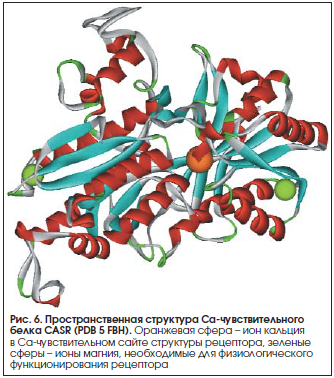
Са-чувствительный рецептор, или «сенсор кальция» (CASR) [13], – рецептор, взаимодействующий с различными G-белками (G(q), G(i), G(q/11), G(i/o), G(12/13) и G(s)) [14]. Рецептор CASR (рис. 6) присутствует, в частности, в клетках паращитовидной железы, секретирующих паратиреоидный гормон (ПТГ), и в клетках эндотелия почечных канальцев. Врожденные повреждения гена CASR приводят к гиперкальциемическим или гипокальциемическим расстройствам: семейной гипокальциурической гиперкальциемии, неонатальному острому первичному гиперпаратиреозу, аутосомно-доминантной гипокальциемической гиперкальциурии [15]. Заметим, что осуществлению биологических эффектов рецептора CASR способствует активность калиевых каналов [16].
В паращитовидной железе CASR «измеряет» концентрации ионов Са2+ в плазме крови и активирует внутриклеточные сигнальные пути, регулирующие секрецию ПТГ или фильтрацию катионов в почках. В остеоцитах CASR детектирует уровни внеклеточного кальция и активирует остеогенез. Высокие внеклеточные уровни ионов Ca2+ (порядка 10 мМ) стимулируют экспрессию остеогенных маркеров, включая щелочную фосфатазу, костный сиалопротеин, коллагены, остеокальцин IA1, и увеличивают минерализацию кости. Кроме того, блокада рецептора CASR ингибирует клеточный ответ остеоцитов на изменения внеклеточной концентрации Ca2+ [17].
Однако рецептор CASR играет и другие важные роли, далеко простирающиеся за рамки регулирования уровней внеклеточного Са2+. Например, главная роль CASR в почках заключается в регуляции реабсорбции кальция в восходящем отделе петли Генле, причем вне зависимости от секреции ПТГ (CASR модулирует уровни белка клаудин-14, контролирующего парацеллюлярный транспорт ионов) [18].
Также CASR является физиологическим регулятором роста, дифференцировки и выживания остеобластов и остеокластов [19]. Экспрессия рецептора CASR в хрящевой и костной ткани непосредственно регулирует скелетный гомеостаз и метаболизм соединительной ткани. Рецептор CASR вносит важный вклад в рост хрящевой пластинки, в т. ч. в процессы роста и дифференцировки остеобластов и остеокластов [20] (рис. 7).
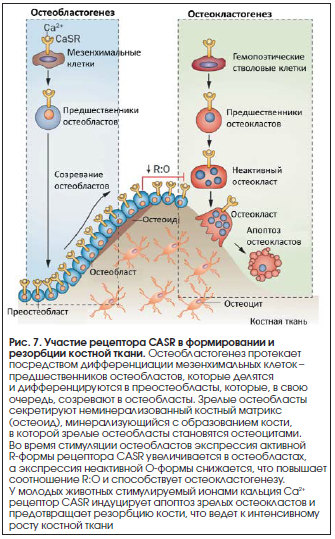
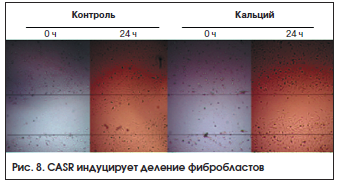
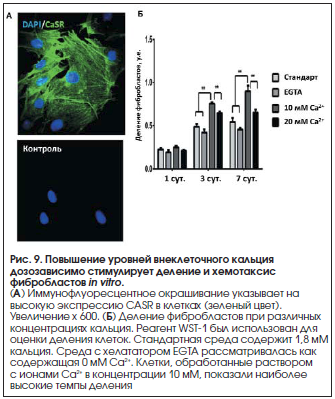
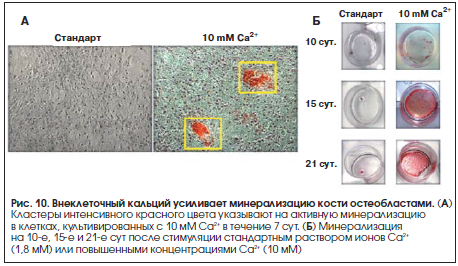
В эксперименте было показано, что активируемый ионами Ca2+ рецептор стимулирует деление фибробластов и секрецию матриксных металлопротеиназ ММР-3, ММР-9 [21]. Повышение уровней внеклеточного кальция in vitro дозозависимо стимулирует деление фибробластов (рис. 8, контроль – 105 клеток, кальций – 2,2•105 клеток, p<0,05) и их активность (хемотаксис, рис. 9). Внеклеточный кальций, действуя через рецептор CASR, усиливает минерализацию кости остеобластами (рис. 10) [17].
Как известно, фибробласты являются клетками, производящими все компоненты соединительной ткани: коллагеновые и эластиновые волокна и протеингликаны гелеобразной среды. Стимулирование CASR деления фибробластов неизбежно связано с повышением общего уровня активности фибробластов, в т. ч. более активным биосинтезом коллагена. Таким образом, активация рецептора CASR ионами Ca2+ является наиболее убедительным механизмом коллаген-продуцирующего действия кальциевых препаратов.
Костный морфогенетический белок 4
Костный морфогенетический белок 4 индуцирует образование хряща и кости, участвует в развитии зубов, формировании конечностей и заживлении переломов. Интересно, что механическая нагрузка на кость способствует синтезу внеклеточного матрикса остеобластами на фоне увеличения уровней белков BMP-2/4 [22].
Повышение уровня внеклеточного кальция стимулирует увеличение числа остеобластов и ингибирует образование остеокластов, в частности, посредством воздействия на уровни экспрессии костных морфогенетических белков. Например, добавление 0,1–0,4 мМ CaCl2 к клеткам в культуре достоверно увеличивало уровни мРНК BMP-2 и BMP-4, количество синтезируемого коллагена I, оцененного по уровням карбоксиконцевого пептида проколлагена I [23]. Повышенные уровни Ca2+ увеличивают экспрессию генов белков морфогенеза костей (в частности, BMP-2) [24].
Взаимосвязи между активностью рецептора CASR и экспрессией морфогенетических белков остаются недостаточно изученными. Считается, с одной стороны, что регулируемая секреция BMP-2 происходит в ответ на активацию рецептора CASR [25]. С другой стороны, использование кальцимиметика NPS-R568, специфического агониста для рецептора CASR, не увеличивало экспрессию BMP–2. Кроме того, известно, что CASR реагирует не только на уровни Са2+, но и на ионы Mg2+, Sr2+, Gd3+. Однако только ионы Са2+, Sr2+, но не Mg2+ или Gd3+ вызывали дозозависимое увеличение уровней мРНК BMP-2. Поэтому возможно, что за увеличение экспрессии костных морфогенетических белков при высоких уровнях кальция может отвечать и другой белок – рецептор кальция, отличный от рецептора CASR [24].
О других Са-зависимых белках и их воздействии на метаболизм коллагена
К другим Са-зависимым белкам, так или иначе влияющим на метаболизм коллагена, относятся матриксные металлопротеиназы (ММП) и некоторые ростовые факторы (табл. 3). ММП осуществляют протеолиз тройных спиралей коллагенов различных типов и играют роль в процессе заживления ран, ремоделировании соединительной ткани, деградации хряща, развитии и минерализации кости и заживлении переломов костей [26]. В структурах ММП содержатся Са-связывающие сайты, так что достаточные уровни кальция необходимы для деградации коллагена посредством ММП. Таким образом, ММП не могут непосредственно усиливать процессы биосинтеза коллагена.
Более вероятно, что уровни внеклеточного кальция могут способствовать повышению биологической активности ростовых факторов, активность которых связана с увеличением биосинтеза коллагена. Общеизвестно, что эффекты ростовых факторов TGFB1, PDGFRB и CTGF (табл. 3) осуществляются за счет «всплеска» внутриклеточных концентраций ионов Са2+ в момент активации рецептора. Повышение внеклеточных концентраций Са2+ (что происходит при приеме кальциевых препаратов) может способствовать повышению внутриклеточных концентраций Са2+, например, за счет неспецифической диффузии через аквапорины или другие транспортные каналы. Иначе говоря, повышение концентрации внутриклеточного кальция вследствие приема кальциевых препаратов как бы имитирует активацию факторов роста TGFB1, PDGFRB и CTGF, активность которых связана с повышением биосинтеза коллагена.
Преобразующий фактор роста бета-1 (TGF-бета1) контролирует деление и дифференцировку многих типов клеток, в т. ч. фибробластов и остеобластов. TGF-бета1 стимулирует приток ионов Са2+ в цитоплазму клетки [27] и синтез коллагена в остеобластах (р=0,001), что имеет важное значение для образования костной ткани. На остеобластах в культуре одновременное добавление к среде Ca(OH)2 и TGF-бета1 значительно увеличило синтез белка вообще и синтез коллагена в частности (р=0,048) [28].
Рецептор тромбоцитарных факторов роста PDGF-B и PDGF-D (PDGFRB) играет существенную роль в регуляции клеточного деления, выживаемости, дифференцировки и миграции клеток. Мутации в структуре молекулы рецептора ухудшают заживление ран и уменьшают отложение коллагена в соединительной ткани [29]. Рецептор PDGFRB активирует фосфолипазу С1 (PLCG1), что инициирует процессы внутриклеточной передачи сигнала с участием сигнальных молекул диацилглицерола, инозитол-1,4,5-трифосфата, мобилизацию внутриклеточного Ca2+ и активацию протеинкиназы C. Активация рецептора вызывает рост внутриклеточной концентрации Ca2+, что повышает экспрессию генов коллагена и фибронектина в фибробластах [30].
Фактор роста соединительной ткани (CTGF) способствует делению и дифференцировке хондроцитов, обеспечивает клеточную адгезию фибробластов, осуществляет положительное регулирование процесса биосинтеза коллагена [31] посредством сигнальных путей Rac1/MLK3/JNK/AP-1 [32]. В частности, CTGF связывается с рецептором-2 факторов роста фибробластов (FGFR2) и стимулирует Са-зависимую внутриклеточную передачу сигнала [33].
Таким образом, первично минерализация кости начинается внутри коллагеновых фибрилл, а затем, по мере нарастания процесса, минерализация и насыщение кальцием усиливаются между фибриллами [34]. Аналогичная последовательность наблюдается при минерализации тканей дентина зубов [35]. Установлена следующая последовательность процессов формирования тканей кости во времени: остеобласты формируют неминерализованный органический остеоид (костную матрицу), который преимущественно состоит из коллагена I типа. Эта матрица служит своего рода «ловушкой» и основой для неорганических кристаллов гидрокси-апатита. Таким образом, в минерализации остеоида прослеживаются 2 стадии. Первичная минерализация (изначальное включение ионов кальция и фосфата в коллагеновый матрикс) происходит быстро – в течение 2–3 нед. и составляет примерно 70% общего содержания минералов. Вторичная минерализация (окончательное созревание минеральных кристаллов) происходит в течение значительно более длительного времени – до 1 года и более [36].
Заключение
Миллионам женщин старше 40 лет грозит перелом из-за хрупкости костей вследствие вымывания кальция. Каждые 5 мин в России происходит перелом проксимального отдела бедренной кости [37]. В особой группе риска находятся 34 млн женщин России старше 40 лет, и 24 млн не знают об этом. Основные причины хрупкости костей – вымывание кальция и утрата коллагена. Улучшение биосинтеза коллагена – необходимое условие для восстановления структуры кости при срастании переломов, регенерации кости при постменопаузальном, лекарственном остеопорозе, а также при других нарушениях целостности кости. Нормализация биосинтеза коллагена способствует лучшему удержанию кальция в костной ткани и, следовательно, повышению минеральной плотности кости. В отличие от других препаратов Кальцемин Адванс содержит кальций и минералы, формирующие коллагеновую сетку, что удерживает кальций в костях. Она препятствует вымыванию кальция и сохраняет прочность костной ткани.
Таким образом, Кальцемин Адванс и сохраняет прочность костной ткани: останавливает вымывание кальция, способствует синтезу коллагенового матрикса и насыщению костной ткани необходимыми микро- и макроэлементами.
Системно-биологический анализ кальций-зависимых белков протеома человека показал, что ионы кальция стимулируют биосинтез коллагена посредством действия ионов кальция на Са-чувствительный рецептор CASR и костный морфогенетический белок BMP4.
Костный метаболизм вообще и биосинтез коллагена в частности нуждается в поддержке определенными «остеотропными» микронутриентами. В частности, процесс биосинтеза коллагена нуждается в ионах Са2+, Mg2+, Fe2+, Mn2+, Zn2+, Cu+ как кофакторах соответствующих ферментов. Поэтому препараты кальция, способствующие повышению обеспеченности организма магнием, цинком, медью, марганцем (например, препарат Кальцемин Адванс), повышают потенциал коллагенообразования в соединительной ткани.












