–Т–≤–µ–і–µ–љ–Є–µ
–•–Є—А—Г—А–≥–Є—П —А–∞–Ї–∞ –ґ–µ–ї—Г–і–Ї–∞ –Њ—Б—В–∞–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ —Б–ї–Њ–ґ–љ—Л—Е –≤ —В–µ—Е–љ–Є—З–µ—Б–Ї–Њ–Љ –њ–ї–∞–љ–µ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–є –≤ –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є. –І–∞—Б—В–Њ—В–∞ –Ї–∞–Ї –Є–љ—В—А–∞-, —В–∞–Ї –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—Б–Њ–Ї–∞, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –∞–љ–µ—Б—В–µ–Ј–Є–Њ–ї–Њ–≥–Є–Є –Є —Г—А–Њ–≤–µ–љ—М —В–µ—Е–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П [1].
–†–∞–Ј–≤–Є—В–Є–µ –Љ–∞–ї–Њ–Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е —В–µ—Е–љ–Њ–ї–Њ–≥–Є–є –≤ —Ж–µ–ї–Њ–Љ –љ–µ –Љ–Њ–≥–ї–Њ –љ–µ –Њ–Ї–∞–Ј–∞—В—М —Б–≤–Њ–µ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –њ–Њ–і—Е–Њ–і–µ –Ї –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О —В–∞–Ї–Њ–є —Б–ї–Њ–ґ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –Ї–∞–Ї —А–∞–Ї –ґ–µ–ї—Г–і–Ї–∞. –°—В—А–µ–Љ–ї–µ–љ–Є–µ –Ї —Б–љ–Є–ґ–µ–љ–Є—О —В—А–∞–≤–Љ–∞—В–Є—З–љ–Њ—Б—В–Є –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ —Б —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ–Љ –Њ–±—Й–µ–≥–Њ –Ї–∞—З–µ—Б—В–≤–∞ –Њ–њ–µ—А–∞—Ж–Є–Є –Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л—Е –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Є–≤–µ–ї–Њ –Ї –≤–љ–µ–і—А–µ–љ–Є—О –Љ–∞–ї–Њ–Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е –ї–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е –Є —А–Њ–±–Њ—В-–∞—Б—Б–Є—Б—В–Є—А–Њ–≤–∞–љ–љ—Л—Е —В–µ—Е–љ–Њ–ї–Њ–≥–Є–є –≤ –Њ–±–ї–∞—Б—В—М —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —А–∞–Ї–∞ –ґ–µ–ї—Г–і–Ї–∞ [2]. –†–Њ–±–Њ—В-–∞—Б—Б–Є—Б—В–Є—А–Њ–≤–∞–љ–љ—Л–µ –Њ–њ–µ—А–∞—Ж–Є–Є, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –њ—А–Є–≤–ї–µ–Ї–∞—О—В —Б–≤–Њ–Є–Љ–Є —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –±—Л—В—М —А–µ–∞–ї–Є–Ј–Њ–≤–∞–љ—Л –≤ —Г–ї—Г—З—И–µ–љ–Є–Є –Ї–∞—З–µ—Б—В–≤–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞, —Б–љ–Є–ґ–µ–љ–Є–Є —З–∞—Б—В–Њ—В—Л –Є–љ—В—А–∞- –Є –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –њ–Њ–≤—Л—И–µ–љ–Є–Є –Ї–∞—З–µ—Б—В–≤–∞ –ї–Є–Љ—Д–∞–і–µ–љ—Н–Ї—В–Њ–Љ–Є–Є –Є —Г–ї—Г—З—И–µ–љ–Є–Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤. –Ш–Ј–≤–µ—Б—В–љ—Л —В–∞–Ї–Є–µ –Њ–±—Й–Є–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –Љ–∞–ї–Њ–Є–љ–≤–∞–Ј–Є–≤–љ–Њ–є —Е–Є—А—Г—А–≥–Є–Є, –Ї–∞–Ї –Љ–µ–љ—М—И–∞—П —В—А–∞–≤–Љ–∞—В–Є–Ј–∞—Ж–Є—П —В–Ї–∞–љ–µ–є –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є –њ–µ—А–µ–і–љ–µ–є –±—А—О—И–љ–Њ–є —Б—В–µ–љ–Ї–Є, –≤—Б–ї–µ–і—Б—В–≤–Є–µ —З–µ–≥–Њ —Б–љ–Є–ґ–∞—О—В—Б—П —А–Є—Б–Ї–Є —А–∞–Ј–≤–Є—В–Є—П —Б–њ–∞–µ—З–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П —Б—В–µ–њ–µ–љ—М —Б–Є—Б—В–µ–Љ–љ–Њ–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є, —Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –Ї–Њ—Б–Љ–µ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В. –Т —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ-–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≥–Њ—А–∞–Ј–і–Њ –Љ–µ–љ—М—И–µ, —З–µ–Љ –њ–Њ—Б–ї–µ –Њ—В–Ї—А—Л—В—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤. –≠—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–љ–љ–µ–є –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–Є –Є —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Є, –±–Њ–ї–µ–µ —А–∞–љ–љ–µ–Љ—Г –љ–∞—З–∞–ї—Г –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П, —Б–љ–Є–ґ–µ–љ–Є—О —А–Є—Б–Ї–Њ–≤ —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Њ—В–Ї–∞–Ј—Г –Њ—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –љ–∞—А–Ї–Њ—В–Є—З–µ—Б–Ї–Є—Е –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Њ–≤, —Г–Љ–µ–љ—М—И–µ–љ–Є—О –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ. –Я–Њ–Љ–Є–Љ–Њ –Њ–±—Й–Є—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –Љ–∞–ї–Њ–Є–љ–≤–∞–Ј–Є–≤–љ–Њ–є —Е–Є—А—Г—А–≥–Є–Є, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –±—Л—В—М —А–µ–∞–ї–Є–Ј–Њ–≤–∞–љ—Л –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є –ї–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є —В–µ—Е–љ–Є–Ї–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М –Є –Ј–љ–∞—З–Є–Љ—Л–µ —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞, –њ—А–Є–≤–ї–µ–Ї–∞—В–µ–ї—М–љ—Л–µ —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –њ—А–µ—Ж–Є–Ј–Є–Њ–љ–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є [3, 4]:
-
3D-–Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ–є —З–µ—В–Ї–Њ—Б—В–Є —Б —Б–Є—Б—В–µ–Љ–Њ–є –Њ–±–Ј–Њ—А–∞ InSite —Б –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –Є–љ—Д—А–∞–Ї—А–∞—Б–љ–Њ–є –љ–∞–≤–Є–≥–∞—Ж–Є–Є –Є –Є–љ—В–µ–≥—А–∞—Ж–Є–Є –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –Њ—В –і—А—Г–≥–Є—Е –Є—Б—В–Њ—З–љ–Є–Ї–Њ–≤ –≤–Є–і–µ–Њ—Б–Є–≥–љ–∞–ї–∞, —В–∞–Ї–Є—Е –Ї–∞–Ї –∞–њ–њ–∞—А–∞—В —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–∞—П —Б—В–Њ–є–Ї–∞ (—Д—Г–љ–Ї—Ж–Є—П TilePro);
-
—В–µ—Е–љ–Њ–ї–Њ–≥–Є—П EndoWrist вАФ –≥–Є–±–Ї–Є–µ –Є–љ—Б—В—А—Г–Љ–µ–љ—В—Л —Б —Б–µ–Љ—М—О —Б—В–µ–њ–µ–љ—П–Љ–Є —Б–≤–Њ–±–Њ–і—Л, —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –Њ—В–≤–µ–і–µ–љ–Є—П, —Г–і–µ—А–ґ–∞–љ–Є—П, –і–Є—Б—Б–µ–Ї—Ж–Є–Є, –Є–љ—В—А–∞–Ї–Њ—А–њ–Њ—А–∞–ї—М–љ–Њ–≥–Њ —И–≤–∞;
-
–Љ–∞—Б—И—В–∞–±–Є—А–Њ–≤–∞–љ–Є–µ –і–≤–Є–ґ–µ–љ–Є–є —А—Г–Ї –Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤;
-
—Г—Б—В—А–∞–љ–µ–љ–Є–µ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —В—А–µ–Љ–Њ—А–∞ —А—Г–Ї –Њ–њ–µ—А–Є—А—Г—О—Й–µ–≥–Њ —Е–Є—А—Г—А–≥–∞;
-
–±–ї–Њ–Ї–Є—А–Њ–≤–Ї–∞ –і–≤–Є–ґ–µ–љ–Є–є –Љ–∞–љ–Є–њ—Г–ї—П—В–Њ—А–Њ–≤ –њ—А–Є –Њ—В–≤–µ–і–µ–љ–Є–Є –≤–Ј–≥–ї—П–і–∞ —Е–Є—А—Г—А–≥–∞ –Њ—В –Њ–Ї—Г–ї—П—А–Њ–≤ –Ї–Њ–љ—Б–Њ–ї–Є;
-
–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Е–Є—А—Г—А–≥—Г —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ —Г–њ—А–∞–≤–ї—П—В—М —В—А–µ–Љ—П –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–Љ–Є –Є –Ї–∞–Љ–µ—А–Њ–є, —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Н–Ї—Б—В—А–µ–љ–љ–Њ–≥–Њ —А–µ–∞–≥–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –љ–µ–Њ—В–ї–Њ–ґ–љ—Г—О —Б–Є—В—Г–∞—Ж–Є—О;
-
—Д—Г–љ–Ї—Ж–Є—П –∞–≤—В–Њ—Д–Њ–Ї—Г—Б–Є—А–Њ–≤–Ї–Є, –Ї–∞–ї–Є–±—А–Њ–≤–Ї–Є, –±–∞–ї–∞–љ—Б–∞ –±–µ–ї–Њ–≥–Њ, –∞ —В–∞–Ї–ґ–µ –ї–∞–Ј–µ—А–љ–Њ–≥–Њ –љ–∞–≤–µ–і–µ–љ–Є—П –≤ —Б–Є—Б—В–µ–Љ–µ da Vinci Xi, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г—Б–Ї–Њ—А–µ–љ–Є—О –і–Њ–Ї–Є–љ–≥–∞ –Є –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є–Є —А–∞—Б—Б—В–∞–љ–Њ–≤–Ї–Є —В—А–Њ–∞–Ї–∞—А–Њ–≤;
-
—Г–і–Њ–±–љ–∞—П —Н—А–≥–Њ–љ–Њ–Љ–Є–Ї–∞ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –±—А–Є–≥–∞–і—Л.
–Т–њ–µ—А–≤—Л–µ —А–Њ–±–Њ—В da Vinci –њ—А–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–Љ –ї–µ—З–µ–љ–Є–Є —А–∞–Ї–∞ –ґ–µ–ї—Г–і–Ї–∞ –±—Л–ї –њ—А–Є–Љ–µ–љ–µ–љ –≤ 2001вАУ2002 –≥. –Ь. –•–∞—И–Є–Ј—Г–Љ–µ (–ѓ–њ–Њ–љ–Є—П) –Є –Я. –Ф–ґ—Г–ї–Є–∞–љ–Њ—В—В–Є (–Ш—В–∞–ї–Є—П) [4, 5]. –Ф–≤–∞–і—Ж–∞—В–Є–ї–µ—В–љ–Є–є –Њ–њ—Л—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —А–Њ–±–Њ—В-–∞—Б—Б–Є—Б—В–Є—А–Њ–≤–∞–љ–љ—Л—Е —В–µ—Е–љ–Њ–ї–Њ–≥–Є–є –њ–Њ–Ї–∞–Ј–∞–ї –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М, –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –∞–і–µ–Ї–≤–∞—В–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –≤ –Њ–Ї–∞–Ј–∞–љ–Є–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ —А–∞–Ї–Њ–Љ –ґ–µ–ї—Г–і–Ї–∞ [6]. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ –њ–Њ–ї–љ–Њ—Б—В—М—О —А–µ—И–µ–љ—Л –њ—А–Њ–±–ї–µ–Љ–љ—Л–µ —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л –≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞. –Ъ –љ–Є–Љ –Љ–Њ–ґ–љ–Њ –Њ—В–љ–µ—Б—В–Є:
-
—Б—В–∞—В–Є—З–љ–Њ—Б—В—М –Ї–Њ–љ—Б–Њ–ї–Є –њ–∞—Ж–Є–µ–љ—В–∞ –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Б–Љ–µ–љ—Л –њ–Њ–ї–Њ–ґ–µ–љ–Є—П –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Б—В–Њ–ї–∞ –≤–Њ –≤—А–µ–Љ—П –Њ–њ–µ—А–∞—Ж–Є–Є;
-
–Њ—В—Б—Г—В—Б—В–≤–Є–µ —В–∞–Ї—В–Є–ї—М–љ–Њ–є –Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є, —З—В–Њ –Љ–Њ–ґ–µ—В –Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞—В—М—Б—П –≤–Є–Ј—Г–∞–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–Њ–є –≤ –њ–Њ—Б—В–Њ—П–љ–љ–Њ–Љ —А–µ–ґ–Є–Љ–µ 3D-InSite –њ—А–Є –љ–∞–Ї–Њ–њ–ї–µ–љ–љ–Њ–Љ –Њ–њ—Л—В–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤;
-
–Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—В–∞—Ж–Є–Є –≤—Б—В—А–Њ–µ–љ–љ–Њ–≥–Њ —А–µ–Ї–Њ—А–і–µ—А–∞;
-
—Д—Г–љ–Ї—Ж–Є—П EndoWrist –љ–µ –і–Њ—Б—В—Г–њ–љ–∞ –і–ї—П –≥–∞—А–Љ–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Ї–∞–ї—М–њ–µ–ї—П, —З—В–Њ –љ–Є–≤–µ–ї–Є—А—Г–µ—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П;
-
—А–∞–±–Њ—В–∞ –∞—Б—Б–Є—Б—В–µ–љ—В–∞ –≤ —Д–Њ—А–Љ–∞—В–µ 2D;
-
–≤—Л—Б–Њ–Ї–∞—П —Б—В–Њ–Є–Љ–Њ—Б—В—М —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –Є —А–∞—Б—Е–Њ–і–љ–Њ–≥–Њ –Њ–±–Њ—А—Г–і–Њ–≤–∞–љ–Є—П.
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —Н—В–Њ, —А–Њ–±–Њ—В-–∞—Б—Б–Є—Б—В–Є—А–Њ–≤–∞–љ–љ—Л–µ –Њ–њ–µ—А–∞—В–Є–≤–љ—Л–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–µ–∞–ї–Є–Ј–Њ–≤–∞—В—М –≤—Б–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –Љ–∞–ї–Њ–Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е —В–µ—Е–љ–Њ–ї–Њ–≥–Є–є –і–ї—П –њ–∞—Ж–Є–µ–љ—В–∞, –∞ —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ —Б–Њ–Ј–і–∞—О—В –Ї–Њ–Љ—Д–Њ—А—В–љ—Л–µ —Г—Б–ї–Њ–≤–Є—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –і–ї—П –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –±—А–Є–≥–∞–і—Л вАФ —Б —Г–і–Њ–±–љ–Њ–є —Н—А–≥–Њ–љ–Њ–Љ–Є–Ї–Њ–є, —Е–Њ—А–Њ—И–µ–є 3D-InSite-–≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–µ–є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О —Е–Є—А—Г—А–≥—Г —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М –±–Њ–ї—М—И—Г—О —З–∞—Б—В—М —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤ –Є —А–∞–±–Њ—В—Г –Ї–∞–Љ–µ—А—Л, —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Г—О –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –і–ї—П –њ–∞—Ж–Є–µ–љ—В–∞. –Ъ–Њ–ї–ї–µ–Ї—В–Є–≤ –°–Я–± –У–С–£–Ч ¬Ђ–У–Њ—А–Њ–і—Б–Ї–∞—П –±–Њ–ї—М–љ–Є—Ж–∞ вДЦ 40¬ї –Њ–і–љ–Є–Љ –Є–Ј –њ–µ—А–≤—Л—Е –≤ –†–Њ—Б—Б–Є–Є —Б—В–∞–ї –∞–Ї—В–Є–≤–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —А–Њ–±–Њ—В-–∞—Б—Б–Є—Б—В–Є—А–Њ–≤–∞–љ–љ—Л–µ –Њ–њ–µ—А–∞—Ж–Є–Є –≤ –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ї–Њ–Љ –ґ–µ–ї—Г–і–Ї–∞.
–¶–µ–ї—М –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В—Л: –Њ–њ–Є—Б–∞–љ–Є–µ —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–Є –Є –і–µ–Љ–Њ–љ—Б—В—А–∞—Ж–Є—П —В–µ—Е–љ–Є—З–µ—Б–Ї–Є—Е –∞—Б–њ–µ–Ї—В–Њ–≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –і–ї—П –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –њ—А–Є —А–∞–Ї–µ –ґ–µ–ї—Г–і–Ї–∞.
–Ґ–µ—Е–љ–Є–Ї–∞ –Њ–њ–µ—А–∞—Ж–Є–є
–Я—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –Љ—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –і–≤–∞ —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ da Vinci вАФ Si –Є Xi.
–Ф–Њ–Ї–Є–љ–≥
–Я—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –њ—А–Є —А–∞–Ї–µ –ґ–µ–ї—Г–і–Ї–∞ –љ–∞–Љ–Є –±—Л–ї–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–∞ —Б–ї–µ–і—Г—О—Й–∞—П —А–∞—Б—Б—В–∞–љ–Њ–≤–Ї–∞ —В—А–Њ–∞–Ї–∞—А–Њ–≤ –Є –њ–Њ–і–Ї–ї—О—З–µ–љ–Є—П –Љ–∞–љ–Є–њ—Г–ї—П—В–Њ—А–Њ–≤. –Я—А–Є —А–∞–±–Њ—В–µ –љ–∞ da Vinci Si –≤ –ї–µ–≤–Њ–Љ, –њ—А–∞–≤–Њ–Љ –њ–Њ–і—А–µ–±–µ—А—М—П—Е –Є –≤ –њ—А–∞–≤–Њ–є –Љ–µ–Ј–Њ–≥–∞—Б—В—А–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –њ–Њ —Б—А–µ–і–Є–љ–љ–Њ-–Ї–ї—О—З–Є—З–љ–Њ–є –ї–Є–љ–Є–Є вАФ –њ–Њ –Њ–і–љ–Њ–Љ—Г —А–∞–±–Њ—З–µ–Љ—Г —В—А–Њ–∞–Ї–∞—А—Г –і–Є–∞–Љ–µ—В—А–Њ–Љ 8 –Љ–Љ —Б –і–∞–ї—М–љ–µ–є—И–Є–Љ –њ–Њ–і–Ї–ї—О—З–µ–љ–Є–µ–Љ —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Љ–∞–љ–Є–њ—Г–ї—П—В–Њ—А–Њ–≤ вДЦ 1, 2, 3 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –≤ —Г–Љ–±–Є–ї–Є–Ї–∞–ї—М–љ–Њ–є –Ј–Њ–љ–µ вАФ —В—А–Њ–∞–Ї–∞—А –і–Є–∞–Љ–µ—В—А–Њ–Љ 12 –Љ–Љ –і–ї—П —Г—Б—В–∞–љ–Њ–≤–Ї–Є –≤–Є–і–µ–Њ—Б–Є—Б—В–µ–Љ—Л, –≤ –ї–µ–≤–Њ–є –Љ–µ–Ј–Њ–≥–∞—Б—В—А–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –њ–Њ —Б—А–µ–і–Є–љ–љ–Њ-–Ї–ї—О—З–Є—З–љ–Њ–є –ї–Є–љ–Є–Є вАФ –∞—Б—Б–Є—Б—В–µ–љ—В—Б–Ї–Є–є —В—А–Њ–∞–Ї–∞—А –і–Є–∞–Љ–µ—В—А–Њ–Љ 12 –Љ–Љ. –Я—А–Є –њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–Є —В–Њ—В–∞–ї—М–љ–Њ–є –≥–∞—Б—В—А—Н–Ї—В–Њ–Љ–Є–Є –≤ –њ—А–∞–≤–Њ–є –Љ–µ–Ј–Њ–≥–∞—Б—В—А–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –њ–Њ —Б—А–µ–і–Є–љ–љ–Њ-–Ї–ї—О—З–Є—З–љ–Њ–є –ї–Є–љ–Є–Є —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї–Є —В—А–Њ–∞–Ї–∞—А –і–Є–∞–Љ–µ—В—А–Њ–Љ 12 –Љ–Љ —Б –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ 8-–Љ–Є–ї–ї–Є–Љ–µ—В—А–Њ–≤—Л–Љ —А–∞–±–Њ—З–Є–Љ —В—А–Њ–∞–Ї–∞—А–Њ–Љ —Б —Ж–µ–ї—М—О –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –ї–Є–љ–µ–є–љ–Њ–≥–Њ —Б—И–Є–≤–∞—О—Й–µ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞. –І–µ—А–µ–Ј —А–∞–Ј—А–µ–Ј –≤ —Б—Г–±–Ї—Б–Є—Д–Њ–Є–і–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –і–ї–Є–љ–Њ–є 5 –Љ–Љ –і–ї—П –Њ—В–≤–µ–і–µ–љ–Є—П –ї–µ–≤–Њ–є –і–Њ–ї–Є –њ–µ—З–µ–љ–Є —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї–Є —А–µ—В—А–∞–Ї—В–Њ—А –Э–∞—В–∞–љ—Б–Њ–љ–∞. –Я—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≤ —А–∞–±–Њ—В–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ da Vinci Xi —В–Њ–њ–Є—З–µ—Б–Ї–∞—П —А–∞—Б—Б—В–∞–љ–Њ–≤–Ї–∞ —А–∞–±–Њ—З–Є—Е –Є –Њ–њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —В—А–Њ–∞–Ї–∞—А–Њ–≤ –Њ—Б—В–∞–µ—В—Б—П –±–µ–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є–є, –Њ—В–ї–Є—З–Є–µ–Љ –ґ–µ —П–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Г—Б—В–∞–љ–Њ–≤–Ї–Є 8-–Љ–Є–ї–ї–Є–Љ–µ—В—А–Њ–≤–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ–Њ–≥–Њ —В—А–Њ–∞–Ї–∞—А–∞ –њ–Њ–і –≤–Є–і–µ–Њ—Б–Є—Б—В–µ–Љ—Г. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤—Б–µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Њ—Б—М 5 —В—А–Њ–∞–Ї–∞—А–Њ–≤ (—А–Є—Б. 1). –Я–Њ–ї–Њ–ґ–µ–љ–Є–µ –љ–∞ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ —Б—В–Њ–ї–µ –±—Л–ї–Њ –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–Љ –њ—А–Є –≤—Б–µ—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞—Е вАФ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ–±—А–∞—В–љ–Њ–≥–Њ –Ґ—А–µ–љ–і–µ–ї–µ–љ–±—Г—А–≥–∞.
![–†–Є—Б. 1. –°—Е–µ–Љ–∞ —А–∞—Б—Б—В–∞–љ–Њ–≤–Ї–Є —В—А–Њ–∞–Ї–∞—А–Њ–≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ da Vinci Xi (—З–∞—Б—В–Є—З–љ–Њ –∞–і–∞–њ—В–Є—А–Њ–≤–∞–љ–Њ –њ–Њ [7]) Fig. 1. Trocars of the da Vinci Xi complex arrangement scheme (adapted [7]) –†–Є—Б. 1. –°—Е–µ–Љ–∞ —А–∞—Б—Б—В–∞–љ–Њ–≤–Ї–Є —В—А–Њ–∞–Ї–∞—А–Њ–≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ da Vinci Xi (—З–∞—Б—В–Є—З–љ–Њ –∞–і–∞–њ—В–Є—А–Њ–≤–∞–љ–Њ –њ–Њ [7]) Fig. 1. Trocars of the da Vinci Xi complex arrangement scheme (adapted [7])](/upload/medialibrary/973/218-1.png)
–Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Ј–∞—А—Г–±–µ–ґ–љ—Л—Е –Ї–Њ–ї–ї–µ–≥, –Ї–Њ—В–Њ—А—Л–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –і–Њ —Б–µ–Љ–Є —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤, –љ–∞–Љ–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ –Є –Њ–њ—В–Є–Љ–Є–Ј–Є—А–Њ–≤–∞–љ –њ—А–Њ—Ж–µ—Б—Б –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –≥–∞—Б—В—А—Н–Ї—В–Њ–Љ–Є–Є –Є –і–Є—Б—В–∞–ї—М–љ–Њ–є —Б—Г–±—В–Њ—В–∞–ї—М–љ–Њ–є —А–µ–Ј–µ–Ї—Ж–Є–Є –ґ–µ–ї—Г–і–Ї–∞ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —З–µ—В—Л—А–µ—Е —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞—В—М –Љ–µ—В–Њ–і–Є–Ї—Г –Є —Б–љ–Є–Ј–Є—В—М —Д–Є–љ–∞–љ—Б–Њ–≤—Л–µ –Ј–∞—В—А–∞—В—Л [8]. –Я—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –Љ—Л –љ–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Є–є –≥–∞—А–Љ–Њ–љ–Є—З–µ—Б–Ї–Є–є —Б–Ї–∞–ї—М–њ–µ–ї—М, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –±—А–∞–Ј–Є–ї—М—Б–Ї–Є—Е –Ї–Њ–ї–ї–µ–≥, —Б—З–Є—В–∞—П, —З—В–Њ –і–∞–љ–љ—Л–є –Є–љ—Б—В—А—Г–Љ–µ–љ—В –љ–µ –Є–Љ–µ–µ—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –њ–Њ –њ—А–Є—З–Є–љ–µ —Б–≤–Њ–Є—Е –Ї–Њ–љ—Б—В—А—Г–Ї—В–Є–≤–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є [9]. –Я—А–Є –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞—Е –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –Є–љ—Б—В—А—Г–Љ–µ–љ—В—Л: Large Needle Driver, Fenestrated Bipolar Forceps, Monopolar Curved Scissors, ProGrasp Forceps.
–Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ da Vinci Xi
–Ъ–Њ–Љ–њ–ї–µ–Ї—Б da Vinci —З–µ—В–≤–µ—А—В–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П Xi –Є–Љ–µ–µ—В —А—П–і —В–µ—Е–љ–Є—З–µ—Б–Ї–Є—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –Є –Њ–±—К–µ–Ї—В–Є–≤–љ—Л—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Б–Є—Б—В–µ–Љ–Њ–є –њ—А–µ–і—Л–і—Г—Й–µ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П Si. –Ъ–Њ–љ—Б–Њ–ї—М (—В–µ–ї–µ–ґ–Ї–∞) –њ–∞—Ж–Є–µ–љ—В–∞ –Є–Љ–µ–µ—В —Г–ї—Г—З—И–µ–љ–љ—Г—О —Н—А–≥–Њ–љ–Њ–Љ–Є–Ї—Г —Б –≤—Л—Б–Њ–Ї–Њ–є –Љ–Њ–±–Є–ї—М–љ–Њ—Б—В—М—О —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Љ–∞–љ–Є–њ—Г–ї—П—В–Њ—А–Њ–≤, –≤–µ—А—В–Є–Ї–∞–ї—М–љ—Л–Љ –і–Њ—Б—В—Г–њ–Њ–Љ –Ї –њ–∞—Ж–Є–µ–љ—В—Г —Б –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–∞—Й–µ–љ–Є—П –±–ї–Њ–Ї–∞ –љ–∞ 360¬∞, —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –Љ—Г–ї—М—В–Є–Ї–≤–∞–і—А–∞—В–љ—Л–є –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є–є –і–Њ—Б—В—Г–њ –Є–Ј —З–µ—В—Л—А–µ—Е —Б–µ–Ї—В–Њ—А–Њ–≤ —Б –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–≥–Њ –і–Њ–Ї–Є–љ–≥–∞. –°–µ–љ—Б–Њ—А–љ–∞—П –њ–∞–љ–µ–ї—М –Ї–Њ–љ—Б–Њ–ї–Є –њ–∞—Ж–Є–µ–љ—В–∞ —Б –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ –њ—А–Њ–≥—А–∞–Љ–Љ–љ—Л–Љ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–µ–Љ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–њ—В–Є–Љ–Є–Ј–Є—А–Њ–≤–∞—В—М –і–Њ–Ї–Є–љ–≥ –њ–Њ–і –Ї–Њ–љ–Ї—А–µ—В–љ—Г—О –Ј–Њ–љ—Г –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –Є –њ—А–Њ–≤–µ—Б—В–Є –њ–Њ–і–Ї–ї—О—З–µ–љ–Є–µ –Ї–Њ–љ—Б–Њ–ї–Є —Б –ї—О–±–Њ–є —Б—В–Њ—А–Њ–љ—Л –Њ—В –њ–∞—Ж–Є–µ–љ—В–∞. –Я—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Б–Є—Б—В–µ–Љ—Л Si –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –њ—А–Є —А–∞–Ї–µ –ґ–µ–ї—Г–і–Ї–∞ –і–Њ–Ї–Є–љ–≥ –≤–Њ–Ј–Љ–Њ–ґ–µ–љ —В–Њ–ї—М–Ї–Њ —Б–Њ —Б—В–Њ—А–Њ–љ—Л –≥–Њ–ї–Њ–≤—Л –њ–∞—Ж–Є–µ–љ—В–∞. –Ы–∞–Ј–µ—А–љ–Њ–µ –љ–∞–≤–µ–і–µ–љ–Є–µ (targeting) –њ–Њ–Љ–Њ–≥–∞–µ—В –≤ —А–∞—Б—Б—В–∞–љ–Њ–≤–Ї–µ —В—А–Њ–∞–Ї–∞—А–Њ–≤ –Є —Г—Б—В–∞–љ–Њ–≤–Ї–µ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–ї–Њ–ґ–µ–љ–Є—П –Љ–∞–љ–Є–њ—Г–ї—П—В–Њ—А–Њ–≤, –∞ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–∞—П —Д—Г–љ–Ї—Ж–Є—П patient clearance –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–±–µ–ґ–∞—В—М –Ї–Њ–љ—Д–ї–Є–Ї—В–∞ –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤ –Є —А–∞—Б—И–Є—А–Є—В—М —Б–њ–µ–Ї—В—А —А–∞–±–Њ—В—Л –≤ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–Њ–ї–µ. –Ч–љ–∞—З–Є–Љ—Л–µ –Њ—В–ї–Є—З–Є—В–µ–ї—М–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –Љ–Њ–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М –≤ –Ї–∞–Љ–µ—А–µ –Є —Н–љ–і–Њ—Б–Ї–Њ–њ–µ. –≠–љ–і–Њ—Б–Ї–Њ–њ –±–Њ–ї–µ–µ –і–ї–Є–љ–љ—Л–є –Є –Є–Љ–µ–µ—В —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ—Л–є –і–Є–∞–Љ–µ—В—А 8 –Љ–Љ, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—В—М –µ–≥–Њ –≤ –ї—О–±–Њ–є –Є–Ј —З–µ—В—Л—А–µ—Е —В—А–Њ–∞–Ї–∞—А–Њ–≤. –Ъ–∞–Љ–µ—А–∞ –Є–Љ–µ–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–Є–є —А–∞–Ј–Љ–µ—А –Є –Љ–∞—Б—Б—Г —Б –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –Ї–∞–ї–Є–±—А–Њ–≤–Ї–Њ–є 3D-–Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П, –∞–≤—В–Њ—Д–Њ–Ї—Г—Б–Є—А–Њ–≤–Ї–Њ–є, –±–∞–ї–∞–љ—Б–Њ–Љ –±–µ–ї–Њ–≥–Њ –Є –≤—Б—В—А–Њ–µ–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—В–љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є fire fly laser. –•–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–є —Н–ї–µ–Ї—В—А–Њ–≥–µ–љ–µ—А–∞—В–Њ—А ERBE Vio dV –Є–љ—В–µ–≥—А–Є—А–Њ–≤–∞–љ –≤ –≤–Є–і–µ–Њ—Б—В–Њ–є–Ї—Г –Є –Є–Љ–µ–µ—В –њ—А–Њ–≥—А–∞–Љ–Љ–љ–Њ–µ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–µ, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–µ–µ –њ—А–Њ–≤–µ—Б—В–Є –љ–∞—Б—В—А–Њ–є–Ї–Є –љ–∞ –Ї–Њ–љ—Б–Њ–ї–Є —Е–Є—А—Г—А–≥–∞.
–†–Њ–±–Њ—В-–∞—Б—Б–Є—Б—В–Є—А–Њ–≤–∞–љ–љ–∞—П –і–Є—Б—В–∞–ї—М–љ–∞—П —Б—Г–±—В–Њ—В–∞–ї—М–љ–∞—П —А–µ–Ј–µ–Ї—Ж–Є—П –ґ–µ–ї—Г–і–Ї–∞ —Б D2-–ї–Є–Љ—Д–∞–і–µ–љ—Н–Ї—В–Њ–Љ–Є–µ–є
–Я–Њ—Б–ї–µ —А–µ–≤–Є–Ј–Є–Є –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є –і–Њ–Ї–Є–љ–≥–∞ –њ—А–Њ–≤–Њ–і–Є–ї–Є –Љ–Њ–±–Є–ї–Є–Ј–∞—Ж–Є—О –±–Њ–ї—М—И–Њ–≥–Њ —Б–∞–ї—М–љ–Є–Ї–∞ —Б –Њ—В—Б–µ—З–µ–љ–Є–µ–Љ –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –Љ–Њ–љ–Њ–њ–Њ–ї—П—А–љ—Л—Е –љ–Њ–ґ–љ–Є—Ж –Њ—В –Њ–±–Њ–і–Њ—З–љ–Њ–є –Ї–Є—И–Ї–Є –љ–∞ –≤—Б–µ–Љ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є —Б –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ–Љ –≤ —Б–∞–ї—М–љ–Є–Ї–Њ–≤—Г—О —Б—Г–Љ–Ї—Г –Є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Ј–∞–і–љ–µ–є —Б—В–µ–љ–Ї–Є –ґ–µ–ї—Г–і–Ї–∞. –Т —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Є –Њ–њ—Г—Е–Њ–ї–Є —Б –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–µ–є –њ–Њ –Љ–∞–ї–Њ–є –Ї—А–Є–≤–Є–Ј–љ–µ —Б —Б–Ґ-—Б—В–∞–і–Є–µ–є 1bвАУ2 –≤—Л–њ–Њ–ї–љ—П–ї–Є —А–∞—Б—Б–µ—З–µ–љ–Є–µ –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Њ–±–Њ–і–Њ—З–љ–Њ–є —Б–≤—П–Ј–Ї–Є –љ–∞ —А–∞—Б—Б—В–Њ—П–љ–Є–Є 4вАУ5 —Б–Љ –Њ—В –±–Њ–ї—М—И–Њ–є –Ї—А–Є–≤–Є–Ј–љ—Л –ґ–µ–ї—Г–і–Ї–∞ —Б —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ–Љ –±–Њ–ї—М—И–Њ–≥–Њ —Б–∞–ї—М–љ–Є–Ї–∞. –Ь–Њ–±–Є–ї–Є–Ј–∞—Ж–Є—О –ґ–µ–ї—Г–і–Ї–∞ –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є –≤ –ї–∞—В–µ—А–∞–ї—М–љ–Њ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є –њ–Њ –Љ–µ–ґ—Д–∞—Б—Ж–Є–∞–ї—М–љ–Њ–Љ—Г —Б–ї–Њ—О –і–Њ —Г—А–Њ–≤–љ—П –љ–Є–ґ–љ–µ–≥–Њ –Ї—А–∞—П —Б–µ–ї–µ–Ј–µ–љ–Ї–Є —Б —А–∞–Ј–і–µ–ї—М–љ—Л–Љ –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ, –Ї–ї–Є–њ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Є –њ–µ—А–µ—Б–µ—З–µ–љ–Є–µ–Љ –ї–µ–≤—Л—Е –ґ–µ–ї—Г–і–Њ—З–љ–Њ-—Б–∞–ї—М–љ–Є–Ї–Њ–≤—Л—Е –≤–µ–љ—Л –Є –∞—А—В–µ—А–Є–Є —Г –Њ—Б–љ–Њ–≤–∞–љ–Є—П —Б —Г–і–∞–ї–µ–љ–Є–µ–Љ 4sb –≥—А—Г–њ–њ—Л –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤, –∞ –≤ —Б–ї—Г—З–∞—П—Е —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –±–Њ–ї—М—И–Њ–≥–Њ —Б–∞–ї—М–љ–Є–Ї–∞ –ї–µ–≤—Г—О –ґ–µ–ї—Г–і–Њ—З–љ–Њ-—Б–∞–ї—М–љ–Є–Ї–Њ–≤—Г—О –∞—А—В–µ—А–Є—О –њ–µ—А–µ—Б–µ–Ї–∞–ї–Є –≤—Л—И–µ –Њ—В—Е–Њ–ґ–і–µ–љ–Є—П –∞—А—В–µ—А–Є–Є –±–Њ–ї—М—И–Њ–≥–Њ —Б–∞–ї—М–љ–Є–Ї–∞ (—А–Є—Б. 2 A).
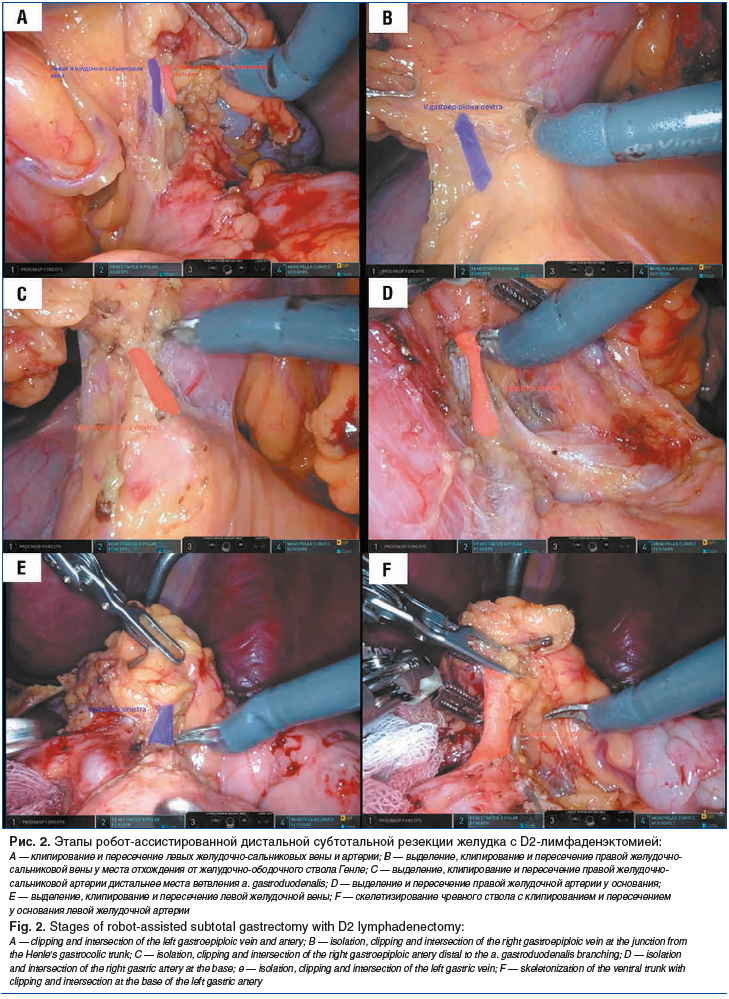
–Ф–∞–ї—М–љ–µ–є—И—Г—О –Љ–Њ–±–Є–ї–Є–Ј–∞—Ж–Є—О –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є –≤ –Љ–µ–і–Є–∞–ї—М–љ–Њ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є —Б —А–∞—Б—Б–µ—З–µ–љ–Є–µ–Љ —Д—М—О–ґ–љ-—Д–∞—Б—Ж–Є–Є —Б –Њ–±—А–∞–±–Њ—В–Ї–Њ–є 6-q –≥—А—Г–њ–њ—Л –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤, —Б –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ, –Ї–ї–Є–њ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Є –њ–µ—А–µ—Б–µ—З–µ–љ–Є–µ–Љ –њ—А–∞–≤–Њ–є –ґ–µ–ї—Г–і–Њ—З–љ–Њ-—Б–∞–ї—М–љ–Є–Ї–Њ–≤–Њ–є –≤–µ–љ—Л —Г –Љ–µ—Б—В–∞ –Њ—В—Е–Њ–ґ–і–µ–љ–Є—П –Њ—В –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Њ–±–Њ–і–Њ—З–љ–Њ–≥–Њ —Б—В–≤–Њ–ї–∞ –У–µ–љ–ї–µ –Є –њ—А–∞–≤–Њ–є –ґ–µ–ї—Г–і–Њ—З–љ–Њ-—Б–∞–ї—М–љ–Є–Ї–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є –і–Є—Б—В–∞–ї—М–љ–µ–µ –Љ–µ—Б—В–∞ –≤–µ—В–≤–ї–µ–љ–Є—П a. gastroduodenalis —Б –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –Є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–µ–є –њ–Њ—Б–ї–µ–і–љ–µ–є –і–Њ —Г—А–Њ–≤–љ—П –Њ—В—Е–Њ–ґ–і–µ–љ–Є—П –Њ—В –Њ–±—Й–µ–є –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є (—А–Є—Б. 2 –Т, –°).
–°–ї–µ–і—Г—О—Й–Є–Љ —Н—В–∞–њ–Њ–Љ –≤—Л–њ–Њ–ї–љ—П–ї–Є –Љ–Њ–±–Є–ї–Є–Ј–∞—Ж–Є—О –Ј–∞–і–љ–µ–є –Є –≤–µ—А—Е–љ–µ–є —Б—В–µ–љ–Ї–Є –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є —Б –і–∞–ї—М–љ–µ–є—И–Є–Љ –њ—А–Њ—И–Є–≤–∞–љ–Є–µ–Љ –Є –њ–µ—А–µ—Б–µ—З–µ–љ–Є–µ–Љ –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –ї–Є–љ–µ–є–љ–Њ–≥–Њ —Б—И–Є–≤–∞—О—Й–µ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –њ—А–Њ–≤–Њ–і–Є–ї–Є –Њ–±—А–∞–±–Њ—В–Ї—Г –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є —Б–≤—П–Ј–Ї–Є —Б –ї–Є–Љ—Д–∞–і–µ–љ—Н–Ї—В–Њ–Љ–Є–µ–є 12–∞ –≥—А—Г–њ–њ—Л –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ —Б –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–є –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є –Є –њ–µ—А–µ—Б–µ—З–µ–љ–Є–µ–Љ –њ—А–∞–≤–Њ–є –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є —Г –Њ—Б–љ–Њ–≤–∞–љ–Є—П —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –Њ—В—Б–µ—З–µ–љ–Є–µ–Љ –Љ–∞–ї–Њ–≥–Њ —Б–∞–ї—М–љ–Є–Ї–∞ —Г –Ї—А–∞—П –њ–µ—З–µ–љ–Є (—А–Є—Б. 2 D). –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –≤—Л–њ–Њ–ї–љ—П–ї–Є —А–∞—Б—Б–µ—З–µ–љ–Є–µ –Ї–∞–њ—Б—Г–ї—Л –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –њ–Њ –≤–µ—А—Е–љ–µ–Љ—Г –Ї—А–∞—О, –≤—Л–і–µ–ї–µ–љ–Є–µ –Њ–±—Й–µ–є –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є —Б –ї–Є–Љ—Д–∞–і–µ–љ—Н–Ї—В–Њ–Љ–Є–µ–є 8–∞ –≥—А—Г–њ–њ—Л –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤, –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ, –Ї–ї–Є–њ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Є –њ–µ—А–µ—Б–µ—З–µ–љ–Є–µ–Љ –ї–µ–≤–Њ–є –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –≤–µ–љ—Л –Є –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ–Љ –≤ –ї–∞—В–µ—А–∞–ї—М–љ–Њ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є –ї–Є–Љ—Д–∞–і–µ–љ—Н–Ї—В–Њ–Љ–Є–Є 11—А –≥—А—Г–њ–њ—Л –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ –≤–і–Њ–ї—М —Б–µ–ї–µ–Ј–µ–љ–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є (—А–Є—Б. 2 E).
–°–ї–µ–і—Г—О—Й–Є–Љ —И–∞–≥–Њ–Љ –≤—Л–і–µ–ї—П–ї–Є –њ—А–∞–≤—Г—О –љ–Њ–ґ–Ї—Г –і–Є–∞—Д—А–∞–≥–Љ—Л, —Б–Ї–µ–ї–µ—В–Є–Ј–Є—А–Њ–≤–∞–ї–Є —З—А–µ–≤–љ—Л–є —Б—В–≤–Њ–ї —Б –Ї–ї–Є–њ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Є –њ–µ—А–µ—Б–µ—З–µ–љ–Є–µ–Љ —Г –Њ—Б–љ–Њ–≤–∞–љ–Є—П –ї–µ–≤–Њ–є –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є —Б –Њ–±—А–∞–±–Њ—В–Ї–Њ–є 9-–є –Є 7-–є –≥—А—Г–њ–њ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ (—А–Є—Б. 2 F). –Ъ–ї–µ—В—З–∞—В–Ї—Г –Ї–∞—А–і–Є–Њ—Н–Ј–Њ—Д–∞–≥–µ–∞–ї—М–љ–Њ–є –Ј–Њ–љ—Л —Б —Г–і–∞–ї–µ–љ–Є–µ–Љ 1-–є –Є 3-–є –≥—А—Г–њ–њ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ –Љ–Њ–±–Є–ї–Є–Ј–Њ–≤–∞–ї–Є –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –Љ–Њ–љ–Њ–њ–Њ–ї—П—А–љ—Л—Е –љ–Њ–ґ–љ–Є—Ж –Є —Б–Љ–µ—Й–∞–ї–Є –≤ —Б—В–Њ—А–Њ–љ—Г –њ—А–µ–њ–∞—А–∞—В–∞.
–Ц–µ–ї—Г–і–Њ–Ї –њ—А–Њ—И–Є–≤–∞–ї–Є –Є –њ–µ—А–µ—Б–µ–Ї–∞–ї–Є –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –ї–Є–љ–µ–є–љ–Њ–≥–Њ —Б—И–Є–≤–∞—О—Й–µ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–µ–µ –љ–∞ 5вАУ10 —Б–Љ –Њ—В –Њ–њ—Г—Е–Њ–ї–Є –њ–Њ –±–Њ–ї—М—И–Њ–є –Ї—А–Є–≤–Є–Ј–љ–µ –љ–∞ —Г—А–Њ–≤–љ–µ –љ–Є–ґ–љ–µ–≥–Њ –Ї—А–∞—П —Б–µ–ї–µ–Ј–µ–љ–Ї–Є, –њ–Њ –Љ–∞–ї–Њ–є вАФ –љ–∞ —Г—А–Њ–≤–љ–µ –Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞.
–Ф–ї—П –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П —А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–≥–Њ —Н—В–∞–њ–∞ –Њ–њ–µ—А–∞—Ж–Є–Є –њ–Њ –С–Є–ї—М—А–Њ—В 2 –≤—Л–і–µ–ї—П–ї–Є –њ–µ—В–ї—О —В–Њ—Й–µ–є –Ї–Є—И–Ї–Є –≤ 30 —Б–Љ –Њ—В —Б–≤—П–Ј–Ї–Є –Ґ—А–µ–є—Ж–∞ –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї–Є –њ–Њ–Ј–∞–і–Є- –Є–ї–Є –≤–њ–µ—А–µ–і–Є-–Њ–±–Њ–і–Њ—З–љ—Л–є –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–∞–љ–∞—Б—В–Њ–Љ–Њ–Ј (–≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –і–ї–Є–љ—Л –±—А—Л–ґ–µ–є–Ї–Є —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є) –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –ї–Є–љ–µ–є–љ–Њ–≥–Њ —Б—И–Є–≤–∞—О—Й–µ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ —Б —Г—И–Є–≤–∞–љ–Є–µ–Љ —В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–≤–µ—А—Б—В–Є—П –Њ–і–љ–Њ—А—П–і–љ—Л–Љ —И–≤–Њ–Љ.
–Ф–ї—П –Є–Ј–≤–ї–µ—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Є–Ј –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є –≤–µ—А—Е–љ–µ-—Б—А–µ–і–Є–љ–љ—Г—О –Є–ї–Є –ї–µ–≤–Њ–±–Њ–Ї–Њ–≤—Г—О (–≤ –Њ–±–ї–∞—Б—В–Є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є 12-–Љ–Є–ї–ї–Є–Љ–µ—В—А–Њ–≤–Њ–≥–Њ —В—А–Њ–∞–Ї–∞—А–∞) –Љ–Є–љ–Є-–ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є—О —Б –і–ї–Є–љ–Њ–є —А–∞–Ј—А–µ–Ј–∞ 7вАУ8 —Б–Љ. –Ь–µ–ґ–Ї–Є—И–µ—З–љ—Л–є –∞–љ–∞—Б—В–Њ–Љ–Њ–Ј –њ–Њ –С—А–∞—Г–љ—Г —Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї–Є –Є–љ—В—А–∞–Ї–Њ—А–њ–Њ—А–∞–ї—М–љ–Њ –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –ї–Є–љ–µ–є–љ–Њ–≥–Њ —Б—И–Є–≤–∞—О—Й–µ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ –Є–ї–Є —Н–Ї—Б—В—А–∞–Ї–Њ—А–њ–Њ—А–∞–ї—М–љ–Њ —А—Г—З–љ—Л–Љ –Њ–і–љ–Њ—А—П–і–љ—Л–Љ —И–≤–Њ–Љ.
–Т —Б–ї—Г—З–∞–µ —А–µ–Ј–µ–Ї—Ж–Є–Є –ґ–µ–ї—Г–і–Ї–∞ –њ–Њ –С–Є–ї—М—А–Њ—В 1 –њ–µ—А–µ—Б–µ—З–µ–љ–Є–µ –ґ–µ–ї—Г–і–Ї–∞ –њ—А–Њ–≤–Њ–і–Є–ї–Є –љ–∞ –≥—А–∞–љ–Є—Ж–µ —Б—А–µ–і–љ–µ–є –Є –љ–Є–ґ–љ–µ–є —В—А–µ—В–Є —В–µ–ї–∞ –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї–Є –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–Њ–∞–љ–∞—Б—В–Њ–Љ–Њ–Ј –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –ї–Є–љ–µ–є–љ–Њ–≥–Њ —Б—И–Є–≤–∞—О—Й–µ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ —Б —Г—И–Є–≤–∞–љ–Є–µ–Љ —В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–≤–µ—А—Б—В–Є—П –Њ–і–љ–Њ—А—П–і–љ—Л–Љ —И–≤–Њ–Љ –Є–ї–Є –µ–≥–Њ –Ј–∞–Ї—А—Л—В–Є–µ–Љ –њ—Г—В–µ–Љ –њ—А–Њ—И–Є–≤–∞–љ–Є—П –∞–њ–њ–∞—А–∞—В–Њ–Љ —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ delta-shape-–∞–љ–∞—Б—В–Њ–Љ–Њ–Ј–∞. –Ю–њ–µ—А–∞—Ж–Є—О –Ј–∞–≤–µ—А—И–∞–ї–Є –і—А–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ–і–њ–µ—З–µ–љ–Њ—З–љ–Њ–≥–Њ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–∞ –љ–∞ 2вАУ3 —Б—Г—В.
–†–Њ–±–Њ—В-–∞—Б—Б–Є—Б—В–Є—А–Њ–≤–∞–љ–љ–∞—П –≥–∞—Б—В—А—Н–Ї—В–Њ–Љ–Є—П —Б D2-–ї–Є–Љ—Д–∞–і–µ–љ—Н–Ї—В–Њ–Љ–Є–µ–є
–Я–µ—А–≤—Л–µ —Н—В–∞–њ—Л –Љ–Њ–±–Є–ї–Є–Ј–∞—Ж–Є–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ. –°–ї–µ–і—Г—О—Й–Є–Љ —И–∞–≥–Њ–Љ –≤—Л–і–µ–ї—П–ї–Є —Б–µ–ї–µ–Ј–µ–љ–Њ—З–љ—Г—О –∞—А—В–µ—А–Є—О –і–Њ –≤–Њ—А–Њ—В —Б–µ–ї–µ–Ј–µ–љ–Ї–Є —Б –ї–Є–Љ—Д–∞–і–µ–љ—Н–Ї—В–Њ–Љ–Є–µ–є 10-–є –≥—А—Г–њ–њ—Л –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤, –і–∞–ї—М–љ–µ–є—И–Є–Љ –њ–µ—А–µ—Б–µ—З–µ–љ–Є–µ–Љ –ґ–µ–ї—Г–і–Њ—З–љ–Њ-—Б–µ–ї–µ–Ј–µ–љ–Њ—З–љ–Њ–є —Б–≤—П–Ј–Ї–Є —Б –Ї–Њ–∞–≥—Г–ї—П—Ж–Є–µ–є –Є –Ї–ї–Є–њ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Ї–Њ—А–Њ—В–Ї–Є—Е –ґ–µ–ї—Г–і–Њ—З–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤.
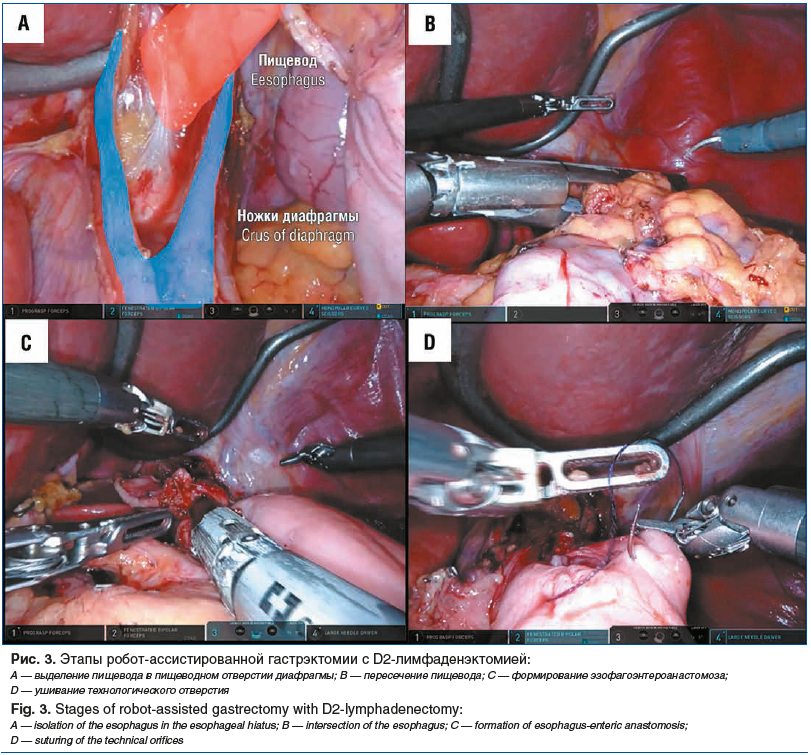
–Я–Є—Й–µ–≤–Њ–і –≤—Л–і–µ–ї—П–ї–Є –≤ –њ–Є—Й–µ–≤–Њ–і–љ–Њ–Љ –Њ—В–≤–µ—А—Б—В–Є–Є –і–Є–∞—Д—А–∞–≥–Љ—Л –Є –њ–µ—А–µ—Б–µ–Ї–∞–ї–Є –≤—Л—И–µ –Ї–∞—А–і–Є–Є –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –ї–Є–љ–µ–є–љ–Њ–≥–Њ —Б—И–Є–≤–∞—О—Й–µ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ 45 –Љ–Љ (—А–Є—Б. 3 A, B). –Т —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–Є –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–µ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б —Ж–µ–ї—М—О –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –≥—А–∞–љ–Є—Ж—Л —А–µ–Ј–µ–Ї—Ж–Є–Є. –Ч–∞—В–µ–Љ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї–Є –њ–Њ–Ј–∞–і–Є–Њ–±–Њ–і–Њ—З–љ—Л–є —Н–Ј–Њ—Д–∞–≥–Њ—Н–љ—В–µ—А–Њ–∞–љ–∞—Б—В–Њ–Љ–Њ–Ј –љ–∞ –Њ—В–Ї–ї—О—З–µ–љ–љ–Њ–є –њ–Њ –†—Г –њ–µ—В–ї–µ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є —Б —Г—И–Є–≤–∞–љ–Є–µ–Љ —В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–≤–µ—А—Б—В–Є—П –љ–µ–њ—А–µ—А—Л–≤–љ—Л–Љ –Њ–і–љ–Њ—А—П–і–љ—Л–Љ —И–≤–Њ–Љ –Є–ї–Є –Ј–∞–Ї—А—Л—В–Є–µ–Љ –ї–Є–љ–µ–є–љ—Л–Љ —Б—И–Є–≤–∞—О—Й–Є–Љ –∞–њ–њ–∞—А–∞—В–Њ–Љ —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ delta shape-–∞–љ–∞—Б—В–Њ–Љ–Њ–Ј–∞ (—А–Є—Б. 3 C, D). –†—Г-–њ–µ—В–ї—О —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–Є –≤ –Њ–Ї–љ–µ –±—А—Л–ґ–µ–є–Ї–Є –Њ–±–Њ–і–Њ—З–љ–Њ–є –Ї–Є—И–Ї–Є —Г–Ј–ї–Њ–≤—Л–Љ–Є —И–≤–∞–Љ–Є.
–Ф–ї—П –Є–Ј–≤–ї–µ—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Є–Ј –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б—А–µ–і–Є–љ–љ—Г—О –Љ–Є–љ–Є-–ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є—О —Б –і–ї–Є–љ–Њ–є —А–∞–Ј—А–µ–Ј–∞ 7 —Б–Љ. –Ю–њ–µ—А–∞—Ж–Є—О –Ј–∞–≤–µ—А—И–∞–ї–Є –і—А–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ–і–і–Є–∞—Д—А–∞–≥–Љ–∞–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–∞ –љ–∞ 5 —Б—Г—В.
ICG-–љ–∞–≤–Є–≥–∞—Ж–Є—П, —В–µ—Е–љ–Є–Ї–∞ –Ї–∞—А—В–Є—А–Њ–≤–∞–љ–Є—П –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤
–†–Њ–±–Њ—В–Є—З–µ—Б–Ї–Є–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б da Vinci Si –љ–µ –Є–Љ–µ–µ—В –≤—Б—В—А–Њ–µ–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—В–љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є fire fly laser, –∞ —В–∞–Ї–ґ–µ –љ–µ—В –і–∞–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є –≤ –±–∞–Ј–Њ–≤–Њ–є –Ї–Њ–Љ–њ–ї–µ–Ї—В–∞—Ж–Є–Є, —З—В–Њ —В—А–µ–±—Г–µ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ—Б–љ–∞—Й–µ–љ–Є—П –≤ –≤–Є–і–µ –Њ—В–і–µ–ї—М–љ–Њ–є —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–є –≤–Є–і–µ–Њ–Ї–∞–Љ–µ—А—Л. –Ъ–Њ–Љ–њ–ї–µ–Ї—Б da Vinci Xi –Є–Љ–µ–µ—В –≤—Б—В—А–Њ–µ–љ–љ—Г—О —Б–Є—Б—В–µ–Љ—Г –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є–љ—Д—А–∞–Ї—А–∞—Б–љ–Њ–≥–Њ –ї–∞–Ј–µ—А–љ–Њ–≥–Њ –Є—Б—В–Њ—З–љ–Є–Ї–∞ –Є–Ј–ї—Г—З–µ–љ–Є—П (ICG, –Њ—В –∞–љ–≥–ї. Indocyanine green) —Б –њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О 1,5вАУ2,5 —Б–Љ. –° —Ж–µ–ї—М—О –Ї–Њ–љ—В—А–Њ–ї—П –њ–Њ–ї–љ–Њ—В—Л D2-–ї–Є–Љ—Д–∞–і–µ–љ—Н–Ї—В–Њ–Љ–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –і–≤–∞ —Б–њ–Њ—Б–Њ–±–∞ –≤–≤–µ–і–µ–љ–Є—П –Ї—А–∞—Б–Є—В–µ–ї—П вАФ –Є–љ–і–Њ—Ж–Є–∞–љ–Є–љ–∞ –Ј–µ–ї–µ–љ–Њ–≥–Њ (ICG).
–°–њ–Њ—Б–Њ–± вДЦ 1 вАФ —Б—Г–±–Љ—Г–Ї–Њ–Ј–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ: –њ–µ—А–µ–і —Н—В–∞–њ–Њ–Љ –і–Њ–Ї–Є–љ–≥–∞ –≤—Л–њ–Њ–ї–љ—П–ї–Є –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Г—О —Д–Є–±—А–Њ–≥–∞—Б—В—А–Њ—Б–Ї–Њ–њ–Є—О, –њ—А–Є –њ–Њ–Љ–Њ—Й–Є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—К–µ–Ї—В–Њ—А–∞ –њ–Њ–і –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Г—О –≥—А–∞–љ–Є—Ж—Г –Њ–њ—Г—Е–Њ–ї–Є —Б—Г–±–Љ—Г–Ї–Њ–Ј–љ–Њ –≤–≤–Њ–і–Є–ї–Є —А–∞—Б—В–≤–Њ—А ICG, –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л–є –њ—Г—В–µ–Љ –і–Њ–±–∞–≤–ї–µ–љ–Є—П 5 –Љ–ї –≤–Њ–і—Л –і–ї—П –Є–љ—К–µ–Ї—Ж–Є–є –≤–Њ —Д–ї–∞–Ї–Њ–љ —Б —Б—Г—Е–Є–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ 25 –Љ–≥. –Я—А–Є —В–∞–Ї–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –ї–Є–Љ—Д–Њ–≥–µ–љ–љ–Њ–µ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –і–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, –Ї–Њ—В–Њ—А—Л–є –љ–µ —П–≤–ї—П–µ—В—Б—П –Њ–љ–Ї–Њ—В—А–Њ–њ–љ—Л–Љ, –љ–Њ –Њ–±–ї–∞–і–∞–µ—В —Е–Њ—А–Њ—И–Є–Љ–Є –ї–Є–Љ—Д–Њ—В—А–Њ–њ–љ—Л–Љ–Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ–Є, –љ–∞–Ї–∞–њ–ї–Є–≤–∞—П—Б—М –≤ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–∞—Е, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –Љ–Њ–≥—Г—В —П–≤–ї—П—В—М—Б—П –њ—Г—В—П–Љ–Є —А–µ–≥–Є–Њ–љ–∞—А–љ–Њ–≥–Њ –Љ–µ—В–∞—Б—В–∞–Ј–Є—А–Њ–≤–∞–љ–Є—П. –Ф–∞–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –Є–Љ–µ–µ—В —З–µ—В–Ї–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –Љ–∞–Ї—Б–Є–Љ—Г–Љ –њ–Њ–≥–ї–Њ—Й–µ–љ–Є—П –≤ –Є–љ—Д—А–∞–Ї—А–∞—Б–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –њ—А–Є 800 –љ–Љ –Є –Љ–∞–Ї—Б–Є–Љ—Г–Љ —Н–Љ–Є—Б—Б–Є–Є –њ—А–Є —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—В–љ–Њ–Љ –Є–Ј–Љ–µ—А–µ–љ–Є–Є –њ—А–Є 830 –љ–Љ, —З—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Њ –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї—П–Љ–Є –≤ —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –Є—Б—В–Њ—З–љ–Є–Ї–∞ –Є–љ—Д—А–∞–Ї—А–∞—Б–љ–Њ–≥–Њ –Є–Ј–ї—Г—З–µ–љ–Є—П. –†–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ —А–∞—Б—В–≤–Њ—А–∞ –њ–Њ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–Љ —Б–Њ—Б—Г–і–∞–Љ –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ –љ–∞ 15вАУ20-–є –Љ–Є–љ—Г—В–µ –њ–Њ—Б–ї–µ –≤–≤–µ–і–µ–љ–Є—П, –њ—А–Њ–Ї—А–∞—И–Є–≤–∞–љ–Є–µ —А–µ–≥–Є–Њ–љ–∞—А–љ—Л—Е –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ вАФ –љ–∞ 30вАУ60-–є –Љ–Є–љ—Г—В–µ (—А–Є—Б. 4).

–°–њ–Њ—Б–Њ–± вДЦ 2 вАФ —Б—Г–±—Б–µ—А–Њ–Ј–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ: –њ—А–Њ–≤–Њ–і–Є–ї–Є –њ–Њ—Б–ї–µ –і–Њ–Ї–Є–љ–≥–∞ –Є —Г—Б—В–∞–љ–Њ–≤–Ї–Є —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е —А–∞–±–Њ—З–Є—Е –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤. –°–Њ–±–Є—А–∞–ї–Є –Є–љ—К–µ–Ї—В–Њ—А, —Б–Њ—Б—В–Њ—П—Й–Є–є –Є–Ј –Є–≥–ї—Л, —И–њ—А–Є—Ж–∞ –Є –Ї–∞–њ–µ–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –Ї–Њ—В–Њ—А—Л–є –Ј–∞–≤–Њ–і–Є–ї–Є –≤ –±—А—О—И–љ—Г—О –њ–Њ–ї–Њ—Б—В—М —З–µ—А–µ–Ј 12-–Љ–Є–ї–ї–Є–Љ–µ—В—А–Њ–≤—Л–є —В—А–Њ–∞–Ї–∞—А. –Ю—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є —Б—Г–±—Б–µ—А–Њ–Ј–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ 5 –Љ–ї —А–∞—Б—В–≤–Њ—А–∞ ICG –њ–Њ–і –і–Є—Б—В–∞–ї—М–љ—Г—О –Є–ї–Є –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Г—О –≥—А–∞–љ–Є—Ж—Г –Њ–њ—Г—Е–Њ–ї–Є –њ—А–Є —Б—В–∞–і–Є–Є –Ґ4–∞ –Є–ї–Є –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤ –њ—А–Њ–µ–Ї—Ж–Є–Є –Њ–њ—Г—Е–Њ–ї–Є –њ—А–Є —Б—В–∞–і–Є–Є –Ґ2вАУ–Ґ3. –°–Ї–Њ—А–Њ—Б—В—М —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –±—Л–ї–∞ –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ–є –њ–µ—А–≤–Њ–Љ—Г —Б–њ–Њ—Б–Њ–±—Г.
ICG –і–ї—П –Њ—Ж–µ–љ–Ї–Є –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П —А–µ–Ј–µ—Ж–Є—А—Г–µ–Љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤
–Я—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є —А–Њ–±–Њ—В-–∞—Б—Б–Є—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–є –і–Є—Б—В–∞–ї—М–љ–Њ–є —Б—Г–±—В–Њ—В–∞–ї—М–љ–Њ–є —А–µ–Ј–µ–Ї—Ж–Є–Є –ґ–µ–ї—Г–і–Ї–∞ –њ—А–Є —Б–Њ–Љ–љ–Є—В–µ–ї—М–љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –Ј–∞–і–љ–µ–є –∞—А—В–µ—А–Є–Є –ґ–µ–ї—Г–і–Ї–∞ (a. gastrica posterior), –∞ —В–∞–Ї–ґ–µ –њ—А–Є —Б–ї–∞–±–Њ–≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –Ї–Њ—А–Њ—В–Ї–Є—Е –∞—А—В–µ—А–Є—П—Е –ґ–µ–ї—Г–і–Ї–∞ (–∞–∞. gastricae breves) –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ —В—А–µ–±—Г–µ—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П –Њ—Б—В–∞—О—Й–µ–є—Б—П –Ї—Г–ї—М—В–Є –ґ–µ–ї—Г–і–Ї–∞ —Б —Ж–µ–ї—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –µ–µ –љ–µ–Ї—А–Њ–Ј–∞. –Ф–ї—П —Н—В–Њ–≥–Њ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –≤–≤–Њ–і–Є–ї–Є 5 –Љ–ї —А–∞—Б—В–≤–Њ—А–∞ ICG, –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –њ—Г—В–µ–Љ –і–Њ–±–∞–≤–ї–µ–љ–Є—П 5 –Љ–ї –≤–Њ–і—Л –і–ї—П –Є–љ—К–µ–Ї—Ж–Є–є –≤–Њ —Д–ї–∞–Ї–Њ–љ —Б —Б—Г—Е–Є–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ 25 –Љ–≥, —Б –і–∞–ї—М–љ–µ–є—И–µ–є –Њ—Ж–µ–љ–Ї–Њ–є –∞–і–µ–Ї–≤–∞—В–љ–Њ—Б—В–Є –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П —З–µ—А–µ–Ј 10вАУ15 –Љ–Є–љ –њ—Г—В–µ–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —А–µ–ґ–Є–Љ–∞ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –љ–∞ –Ї–Њ–љ—Б–Њ–ї–Є —Е–Є—А—Г—А–≥–∞.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Э–∞—И –Њ–њ—Л—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –і–Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є —В–∞–Ї–Њ–є —Б–ї–Њ–ґ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –Ї–∞–Ї —А–∞–Ї –ґ–µ–ї—Г–і–Ї–∞. –Я–Њ –Њ–њ–Є—Б–∞–љ–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–µ –љ–∞–Љ–Є –±—Л–ї–Њ –њ—А–Њ–Њ–њ–µ—А–Є—А–Њ–≤–∞–љ–Њ 79 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –±—Г–і—Г—В –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ –Њ—В–і–µ–ї—М–љ–Њ–є –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є.
–Т—Л–Ј—Л–≤–∞–µ—В –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–є –Є–љ—В–µ—А–µ—Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ ICG —Б –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤ –Є–љ—Д—А–∞–Ї—А–∞—Б–љ–Њ–Љ —Б–њ–µ–Ї—В—А–µ –µ–≥–Њ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –≤ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–∞—Е, —П–≤–ї—П—О—Й–Є—Е—Б—П –њ—Г—В—П–Љ–Є –ї–Є–Љ—Д–Њ–≥–µ–љ–љ–Њ–≥–Њ –Љ–µ—В–∞—Б—В–∞–Ј–Є—А–Њ–≤–∞–љ–Є—П, –Њ—Б–Њ–±–µ–љ–љ–Њ —В–µ—Е –≥—А—Г–њ–њ, –Ї–Њ—В–Њ—А—Л–µ –≤—Л—Е–Њ–і—П—В –Ј–∞ –≥—А–∞–љ–Є—Ж—Л —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –ї–Є–Љ—Д–∞–і–µ–љ—Н–Ї—В–Њ–Љ–Є–Є. –Я–Њ –≤—Б–µ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є, —Г–і–∞–ї–µ–љ–Є–µ —В–∞–Ї–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–Њ—А–∞–ґ–µ–љ–љ—Л—Е –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ –љ–µ —Г–ї—Г—З—И–Є—В –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–µ –Ї–∞—З–µ—Б—В–≤–Њ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ —Б –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П, –Њ–і–љ–∞–Ї–Њ –њ–Њ–Ј–≤–Њ–ї–Є—В –њ–Њ–≤—Л—Б–Є—В—М —В–Њ—З–љ–Њ—Б—В—М —Б—В–∞–і–Є—А–Њ–≤–∞–љ–Є—П, –Њ–њ—А–µ–і–µ–ї–Є—В—М –њ—А–Њ–≥–љ–Њ–Ј—Л –Є –њ—А–Њ–≤–µ—Б—В–Є –Ї–Њ—А—А–µ–Ї—Ж–Є—О –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Ъ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞–Љ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –≤—Б–µ–≥–Њ —З–µ—В—Л—А–µ—Е —А–Њ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤, –љ–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, —Б–ї–µ–і—Г–µ—В –Њ—В–љ–µ—Б—В–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Б–љ–Є–Ј–Є—В—М —Д–Є–љ–∞–љ—Б–Њ–≤—Г—О –љ–∞–≥—А—Г–Ј–Ї—Г –љ–∞ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–µ —Г—З—А–µ–ґ–і–µ–љ–Є–µ.
–°–≤–µ–і–µ–љ–Є—П –Њ–± –∞–≤—В–Њ—А–∞—Е:
–Ъ–Њ–≤–∞–ї–µ–љ–Ї–Њ –°–µ—А–≥–µ–є –Р–ї–µ–Ї—Б–µ–µ–≤–Є—З вАФ –≤—А–∞—З-–Њ–љ–Ї–Њ–ї–Њ–≥, –Ј–∞–≤–µ–і—Г—О—Й–Є–є –Њ—В–і–µ–ї–µ–љ–Є–µ–Љ –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є –°–Я–± –У–С–£–Ч ¬Ђ–У–Њ—А–Њ–і—Б–Ї–∞—П –±–Њ–ї—М–љ–Є—Ж–∞ вДЦ 40¬ї; 197706, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, –≥. –°–µ—Б—В—А–Њ—А–µ—Ж–Ї, —Г–ї. –С–Њ—А–Є—Б–Њ–≤–∞, –і. 9; ORCID iD 0000-0002-5850-0599.
–У–ї–∞–і—Л—И–µ–≤ –Ф–Љ–Є—В—А–Є–є –Т–ї–∞–і–Є–Љ–Є—А–Њ–≤–Є—З вАФ –і.–Љ.–љ., –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М –≥–ї–∞–≤–љ–Њ–≥–Њ –≤—А–∞—З–∞ –њ–Њ —Е–Є—А—Г—А–≥–Є–Є –°–Я–± –У–С–£–Ч ¬Ђ–У–Њ—А–Њ–і—Б–Ї–∞—П –±–Њ–ї—М–љ–Є—Ж–∞ вДЦ 40¬ї; 197706, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, –≥. –°–µ—Б—В—А–Њ—А–µ—Ж–Ї, —Г–ї. –С–Њ—А–Є—Б–Њ–≤–∞, –і. 9; –і–Њ—Ж–µ–љ—В –Ї–∞—Д–µ–і—А—Л –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–є —Е–Є—А—Г—А–≥–Є–Є –Т–Њ–µ–љ–љ–Њ-–Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –∞–Ї–∞–і–µ–Љ–Є–Є –Є–Љ–µ–љ–Є –°.–Ь. –Ъ–Є—А–Њ–≤–∞; 194044, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, —Г–ї. –Р–Ї–∞–і–µ–Љ–Є–Ї–∞ –Ы–µ–±–µ–і–µ–≤–∞, –і. 6–Ц; ORCID iD 0000-0001-5318-2619.
–Ь–Њ–Є—Б–µ–µ–≤ –Ь–Є—Е–∞–Є–ї –Х–≤–≥–µ–љ—М–µ–≤–Є—З вАФ –≤—А–∞—З-–Њ–љ–Ї–Њ–ї–Њ–≥ –Њ—В–і–µ–ї–µ–љ–Є—П –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є –°–Я–± –У–С–£–Ч ¬Ђ–У–Њ—А–Њ–і—Б–Ї–∞—П –±–Њ–ї—М–љ–Є—Ж–∞ вДЦ 40¬ї; 197706, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, –≥. –°–µ—Б—В—А–Њ—А–µ—Ж–Ї, —Г–ї. –С–Њ—А–Є—Б–Њ–≤–∞, –і. 9; ORCID iD 0000-0002-6180-6695.
–Т–µ—В–Њ—И–Ї–Є–љ –Т—П—З–µ—Б–ї–∞–≤ –Р–љ–і—А–µ–µ–≤–Є—З вАФ –≤—А–∞—З-—Е–Є—А—Г—А–≥ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Њ—В–і–µ–ї–µ–љ–Є—П –і–ї—П –њ—А–Њ—В–Є–≤–Њ—И–Њ–Ї–Њ–≤—Л—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є –°–Я–± –У–С–£–Ч ¬Ђ–У–Њ—А–Њ–і—Б–Ї–∞—П –±–Њ–ї—М–љ–Є—Ж–∞ вДЦ 40¬ї; 197706, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, –≥. –°–µ—Б—В—А–Њ—А–µ—Ж–Ї, —Г–ї. –С–Њ—А–Є—Б–Њ–≤–∞, –і. 9; ORCID iD 0000-0001-5346-9257.
–°–≤–Є—В–Є—З –Т–∞–і–Є–Љ –Ѓ—А—М–µ–≤–Є—З вАФ –≤—А–∞—З-–Њ–љ–Ї–Њ–ї–Њ–≥ –Њ—В–і–µ–ї–µ–љ–Є—П –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є –°–Я–± –У–С–£–Ч ¬Ђ–У–Њ—А–Њ–і—Б–Ї–∞—П –±–Њ–ї—М–љ–Є—Ж–∞ вДЦ 40¬ї; 197706, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, –≥. –°–µ—Б—В—А–Њ—А–µ—Ж–Ї, —Г–ї. –С–Њ—А–Є—Б–Њ–≤–∞, –і. 9; ORCID iD 0009-0002-2293-0527.
–У–љ–µ–і–∞—И –°–µ—А–≥–µ–є –°–µ—А–≥–µ–µ–≤–Є—З вАФ –≤—А–∞—З-–Њ–љ–Ї–Њ–ї–Њ–≥ –Њ—В–і–µ–ї–µ–љ–Є—П –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є –°–Я–± –У–С–£–Ч ¬Ђ–У–Њ—А–Њ–і—Б–Ї–∞—П –±–Њ–ї—М–љ–Є—Ж–∞ вДЦ 40¬ї; 197706, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, –≥. –°–µ—Б—В—А–Њ—А–µ—Ж–Ї, —Г–ї. –С–Њ—А–Є—Б–Њ–≤–∞, –і. 9; ORCID iD 0009-0003-4743-3014.
–Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –Ъ–Њ–≤–∞–ї–µ–љ–Ї–Њ –°–µ—А–≥–µ–є –Р–ї–µ–Ї—Б–µ–µ–≤–Є—З, kowalenko78@yandex.ru.
–Я—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є: –љ–Є–Ї—В–Њ –Є–Ј –∞–≤—В–Њ—А–Њ–≤ –љ–µ –Є–Љ–µ–µ—В —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Љ–µ—В–Њ–і–∞—Е.
–Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В.
–°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 27.02.2023.
–Я–Њ—Б—В—Г–њ–Є–ї–∞ –њ–Њ—Б–ї–µ —А–µ—Ж–µ–љ–Ј–Є—А–Њ–≤–∞–љ–Є—П 23.03.2023.
–Я—А–Є–љ—П—В–∞ –≤ –њ–µ—З–∞—В—М 17.04.2023.
About the authors:
Sergey A. Kovalenko вАФ oncologist of the Department of Abdominal Oncology, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0000-0002-5850-0599.
Dmitry V. Gladyshev вАФ Dr. Sc. (Med.), Deputy Chief Medical Officer of Surgery, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; Associate Professor of the Department of Hospital Surgery of the S.M. Kirov Military Medical Academy; 6 Zh, Lebedeva str., St. Petersburg, Russian Federation; ORCID iD 0000-0001-5318-2619.
Mikhail E. Moiseev вАФ oncologist of the Department of Abdominal Oncology, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0000-0002-6180-6695.
Vyacheslav A. Vetoshkin вАФ surgeon of the Department of Surgery for Anti-shock Measures, St. Petersburg St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0000-0001-5346-9257.
Vadim Yu. Svitich вАФ oncologist of the Department of Abdominal Oncology, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0009-0002-2293-0527.
Sergey S. Gnedash вАФ oncologist of the Department of Abdominal Oncology, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0009-0003-4743-3014.
Contact information: Sergey A. Kovalenko, e-mail: kowalenko78@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 27.02.2023.
Revised 23.03.2023.
Accepted 17.04.2023.












